Fosfaat
Voorkoms
|
Algemeen | |
|---|---|
| Naam | Fosfaat |
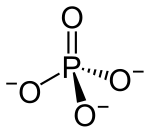 |

|
| Termochemiese radius | 2,30 Å[1] |
| 206,8 [Scm2/mol][2] | |
| Lys van anione | |
Fosfaat(PO43-) is die vorm waarinfosfordie meeste in verbindings voorkom. Fosfate is suurreste vanfosforsuur(H3PO4). Die meeste fosfate los nie maklik in water op nie, en kan daarom maklik uit 'n oplossing met 'nneerslagreaksieverwyder word.
Fosfate is belangrike misstowwe. Hulle word hoofsaaklik asapatietgemyn.Hidroksielapatietis 'n biologies belangrike stof. Dit is byvoorbeeld deel van onstande.
Die fosfaatioon is 'n sterk basis. In water vorm dit maklik diewaterstoffosfaatioonHPO2−4
- HPO2−4+H2OH3O++PO3−4Ka3= 3,98×10−13[pKa3= 12,37]


