Etaan
|
Algemeen | |
|---|---|
| Naam | Etaan[1] |
| Sistematiese naam | dikarbaan (nooit aanbeveel nie)[1] |
![Struktuurformule van Etaan[1]](https://upload.wikimedia.org/wikipedia/commons/thumb/3/35/Ethan_Lewis.svg/130px-Ethan_Lewis.svg.png) |
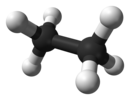 |
| Chemiese formule | C2H6 |
| Molêre massa | 30,070 g·mol-1 |
| CAS-nommer | 74-84-0 |
| Voorkoms | Kleurlose gas |
| Reuk | Reukloos |
| Fasegedrag | |
| Smeltpunt | -182.8 °C (90,4 K) |
| Kookpunt | -88.5 °C (184,6 K) |
| Digtheid | 1,3562 kg·m−3 (gas teen 0 °C)[2] 544 kg·m−3 (vlooistof teen -88,5 °C) 206 kg·m−3 (teen kritiese punt 32,1 °C) |
| Oplosbaarheid | 56.8 mg·L-1 (in water)[3] |
| ΔfHɵ | -84 kJ·mol-1 |
|
Suur-basis eienskappe | |
| pKa | 50 |
|
Veiligheid | |
| Flitspunt | -135 °C |
| Selfontbrandingspunt | 472 °C |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Etaan is 'n organiese chemiese verbinding met chemiese formule C2H6 en dit behoort tot die groep verbindings wat alkane genoem word. Teen standaardtemperatuur en -druk is etaan 'n kleurlose, reuklose gas. Soos baie koolwaterstowwe word etaan op industriële skaal geïsoleer van aardgas en as 'n petrochemiese neweproduk van petroleumraffinering. Die belangrikste gebruik daarvan is as voedingsmiddel vir etileenproduksie.
Verwante verbindings kan gevorm word deur 'n waterstofatoom met 'n ander funksionele groep te vervang; die etaangedeelte word 'n etielgroep genoem. Byvoorbeeld, 'n etielgroep wat aan 'n hidroksielgroep gekoppel is, lewer etanol, die alkohol in drank.
Chemie
[wysig | wysig bron]
Struktuur
[wysig | wysig bron]Etaanmolekule verkies 'n verspreide konformasie (A) teenoor 'n "in-lyn"-konformasie (B), soos blyk uit die rotasieversperring rondom die koolstof-koolstofbinding. Die rotasieversperring word waarskynlik veroorsaak deur die afstoting tussen waterstofatome aan weeskante van die molekule as hulle in lyn beweeg.[4] Daarbenewens sal hiperkonjugasie tussen die orbitale van die waterstofatoom en die σ-orbitale van die koolstof-koolstofbinding geneig wees om die verspreide konformasie te stabiliseer.[5][6] Die fisiese oorsprong van die versperring is egter nog nie heeltemal beslis nie.[7]
Sintese
[wysig | wysig bron]In die laboratorium kan etaan gesintetiseer word deur Kolbe-elektrolise waarin 'n waterige oplossing van 'n asetaatsout geëlektroliseer word. Aan die anode word asetaat geoksideer om koolstofdioksied- en metielradikale te produseer, en die hoogs reaktiewe metielradikale vorm saam om etaan te produseer:
Reaksies
[wysig | wysig bron]Die chemie van etaan behels hoofsaaklik vrye radikale reaksies. Etaan kan met die halogene, veral chloor en broom, reageer deur vryradikale halogenering. Hierdie reaksie gaan voort deur die voortplanting van die etielradikaal:
- C2H5• + Cl2 → C2H5 + Cl•
- Cl• + C2H6 → C2H5• + HCl
Aangesien halogeen-etane verdere vryradikale halogenering kan ondergaan, lei hierdie proses tot 'n mengsel van verskeie gehalogeneerde produkte. In die chemiese industrie word meer selektiewe chemiese reaksies gebruik vir die vervaardiging van enige twee-koolstofhalogenoalkaan.
Verbranding
[wysig | wysig bron]Die volledige verbranding van etaan stel 1559,7 kJ/mol (of 51,9 kJ/g) hitte vry en produseer koolstofdioksied en water volgens die chemiese vergelyking:
- C2H6 + 7O2 → 4CO2 + 6H2O + 3120 kJ
Verbranding kan ook plaasvind sonder 'n oormaat suurstof, wat 'n mengsel van amorfe koolstof en koolstofmonoksied vorm, b.v.:
- 2C2H6 + 4O2 → 2C + 2CO2 + 6H2O + hitte
Sommige mindere produkte in die onvolledige verbranding van etaan sluit in asetaldehied, metaan, metanol, etanol en etileen.
Atmosferiese en buiteaardse etaan
[wysig | wysig bron]
Etaan kom voor as 'n spoorgas in die aarde se atmosfeer. Alhoewel etaan 'n kweekhuisgas is, kom dit baie minder voor as metaan, het dit 'n leeftyd van slegs 'n paar maande, [30] en is dit ook minder doeltreffend om straling op te neem in verhouding tot massa. Die potensiaal vir aardverwarming van etaan is hoofsaaklik die gevolg van sy omskakeling in die atmosfeer na metaan.[8]
Dit is opgespoor as 'n spoorkomponent in die atmosfeer van al vier reuse-planete en in die atmosfeer van Saturnus se maan Titaan.[9]
Geskiedenis
[wysig | wysig bron]Etaan is die eerste keer in 1834 deur Michael Faraday gesintetiseer deur elektrolise van 'n kaliumasetaatoplossing. Hy het die koolwaterstofproduk van hierdie reaksie verkeerd geïdentifiseer as metaan en dit nie verder ondersoek nie.[10] In 'n poging om die verouderde "radikale teorie" van organiese chemie te bevestig het Hermann Kolbe en Edward Frankland in die tydperk 1847–1849 etaan geproduseer deur die reduksie van propionitriel (etielsianied)[11] en etieljodied[12] met kaliummetaal, en, net soos Faraday, deur die elektrolise van waterige asetate. Hulle het die produk van die reaksies verkeerd geïdentifiseer as die metielradikaal, in plaas van etaan. Hierdie fout is in 1864 reggestel deur Carl Schorlemmer, wat getoon het dat die produk van al hierdie reaksies in werklikheid etaan was.[13] In 1864 het Edmund Ronalds etaan opgelos in ligte ruolie ontdek.[14][15]
Verwysings
[wysig | wysig bron]- ↑ 1,0 1,1 Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book) (in Engels). Cambridge: The Royal Society of Chemistry. 2014. p. 4. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Net so is die behoue name, 'etaan', 'propaan', en 'butaan', nooit deur sistematiese name, 'dikarbaan', 'trikarbaan', en 'tetrakarbaan' vervang nie.
- ↑ "Ethane – Compound Summary". PubChem Compound (in Engels). National Center for Biotechnology Information. 16 September 2004. Besoek op 25 Januarie 2021.
- ↑ Lide, David (2005). CRC handbook of chemistry and physics (in Engels). Boca Raton: CRC Press. ISBN 0-8493-0486-5. OCLC 61108810.
- ↑ Mo, Y.; Wu, W.; Song, L.; Lin, M.; Zhang, Q.; Gao, J. (2004). "The Magnitude of Hyperconjugation in Ethane: A Perspective from Ab Initio Valence Bond Theory". Angew. Chem. Int. Ed. (in Engels). 43 (15): 1986–1990. doi:10.1002/anie.200352931. PMID 15065281.
- ↑ Pophristic, V.; Goodman, L. (2001). "Hyperconjugation not steric repulsion leads to the staggered structure of ethane". Nature (in Engels). 411 (6837): 565–8. Bibcode:2001Natur.411..565P. doi:10.1038/35079036. PMID 11385566. S2CID 205017635.
- ↑ Schreiner, P. R. (2002). "Teaching the right reasons: Lessons from the mistaken origin of the rotational barrier in ethane". Angewandte Chemie International Edition (in Engels). 41 (19): 3579–81, 3513. doi:10.1002/1521-3773(20021004)41:19<3579::AID-ANIE3579>3.0.CO;2-S. PMID 12370897.
- ↑ Ercolani, G. (2005). "Determination of the Rotational Barrier in Ethane by Vibrational Spectroscopy and Statistical Thermodynamics". J. Chem. Educ. (in Engels). 82 (11): 1703–1708. Bibcode:2005JChEd..82.1703E. doi:10.1021/ed082p1703.
- ↑ Aydin, M.; Williams, M. B.; Saltzman, E. S. (12 April 2007). "Feasibility of reconstructing paleoatmospheric records of selected alkanes, methyl halides, and sulfur gases from Greenland ice cores". Journal of Geophysical Research (in Engels). American Geophysical Union (AGU). 112 (D7). doi:10.1029/2006jd008027. ISSN 0148-0227.
- ↑ Brown, Bob (2008). "NASA Confirms Liquid Lake on Saturn Moon" (in Engels). NASA Jet Propulsion Laboratory. Geargiveer vanaf die oorspronklike op 5 Junie 2011. Besoek op 25 Januarie 2021.
- ↑ Faraday, Michael (1834). "Experimental researches in electricity: Seventh series". Philosophical Transactions (in Engels). 124: 77–122. Bibcode:1834RSPT..124...77F. doi:10.1098/rstl.1834.0008. S2CID 116224057.
- ↑ Kolbe, Hermann; Frankland, Edward (1849). "On the products of the action of potassium on cyanide of ethyl". Quarterly Journal of the Chemical Society of London (in Engels). Royal Society of Chemistry. 1: 60–74. doi:10.1039/QJ8490100060. ISSN 1743-6893.
- ↑ Frankland, Edward (1850). "On the isolation of the organic radicals". Quarterly Journal of the Chemical Society of London (in Engels). 2 (3): 263–296. doi:10.1039/QJ8500200263. ISSN 1743-6893.
- ↑ Schorlemmer, Carl (1864). "Ueber die Identität des Aethylwasserstoffs und des Methyls [Oor die identiteit van die etielwaterstowe en die metiele]". Annalen der Chemie und Pharmacie (in Duits). 132 (2): 234–238. doi:10.1002/jlac.18641320217. ISSN 0075-4617.
- ↑ Roscoe, H.E.; Schorlemmer, C. (1881). Treatise on Chemistry (in Engels). Vol. 3. Macmillan. pp. 144–145.
- ↑ Watts, H.; Muir, M.M.P.; Morley, H.F. (1868). Watts' Dictionary of Chemistry (in Engels). Vol. 4. Longmans, Green. p. 385. Besoek op 25 Januarie 2021.
