Osoon
|
Algemeen | |
|---|---|
| Naam | Osoon |
| IUSTC-naam | trisuurstof |
 |
 |
| Chemiese formule | O3 |
| Molêre massa | 48.0 [g/mol] |
| CAS-nommer | 10028-15-6[1] |
| Voorkoms | ligteblou gas |
| Reuk | skerp |
| Fasegedrag | |
| Smeltpunt | -193 °C[1] |
| Kookpunt | -112 °C[1] |
| Digtheid | 1,6*lug[1] |
| Oplosbaarheid | 570 mg/L water 20 °C suiwere osoon[1] |
| Termodinamies | |
| ΔfHɵ | 142.7 [kJ/mol][2] |
| Henry se konstante | 1.17 x 10-2[mol/L.atm] - 2400[K][3] |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | N/A |
| LD50 | 12,6 dpm, 3 uur (muis)[1] |
|
Tensy anders vermeld is alle data virstandaardtemperatuur en -druktoestande. | |
| Portaal | |
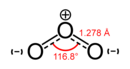
Osoon(O3) is 'n reaktieweallotroopvansuurstof.'n Osoonmolekuul is 'n polêre molekuul wat uit drie kovalentgebonde suurstofatome bestaan. Dit is 'n irriterende, giftige gas met 'n ligteblou kleur teen standaardtemperatuur en -druk. Dit word 'n donkerblou vloeistof onder -112°Cen 'n donkerblou vastestof onder -193 °C.
Atmosfeer
[wysig|wysig bron]Osoon kom in dieosoonlaagin die boonste gedeelte van diestratosfeervan die aarde voor, wat laasgenoemde se natuurlike beskerming teen diesonse ultravioletstraling (hoë energiestraling) is. Osoon in die stratosfeer is dus "goeie osoon" wat die son se ultravioletstraling absorbeer en sodoende die mense, diere en plante teen die hoë energiestraling beskerm. Die vorming van ozone in die stratosfeer is 'nfotochemieseproses. Suurstof neem energie op deur absorpsie van 'n foton en dissosieer:
'n Suurstofatoom reageer met 'n suurstof molekuul, maar hierdie reaksie vereis dat 'n derde molekuul M die oorskot aan energie kan wegdra[2]
Die ultraviolette straling van die son en suurstofatome kan osoon ook weer vernietig:
'n Ewewigskonsentrasie van osoon sal so vorm, veral omdat die vernietiging nie baie vinnig verloop nie. Tydens die winter sal egter aan die pole die osoonkonsentrasie terugloop omdat daar lang tyd geen sonlig meer is nie, maar die terugloop is nie baie vinnig nie
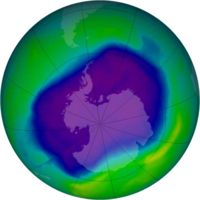
Die aanwesigheid vanfreonuit spuitbusse en koelkaste in die atmosfeer het dit egter verander omdat chlooratome wat ontstaan deur fotodissosiasie van freon as 'n katalisator vir die afbraakproses optree. Dit veroorsaak die osoongat bo die pole.
Een stap is byvoorbeeld:
Bo die pole is die temperatuur soms baie laag (190K) en die yskristalle in die atmosfeer versterk die katalitiese effekte.
Daar word ook osoon in dietroposfeeraangetref. Maar anders is die osoon in die osoonlaag, is hierdie "slegte osoon" wat skadelik is vir asemhalende wesens. Die het 'n irriterende effek op die mens se neus, keel en oë, en beskadig longweefsel en plante.
Verwysings
[wysig|wysig bron]- ↑1,01,11,21,31,41,5"Ozone Solutions Inc. Safety Data Sheet"(PDF)(in Engels). Geargiveer vanafdie oorspronklike(PDF)op 11 Julie 2019.Besoek op20 Januarie2016.
- ↑2,02,1"U. Waterloo (Cdn)"(in Engels). Geargiveer vanafdie oorspronklikeop 10 November 2018.Besoek op21 Januarie2016.
- ↑Sander.






