Uraan
Uraanis 'n silwerwitmetaalagtigechemiese elementin dieaktiniedereeks van dieperiodieke tabel,met 'natoomgetalvan 92. Uraan word met diechemiese simboolUweergegee. 'n Uraan-atoom het 92protoneen 92elektrone.6 van die elektrone isvalenselektrone.Die uraankern bevat tussen 141 en 146neutrone.Daar word gewoonlik 6isotopevan uraan onderskei. Al hierdie isotope is onstabiel, maar natuurlike uraan seradioaktiwiteitis redelik swak, omdat die twee algemeenste isotope,uraan-238(146 neutrone) enuraan-235(143 neutrone) 'n uiters langhalfleeftydhet. Uraan het die tweede hoogsteatoomgetalvan elemente wat natuurlik voorkom, naasplutonium-244.[2]Uraan sedigtheidis omtrent 71% hoër as dié vanlood,maar nie so dig soosgoudofiridiumnie. In die natuur kom dit in lae konsentrasies voor (min deeltjies per miljoen) in grond, rotse en water, en word kommersieel ontgin uit uraandraendemineralesoosuraniniet.
In die natuur kom uraan voor as uraan-238 (99,284%), uraan-235 (0,711%),%),[3]en baie klein hoeveelhedeuraan-234(0,0058%). Uraan verval stadig deur die uitstraling van 'nalfadeeltjie.Diehalfleeftydvan uraan-238 is omtrent 4,47 miljard jaar en vir uraan-235 is dit 704 miljoen jaar,[4]wat dit nuttig maak vir die datering van die Aarde se ouderdom.
Hedendaagse gebruike van uraan baat by die uniekekerneienskappedaarvan. Uraan-235 word geken daarvoor dat dit die enigstesplytbareisotoopis wat natuurlik voorkom. Uraan-238 is splytbaar deur vinnige neutrone en is ookfertiel(wat omgeskakel kan word na splytbare plutonium-239 in 'nkernreaktor). 'n Kunsmatige splytbare isotoop, uraan-233 kan geproduseer word vanuit natuurliketorium,wat ook belangrik is vir kerntegnologie. Uraan-235, en tot 'n mindere mate uraan-233, het 'n hoër waarskynlikheid vir spontane kernsplyting as uraan-238 wanneer dit deur stadige neutrone gebombardeer word. Hierdiekernreaksiegenereer die hitte in kernreaktore en voorsien die kernsplytingsmateriaal virkernwapens.Albei gebruike is afhanklik van die beskikbaarheid van uraan om 'n volhoubarekettingreaksievoort te bring. Verarmde uraan (uraan-238) word gebruik in kinetiese energie penetratore en inpantserplate.[5]
Uraan word gebruik as 'n kleurmiddel inuraanglas,wat 'n oranje-rooi tot lemoen-geel skynsels produseer. Dit was ook gebruik vir tinte en beskaduwing tydens vroeëfotografie.Die ontdekking van uraan in die mineraalUraniniet(of pikblende) in 1789 kan aanMartin Heinrick Klaprothtoegeskryf word. Hy het die element vernoem na die planeetUranus.Eugène-Melchior Péligotwas die eerste persoon wat die metaal geskei het, en dieradioaktieweeienskappe daarvan is ontdek in 1896 deurHenri Becquerel.Navorsing vanEnrico Fermien ander persone wat in 1934 begin het, het gelei tot die gebruik daarvan in diekernkragindustrieen inLittle Boy,die eerste kernwapen wat gebruik is in 'n oorlog. 'n Daaropvolgendebewapeningsresiesgedurende dieKoue Oorlogtussen dieVerenigde State van Amerikaen dieSowjetuniehet tienduisende kernwapens geproduseer watverrykte uraanen uraan-verarmde plutonium gebruik. Die bewaring van daardie wapens en hul kernmateriaal na dieineenstorting van die Sowjetuniein 1991 is steeds 'n voortdurende bekommernis vir gesondheid en veiligheid van die publiek.[6]
Eienskappe
[wysig|wysig bron]
Wanneer uraangesuiwerword, is dit 'n silwer-wit, swak radioaktiewemetaal,weinig sagter asstaal,[7]sterkelektropositiefen 'n swakelektriese geleier.[8]Dit ispletbaar,smeebaaren effensparamagneties.[7]Uraanmetaal het 'n baie hoëdigtheid,omtrent 70% digter aslood,maar effens minder dig asgoud.
Uraanmetaal reageer met byna allenie-metaalelemente en hulchemiese verbindings,met 'n reaktiwiteit wat verhoog met temperatuur.[9]Soutsuurensalpetersuurlos uraan op, maar nie-oksiderende sure val die element baie stadig aan.[8]Indien dit fyn gemaal word, sal uraan met koue water reageer, en in lug word uraanmetaal bedek met 'n donker laag uraanoksied.[7]Uraan in erts word chemies onttrek en omgeskakel nauraandioksiedof ander chemiese vorme wat in die industrie gebruik kan word.
Uraan-235 iskernsplytbaar,en die eerste isotoop wat ontdek is met hierdie eienskap. Ander natuurlike isotope kan splytbaar gemaak word, maar kom nie in die natuur in daardie toestand voor nie. Wanneer uraan-235 met stadige neutrone gebombardeer word, sal hierdie isotoop in die meeste gevalle opdeel in twee kleineratoomkerne,die kernverbindingsenergieloslaat, en ook nog neutrone. Wanneer hierdie neutrone weer deur ander uraan-235 kerne geabsorbeer word, sal 'n kettingreaksie begin wat tot 'n ontploffing kan lei, indien die reaksie nie verstadig word deur 'n neutron bemiddelaar nie. Laasgenoemde absorbeer die vrye neutrone. So min as 7kguraan-235 kan gebruik word om 'natoombomte maak.[10]Die eerste kernbom wat in oorlog gebruik is,Little Boy,het staatgemaak op uraansplyting, maar die eerste kernontploffing (The gadget) en die bom watNagasakiverwoes het (Fat Man), was plutonium bomme.
Uraanmetaal het drieallotropiesevorme:[11]
- α (ortorombies) stabiel tot en met 660 °C
- β (tetragonaal) stabiel vanaf 660 °C tot 760 °C
- γ (ruimtegesentreerde kubies) vanaf 760 °C tot en met smeltpunt—dit is die mees plet- en rekbare toestand.
Toepassings
[wysig|wysig bron]Militêr
[wysig|wysig bron]
Uraan word hoofsaaklik in die militêre sektor gebruik in hoë-digtheid penetratore. Hierdie ammunisie bestaan gewoonlik uit 'nverarmde uraan-allooi met 1 tot 2% ander elemente. Met 'n hoë snelheidsimpak sorg die digtheid, hardheid, en vlambaarheid van die projektiel vir die vernietiging van swaar gepantserde voertuie. Tenkpantser en ander verwyderbarevoertuigpantserword ook verhard met verarmde uraanplate. Die gebruik van verarmde uraan in wapens na die Persiese Golf- en Balkanoorloë het in politieke en omgewingskringe betwisbaar geraak — die gevolge van uraanverbindings in die grond is vervolgens bevraagteken (sienGolfoorlogsindroom).[10]
Verarmde uraan word ook gebruik as skutmateriaal in sommige houers wat radioaktiewe materiale stoor. Alhoewel die metaal op sigself radioaktief is, maak die hoë digtheid dit meer doeltreffend asloodom radiasie vanaf sterk bronne, soosradium,te stop.[8]Ander gebruike van verarmde uraan sluit die volgende in: teengewigte vir vliegtuigbeheeroppervlaktes, ballas in missielherintrede voertuie,en as skutmateriaal.[7]Weens uraan se hoë digtheid, word hierdie materiaal gebruik intraagheidsgeleidingstelselsen ingiroskopiesekompasse.[7]Verarmde uraan geniet voorkeur bo soortgelyke digte materiale weens die betreklik maklike masjieneerbaarheid, gieting, en die relatiewe lae koste daarvan.[12]Die hoof risiko van blootstelling deur verarmde uraan is chemiese vergiftiging deur uraanoksied — 'n groter risiko as radioaktiewe bestraling (uraan is 'n swakalfa-uitstraler).
Gedurende die einde van dieTweede Wêreldoorlog,dieKoue Oorlog,en in 'n mindere mate na dit, was uraan gebruik as 'n bron van kernspytingsmateriaal vir die produksie vankernwapens.Daar was hoofsaaklik twee tipes kernsplytingsbomme gebou: 'n relatief eenvoudige toestel wat uraan-235 gebruik, en 'n meer ingewikkelde meganisme wat uraan-238-afgeleideplutonium-239gebruik het. Later is 'n meer komplekse en by verre kragtige fusiebom ontwikkel: 'n plutonium gebaseerde toestel in 'n uraan-omhulsel wat veroorsaak dat 'n mengseltritiumendeuteriumkernfusieondergaan.[13]
Siviel
[wysig|wysig bron]
Uraan word in die siviele sektor hoofsaaklik gebruik as 'n bron van brandstof virkernkragsentrales.Een kilogram uraan-235 kan teoreties ongeveer 80biljoenjouleenergie (8×1013joule) verskaf, met die aanname dat volledige kernsplyting plaasvind, wat 3 000tonsteenkoolverteenwoordig.[5]
Kommersiëlekernkragaanlegtegebruik tipies brandstof wat verryk is tot ongeveer 3% uraan-235.[5]DieCANDU-reaktoris die enigste kommersiële reaktor wat die vermoë het om onverrrykte uraan te gebruik. Brandstof wat vir die V.S.A. vloot se kernskepe gebruik word is gewoonlik hoogs verryk met uraan-235 (die eksakte waardes is geklassifiseerd). In 'nkweekreaktorkan uraan-238 omgeskakel word inplutoniumdeur die volgende reaksie:[7]238U (n, gamma) →239U -(beta) →239Np -(beta) →239Pu.
Een van die groot probleemareas rondom die gebruik van uraan in kernkragtegnologie is die verwydering daarvan. Konvensionelekernreaktoreverbruik slegs tussen 1 tot 2% uraanbrandstof.

Voor die ontdekking van radioaktiwiteit was uraan hoofsaaklik gebruik in klein hoeveelhede vir die vervaardiging van geel glas en die verglasing van potte, byvoorbeelduraanglasen in Fiestaware.
Die ontdekking en isolering vanradiumin uraanerts (pikblende) deurMarie Curiehet aanleiding gegee tot die ontginning van uraan vir radium-ekstraksie, wat gebruik was om naggloeiende verwe vir horlosies en vliegtuigwyserplate te maak.[14]Dit het veroorsaak dat kolossale hoeveelhede uraan vir afvalproduk gelaat is, omdat ongeveer drietonuraan verwerk moet word vir eengramradium. Hierdie afvalproduk is gestuur na die verglasingsindustrie, wat uraanverglasing goedkoop en volop gemaak het. Afgesien die verglasing in pottebakkerye, het uraanteëlvervaardiging die meeste van die gebruik opgeneem, vanwaar die groen, geel, ligpers, swart, blou, rooi en ander kleure vir gewone badkamer- en kombuisteëls.

Uraan was ook gebruik infotografiesechemikalieë (veraluraannitraatin die ink),[7]in lampgloeidrade, vir die voorkoms vankunsgebitte,en in die leer- en houtbedrywe as kleurmiddel. Uraansoute word gebruik as 'nbytstofin sy of wol. Uranielasetaat en uranielformaat word gebruik vir elektondigte “kleurmiddels” inelektronmikroskopie,vir die kontras van biologiese eksemplare in ultradun dele en vir dienegatiewe kladvanvirusse,geïsoleerdeselorganelleenmakromolekules.
Die ontdekking van radioaktiwiteit in uraan het tot die addisionele wetenskaplike en praktiese gebruike van die element gelei. Die langhalfleeftydvan die uraan-238 isotoop (4,51×109jaar) word gebruik in die beraming van die vroegstevulkaniese rotse,en vir ander tipesradiometriese datering,waturaan-lood dateringenuraan-torium dateringinsluit. Uraanmetaal word gebruik vir X-straal teikens wanneer hoë-energieX-stralegemaak word.[7]
Geskiedenis
[wysig|wysig bron]Prehistoriese, natuurlike kernsplyting
[wysig|wysig bron]In 1972 het die Franse fisikus,Francis Perrin,vyftien antieke en onaktiewenatuurlike kernsplytingsreaktoreontdek in drie afsonderlike ertsneerslae by dieOklomyn inGaboen,Wes-Afrika.Dit staan gesamentlik bekend as dieOklo-Fossielreaktore.Die ertsneerslag word rondom 1,7 biljoen jaar oud beraam; dit word beweer dat op daardie stadium het uraan-235 omtrent drie persent van die totale uraan op die Aarde beslaan.[15]Die uraan-235 inhoud is hoog genoeg sodat 'n volhoubare kernsplytingskettingreaksie toegelaat is, op voorwaarde dat ander ondersteunende toetande ook bestaan. Die kapasiteit van die omliggende sediment vir die berging vankernafvalis deur die V.S.A. se federale regering aangehaal as bewyse vir die lewensvatbaarheid om uitgeputte kernafval by dieYucca Berg Kernafval Repositoriumte stoor.[15]
Gebruike voor ontdekking
[wysig|wysig bron]Die gebruik van uraan in die natuurlikeoksiedvormdateer ten minste uit die jaar 79n.C.toe dit gebruik was vir die byvoeging van 'n gelerige kleur bykeramiekverglasing.[7]Geel glas met 1% uraanoksied is in 1912 gevind in 'nRomeinsevilla op KaapPosillopoin dieBaai van Napels,Italiëdeur R.T. Gunther van dieOxford Universiteit.[16]In die beginjare van dieMiddeleeuewas pikblende onttrek vanuit dieHabsburgsilwermyne inJoachimsthal,Boheme(nou Jáchymov in dieTseggiese Republiek), en gebruik as 'n kleurmiddel in die plaaslikeglasvervaardigingsbedryf.[17]In die vroeë 19de eeu was die wêreld se bekendste bronne van uraanerts eens hierdie myne.
Ontdekking
[wysig|wysig bron]
Die ontdekking van uraan kan toegeskryf word aan die Duitse chemikus,Martin Heinrich Klaproth.Terwyl hy te werk was in sy ekspertimentele laboratorium inBerlynin 1789, was Klaproth in staat om 'n gelerige verbinding in neerslagvorm (waarskynliknatriumdiuranaat) te skei deur pikblende insalpetersuurop te los, en die oplossing te neutraliseer metnatriumhidroksied.[17]Klaproth het die fout gemaak om aan te neem dat die geel stof 'n oksied van 'n onontdekte element was. Hy het dit methoutskoolverhit, 'n swart poeier verkry, en verneem die poeier is die nuut ontdekte metaal op sigself (inteendeel, daardie poeier was 'n oksied van uraan).[17][18]Hy het die nuutontdekte element na die planeetUranusvernoem, watWilliam Herschelag jaar vantevore ontdek het.[19]
In 1841 hetEugène-Melchior Péligot,'n professor van Analitiese Chemie aan dieConservatoire national des arts et métiers(Sentrale Skool van Kunste en Vervaardigings) inParys,die eerste monster uraanmetaal geskei deururaantetrachloriedte verhit metkalium.[17][20]In 1850 is die eerste kommersiële gebruik van uraan in glas ontwikkel deur Lloyd & Summerfield vanBirmingham,Engeland.Uraan was nie juis gevaarlik beskou gedurende die meeste van die 19de eeu nie, wat tot baie gebruike van die element gelei het. Een van daardie gebruike van die oksied was, soos reeds genoem en nie meer 'n geheim nie, die verkleuring van erdewerke en glas.
Antoine Henri Becquerelhet in 1896radioaktiwiteitontdek deur uraan te gebruik.[9]Becquerel het die ontdekking inParysgemaak deur 'n monster uraansout, K2UO2(SO4)2,bo-op 'nfotografiese plaatte los wat nog nie blootgestel was nie. Hy het opgemerk die plaat wat in 'n laai gelê het, het ‘mistig’ geraak.[21]Hy het beslis dat 'n vorm onsigbare lig of strale wat deur die uraan uitgestraal is, het die plaat blootgestel.
Kernsplytingsnavorsing
[wysig|wysig bron]
'n Span wat deurEnrico Fermiin 1934 gelei is, het waargeneem dat uraan met neutrone gebombardeer die uitstraling vanbeta straleproduseer (elektroneofpositrone;sienbetadeeltjie).[22]Die spytingsproduk was eers verkeerdelik gesien as nuwe elemente metatoomgetalle93 an 94, wat die Dekaan van die Fakulteit van Rome, Orso Mario Corbino, ‘’ausonium’’ en ‘’hesperium’’ onderskeidelik gedoop het.[23][24][25][26]Die eksperimente wat gelei het tot die ontdekking van uraan se vermoë om te splyt (uitmekaar te breek) na ligter elemente en dan diebindingsenergievry te stel was uitgevoer deurOtto HahnenFritz Strassmann[22]in Hahn se laboratorium inBerlyn.Lise Meitneren haar familielid, fisikusOtto Robert Frisch,het in Febuarie 1939 die fisiese verduideliking daarvan gepubliseer, en die proses ‘kernsplyting’ benoem.[27]Gou daarna het Fermi gepostuleer dat die kernsplyting van uraan dalk genoeg neutrone kan vrylaat om 'n kernreaksie te onderhou. Sy hipotese is in 1939 bevestig, en later is daar gevind dat 'n gemiddelde van 2,5 neutrone vrygestel word vir elke splyting van die skaars uraan isotoop, uraan-235.[22]Verdere werk het gevind dat die meer algemene uraan-238 isotoop kangetransmuteerword naplutonium,wat, soos uraan-235, ook splytbaar is deur termiese neutrone. Hierdie ontdekkings het talle lande gelei om aan die werk te spring met die ontwikkeling van kernwapens enkernkrag.
Op 2 Desember 1942, deel van dieManhattan-projek,het 'n ander span wat gelei was deur Fermi die eerste kunsmatige self-onderhoudende kettingreaksie,Chicago Stapel-1geïnisieer. In 'n laboratorium onder die pawiljoen vanStaggveldby dieChicago Universiteit,het hierdie span die regte toestande geskep vir só 'n reaksie deur 360tongrafiet,53 ton uraanoksied en 5,5 ton uraanmetaal op te hoop.[22]
Bomme
[wysig|wysig bron]
Twee hooftipes atoombomme was ontwikkel deur die V.S.A. gedurende dieTweede Wêreldoorlog:'n uraangebaseerde toestel (kodenaam “Little Boy”) met kernmateriaal van hoogsverrykte uraan,en 'n plutoniumgebaseerde toestel (sienTrinity-kernwapentoetsenFat Man) met plutonium afgelei vanaf uraan-238. Die eerste kernwapen wat in 'n oorlog gebruik was, was die uraangebaseerde Little Boy toestel. Dit was oor dieJapannesestadHiroshimaop 6 Augustus 1945 gedetoneer. Die ontploffing was ekwivalent aan 12 500 tonTNT,waarvan die rukwind en termiese golf amper 50 000 geboue en 75 000 mense vernietig het.[21]Aanvanklik was dit geglo dat uraan betreklik skaars is, en datkernvermeerderingvoorkom kan word deur al die uraanvoorrade uit te koop, maar in 'n dekade is groot uraanreserwes ontdek in baie plekke regoor die wêreld.[28]
Reaktore
[wysig|wysig bron]
DieX-10 GrafietreaktorbyOak Ridge Nasionale Laboratorium(ORNL) in Oak Ridge, Tennessee, voorheen bekend as die Clinton Stapel en X-10 Stapel, was die wêreld se tweede kunsmatige kenreaktor (ná Enrico Fermi se Chicago Stapel), maar die eerste reaktor wat ontwerp was vir voortdurende bedryf. DieEksperimentele Kweekreaktor Iby dieIdaho Nasionale Laboratorium(INL) naby Arco,Idahohet die eerste kernreaktor geword om elektrisiteit te produseer, op 20 Desember 1951. Aanvanklik het hierdie reaktor vier 150-wattgloeilampe laat skyn, maar verbeteringe het uiteindelik die reaktor in staat gestel om krag aan die hele fasiliteit te verskaf (later was die hele dorp Arco seelektrisiteitvoorsien deur kernkrag, 'n eerste in die wêreld).[29]Die wêreld se eerstekernkragsentraleop kommersiële skaal, dieObninsk Kernkragsentalein dieSowjetunie,het opwekking begin met reaktor AM-1 op 27 Junie 1954. Ander kernkragsentrales wat gevolg het was Sellafield inEngelandwat opwekking begin het op 17 Oktober 1956[30]en dieShippingport Atomiese KragstasieinPennsilvaniëmet bedryfstelling op 26 Mei 1985. Kernkrag was die eerste keer vir aandrywing gebruik deur 'nduikbootin dieUSS Nautilus(SSN-571) in 1954.[22]
Kontaminasie en die Koue Oorlog nalatenskap
[wysig|wysig bron]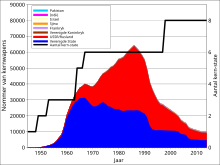
Bogrondsekerntoetsedeur die Sowjetunie en die V.S.A. in die 1950’s en vroeë 1960’s, en deurFrankrykenIsraelin die 1970’s en 1980’s[12]het beduidende hoeveelhedekernafvalvanaf uraan dogterisotope regoor die wêreld versprei.[31]Addisionele afval en besoedeling het voorgekom vanaf verskeiekernongelukke.[32][33]
Uraanmynwerkers toon meer voorvalle vankanker.'n Oormatige risiko van longkanker tussen die Navajo uraanmynwerkers is gedokumenteer, en skakel nou aan hul beroep.[34]In die V.S.A. is 'n wet, die “Bestraling Blootstelling Kompensasie Wet,” in 1990 deurgevoer wat vereis dat $100 000 vir “medelye betaling” aan uraanmyners met kanker of ander respiratoriese kwale betaal moet word.[35]
Gedurende dieKoue Oorlogtussen die Sowjetunie en die V.S.A. is enorme voorrade uraan bymekaargemaak en tienduisende kernwapens was geskep deur verrykte uraan, en gemaakte plutonium vanaf uraan. Sedert die ineenstorting van die Sowjetunie in 1991, word daar beraam dat ongeveer 540 ton hoogs verrykte wapens graaduraan (genoeg om 40 000 kernplofkoppe te maak) gestoor is in fasiliteite met dikwels onvoldoende bewaking in dieRussiese Federasieen ander vorige Sowjetstate.[10]Polisie inAsië,EuropaenSuid-Amerikahet ten minste in 16 gevalle vanaf 1993 tot 2005 gesmokkelde bomgraad uraan- of plutoniumvragte onderskep,die meeste afkomstig vanaf eens Sowjetbronne.[10]vanaf 1993 tot 2005 het die V.S.A. ongeveer $550miljoengespandeer vir die beveiliging van uraan en plutonium voorrade in Rusland.[10]Hierdie geld was gebuik vir die verbetering en sekuriteitsverhoging by navorsing- en stoorfasiliteite. DieScientific Americanhet in Februarie 2006 gerapporteer dat sommige van hierdie fasiliteite se sekuriteit hewig vervalle kettingskakelomheinings beslaan. Volgens 'n onderhoud in die artikel het een van hierdie fasiliteite monsters verrykte (wapengraad) uraan in 'n besemkas gestoor voor die verbeteringsprojek; 'n ander het boekgehou van die kernplofkopvoorraad deur die bewaring van indekskaarte in 'n skoenboks.[36]
Voorkoms
[wysig|wysig bron]Bioties en abioties
[wysig|wysig bron]
Uraan is 'n element wat natuurlik voorkom, en gevind word in lae konsentrasies in alle rotse, grond en water. Uraan is ook die element met die hoogsteatoomgetalwat natuurlik op die aarde voorkom in beduidende hoeveelhede, en word altyd gevind in verbinding met ander elemente.[7]Saam met ander elemente met hoër atoomgetalle as dié vanyster,word dit net natuurlik gevorm insupernovas.[37]Die verval van uraan,toriumenkalium-40in dieaardmantelword beskou as die hoofbron van hitte[38][39]wat diebuitense kern'n vloeistof hou en die mantel konveksie dryf, wat op sy beurt weerplaattektoniekveroorsaak.
Uraan se gemiddelde konsentrasie in dieAardesekorsis (afhangend van die bron) 2 tot 4 dele per miljoen,[8][12]of omtrent 40 keer meer volop assilwer.[9]Daar word bereken dat die aarde se kors vanaf die oppervalk tot sowat 25 km afwaarts bevat 1017kg uraan, terwyl dieoseaandalk ongeveer 1013kg kan bevat.[8]Die konsentrasie van uraan in grond strek van 0,7 tot 11 dele per miljoen (en tot 15 dele per miljoen in landbougrond, weens die gebruik van fosfaatkunsmis) en die konsentrasie in seewater is 3 dele per miljard.[12]
Uraan is meer oorvloedig asantimoon,tin,kadmium,kwik,ofsilwer,en is omtrent so volop soosarseenofmolibdeen.[7][12]Uraan word gevind in honderde tipes minerale, wat uraniniet (die mees algemene uraanerts),karnotiet,autuniet,uranofaan,toberniet,enkoffinietinsluit.[7]In uraanryke ertse kom beduidende hoeveelhede uraankonsentrasies voor, soosfosfaatklipneerslae,en minerale soosligniet- enmonasietsande[7](dit word kommersieel herwin vanuit bronne met so min as 0,1% uraan[9]).

Daar is bewys dat sommige baterieë soosS. putrefaciensenG. metallireducensuraan(VI) kan reduseer tot uraan(IV).[40]
Sommige organismes, soos die korsmosTrapelia involutaofmikroörganismessoos diebakterieCitrobacter,kan konsentrasies uraan absorbeer tot 300 keer hoër as hul omgewing..[41]Citrobacterspesies absorbeeruranielionewanneergliserolfosfaat(of ander soortgelyke organiese fosfate) aan hulle gegee word. Na een dag kan een gram bakterieë bekors word met nege gram uranielfosfaatkristalle; dit skep die moontlikheid dat hierdie organismes inbiogeneeskundetot dieonbesoedelingvan uraan-gekontamineerde water gebruik kan word.[17][42]
In die natuur vorm uraan(VI) 'n hoogs oplosbare karbonaatkomplekseby hoë pH’s (basies). Dit lei tot 'n verhoging in vervoerbaarheid en beskikbaarheid van uraan om vanaf kernafval na grond en ondergrondse water te beweeg, wat kan lei tot gesondheidsgevare. Dit is egter moeilik om uraan in die fosfaatvorm te presipiteer indien oortollige karbonaat teenwoordig is by 'n alkaliese pH. Daar is gevind dat 'nSphingomonassp. stam 'n hoë aktiwiteit alkaliese fosfatase kan uitdruk, wat al toegepas is vir die biopresipitasie van uraan in uranielfosfaat spesies vanuit alkaliese oplossings. Die presipitasie vermoë was verhoog deur die fosfatase proteïen inE. colioormatig uit te druk.[43]
Planteabsorbeer sommige uraan vanuit grond. Droë-gewig konsentrasies uraan in plante wissel van 5 tot 60 dele per miljard, en as wat verkry word uit verbrande hout kan konsentrasies tot 4 dele per miljoen bevat.[17]Droë-gewig konsentrasies uraan invoedselplanteis tipies laer met een tot tweemikrogramper dag, wat ingeneem word deur dit wat mense eet.[17]
Produksie en ontginning
[wysig|wysig bron]
Uraanproduksie wêreldwyd het in 2006 39 655tonbehaal, waarvan 25% ontgin is inKanada.Ander belangrike lande wat uraan myn isAustralië(19,1%),Kasakstan(13,3%),Niger(8,7%),Rusland(8,6%), enNamibië(7,8%).
Uraanerts word gemyn met verskeie metodes:oopgroef,ondergronds,in situ loging,en deurboorgatmyne.[5]Lae graad uraanerts wat ontgin is in 2006 bevat tipies 0,01 tot 0,25% uraanoksides. Omvangryke ekstaksiemetodes moet toegepas word om metaal van die erts te skei.[44]Hoë graad erts wat gevind word in dieAthabasca Kom,Saskatchewan,Kanada kan tot 23% uraanoksiedes op 'n gemiddelde basis bevat.[45]Uraanerts word verbrysel en verwerk tot 'n fyn poeier en dan geloog met óf 'nsuuróf 'nalkali.Die uitgeloogde produk word dan onderwerp aan verskeie stappe vanpresipitering,oplosmiddelekstraksie,enioonuitruiling.Die mengsel wat verkry word, genaamdgeelkoek,bevat ten minste 75% uraanoksides. Geelkoek word dangekalsineerom onsuiwerhede van te malingsproses te verwyder voor verdere verwerking.[46]
Kommersiële graad uraan kan geproduseer word deur diereduksievan uraanhaliedemet 'nalkalimetaalof 'nalkali-aard metaal.[7]Uraanmetaal kan ook voorberei word deurelektoliesevan KU5ofuraantetrafloried,opgelos in 'n gesmeltekalsiumchloriedennatriumchloriedoplossing.[7]Baie suiwer uraan word geproduseer deur dietermiese ontbindingvan uraanhaliedes in 'n warm filament.[7]
Bronne en reserwes
[wysig|wysig bron]Ekonomiese uraanbronne sal vir ongeveer 100 jaar teen die 2006 verbruikingstempo voortbestaan, terwyl dit verwag word dat omtrent dubbel daardie hoeveelheid nog ontdek moet word. Met herverwerking en herwinning kan hierdie reserwes 'n nog vir duisende jare lewer.[47]Daar word beraam dat 5,5 miljoen ton uraanerts reserwes ekonomies ontginbaar is teen US$59/lb,[47]terwyl 35 miljoen ton geklassifiseer word as mineraalhulpbonne (redelike vooruitsigte vir uiteindelike ekonomiese ontginning).[48]'n Beraamde, bykomende 4,6 miljard ton uraan word gevind inseewater(Japannesewetenskaplikes in die 1980’s het bewys dat die ekstraksie van uraan vanuit seewater deurioonuitruilingte gebruik is tegnies moontlik).[49][50]
Uraaneksplorasie neem toe met US$200 miljoen wat wêreldwyd gespandeer is in 2005, 'n 54% toename op die vorige jaar.[48]Hierdie tendens het deur 2006 aangehou, toe eksplorasie-uitgawes tot oor $774 miljoen opgeskiet het, 'n toename oor 250% in vergelyking met 2004.
Australië besit 23% van die wêreld se uraanreserwes,[51]en die wêreld se grootste enkele uraanneerslag is geleë by die Olimpiese Dam Myn inSuid-Australië.[52]
Sommige kernbrandstowwe word verkry vanuit gedemonteerde kernwapens.[53]
Voorraad
[wysig|wysig bron]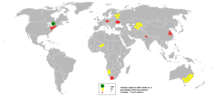
In 2005 het sewentien lande gekonsentreerde uraanoksiedes geproduseer, metKanada(27,9% van die wêreld se produksie) enAustralië(22,8%) die wêreld se grootste produsente, asookKasakstan(10,5%),Rusland(8,0%),Namibië(7,5%),Niger(7,4%),Usbekistan(5,5%), dieV.S.A.(2,5%),Argentinië(2,1%),Oekraïne(1,9%) enChina(1,7%) wat noemenswaardige hoeveelhede produseer.[54]In Kasakstan neem produksie gedurig toe, en mag selfs die wêreld se grootse produsent raak met 'n verwagte produksie van 12 826 ton vir 2009, in vergelyking met Kanada en Australië se verwagte 11 100 en 9 430 ton onderskeidelik.[55][56]Daar word geglo dat die beslissende hoeveelheid beskikbare uraan genoegsaam vir ten minste die volgende 85 jaar sal wees,[48]alhoewel sommige studies toon dat onderbelegging in die laat twintigste eeu voorsieningsprobleme in die 21ste eeu kan veroorsaak.[57]Kenneth S. Deffeyes en Ian D. MacGregor het dit uitgewys dat uraanneerslae blykbaar in 'n logaritmiese-normale verspreiding voorkom. Daar is 'n 300-voudige toename in die herwinbare uraanhoeveelhede vir elke tienvoudige toename in die ertsgraad.[58]Dit beteken dat daar is min hoëgraad-erts beskikbaar teenoor direk eweredige laegraad-erts in 'n meerdere mate.
Verbindings
[wysig|wysig bron]Oksidasietoestande en oksiedes
[wysig|wysig bron]Oksiedes
[wysig|wysig bron]
Gekalsineerde uraangeelkoekwat geproduseer word in baie groot meule bevat 'n verspreiding van uraanoksied spesies in die verskeie vorme wat strek van die mees tot minste geoksideerde toestand. Deeltjies met kort residensie tye in 'n kalsieeroond sal gewoonlik minder geoksideerd wees as dié met langer residensie tye, of deeltjies wat in die skoorsteenskroptoring herwin word. Daar word gewoonlik na 'n uraaninhoud van U3O8verwys, wat dateer uit die dae van dieManhattan-projektoe U3O8gebruik was as 'n analitiese chemie standaard vir verslae.
Fase verhoudingsin die uraan-suurstof stelsel is redelik kompleks. Die mees geoksideerde toestand van uraan is uraan(IV) en uraan(VI), asook hul twee ooreenstemmendeoksiedeswat onderskeidelikuraandioksied(UO2) enuraantrioksied(UO3) heet.[59]Anderuraanoksidessoos uraanmonoksied (UO) en uraanperoksied (UO4•2H2O) bestaan ook.
Die mees algemene vorm van uraanoksied istriuraanoktaoksied(U3O8) en UO2.[60]Albei oksied vorme isvastestowwemet 'n lae oplosbaarheid in water, en relatief stabiel oor 'n wye reeks omgewingstoestande. Triuraanoktaoksied is (afhangende van die toestande) die mees stabiele vorm van uraan en is ook die mees algemene vorm wat in die natuur voorkom. Uraandioksied is die vorm wat algemeen as 'n kernreaktorbrandstof gebruik word.[60]By omgewingstemperature sal UO2geleidelik omskakel in U3O8.Die stabiliteit van uraanoksides maak dit die voorkeur vorm vir uraanberging en verwydering.[60]
Waterige chemie
[wysig|wysig bron]Soute van al vier uraan oksidasie toestande is wateroplosbaaren word bestudeer inwaterige oplossings.Dieoksidasietoestande is: U3+(rooi), U4+(groen), UO2+(onstabiel), en UO22+(geel).[61]'n Klein hoeveelheidvastestofen halfmetaalverbindings,soos UO en US, bestaan vir die oksidasietoestand uraan(II), maar geen eenvoudige ione kom voor nie. Ione van U3+maakwaterstofvry vanuitwateren word dus baie onstabiel beskou. Die UO22+-ioon verteenwoordig die uraan(VI) toestand en kom voor in verbindings soosuranielkarbonaat,uranielchloriedenuranielsulfaat.UO22+vorm ookchemiese kompleksemet verskeieorganiesechelaat-agente, soosuranielasetaat– die mees algemene vorm.[61]
Kabonate
[wysig|wysig bron]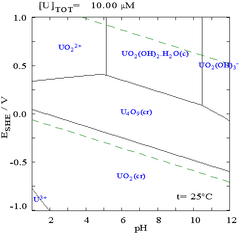

Die wisselwerking van kabonaat anione met uraan(VI) veroorsaak dat diePourbaix diagramnoemenswaardig gewysig word indien die medium vanaf 'n wateroplossing na oplossing wat karbonaat bevat verander. Terwyl die meerderheid karbonate onoplosbaar in water is, is uraankarbonate soms wel oplosbaar in water. Dit is so omdat 'n U(VI)katioonkan bind met twee terminale oksides en drie of meer karbonate om 'n anioonkompleks te vorm.
Die effek van pH
[wysig|wysig bron]

Die uraanfraksie diagramme met die teenwoordigheid van karbonate illustreer dit verder: wanneer die pH van 'n uraan(VI) oplossing vermeerder, sal die uraan omgeskakel word na 'n hidreerde uraanoksied hidroksied en by hoë pH’s sal dit 'n anioniese hidroksiedkompleks word.
Wanneer karbonate bygevoeg word, sal uraan omgeskakel word na 'n reeks karbonaatkomplekse indien die pH vermeerder. Een gevolg van hierdie reaksies is die toename in oplosbaarheid van uraan in 'n pH reeks van 6 tot 8 'n verskynsel wat 'n invloed het op die langtermyn stabiliteit van uitgeputte uraandioksied kernbrandstowwe.
Hidrides, karbides, en nitrides
[wysig|wysig bron]Uraan wat verhit word in die teenwoordigheid vanwaterstofby 'n temperatuur van 250 tot 300 °C reageer omuraanhidriedte vorm. By hoër temperature sal die waterstof omkeerbaar verwyder word. Hierdie eienskap van uraan maak uraanhidrides geskik as 'n begin-materiaal vir die vervaardiging van reaktiewe met verskeie anderkarbiede-,nitriede-, enhaliedeverbindings.[63]Twee kristal veranderinge van uraanhidried betaan: 'n α vorm verkrygbaar teen lae temperature, en 'n β vorm wat geskep word teen temperature bo 250 °C.[63]
Albeiuraankarbidesenuraannitridesis realtiefinertehalfmetaalagtigeverbindings wat minimaal oplosbaar is insure,reageer met water, en kan verbrand inlugom U3O8te vorm.[63]Karbides van uraan sluit uraanmonokarbied (UC), uraandikarbied (UC2), en diuraantrikarbied (U2C3) in. UC en UC2word gevorm deurkoolstofby gesmelte uraan te voeg, of deur die uraanmetaal aankoolstofmonoksiedby hoë termperature bloot te stel. U2C3is stabiel onder 1 800 °C, en word voorberei deur 'n verhitte mengsel UC en UC2onder meganiese spanning te onderwerp.[64]Uraannitrides word verkry deur die direkte blootstelling van die metaal aanstikstofinsluitend unraanmononitried (UN), uraandinitried (UN2) en diuraantrinitried (U2N3).[64]
Halides
[wysig|wysig bron]
Alle uraanfluoride word geskep deururaantetrafluoriedte gebruik (UF4); UF4word self voorberei deur die hidrofluorinering van uraandioksied.[63]Die reduksie van UF4met waterstof teen 'n temperatuur van 1 000 °C produseer uraantrifluoried UF3.Onder die korrekte toestande – temperatuur en druk – sal die reaksie tussen soliede UF4meturaanheksafluoriedgas(UF6) intermediêre fluorides vorm soos U2F9,U4F17en UF5.[63]
Teen kamertemperatuur het UF6'n hoëdampdruk,wat dit gebruiklik maak in diegasdiffusieproses om uraan-235 vanuit die meer algemene uraan-238 isotoop te skei. Hierdie verbinding kan voorberei word uit uraandioksied en uraanhidried deur die volgende proses:[63]
- UO2+ 4 HF → UF4+ 2 H2O (500 °C, endotermies)
- UF4+ F2→ UF6(350 °C, endotermies)
Die gevormde UF6,'n wit vastestof, is hoogsreaktief(by fluorinering, sublimeer maklik (vorm byna 'nperfekte gasdamp)), en is die mees vlugtige verbinding van uraan wat bestaan.[63]
Een metode omuraantetrachloried(UCl4) te berei is deur die reaksie tussenchloormet uraanmetaal of uraanhidried. Die reduksie van UCl4in die teenwoordigheid van waterstof produseer uraantricloried (UCl3) terwyl hoër uraanchlorides geproduseer word deur die reaksie met bykomstige chloor.[63]Alle uraanchlorides reageer met water en lug.
Bromides en jodides van uraan word gevorm deur die direkte reaksie vanbroomenjodium,ooreenkomstig, of deur die addisie van UH3by die betrokke element se sure.[63]Bekende voorbeelde sluit die volgende in: UBr3,UBr4,UI3en UI4.Uraanoksihalides is wateroplosbaar en sluit UO2F2,UOCl2,UO2Cl2en UO2Br2in. Die stabiliteit van oksihalides verminder soos dieatoommassavan die halide komponent toeneem.[63]
Minerale
[wysig|wysig bron]Verwysings
[wysig|wysig bron]- ↑(en)The Chemistry of the Actinide and Transactinide Elements: Third Editionby L.R. Morss, N.M. Edelstein, J. Fuger, eds. (Netherlands: Springer, 2006.)
- ↑(en)Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971)."Detection of Plutonium-244 in Nature".Nature.234:132–134.doi:10.1038/234132a0.
- ↑(en)"Health Concerns about Military Use of Depleted Uranium"(PDF).Geargiveer(PDF)vanaf die oorspronklike op 7 Februarie 2012.
- ↑(en)"WWW Table of Radioactive Isotopes".Geargiveer vanafdie oorspronklikeop 27 April 2007.Besoek op20 April2010.
- ↑5,05,15,25,3(en)Emsley 2001,p. 479.
- ↑(en)"U.S. to pump money into nuke stockpile, increase security,"RIA Novosti18 Februarie 2010
- ↑7,007,017,027,037,047,057,067,077,087,097,107,117,127,137,147,15(en)C. R. Hammond (2000).The Elements, in Handbook of Chemistry and Physics 81st edition(PDF).CRC press.ISBN0-8493-0481-4.
- ↑8,08,18,28,38,4(en)"Uranium".The McGraw-Hill Science and Technology Encyclopedia(5th edition). The McGraw-Hill Companies, Inc.. Geargiveer27 Julie 2011 opWayback Machine
- ↑9,09,19,29,3(en)"uranium".Columbia Electronic Encyclopedia(6th Edition). Columbia University Press. Geargiveer27 Julie 2011 opWayback Machine
- ↑10,010,110,210,310,4(en)"uranium".Encyclopedia of Espionage, Intelligence, and Security.The Gale Group, Inc.. Geargiveer27 Julie 2011 opWayback Machine
- ↑(en)A. D. Rollett (2008).Applications of Texture Analysis.John Wiley and Sons. p. 108.ISBN0-470-40835-9.
- ↑12,012,112,212,312,4(en)Emsley 2001,p. 480.
- ↑(en)"Nuclear Weapon Design".Federation of American Scientists. 1998.Geargiveervanaf die oorspronklike op 28 Augustus 2016.Besoek op19 Februarie2007.
- ↑(en)"Dial R for radioactive – 12 July 1997 – New Scientist".Newscientist.Geargiveervanaf die oorspronklike op 15 Augustus 2014.Besoek op12 September2008.
- ↑15,015,1(en)"Oklo: Natural Nuclear Reactors".Office of Civilian Radioactive Waste Management.Geargiveer vanafdie oorspronklikeop 20 Oktober 2008.Besoek op28 Junie2006.
- ↑(en)Emsley 2001,p. 482.
- ↑17,017,117,217,317,417,517,6(en)Emsley 2001,p. 477.
- ↑(de)M. H. Klaproth(1789). "Chemische Untersuchung des Uranits, einer neuentdeckten metallischen Substanz".Chemische Annalen.2:387–403.
- ↑(en)"Uranium".The American Heritage Dictionary of the English Language(4th edition). Houghton Mifflin Company. Geargiveer27 Julie 2011 opWayback Machine
- ↑(fr)E.-M. Péligot (1842)."Recherches Sur L'Uranium".Annales de chimie et de physique.5(5): 5–47.
- ↑21,021,1(en)Emsley 2001,p. 478.
- ↑22,022,122,222,322,4(en)Seaborg 1968,p. 773.
- ↑(en)Fermi, Enrico (12 Desember 1938)."Artificial radioactivity produced by neutron bombardment: Nobel Lecture"(PDF).Royal Swedish Academy of Sciences.
- ↑(en)De Gregorio, A. (2003). "A Historical Note About How the Property was Discovered that Hydrogenated Substances Increase the Radioactivity Induced by Neutrons". [physics.hist-ph].
- ↑(it)Nigro, M, (2004)."Hahn, Meitner e la teoria della fissione"(PDF).Geargiveer vanafdie oorspronklike(PDF)op 25 Maart 2009.Besoek op5 Mei2009.
{{cite web}}:AS1-onderhoud: ekstra leestekens (link) AS1-onderhoud: meer as een naam (link) - ↑(nl)Peter van der Krogt."Elementymology & Elements Multidict".Geargiveervanaf die oorspronklike op 9 Desember 2009.Besoek op5 Mei2009.
- ↑(en)L. Meitner,O. Frisch(1939)."Disintegration of Uranium by Neutrons: a New Type of Nuclear Reaction".Nature.143:239–240.doi:10.1038/224466a0.
- ↑(en)J.E. Helmreich,Gathering Rare Ores: The Diplomacy of Uranium Acquisition, 1943–1954,Princeton UP, 1986: ch. 10
- ↑(en)"History and Success of Argonne National Laboratory: Part 1".U.S. Department of Energy, Argonne National Laboratory. 1998. Geargiveer vanafdie oorspronklikeop 26 September 2006.Besoek op28 Januarie2007.
- ↑(en)"1956:Queen switches on nuclear power".BBC news.17 Oktober 1956.Geargiveervanaf die oorspronklike op 27 Oktober 2019.Besoek op28 Junie2006.
- ↑(en)T. Warneke, I. W. Croudace, P. E. Warwick, R. N. Taylor (2002). "A new ground-level fallout record of uranium and plutonium isotopes for northern temperate latitudes".Earth and Planetary Science Letters.203(3–4): 1047–1057.doi:10.1016/S0012-821X(02)00930-5.
{{cite journal}}:AS1-onderhoud: meer as een naam (link) - ↑(en)Newtan, Samuel Upton (2007).Nuclear War 1 and Other Major Nuclear Disasters of the 20th Century,AuthorHouse.
- ↑(en)"The Worst Nuclear Disasters".Geargiveer vanafdie oorspronklikeop 26 Augustus 2013.Besoek op22 April2010.
- ↑(en)Gilliland, Frank D. MD; Hunt, William C. MS; Pardilla, Marla MSW, MPH; Key, Charles R. MD, PhD (Maart 2000)."Uranium Mining and Lung Cancer Among Navajo Men in New Mexico and Arizona, 1969 to 1993".New England Journal of Medicine.42(3): 278–283.
{{cite journal}}:AS1-onderhoud: meer as een naam (link) - ↑(en)The History of Uranium Mining and the Navajo People
- ↑(en)Glaser, Alexander and von Hippel, Frank N. "Thwarting Nuclear Terrorism" Scientific American Magazine, Februarie 2006
- ↑(en)"WorldBook@NASA: Supernova".NASA. Geargiveer vanafdie oorspronklikeop 23 November 2010.Besoek op19 Februarie2007.
- ↑(en)Biever, Celeste (27 Julie 2005)."First measurements of Earth's core radioactivity".New Scientist.
{{cite journal}}:Cite journal requires|journal=(hulp) - ↑(en)"Potassium-40 heats up Earth's core".physicsweb. 7 Mei 2003. Geargiveer vanafdie oorspronklikeop 13 Januarie 2012.Besoek op14 Januarie2007.
- ↑(en)Min, M; Xu, H; Chen, J; Fayek, M (2005). "Evidence of uranium biomineralization in sandstone-hosted roll-front uranium deposits, northwestern China".Ore Geology Reviews.26:198.doi:10.1016/j.oregeorev.2004.10.003.
- ↑(en)Emsley 2001,pp. 476 and 482.
- ↑(en)L. E. Macaskie, R. M. Empson, A. K. Cheetham, C. P. Grey, A. J. Skarnulis (1992). "Uranium bioaccumulation by a Citrobacter sp. as a result of enzymically mediated growth of polycrystallineHUO2PO4".Science.257(5071): 782–784.doi:10.1126/science.1496397.PMID1496397.
{{cite journal}}:AS1-onderhoud: meer as een naam (link) - ↑(en)K.S. Nilgiriwala, A. Alahari, A. S. Rao & S.K. Apte (September 2008)."Cloning and overexpression of an alkaline phosphatase PhoK fromSphingomonassp. BSAR-1 for uranium bioprecipitation from alkaline solutions ".Applied and Environmental Microbiology.74(17): 5516–5523.doi:10.1128/AEM.00107-08.ISSN1098-5336.PMC2546639.PMID18641147.
{{cite journal}}:AS1-onderhoud: meer as een naam (link) - ↑(en)Seaborg 1968,p. 774.
- ↑(en)"Athabasca Basin, Saskatchewan".Geargiveervanaf die oorspronklike op 23 Mei 2020.Besoek op4 September2009.
- ↑(en)C. K. Gupta, T. K. Mukherjee (1990).Hydrometallurgy in extraction processes, Volume 1.CRC Press. pp. 74–75.ISBN0-8493-6804-9.
- ↑47,047,1(en)"Exploration drives uranium resources up 17%".World-nuclear-news.org.Geargiveervanaf die oorspronklike op 26 Mei 2020.Besoek op12 September2008.
- ↑48,048,148,2(en)"Global Uranium Resources to Meet Projected Demand".International Atomic Energy Agency. 2006.Geargiveervanaf die oorspronklike op 5 Augustus 2014.Besoek op29 Maart2007.
- ↑(en)"Uranium recovery from Seawater".Japan Atomic Energy Research Institute. 23 Augustus 1999.Geargiveervanaf die oorspronklike op 7 Maart 2016.Besoek op3 September2008.
- ↑(en)"How long will nuclear energy last?".12 Februarie 1996.Geargiveervanaf die oorspronklike op 23 Mei 2020.Besoek op29 Maart2007.
- ↑(en)"Supply of Uranium".Geargiveervanaf die oorspronklike op 12 Februarie 2013.
- ↑(en)"Uranium Mining and Processing in South Australia".South Australian Chamber of Mines and Energy. 2002.Geargiveervanaf die oorspronklike op 23 Mei 2020.Besoek op14 Januarie2007.
- ↑(en)Military Warheads as a Source of Nuclear FuelGeargiveer24 Februarie 2013 opWayback Machine
- ↑(en)"World Uranium Production".UxC Consulting Company, LLC. Geargiveer vanafdie oorspronklikeop 6 Maart 2016.Besoek op11 Februarie2007.
- ↑(en)Posted by Mithridates (24 Julie 2008)."Page F30: Kazakhstan to surpass Canada as the world's largest producer of uranium by last year (2009)".Mithridates.blogspot.Besoek op12 September2008.
- ↑(tr)"ZAMAN GAZETESİ [İnternetin İlk Türk Gazetesi] - Kazakistan uranyum üretimini artıracak<!- Bot generated title ->".Zaman.tr. Geargiveer vanafdie oorspronklikeop 13 Januarie 2009.Besoek op12 September2008.
- ↑(en)"Lack of fuel may limit U.S. nuclear power expansion".Massachusetts Institute of Technology. 21 Maart 2007.Geargiveervanaf die oorspronklike op 5 November 2013.Besoek op29 Maart2007.
- ↑(en)Kenneth S. Deffeyes and Ian D. MacGregor (1 Januarie 1980)."World Uranium Resources".Scientific American. p. 66.Besoek op21 April2008.
- ↑(en)Seaborg 1968,p. 779.
- ↑60,060,160,2(en)"Chemical Forms of Uranium".Argonne National Laboratory.Besoek op18 Februarie2007.
- ↑61,061,1(en)Seaborg 1968,p. 778.
- ↑62,062,162,262,3(en)Ignasi Puigdomenech,Hydra/Medusa Chemical Equilibrium Database and Plotting Software(2004) KTH Royal Institute of Technology, freely downloadable software at[1]Geargiveer29 September 2007 opWayback Machine
- ↑63,0063,0163,0263,0363,0463,0563,0663,0763,0863,09(en)Seaborg 1968,p. 782.
- ↑64,064,1(en)Seaborg 1968,p. 780.
Bronne
[wysig|wysig bron]Volledige bronnelys inligting vir werke aangehaal
- (en)Emsley, John(2001). "Uranium".Nature's Building Blocks: An A to Z Guide to the Elements.Oxford:Oxford University Press.pp. 476–482.ISBN0-19-850340-7.
- (en)Seaborg, Glenn T.(1968). "Uranium".The Encyclopedia of the Chemical Elements.Skokie,Illinois:Reinhold Book Corporation. pp. 773–786. LCCCN 68-29938.
Eksterne skakels
[wysig|wysig bron]| Wikimedia Commons bevat media in verband metUraan. |
| Sienuraanin Wiktionary, die vrye woordeboek. |
- (en)ATSDR Case Studies in Environmental Medicine: Uranium ToxicityU.S. Department of Health and Human Services
- (en)"Public Health Statement for Uranium".CDC.
- (en)Uranium Resources and Nuclear EnergyGeargiveer6 Mei 2013 opWayback Machine
- (en)U.S. EPA: Radiation Information for Uranium
- (en)"What is Uranium?" from World Nuclear Association
- (en)Nuclear fuel data and analysis from the U.S. Energy Information Administration
- (en)Current market price of uranium
- (en)World Uranium deposit mapsGeargiveer9 April 2005 opWayback Machine
- (en)Annotated bibliography for uranium from the Alsos Digital LibraryGeargiveer14 Desember 2005 opWayback Machine
- (en)NLM Hazardous Substances Databank—Uranium, Radioactive
- (en)'Pac-Man' molecule chews up uranium contamination – earth – 17 January 2008 – New Scientist Environment
- (en)Mining Uranium at Namibia's Langer Heinrich MineGeargiveer21 Februarie 2014 opWayback Machine
- (en)Uranium futures market
- (en)World Nuclear News
- (en)webelements Uraan
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Alkalimetale | Aardalkalimetale | Lantaniede | Aktiniede | Oorgangsmetale | Hoofgroepmetale | Metalloïde | Niemetale | Halogene | Edelgasse | Chemie onbekend |


