ديناميكا حرارية
| صنف فرعي من | |
|---|---|
| جزء من | |
| يمتهنه | |
| المواضيع | |
| شخصيات مهمة |
| الديناميكا الحرارية |
|---|
 |
الديناميكا الحرارية[1][2]أوعلم التحريك الحراري[3]أوالتحريكيات الحرارية[4]أوالديناميات الحرارية[1][5]أوالدينامية الحرارية[5]أوالثرموديناميك[3][5]أوالثرموديناميكا[2](باللاتينية:Thermodynamica) هو أحد فروعالميكانيكا الإحصائيةالذي يدرس خواص انتقال الشكل الحراري للطاقة وتحولاته إلى أوجه أخرى منها، مثل تحولالطاقة الحراريةإلىطاقة ميكانيكيةمثلما فيمحرك احتراق داخليوالآلة البخارية، أو تحول الطاقة الحرارية إلىطاقة كهربائيةمثلما فيمحطات القوى، وتحولالطاقة الحركيةإلىطاقة كهربائيةكما فيتوليد الكهرباءمن السدود والأنهار.
وقد تطورت أساسيات علم الترموديناميكا بدراسة تغيرات الحجموالضغطودرجة الحرارةفيالآلة البخارية.معظم هذه الدراسات تعتمد على فكرة أن أينظام معزولفي أي مكان من الكون يحتوي علىكمية فيزيائيةقابلة للقياس تسمىالطاقة الداخليةللنظام ويرمز لها بالرمز (U). وتمثل هذه الطاقة الداخلية مجموعالطاقة الكامنةوالطاقة الحركيةللذرات والجزيئات ضمن النظام، أي جميع الأنماط التي يمكن أن تنتقل مباشرة كالحرارة، كما تنتميالطاقة الكيميائية(المختزنة فيالروابط الكيميائية)والطاقة النووية(الموجودة فينوى الذرات) إلى الطاقة الداخلية لنظام.
بدأت دراساتالديناميكا الحراريةمع اختراعالآلة البخاريةوترتب عليها قوانين كثيرة تسري أيضا على جميع أنواع الآلات؛ وبصفة خاصة تلك التي تحول الطاقة الحرارية إلىشغل ميكانيكيمثل جميع أنواعالمحركاتأو عند تحولالطاقة الحركيةإلىطاقة كهربائيةمثلا أو العكس.
نفرق في الثرموديناميكا بين «نظام مفتوح» و«نظام مغلق» و«نظام معزول». في النظام المفتوح تعبر مواد النظام حدود النظام إلى الوسط المحيط، بعكس النظام المغلق فلا يحدث تبادل للمادة بين النظام والوسط المحيط. وفي النظام المعزول فلا يحدث بالإضافة إلى ذلك تبادلللطاقةبين النظام المعزول والوسط المحيط، وطبقا لقانون بقاء الطاقة يبقى مجموع الطاقات الموجودة فيه (طاقة حرارية،وطاقة كيميائية،وطاقة حركة،وطاقة مغناطيسية...إلخ) تبقى مجموعها ثابتا.
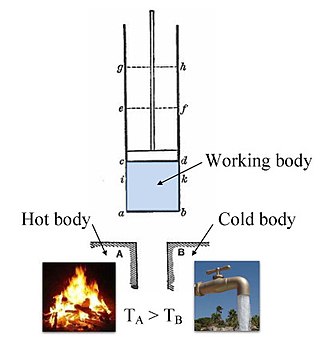
توضح لنا الديناميكا الحرارية اعتمادالحرارةوالشغل الميكانيكيعند حدود النظام علىدوال الحالةالتي تصف حالة النظام. ومن دوال الحالة التي تصف النظام نجد:درجة الحرارةT،والضغطp،وكثافة الجسيماتn،والجهد الكيميائيμوهذه تسمى "خواص مكثفة"، وصفات أخرى مثلالطاقة الداخليةUوإنتروبياS،والحجمVوعدد الجسيماتN، وقد جرى العرف على تسميتهاكميات شمولية.الفرق بين الكميات المكثفة والكميات الشمولية ينحصر في كون الدوال المكثفة لا تتغير بتضخيم النظام (إضافة جزء جديد) مثلالكثافةوالحرارة النوعية، أما الدوال الشمولية أو الكميات الشمولية فهي تزداد بتضخيم النظام مثل عدد الجسيمات،والطاقة الداخلية(المحتوى الحراري في النظام).
أصل الكلمة[عدل]
المصطلح في اللغات الأوروبية (باللاتينية:Thermodynamica) مأخوذ من الأصولاليونانيةθέρμη أيحرارةوδύναμις أيطاقة، وتترجم إلىالديناميكا الحرارية.
تمهيد[عدل]

في أواخر القرن الثامن عشر ظهر علم الديناميكا الحرارية كعلم يدرس تحول الطاقة الحرارية إلى عمل ميكانيكي، واستنادا إلى ذلك وضعت الأسس النظرية لعمل الآلات الحرارية. غير أن التطور المستمر فيالمحركات الحراريةأعطى علم الديناميكا الحرارية أهمية كبيرة تخطت حدود الهندسة الحرارية لتلقى استخداما واسعا في فروع مختلفة من العلوم الأساسية كالفيزياء والكيمياء، وتقنية الطاقة وتقنية المحركات على اختلاف أنواعها وتقنية البطاريات. والديناميكا الحرارية الحديثة هو العلم الذي يتطرق إلى دراسة قوانين التحولات المتبادلة لمختلف أشكال الطاقة، كما ويعالج العمليات أو الظواهر التي تحدث في الطبيعة من خلال تحول الطاقة من شكل إلى آخر. وتختلف الديناميكا الحرارية عن الفيزياء والكيمياء بأنها لا تستند إلى أي نموذج لبناء المادة، كما لا ترتبط بأي تصور عن البنية الجزيئية لهذه المادة، ولكنه يعتمد على القوانين التي تم التوصل إليها تجريبيا.[6]
وعلم الديناميكا الحرارية يرتكز على ثلاث قوانين تجريبيةومعادلة الحالة:[6]
- القانون الأول للديناميكا الحرارية، أو قانون حفظ الطاقة.
- القانون الثاني للديناميكا الحراريةوهو يبين اتجاه سير ظواهر طبيعية تحدث في الطبيعة، مثل انتقال الحرارة من الجسم الساخن إلى البارد.
- القانون الثالث للديناميكا الحراريةوهو يؤكد عدم بلوغ الصفر المطلق لدرجة الحرارة.
وتعطي الديناميكا الحرارية وصفا شاملا للعمليات والظواهر التي تحدث في الطبيعة بصفة عامة، وتفسر لناالتفاعلات الكيميائيةوهي هامة جدا في مجالاتالصناعات الكيماويةوتكرير البترولومحطات الطاقةوإنتاجالبطارياتوكفاءة المحركاتوإنتاج البخار وتعيين خواص الغازات.[6]
يهتم علم الديناميكا الحرارية -كما يدل الاسم-بالحرارةأو الطاقة الحرارية بالدرجة الأولى وبكل الظواهر التي تظهر أو تتعلق بهذه الطاقة مثل عملياتانتقال الحرارةمن جسم لآخر أو كيفية تخزين هذه الطاقة أو توليدها. يقوم علم الديناميكا الحرارية علىأربعة قوانينكبرى وهيالقانون صفر(أو القانون الرابع)والقانون الأولوالقانون الثانيوالقانون الثالث. إلى جانب ذلك وهو الأهم تدرس الديناميكا الحرارية علاقة الحرارة بالتحريك الميكانيكي، مثلما ساعدنا في ذلك على اختراع الآلة البخارية ومحرك البنزين وطرق رفع كفاءتهم، كما تدرس الديناميكا الحرارية العلاقة بين الحرارةوتفاعل كيميائيوتطبيقاتها تجمع بين اختراع البطاريات والمركمات، وأخيرا علاقة الحرارة بالكهرباء حيث تساعدنا على توليدالطاقة الكهربائيةمن عدة وسائل مثل محطات تعمل بالفحم أو بالقوى المائية أوبالطاقة النووية.كل تلك التقنيات تعتمد على تطويرها بغرض رفع كفاءتها على علم الديناميكا الحرارية.
التاريخ[عدل]
قام العالم الفيزيائي الفرنسيسادي كارنوعام 1824 بدراسة كمية الحرارة التي تعمل بهاآلة بخارية.وتبين له أنالبخارالساخن يمكن أن يسخن ماء بارد وأن يقوم بإنتاج عمل ميكانيكي في نفس الوقت. واعتقد كارنو أنه خلال تلك العملية لا يحدث فقدا في الطاقة. كما وصف «كارنو» العمليات الجارية في الآلة البخارية بأنها عملية دورية، أي أنها دورة تتكرر مرارا. واستطاع العالمكلابيرونبعد ذلك بصياغة تلك الدورة في صياغة رياضية وسميت تلك الطريقةدورة كارنو.[7]
ثم جاء الطبيب الألماني «يوليوس ماير» عام 1841 وقدم الافتراض أنالطاقةفي نظام مغلق تكون ثابتة المقدار. فلا يمكن أن تفنى الطاقة، وإنما تتحول من صورة إلى أخرى. هذا الافتراض أصبح معروفاقانون بقاء الطاقة.وقام «ماير» بحسابات في تحويل الحرارة إلى طاقة حركة ميكانيكية. وقام بحساب كمية الطاقة اللازمة لرفع درجة حرارة 1جراممن الماء 1درجة مئوية، وكم تبلغ تلك الطاقة عندما تتحول إلى طاقة ميكانيكية. وأتم ماير الحساب واتضح له أن تلك الكمية من الحرارة تكفي لرفع 1جرام367مترإلى أعلى (في الحقيقة ترفعه 426 متر). وشكلت تلك الحسابات أساساللقانون الأول للديناميكا الحراريةعن الحركة الحرارية (الترموديناميكا).[8]ثم عينجيمس جولعام 1844 المكافئ الميكانيكي الحراري بدقة كبيرة.
وفي عام 1840 قام العالم الكيميائي الألماني السويسريهيرمان هاينريش هسمقالة علمية تحت عنوان: «فحوصات حرارية كيميائية» تتعلق بظاهرة حفظ الطاقة فيالجزيئاتبمشاهداته الحرارة الناتجة من تفاعلات كيميائية.
وبينما كان تصور «كارنو» أن كمية الطاقة تبقى كاملة لا تتغير أثناء عملآلة بخارية، أخذ «ماير» في الحسبان إمكانية تحول الطاقة من صورة إلى أخرى مثل تحولها إلى طاقة حركة عند تشغيل آلة. ثم جاء العالم الفيزيائي الألمانيرودولف كلاوسيوسعام 1854 وربط بين الفكرتين: فكرة كارنو وفكرة ماير، وبيّن أن الآلة البخارية تعمل عندما تسري حرارة من وسط ساخن إلى وسط بارد داخل الآلة، وأيد بذلك فكرة كارنو في أن الطاقة لا تفنى وإنما يمكن أن يتحول جزء منها إلى شغل، أي طاقة ميكانيكية (طاقة حركة). أي أن الطاقة الحرارية لا تبقى بأكملها على صورتها الحرارية - كما كان كارنو يعتقد مقدما - وإنما يتحول جزء منها إلىشغل ميكانيكيويتسرب الباقي إلى الجو المحيط مع العادم.
واتضح ل «كلاوسيوس» أن الطاقة الحرارية في آلة (ألة بخارية) تتحول جزئيا إلى شغل ميكانيكي، والباقي يتسرب في الجو. وتحددالكفاءةلآلة النسبة بين الشغل الميكانيكي الناتج إلى كمية الحرارة المزودة بها الآلة.
تلك المعلومة التي توصل إليها كلاوسيوس شكلت صيغة القانون الثاني للديناميكا الحرارية:«لا توجد آلة تعمل دوريا وينقصر عملها فقط في تحويل الحرارة (كلها) إلى شغل ميكانيكي.»[9]وكمية الحرارة التي لم تنتج شغلا ميكانيكيا أثناء الدورة فهي تُعطى إلى الوسط المحيط. تلك الكمية من الحرارة (طاقة) الغير مستفاد منها ربطها كلاوسيوسبدرجة الحرارةوصاغ منها دالة جديدة أسماهاإنتروبيا.
جميع العمليات التي تسير طبيعيا تحتوي على جزء من الإنتروبيا الغير عكوسية، وظيفتها تصريف الحرارة الغير مستفاد منها إلى الوسط المحيط.
بعد ذلك صاغبولتزمانالإنتروبيا بطريقة يسهل تصورها بأنها مقياس لعدم الانتظام (مقياس للهرجلة في نظام). .[10]وأنه في نظام مغلق (منعزل عن الوسط المحيط) ويحدث فيه تغير عكوسي للحالة فإن فرق الإنتروبيا - بين الحالة الابتدائية والحالة النهاية - يكون مساويا للصفر.
ثم جاء العالم الكيميائي الفرنسي «مارسلين برتلوت» في عام 1862 وبين أن القوة الدافعة وراء تفاعل كيميائي تكمن في الحرارة التي تنتج من التفاعل.
وربطهرمان فون هلمهولتزالألمانيالطاقة الكهربائيةلبطاريةبالطاقة الكيميائيةوالطاقة الحرارية، وتوصل في رسالته العلمية المسماة: «عن حفظ القوة» إلىقانون حفظ الطاقة، بدون علمه عن أعمال «ماير».
ثم تفرغ «هلمهولتز» خلال السنوات التالية لدراسة التفاعلات الكيميائية، وأيد أعمال «برتولت» من حيث نشأة حرارة من تفاعلات كيميائية كثيرة، مع أنه وجد أيضا أن بعضها يبرد أثناء التفاعل. وقام هلمهولتز في رسالته العلمية تحت عنوان:«ترموديناميكية العمليات الكيميائية»[11]بأن الطاقة تتحول خلال تفاعل كيميائي إلى طاقة حرة وطاقة داخلية، تبقى مرتبطة بالنظام.[12]وربط «هلمهولتز»الطاقة الداخليةوالطاقة الحرةبحاصل ضرب الإنتروبياودرجة الحرارة.
وطبقا لهلمهولتز يكون التفاعل الكيميائي ممكنا فقط عندما تنخفض الطاقة الحرارة. كذلك توصل العالم الفيزيائي الكيميائي الأمريكيويلارد غيبسبين الأعوام 1875 - 1878 إلى نفس النتائج التي توصل إليها هلمهولتز.
وسميت العلاقةمعادلة جيبس-هلمهولتزتكريما لهذاين العالمين. وبواسطتها يمكن للكيميائي معرفة إمكانية سير تفاعل وتكوينجزيئاتجديدة. كما يمكنه معرفة درجة الحرارةوتركيز الموادالداخلة في التفاعل والخارجة منه.
بالإضافة إلى الترموديناميكا الكلاسيكية ابتكرت نظرية الحركة الحرارية. وطبقا لهذه النظرية يتكون الغاز من جسيمات - ذرات وجزيئات - تتحرك حرة وعشوائيا وتتصادم ببعضها البعض في فراغ بينها. وعند ارتفاع درجة الحرارة تزداد سرعة حركة الجسيمات وتكثر اصطداماتها وطذلك اصداماتها بجدار الوعاء وتمارس عليه ضغطا.
بجانب الترموديناميكا الكلاسيكية فقد تطورت نظرية الحركة الحرارية للغازات. ويتكون الغاز من جسيمات مثلالذراتأوالجزيئاتتتحرك عشوائيا في فراغ وتحدث بينها اصطدامات. وعندما نرفع درجة حرارة الغاز تتحرك الجسيمات بسرعات أكبر ويزيد معدل اصطدامها بعضها البعض، كما تمارسضغطاعلى جدار الوعاء الموجودة فيه. من العلماء الذين ساهموا في صياغة تلك النظريةرودولف كلاوسيوس،وجيمس ماكسويل،ولودفيغ بولتزمان.[13]واستخدم كل من بولتزمان وماكسويل طرق حساب الاحتمالات (الطرق الإحصائية) بغرض تفسير الكميات الترموديناميكية التي نراها ونقيسها معمليا واعتمادها على خصائص الجزيئات.
قام الفيزيائي «إليوت ليب» عام 1999 بتقديم منظومة للترموديناميكا محاولا تفسير الإنتروبيا بطريقة جديدة، ولكن محاولته هذه لا تغير من نتائج الترموديناميكا الكلاسيكية.
ونظرا للتاريخ الطويل والمراحل العديدة التي تتطورت فيها الترموديناميكا واتساع تطبيقاتها في وصف «الحركة الحرارية التقنية»، (مثل وصف عملمحرك الاحتراق الداخليأو عملالثلاجة)،والترموديناميكا الكيميائية(مثل وصفسرعة التفاعلات الكيميائية)، و «الترموديناميكا الإحصائية» (التي تصف مستويات الطاقة الكمومية في الجوامد) نظرا لهذا التاريخ الطويل فكل من تلك الفروع له طريقته في صياغة المعادلات.
تطور الديناميكا الحرارية وفروعها[عدل]

ساهم في تطور هذا العلمرودولف كلوسيوسوويليام طمسونوهرمان فون هلمهولتز،جوزيه غيبس،وسادي كارنو،وويليم رانكينوغيرهم. وقد تفرع من دراسة الأنظمة الترموديناميكية في عدة فروع، يستخدم كل فرع منها نموذجا خاصا للمعاملة، مثل الاعتماد على تحليل نتائج التجارب أو التحليل الرياضي، أو تطبيق مبادئ خاصة على نظمها المختلفة. من أهم تلك الفروع نذكر:
ترموديناميكا كلاسيكية[عدل]
في الترموديناميكا الكلاسيكية نقوم بوصف حالة نظام (وعلى الأخص في حالة توازنه) وعمليات الأنظمة الحركية الحرارية «أنظمة ترموديناميكية». ويقوم الوصف على استخدام الخواص العينية الكبيرة للنظام التي يسهل قياسها كالحرارة والضغط والحجم، وكذلك وصفها بصياغة معادلات مناسبة للنتائج التجريبية. وفي هذا الإطار تقوم الترموديناميكا الكلاسيكية (أي التقليدية) بدراسة تغيراتالطاقةوالشغلوالحرارةوتغير المادة على أساسقوانين الديناميكا الحرارية.ويعبر التعبير «الكلاسيكية» عن أن الوصف الذي تقوم به لنظام يعتمد على متغيرات معملية يمكن قياسها بالمختبرات، فكانت هي أول سبل تفهمنا خلال القرن التاسع عشر. ثم تبع ذلك محاولات وصف النظام الصغري (أي دراسة كياناته الصغرى) وتمثل ذلك في تطور «الترموديناميكا الإحصائية».
ترموديناميكا إحصائية[عدل]
تسمى الترموديناميكا الإحصائية أيضا «ميكانيكا إحصائية»، وقد نشأت هذه بتقدم معرفتنا عنالنظرية الذريةوتكوين الجزيئات من الذرات خلال النصف الثاني منالقرن التاسع عشرومطلعالقرن العشرين.زودت تلكالمعرفةالترموديناميكا بتفسيرات مبنية على التآثر بين الذراتوالجزيئاتومبنية علىحالات كموميةفي نظام ذرات أو جزيئات وتوزيعها (إحصائيا). ويهتم هذا الفرع بالربط بين الخواص الصغرية لنظام أي في حيز الذرات والجزيئات، وخواصه الشمولية العينية (التي يمكن مشاهدتها معمليا). وتفسير الحركية الحرارية كنتيجة طبيعية لإحصاءات الميكانيكا التقليديةونظرية الكمفي النطاق الصغري. يعود الفضل الأكبر في تفسيرها إلى عالم الفيزياء النمساويلودفيغ بولتزمان.
ترموديناميكا كيميائية[عدل]
تهتم الترموديناميكا الكيميائية (أو الحركية الحرارية الكيميائية) بدراسة العلاقة بينالطاقةوالتفاعلات الكيميائيةوالتحول الكيميائي وكذلك بالتغيرات الفيزيائية المتعلقة بحالة نظام ترموديناميكي من وجهة قوانين الترموديناميكا. يعود الفضل الكبير في تطور فهمنا للترموديناميكا الحرارية إلى اكتشافاتويلارد غيبس1876.
المفاهيم الأساسية[عدل]
المفاهيم الأساسية في الديناميكا الحرارية هي كمية الحرارة ودرجة الحرارة والحرارة النوعية والسعة الحرارية. وتعد مختلف أشكال الجمل الديناميكة الحرارية موضوع الدراسة الذي تتعرض له الديناميكا الحرارية.
النظام الديناميكي الحراري[عدل]

هي جسم أو مجموعة من الأجسام المادية التي تتبادلالطاقةوالمادة فيما بينها، أو مع الوسط المحيط بها (الأجسام الواقعة خارج حدود النظام الدينامي الحراري، والمسماة بالوسط المحيط أو الوسط الخارجي).
مثال:الغاز المحصور في أسطوانة والمكبس يشكلنظاما ديناميكيا حراريا، حيث يمثلالهواء الجويالمحيط بالاسطوانة من الخارج «الوسط المحيط»، وتشكل جدران الاسطوانة مع سطح المكبس حدود النظام ويشكل الغاز المحصور «الجسم العامل».
وتصنف الأنظمة الدينامية الحرارية (بعض البلاد العربية تستخدم تعبير «جملة» بدلا عن «نظام») حسب شروط التبادل للطاقة والمادة مع الوسط الخارجي إلى ما يلي:[6]
- الجملة الدينامية الحرارية المعزولة: وهي النظام الذي لا يتم تبادل لا للطاقة ولا للمادة مع الوسط المحيط.
- الجملة الدينامية الحرارية المغلقة: وهي النظام الذي لا يحدث تبادل للمادة بينه وبين الوسط المحيط ولكن يحدث بينهما تبادلللطاقة.
- الجملة الدينامية الحرارية المفتوحة: وهي النظام التي يحدث بينه وبين الوسط المحيط تبادل للمادة.
ويطلق على مجموعة الخواص الفيزيائية للجملة عند ظروف العمل بالحالة الدينامية الحرارية للجملة، فهناك الحالة المتوازنة (المستقرة)، والحالة غير المتوازنة (غير المستقرة) للجملة الدينامية الحرارية. فالحالة المتوازنة (المستقرة) للجملة الدينامية الحرارية تتميز بأن عناصر الحالة للجملة لا تتغير مع مرور الزمن تحت تأثير الظروف الخارجية الثابتة للوسط المحيط، كما يطلق على حالة الجملة الدينامية الحرارية بأنها متوازنة حراريا عندما تحافظ جميع نقاط الجملة على درجة حرارة ثابتة. وتدعى حالة الجملة الدينامية الحرارية بالمستقرة إذا حافظت عناصر الحالة للجملة في جميع نقاطها على قيم ثابتة تحت تأثير القوى الخارجية ومع مرور الزمن. أما إذا تغيرت قيمة أحد عناصر الحالة تحت تأثير الشروط الخارجية ومع مرور الزمن فتدعى حينئذ الجملة الدينامية الحرارية بغير المستقرة.
كمية الحرارة[عدل]
الحرارة هي إحدى صورالطاقةوتنتقل من نقطة لأخرى أو من جسم لآخر نتيجة للاختلاف في درجة حرارة الجسمين، وتقاس كمية الحرارة بوحدة الطاقة وهيالجول.
إذا قمنا بتسخين 1كيلوجراممنالماءمن درجة حرارة 15درجة مئويةإلى 20 درجة مئوية، يكتسب الماء كمية من الحرارة تساوي:
- كمية الحرارة المكتسبة =الحرارة النوعيةللماء. 5 درجات حرارة =
- = 4810جول/درجة مئوية. 5 درجة مئوية
- = 24050جول
هذه هي كمية الحرارة التي يكتسبها 1 كيلوجرام ماء عند تسخينه ورفعدرجة حرارته5 درجات. وهذا المثال يوضح أيضا الفرق بينالحرارةالتي هيطاقة حراريةوتقاسبالجول، وبيندرجة الحرارةالتي قد نقيسها «بدرجة سيلزيوس» أوكلفن.
يمكن تحويل الحرارة (الطاقة الحرارية) إلى أنواع أخرى من الطاقة مثلطاقة كهربائيةويتم ذلك في محطات القوى، أو تحويل الحرارة إلىطاقة حركيةمثل عملآلة بخاريةأومحرك احتراق داخليوغيرها.
درجة الحرارة[عدل]
درجة الحرارة هي مقياس الاتزان الحراري ونعني بهذا الحالة التي عندها لا تنتقل الحرارة من نقطة لأخرى وذلك لعدم وجود فارق في درجات الحرارة. وتقاس الحرارة بوحداتمئويةأوفهرنهتيةأومطلقة.وتقاس درجات الحرارة بأنواع مختلفة من مقاييس الحرارة أهمها مقياس الحرارة السائلي، ومقياس الحرارة الغازي، ومقياس الحرارة البلاتيني، ومقياس الحرارة ذو المزدوجة الحرارية، وأخيراً مقياس الحرارة المسمى بالبيومتر الضوئي.
الحرارة النوعية[عدل]
هي كمية الحرارة اللازمة لرفع درجة حرارة 1كيلوجراممن المادة درجة مئوية واحدة (أو مطلقة) وبذلك تكون وحدتها هيجوللكل كيلوجرام لكل درجة.
وحدة قياسها هي: جول / (كجم. ْم) أو جول / (كجم. كلفن) (ملحوظة: طبقا للتعريف القديم كانت الحرارة النوعية لمادة هي كمية الحرارة اللازمة لرفع درجة حرارة 1جراممن المادة درجة مئوية واحدة. فكانت وحدتهاسعرة/جرام/درجة).
والجدول أدناه يبين الحرارة النوعية لبعض المواد:
| المادة | جول /(كجم. درجة مئوية واحدة) |
|---|---|
| الماء | 4180 |
| زيت الزيتون | 1971 |
| ألمنيوم | 895 |
| زجاج عادي | 832 |
| نحاس | 389 |
| فضة | 234 |
| الزئبق | 139 |
| الذهب | 125 |
وسبب اختلافالحرارة النوعيةمن مادة إلى أخرى يعود إلى مدى تراصوترابطذراتالمادة ومن ثم قدرتها على احتواء للحرارة.
السعة الحرارية[عدل]
هي كمية الحرارة اللازمة لرفع درجة حرارة كمية معينة من مادة ما درجة مئوية واحدة.
القانون الأساسي في الديناميكا الحرارية[عدل]

يمكن حساب كمية الحرارة Q التي يكتسبها جسمكتلتهM وارتفعت درجة حرارته مقدار dT من العلاقة:
- Q = M. C. dT
أي أن «كمية الحرارة» اللازمة لرفعدرجة حرارةكتلة معينة M من المادة إلى فرق في درجة الحرارة dT، هو حاصل ضربالكتلةM فيالحرارة النوعيةC للمادة في فرق درجات الحرارة. تقاس كمية الحرارة بوحدةالجول.
مع ملاحظة أن:
كل معادلة في الفيزياء والكيمياء لا بد وأن تكونمتجانسةالوحدات، بمعنى:
- =جول
قوانين الديناميكا الحرارية الأربعة[عدل]
القانون الصفري للديناميكا الحرارية[عدل]
إذا كانت حرارة الجسم أ تساوي حرارة الجسم ب وحرارة ب تساوي حرارة ج فإن حرارة أ تساوي حرارة ج.
القانون الأول للديناميكا الحرارية[عدل]
ينص على أن الطاقة في النظام تساويالعملالمبذول (المضاف أو المنتزع) يضاف إليها الطاقة الداخلية (المضافة أو المنتزعة).
أي في نظام مغلق:
حيث (dQ)هي كمية الحرارة التي تخرج من أو تنتقل إلى النظام.
و (dU)هو التغير فيالطاقة الداخليةللنظام (وتعتمد على درجة الحرارة)، و (dW) هوالشغلالمبذول على أو من النظام.
توازن الطاقة في الدورات الحرارية[عدل]

نفترض آلة مكونة منتوربين غازييدخلها البخار ساخنا ويخرج منها باردا مع اكتسابنا لشعل ميكانيكي منه. ثم نقوم بتسخين البخار من جديد لأداء دورة ثانية. يعود الوسط الفعال (البخار) إلى نقطة البداية بعد أداء دورة كاملة في الدورة الحرارية. هذا يسهل حساب الطاقة ولا نحتاج إلى حساب التغيرات فيدوال الحالةللنظام، ويبقى فقط حسابالحرارةوالشغلالمؤدى من النظام خلال الدورة. وسوف نري عندما نتعرض إلىالقانون الثاني للديناميكا الحراريةأنه لا يمكن تحويلالطاقة الحراريةبالكامل إلى شغل (طاقة حركية أو طاقة كهربائية)، حيث لا بد من خروج جزء من الحرارة من النظام في صورة عادم ينتشر في الوسط المحيط (الهواء مثلا).
ويمكن كتابة معادلة التوازن للدورة كالآتي حيث الشغل المكتسب من النظام:
تجمع تلك المعادلةالتكامل الدائريلجميع التيارات الحرارية في الدائرة. ويكون هذا المجموع ذو إشارة موجبة إذا دخلت الحرارة من خارج النظام إليه، وتكون أشارة المجموع سلبة الإشارة إذا خرجت الحرارة من النظام إلى الوسط المحيط. وتكون هي الشغل الذي أداه النظام (محرك مثلا أو كما هو مثالنا هنا في حالةتوربين غازي) خلال دورة واحدة. ونعطي للشغل إشار سالبة عندما نكتسب من النظام شغلا (هذا ما اصطلح عليه العلماء، أن تكون الحرارة أو الشغل الخارج من النظام ذو إشارة سالبة، ويكون ذو إشارة موجبة إذا أدينا نحن شغلا على النظام أو أمددنا النظام بحرارة من الخارج).
تكتب هذه المعادلة أيضا كدالة لمقادير الحرارة:
حيث توضح الحرارة المفقودة من النظام والتي اعطاها النظام غلى الوسط المحيط.
وبالتالي يمكننا حسابالكفاءة الحراريةللآلة:
وتعطينا الكفاءة الحرارية لآلة ما الشغل الناتج من دورتها الحرارية ونسبتها إلى مقدار الحرارة الذي أمددنا الآلة به (وهي تكون عادة في صورة الوقود الذي تحرقة الآلة ولا بد لنا أن ندفع له ثمنا بالدولار أو الجنيهات). وأما جزء الحرارة الذي لم يتحول غلى شغل يستفاد منه فهو يخرج من النظام كعادم وينتشر في الوسط المحيط.
القانون الثاني للديناميكا الحرارية[عدل]
يتعلق القانون الثانيبالاعتلاجأو الأنتروبية وينص على مبدأ أساسي يقول بأن تغيرًا تلقائيًا في نظام فيزيائي لا بد وأن يترافق بازدياد في مقدار اعتلاج هذا النظام.
صاغ العالم الألمانيرودولف كلاوسيوسالقانون الثاني أثناء محاضرته امام الجمعية الفلسفية فيزيوريخفي 24 أبريل 1865 قائلا:
«تميل الانتروبية في الكون إلى نهاية عظمى.»
ويعتبر هذا النص أشهر نص للقانون الثاني. ونظرا للتعريف الواسع الذي يتضمنه هذا القانون، حيث يشملالكونكله من دون أي تحديد لحالته، سواء كان كونا مفتوحا أو مغلقا أو معزولا لكي تنطبق عليه صيغة القانون، يتصور كثير من الناس أن الصيغة الجديدة تعني أن القانون الثاني للحرارة ينطبق على كل شيء يمكن تصوره.ولكن هذا ليس صحيحا فالصيغة الجديدة ماهي إلا تبسيط لحقيقة أعقد من ذلك.
وبمرور السنين اتخذت الصيغة الرياضية للقانون الثاني للديناميكا الحرارية في حالةنظام معزولتجري فيه تحولات معينة الشكل التالي:
حيث:
- Sالإنتروبي(entropy) أو الاعتلاج،
- tالزمن.
والإنتروبيةهي مقياس لعدم النظام في نظام، أي زيادة الهرجلة. والقانون يقول أن الهرجلة تسير تلقائيا وطبيعيا في اتجاه زيادة الهرجلة أو بقائها ثابتة. فمثلا إذا أذبنا قليل منملح الطعامفي كوب من الماء انتشرت جزيئات الملح وتوزعت توزيعا متساويا في الماء. هذه عملية طبيعية تسير من ذاتها، ونقول أن انتروبية النظام قد ازدادت. إذ أن مجموع إنتروبية ملح الطعام «النقي» + إنتروبية الماء النقي يكون أصغر من إنتروبية المخلوط. أي تزداد إنتروبية النظام بأكمله (الماء النقي + الملح) بمرور الزمن بعد الخلط.
القانون الثالث للديناميكا الحرارية[عدل]
«من المستحيل تبريد نظام إلىدرجة الصفر المطلق».
هذا القانون يحدد درجة الصفر المطلق كحد طبيعي لا يمكن تعديها إلى أقل منها. حقيقة أنه يمكن بأداءعملكبير الاقتراب من درجة الصفر المطلقة، مثلما يحدث عند دراسةالميوعة الفائقةللهيليوم-3 حيث تصل درجته الحرجة للميوعة الفائقة عند 0.0026كلفن، إلا أنه من المستحيل التبريد حتى درجة الصفر.
الكمونات الدينامية الحرارية[عدل]
الطاقة الداخليةلنظام (وهي دالةللإنتروبياSوالحجمV وكمية المادة N) وجميع مشتقاتها بواسطةتحويل ليجاندرتعتبر كمونات دينامية حرارية للنظام. وتحول معادلات ليجاندر كمون الانتروبيابالنسبة إلى تغير درجة الحرارة، وكمون الحجمبالنسبة إلى تغير الضغط، وتغير كمية المادةبالنسبة إلى تغيرالكمون الكيميائي.
تستنبط منها 3 أزواج من المتغيراتوينشأ منها بالتاليكمونات ترموديناميكية.
أهم تلك الكمونات والشائعة استعمالا هي (كدوال للمتغيرات فيها):
- طاقة داخلية
- طاقة هلمهولتز الحرة
- إنثالبي
- طاقة غيبس الحرة(الإنثالبي الحر)
- كمون لانداووهو يطبق في حالة العمليات غير العكوسية. (انظر التفاصيل فيكمون دينامي حراري)
الثلاثة كمونات الباقية (ويقل استعمالها) هي:
العمليات الدينامية الحرارية[عدل]
العملية الترموديناميكية هي تغيرنظاممن حالة إلى حالة أخرى، مثل رفع درجة حرارة النظام (غلاية مثلا). وفي حالة تواجد النظام في حالةتوازن ترموديناميكيفيمكن تغير تلك الحالة عن طريق تغيير أحددوال الحالةأو عدة منها، مثل تغييردرجة الحرارةأو تغييرالضغطوالحجموغيرها.
بدأت دراسة «عمليات التحريك الحراري» مع اختراعالآلة البخارية، ثم امتدت بعد ذلك وصاغت قوانينا تنطبق أيضا على جميعالمحركات.وكذلك تنطبق قوانين الحرارة علىتحول الطاقةمن صورة إلى أخرى مثل تحويلطاقة الحركةإلىطاقة كهربائية(كما هو في إنتاج الكهرباء من سدود الأنهار) أو تحويلطاقة كيميائيةإلىطاقة حركةكما هو مسلكمحرك الاحتراق الداخليمثلا أو تحويلطاقة كيميائيةإلىطاقة كهربائيةمثلما يجري فيالبطاريةوفيخلية الوقود.
أنواع عمليات الحركة الحرارية[عدل]
يتغير حالة نظام حركة حرارية بتغير العديد من المتغيرات مثلدرجة الحرارة،والضغطوالحجموالإنتروبياوغيرها. ولدراسة العمليات نسهل على أنفسنا فهمها بجعل أحد تلك المتغيرات ثابتا وملاحظة تغير العوامل الأخرى. من هنا نشأت بعض العمليات التي تهمنا بصفة خاصة نظرا لتطبيقاتها العملية، وخصوصا في دراسة عملالمحركاتوتحويل الطاقةإلى صور مختلفة.
وتنقسم العمليات الترموديناميكية إلى عدة أنواع:
- عملية متساوية الضغط(isobaric): وهي العمليات التي تتم تحت ضغط ثابت. مثال على ذلك التفاعلات الكيميائية التي نجريها في المختبرات، فهي تتم تحت الضغط الجوي.
- عملية متساوية الحجم(isochoric): وهي العمليات التي تتم تحت حجم ثابت.
- عملية متساوية الحرارة(isothermal): وهي العمليات التي تتم تحتدرجة حرارةثابتة، أي نحافظ خلالها على ثبات درجة الحرارة.
- عملية كظومة(adiabatic): وهي العمليات التي تتم في النظام المعزول حراريا عن الوسط المحيط به. أي نمنع خلال تلك العملية أي تبادل للحرارة بين النظام والوسط المحيط.
- عملية متساوية الاعتلاج(isentropic): وهي العمليات التي تتم عنداعتلاجثابت.
- عملية متساوية الإنثالبي(isenthalpic): وهي العمليات التي تتم عندمحتوى حراريثابت.
الخصائص الحرارية[عدل]
من أهم الخصائص الحرارية للمواد:
- الحرارةT
- الضغطP
- الحجمV
- طاقة داخليةU
- الاعتلاج(إنتروبيا) S
- السخانةH (التغير في الإنثالبي يساوي التغير في الطاقة عند ثبوت الضغط لأن H=pv+U)
- السرعة
- العلو
ويمكن تقسيم هذه الخصائص بطريقتين:
- حالية حرارية(كدرجة الحرارةوالضغطوالحجم) أوحالية كالورية، أي معبرة عنالطاقة(كالطاقة الداخليةوالاعتلاجوالسخانة) لجسم أو نظام ما.
- حالية(أي أنها تعبر عن حالة للمادة أو حالة نظام وهي كل الخصائص المذكورة أعلاه، وتسمىدوال الحالة)، أوعملياتية(دوال عملية، أي أنها لا توجد إلا بوجود عملية كعملية انتقال الحرارة من جسم لآخر، وعلى ذلك فهي تمثل «تغير» حالة المادة. ومن هذه الخصائص التي تعتمد على الدوال العمليةالشغلالمكتسب من نظام: فقد يكون شغلا ميكانيكيا، مثلمحرك احتراق داخليأومحرك أوتوأوآلة بخارية...وغيرها، أو شغل كهربائي مثلالبطاريةوخلية الوقودوبطارية ليثيوم أيونالشائع استخدامها في هاتف المحمول.)
المعادلة الحرارية[عدل]
من أهم القوانين التي تصف العلاقة بينالضغطPودرجة الحرارةTوالحجمVوعدد المولاتn فيغاز مثالي:
- PV =n.R.T
حيث R هوثابت الغازات العامولكن هذه العلاقة ليست الوحيدة وهي كذلك ليست صحيحة صحة مطلقة حيث أنه اعتمد في اشتقاقها على بعض الافتراضات المبسطة. افتراضغاز مثاليأنذراتأوجزيئاتالغاز ليس لها حجم ولا توجدقوىبين الجزيئات. كذلك افتراض أن تصادم الجزيئات يكونتصادما مرنا، أي أن الجزيئات لا تغير شكلها عند الاصتدام.
معادلة فان دير فالس[عدل]
معادلةفان دير فالسهي أيضا معادلة حرارية وهي تصف حالةغاز حقيقيحيث تأخذ حجم جسيمات الغاز (الذرات أو الجزيئات) والتآثر بينهم (من قوى جذب أو تنافر) في الحسبان:
حيث a تأخذ قوي التجاذب أو التنافر بين جسيمات الغاز في الحسبان و b تأخذ حجم وشكل الجسيمات في الحسبان.
حساب الطاقة في الترموديناميكا[عدل]
تعيين توازن الطاقة من المبادئ الرئيسية في الثرموديناميكا
يحتاج تغيرطور المادة- مادة صلبة إلىحالة سائلةإلىحالة غازية- وكذلك عمليات الخلط (مثل خلط الملح مع الماء، أو خلط مواد مختلفة) يحتاج إلى «طاقة تحول» مثلحرارة انصهار،وحرارة تبخر،وانثالبي التسامي، أو ما يسمى «إنثالبي التحول»، وبالتالي فإن تلك الطاقة تتحرر خلال سير العملية في الاتجاه العكسي.
وفي حالة تغير كيميائي للمادة يمكن أن تصدر عنها «حرارة تفاعل» أو ما يسمىإنثالبي التفاعل، أو بالعكس يمكن أن يحتاج التفاعل الكيميائي لحرارة من الخارج لكي يسير ويتم.
وبغرض حساب الحرارة الناشئة عن تفاعل كيميائي نقوم أولا بكتابةمعادلة التفاعلمزودةبنسب المواد المختلفة الداخلة والخارجة من التفاعل.انثالبي قياسي للتكوينلكل مادة نقية مشتركة في التفاعل سواء الداخلة في التفاعل والناتجة من التفاعل نجدها في جداول خاصة عند 25درجة مئويةكدرجة حرارة قياسية. ونقوم بجمع إنثالبي المواد الناتجة من التفاعل بنسبها ونطرح منها مجموع إنثالبي المواد الداخلة في التفاعل (قانون هس).
حرارة التفاعل أو «إنثالبي التحول» التي تنتج منتفاعل كيميائيأو منتحول لطور المادةوتنتشر (الحرارة الناتجة) في الوسط المحيط نعطيها إشارة سالبة. وفي حالة تزويدنا للنظامطاقة(حرارة) من الخارج لإتمام التفاعل الكيميائي أو إتمام تحول الطور (مثل تسخين الماء (طور سائل) ليتحول إلى بخار [طور غازي])، فنعطي تلك الحرارة إشارة موجبة.
يعطىالإنثالبيبالمعادلة:
حيث:
- الإنثالبي H
- Uالطاقة الداخلية
- pالضغط
- الحجم V
ويعطىالإنثالبي الحرG بالمعادلة، وهي معروفةبطاقة جيبس الحرة:
حيث:
- Hالإنثالبي
- Tدرجة الحرارةبالكلفن
- Sالإنتروبيا
وبإجراءالتفاضل الكامللمعادلة الإمثالبي الحر، ثم إجراء التكامل على المعادلة يمكن معرفة عما إذا كان التفاعل الكيميائي ممكنا (ذاتيا) أم غير ممكنا:
فإذا كان «فرق الإنثالبيات الحرة» Gلنواتج التفاعل مطروحا منها الإنثالبيات الحرة للمواد الداخلة في التفاعل ذات إشارة سالبة، يكون التفاعل أو تحول الطور ممكنا.وعندما يكون فرق الإمثالبي الحر للتفاعل أو لتحول الطور سالبا الإشارة، ينتج عن ذلك سير التفاعل - طالما لا يوجد ما يعطله - حتى نقطة معينة تصبح عندها .
ويعتبر قانون فاعلية الكتلةحالة خاصة لمثل هذا التوازن، فإذا كان الفرق في الإنثالبيات الحرة ذو إشارة موجبة، فمعنى ذلك أن التفاعل أو تحول الطور غير ممكن.
في عام 1869 كان مارسلين بيرثولد يعتقد أن التفاعلات الكيميائية التيتنشر حرارةهي وحدها الممكنة. وشمل اعتقاده هذا أي تحول أو أي تفاعل كيميائي أنه ممكنا سواء نشر حرارة أم لم تصدر منه حرارة. وكان ذلك بأخذه في الاعتبار شق المعادلة المعبر عن تغيرالإنتروبيا(T*S).
وعلى سبيل المثال:
- عند إذابةسلفات الصوديومفي الماء تنخفض درجة حرارة المحلول عن درجة حرارة الغرفة. فيكون شق الإمنتروبيا في المعادلة ذو إشارة موجبة، وعلي الرغم من ذلك تتزايد درجة عدم الانتظام في المحلول، أي تزداد انتروبية النظام بذوبان السلفات.
- عند انصهار قطعة من الثلج يحتاج الثلح حرارة من الخارج لكي يتحول من طور الثلج (مادة صلبة) إلى سائل (طور السائل.
- لا ترتفع درجة حرارة الماء على الرغم من اكتساب قطعة الثلج حرارة من الجو المحيط، وتتزايد درحة عدم الانتظام وبالتالي تتزايدإنتروبيةالجزيئات في الطور السائل عنه في الطور الصلب.
- تحولالكربونفي وجودثاني أكسيد الكربونلإنتاجأول أكسيد الكربونهو تفاعل كيميائي يتميز بإنثالبية تفاعل موجبة الإشارة. وعن طريق «إنتروبية التفاعل» يمكن إزاحةتوازن التفاعل(انظرتوازن بودوارد) في اتجاه إنتاج أول أكسيد الكربون برفع درجة الحرارة.
أنواع تغير الحالة[عدل]

تحول عكوس:تحول يتم ببطء شديد، يمكن للنظام الحراري في أي نقطة منه العودة في الاتجاه المعاكس معيداً وبدقة تامة جميع الشروط التي قد مرت به في التحول الأصلي المباشر، ويسمى هذا التحول بالتحول الفيزيائي.
تحول لاعكوس:تحول سريع غير قابل للعكس. وتتصف جميع التحولات الطبيعية بأنها لاعكوسية؛ ويسمى هذا التحول بالتحول الكيميائي والسبب تكون ماده جديده.
الدورة المغلقة:تحول يعود فيه النظام إلى نقطة البدء بعد أن يكون قد مر بعدة مراحل مختلفة.
متغيرات مترافقة[عدل]
الفكرة الأساسية في الترموديناميكا هيالطاقة.يقولالقانون الأول للديناميكا الحراريةأن الطاقة الكلية في نظام والوسط المحيط بالنظام تكون ثابتة لا تتغير. فيمكن للطاقة الانتقال إلى النظام عن طريق التسخين أو زيادة الضغط، أو زيادة كمية المادة فيه، كذلك يمكن استخراج طاقة من النظامبالتبريدأوبالتمددفي حجم النظام أو استخراج جزء من مادته.
وفيالميكانيكانحسب التغير في طاقة جسم كحاصل ضرب القوة المؤثرة (ق) على الجسم في المسافة (س) التي انزاحها الجسم.
والمتغيرات المترافقة في الترموديناميكا هي أزواج من المتغيرات ينتمي أحدهما إلىقوةتؤثر على نظام (ترموديناميكي)، والمتغير المرافق يكون بمثابة «الإزاحة» الناتجة،وجداءالإثنين يعطينا كمية الطاقة التي انتقلت إلى الجسم.
من المتغيرات المترافقة التي تهمنا في الأنظمة الترموديناميكية الثلاثة حالات الاتية:
- الضغط-حجم الغاز(إحداثيات ميكانيكية);
- درجة الحرارة-إنتروبية النظام(إحداثيات حرارية);
- كمون كيميائي-عدد الجسيماتفي النظام (إحداثيات مادية).
اقرأ أيضا[عدل]
مراجع[عدل]
- ^ابأحمد شفيق الخطيب(2018).معجم المصطلحات العلمية والفنية والهندسية الجديد: إنجليزي - عربي موضح بالرسوم(بالعربية والإنجليزية) (ط. 1). بيروت:مكتبة لبنان ناشرون.ص. 824.ISBN:978-9953-33-197-3.OCLC:1043304467.OL:19871709M.QID:Q12244028.
- ^ابمعجم الفيزيقا الحديثة(بالعربية والإنجليزية)، القاهرة:مجمع اللغة العربية بالقاهرة، ج. 2، 1986، ص. 317،OCLC:1044656322،QID:Q115526796
- ^ابمعجم مصطلحات الفيزياء(بالعربية والإنجليزية والفرنسية)، دمشق:مجمع اللغة العربية بدمشق، 2015، ص. 484،OCLC:1049313657،QID:Q113016239
- ^المعجم الموحد لمصطلحات الفيزياء العامة والنووية: (إنجليزي - فرنسي - عربي)،سلسلة المعاجم الموحدة(2) (بالعربية والإنجليزية والفرنسية)، تونس:مكتب تنسيق التعريب، 1989، ص. 287،OCLC:1044610077،QID:Q113987323
- ^ابجالمعجم الموحد لمصطلحات الكيمياء: (إنجليزي - فرنسي - عربي)،سلسلة المعاجم الموحدة(5) (بالعربية والإنجليزية والفرنسية)، تونس:مكتب تنسيق التعريب، 1992، ص. 205،OCLC:982029990،QID:Q114804479
- ^ابجدالترموديناميك الهندسي، 1993، د.رضوان المصري، د.ماجدة برمدا، د.نبهان خياطة، مديرية الكتب والمطبوعات الجامعية، منشورات جامعة حلب.
- ^Handbuch der Experimentellen Chemie Sekundarbereich II,Band 7:Chemische Energetik.Aulis Verlag Deubner, Köln, S. 1
- ^Hans Joachim Störig:Kleine Weltgeschichte der Wissenschaften2, Fischer Taschenbuch, Juni 1982, S. 91
- ^Gerd Wedler:Lehrbuch der Physikalischen Chemie.Verlag Weinheim, 1982, S. 59
- ^Lorenz:Abriß der geschichtlichen Entwickelung der Wärmelehre.In:Zeitschrift für Kälteindustrie,1904, Heft 8, S. 144
- ^H. von Helmholtz:Die Thermodynamik chemischer Vorgänge,1882. In:Wissenschaftliche Abhandlungen von Hermann Helmholtz,Band 2. J. A. Barth, Leipzig 1882, S. 958–978
- ^Handbuch der Experimentellen Chemie Sekundarbereich II,Band 7:Chemische Energetik.Aulis Verlag Deubner, Köln, S. 11
- ^Handbuch der Experimentellen Chemie Sekundarbereich II,Band 7:Chemische Energetik.Aulis Verlag Deubner, Köln, S. 9
- ^Schools of thermodynamics– EoHT.info.نسخة محفوظة07 ديسمبر 2017 على موقعواي باك مشين.
| ديناميكا حراريةفيالمشاريع الشقيقة: | |
| |










































