Actina
Plantía:Ficha de familia de proteínes L'actinaye una familia deproteínesglobulares que formen losmicrofilamentos,unu de los trés componentes fundamentales delcitoesqueletode lescélulesde los organismoseucariotes(tamién denominaos eucariontes). Puede atopase comomonómeroen forma llibre, denominadaactina G,o como parte depolímeroslliniales denominaosmicrofilamentosoactina F,que son esenciales pa funciones celulares tan importantes como la movilidá y la contraición de lacélulamientres la división celular.
De la importancia capital de la actina da cuenta'l fechu de que nel conteníu proteico d'una célula supón siempres un eleváu porcentaxe y que'l sosecuenciata biencaltenida,esto ye, que camudó bien pocu a lo llargo de laevolución.[1][2]Por dambes razones puede dicise que la soestructurafoi optimizada. Sobre ésta puédense destacar dos traces peculiares: ye unaenzimaqu'hidrolizaATP,la "moneda universal de la enerxía" de los procesos biolóxicos, faciéndolo bien amodo. Pero coles mesmes precisa d'esamoléculapa caltener la so integridá estructural. Adquier la so forma eficaz nun procesu deplegamientocuasi dedicáu. Amás ye la qu'establez másinteraicionescon otres proteínes de cuantes conócense, lo que-y dexa desempeñar les más variaes funciones qu'algamen a cuasi tolos aspeutos de la vida celular. Lamiosinaye un exemplu de proteína que xune actina. Otru exemplu ye lavilina,que puede enxareyar la actina en fexes o bien cortar los filamentos d'actina, dependiendo de la concentración de catióncalciuna so redolada.[3]
Formando microfilamentos nun procesu dinámicu apurre un andamiaxe que dota a la célula d'una forma con posibilidá de remocicase rápido en respuesta a la so redolada o aseñalesdel organismu, por casu, aumentando la superficie celular pa l'absorción o apurriendo soporte a l'adhesión de les célulespa formartexíos.Sobre esti andamiaxe pueden fondiase otres enzimes,orgánuloscomo'lcilio,dirixir la deformación de lamembrana celularesterna que dexa laingestión celularo lacitocinesis.Tamién puede producir movimientu, bien por ella mesma o ayudada demotores moleculares.D'esa manera contribúi a procesos como'l tresporte intracelular devisículesyorgánulosy lacontraición muscular,o la migración celular, importante neldesarrollu embrionariu,arreglu de firíes o invasividad delcáncer.L'orixe evolutivu d'esta proteína puede rastrexase nescélules procariotas,onde esisten equivalentes. D'últimes ye importante nel control de laespresión xénica.
Un bon númberu d'enfermedaestienen como basealteraciones xenétiquesenapanfilosde losxenesque gobiernen la producción de la actina o de les sos proteínes acomuñaes, siendo tamién esencial nel procesu d'infeiciónde dalgunosmicroorganismospatóxenos.Les mutaciones nos distintos xenes d'actina presentes n'humanos causenmiopatíes,variaciones nel tamañu y la funcióncardiacaysordera.Los componentes del citoesqueleto tamién tienen rellación cola patoxenicidá debacteriesintracelulares yvirus,especialmente en procesos rellacionaos col fuximientu de la respuesta delsistema inmune.[4]
Historia
[editar|editar la fonte]
L'actina foi reparada esperimentalmente per primer vegada en1887porW.D. Halliburton,quien estrayxo unaproteínamuscularque coagulaba preparaciones demiosina,denominándolo "formientu de la miosina".[5]Sicasí, Halliburton foi incapaz d'efeutuar la carauterización de les sos observaciones, y por ello'l descubrimientu atribuyir a Brúnó F. Straub, entós un mozubioquímicuque trabayaba nel llaboratoriu d'Albert Szent-Györgyinel Institutu de química médica de laUniversidá de Szeged,n'Hungría.

En1942,Straub desenvolvió una nueva téunica pa laestraiciónde proteínes musculares que-y dexaba aisllar cantidaes sustanciales d'actina relativamentepura.Esti métodu ye'l mesmu qu'esencialmente s'utiliza nosllaboratoriosanguaño. Szent-Györgyi describiera primeramente una forma másmafosade miosina, producida por estraiciones lentes en músculu, como "miosina activada" y yá que la proteína de Straub producía l'efeutu activador, denominaractina.La mafa menguaba si añadíaseATPal amiestu de dambes proteínes, conocida comoactomiosina.El trabayu de dambos nun pudo ser publicáu nos países occidentales debíu al ambiente bélico de laSegunda Guerra Mundial,saliendo a la lluz en1945cuando foi publicáu como suplementu deActa Physiologica Scandinavica.[7]Straub siguió trabayando na actina hasta1950,publicando que podía xunise alATPy que, mientres lapolimerizaciónde la proteína pa formarmicrofilamentos,s'hidrolizabaa ADP +Pi,que permanecía xuníu al filamentu. Straub suxirió qu'estareaicióndesempeñaba un papel na contraición muscular, pero esto namái ye ciertu nel casu delmúsculu llisuy nun foi verificáu esperimentalmente hasta2001.[8][9]
Lasecuencia d'aminoácidosfoi completada por Elzinga y collaboradores en1973,[10]y laestructura cristalográficade la actina G foi determinada en1990por Kabsch y collaboradores, anque se trataba d'un cocristal nel que formaba un complexu coladesoxirribonucleasa I,[11]siendo propuestu un modelu'l mesmu añu pa la actina F por Holmes y los sos collaboradores.[12]Esti procedimientu de cocristalización con distintes proteínes foi emplegáu repetidamente mientres los siguientes años, hasta qu'en2001llogróse cristalizar la proteína aisllada xunto con ADP. Foi posible gracies al emplegu d'un conxugáu derodaminaque torgaba la polimerización bloquiando l'aminoáciducys-374.[13]Esi mesmu añu produció'l fallecimientu de Christine Oriol-Audit, la investigadora qu'en1977consiguió cristalizar per primer vegada la actina n'ausencia de ABP's. Los cristales resultaron demasiao pequeños pa la teunoloxía de la dómina.[14]
Anque anguaño nun esiste un modelu d'alta resolución de la forma filamentosa, l'equipu de Sawaya realizó en2008un aproximamientu más exactu basándose en múltiples cristales dedímerosd'actina que contauten en distintos llugares.[15]Esti modelu foi refináu por el mesmu autor y por Lorenz. Otros enfoques, como l'usu decriomicroscopía electrónicaoradiaciónsincrotróndexaron apocayá aumentar el nivel de resolución y entender con mayor fondura la naturaleza de les interaiciones y los cambeos conformacionales implicaos na formación del filamentu d'actina.[16][17]
Estructura
[editar|editar la fonte]L'actina ye una de les proteínes más abondoses ente loseucariotesy atópase presente en tou la citoplasma.[3]Ello ye que nesfibres muscularesrepresenta'l 20% en pesu de proteína celular total y, n'otres célules animales, bazcuya ente'l 1 y el 5%. Sicasí, nun esiste un únicu tipu d'actina, sinón que los sosxenescodificantes atópense definíos por unafamilia multigénica(familia que, en plantes, alluga más de 60 elementos, ente xenes ypseudogenesy, n'humanos, más de 30).[18]Esto significa que la información xenética de cada individuu tien instrucciones pa xenerar variantes de la actina (denominaesisoformes) que van tener funciones llixeramente distintes. D'esta miente, los organismos eucariotesespresendistintos xenes que dan llugar a: la actina α, que s'atopa n'estructures contráctiles; la actina β, nel cantu n'espansión de les célules qu'empleguen la proyeición d'estructures celulares como métodu de movilidá; y la actina γ, nos filamentos de lesfibres de estrés.[19]Amás de les semeyances esistentes ente les isoformas d'un organismu, tamién esiste unacaltenimientu evolutivutocantes a estructura y función ente organismos d'inclusivedominiosdistintos aleucariota:enbacteriesconozse l'homóloguMreB,una proteína que ye capaz de polimerizar en microfilamentos;[17]y n'arquiesesiste un representante (Ta0583) entá más similar a les actines d'eucariotes.[20]
L'actina presentar na célula en dos formes: como monómeros globulares denominaos actina G y como polímeros filamentosos denominaos actina F (esto ye, filamentos compuestos d'ensame de monómeros d'actina G). L'actina F puede denominase tamién filamentu. A cada hebra d'actina xúnese una molécula d'adenosín trifosfato(ATP) o d'adenosín difosfato(ADP) de la mesma acomuñada a un catiónMg2+.De les distintes combinaciones posibles ente les formes d'actina y el nucleótido trifosfato, na célula predominen la actina G-ATP y la actina F-ADP.[21][22]
Actina G
[editar|editar la fonte]Tocantes a la so estructura molecular, la actina G tien una apariencia globular almicroscopiu electrónicu de barríu;sicasí, por aciucristalografía de rayos Xpuede apreciase que ta compuesta de dos lóbulos separaos por una hendidura; la estructura conforma'lplega ATPasa,un centru decatálisis enzimáticacapaz de xunir el ATP y Mg2+y hidrolizar el primeru a ADP másfosfatu.Esta plega ye un motivu estructural calteníu que tamién ta presente n'otres proteínes que interaccionan connucleótidos trifosfatocomo lahexoquinasa(una enzima delmetabolismuenerxéticu) o les proteínesHsp70(una familia de proteínes que contribúin a qu'otres proteínes tengan estructures funcionales).[23]L'actina G namái ye funcional cuando tien o bien ADP o bien ATP na so hendidura; sicasí, na célula predomina l'estáu xuníu a ATP cuando la actina atópase llibre.[21]

L'actinacristalizadapor Kabsch, que ye la más utilizada como modelu n'estudios estructurales, yá que foi la primera en serpurificada,procede delmúsculu esqueléticudeconeyu.Tien unes dimensiones averaes de 67 x 40 x 37Å,unmasa molecularde 41785Day unpuntu isoeléctricoenvaloráu en 4,8. El socarga netaapH= 7 ye de -7.[24] [25]
- Estructura primaria
Lasecuencia d'aminoácidoscompleta d'esti tipu d'actina foi determinada por Elzinga y collaboradores en1973,y afinada en trabayos posteriores pol mesmu autor. Contién 374 residuos d'aminoácidos.El so estremuN-terminalye bienácidu.Empieza con unaspartatoacetiláunel so grupu amino, ente que'l soC-terminalyebásicu,formáu por unafenilalaninaprecedida por unacisteínade cierta importancia funcional. Dambos estremos asitiar nuna posición bien próxima dientro del subdominiu I. Tocantes a aminoácidos anómalos, cabo destacar unaNτ-metilhistidinaen posición 73.[24]
- Estructura terciaria-dominios
Ta formada por dosdominiosconocíos como grande y pequeñu, dixebraos por una hendidura en que'l so centru asitiar el llugar d'unión alATP-ADP+Pi.Per debaxo d'ésti esiste una escotadura de menor fondura llamada "riegu". Cuando s'atopen enforma nativa,a pesar del so nome, dambos tienen un tamañu equiparable.[10]
Nos estudiostopolóxicos,por convención, la proteína empobínase de manera que'l dominiu mayor queda a la izquierda, ente que'l menor asítiase a la derecha. Nesta posición, el dominiu pequeñu estrémase de la mesma nel subdominiu I (posición inferior, residuos 1-32, 70-144 y 338-374) y subdominiu II (posición cimera, residuos 33-69). El dominiu mayor tamién s'estrema n'otros dos, el subdominiu III (inferior, residuos 145-180 y 270-337) y el subdominiu IV (cimeru, residuos 181-269). La zona espuesta de los subdominios I y III denominar estremu "barbáu", ente qu'a la de los subdominios II y IV llámase-y estremu "en punta de flecha". Esta denominación fai referencia al fechu de que por cuenta de la pequeña masa del subdominiu 2, la actina adquier polaridá, que se va aldericar darréu al falar de la dinámica d'ensamblaxe. Dellos autores nomen los subdominios como Ia, Ib, IIa y IIb, respeutivamente.[26]
- Otres estructures destacaes
- La estructura supersecundaria más destacada ye unaβ-lláminade cinco cadenes que se componen d'un β-meandro y una unidá β-α β dextrógira. Ta presente en dambos dominios. Esto suxer que la proteína surdió por duplicación xénica.[11]
- El llugar d'unión aladenosín nucleótidoatopar ente dos estructures en forma deforqueta βpertenecientes a los dominios 1 y 3. Los residuos implicaes son Asp11-Lys18 y Asp154-His161 respeutivamente.
- Xusto debaxo del nucleótido atópase'l llugar d'unión alcatión divalente,quein vivoye con mayor probabilidá'lMg2+o'lCa2+ente quein vitroye'l formáu por una estructura quelante na que contribúin laLys18y dososíxenosde losfosfatosα y β delnucleótido.Esti calciu ta coordináu con seis molécules d'agua que s'atopen reteníes polos aminoácidosAsp11,Asp154, yGln137.Xunto col nucleótido forma un complexu qu'acuta los movimientos d'una rexón llamada gonciu ohinge,asitiada ente los residuos 137 y 144, calteniendo d'esta manera la forma nativa de la proteína, hasta'l puntu de que la so retiradadesnaturalizael monómero d'actina. Esta rexón tamién ye importante, porque determina les conformances "abierta" o "zarrada" de la hendidura de la proteína.[26][13]
- Con cuasi toa probabilidá esisten siquier otros trés centros con menorafinidá(entemedia) y otros de baxa afinidá pa cationes divalentes. Especulóse sobre'l papel d'estos centros na polimerización de la actina actuando na etapa d'activación.[26]
- Nel subdominiu 2 esiste una estructura, llamada bucle-D oD-looppor cuenta de que xúnese a l'ADNasa I,asitiada ente los residuosHis40yGly48qu'apaez como un elementu desordenáu na mayoría de los cristales y como una llámina β cuando ta formando complexu cola ADNasa I. Según Domínguezet al.,l'eventu clave de la polimerización sería l'espardimientu d'un cambéu conformacional dende'l centru d'unión al nucleótido hasta esti dominiu, que pasaría de ser un bucle a una héliz. Esta teoría paez ser refutada por otros trabayos.[13][27]
Actina F
[editar|editar la fonte]Una descripción clásica afirma que la actina F tien una estructura filamentosa interpretable como unahélizlevógiramonocatenaria con xiru de 166º y medría de 27,5Åo bien como una hélizdextrógirabicatenaria con mediu pasu de rosca de 350-380 Å, tando cada actina arrodiada d'otros cuatro.[28]La simetría del polímeru d'actina, que ye d'unes 2,17 subunidades por vuelta de héliz ye incompatible cola formación decristales,que namái ye posible cuando éstes son esautamente 2, 3, 4 ó 6 subunidades por vuelta. Por tanto, débense efeutuarmodelosinterpretando datos procedentes de téuniques que salven estos inconvenientes, como lamicroscopía electrónica,lacriomicroscopía electrónica,cristales de dímeros en distintes posiciones odifraición de rayos X.[17]Ye necesariu precisar que falar d'una "estructura" nun ye correutu pa daqué tan dinámicu como un filamentu d'actina. En realidá tendría de falase de distintos estaos estructurales, ente los cualos el datu más constante ye la medría de 27,5 Å, ente que la rotación de les subunidades amuesa una considerable variabilidá, siendo normal reparar desplazamientos d'hasta'l 10% de la so posición ideal. Delles proteínes, como lacofilina,paecen amontar l'ángulu de xiru, pero nuevamente puede interpretase que, en llugar d'ello, estabilicen dellos "estaos estructurales" normales. Estos podríen ser importantes nel procesu de polimerización.[29]
En cuanto al radiu de xiru o grosez del filamentu, les midíes son más revesoses: mientres los primeros modelos asignáben-y un llargor de 25 Å, datos actuales de difraición de rayos X sofitaos por criomicroscopía electrónica coinciden nunos 23,7 Å. Estos mesmos estudios determinaron con bastante precisión los puntos de contautu ente monómeros. Unos establécense con unidaes de la mesma cadena, ente l'estremu "barbáu" d'un monómero y l'estremu "en punta de flecha" del siguiente, ente que los monómeros de cadenes axacentes faen contautu lateralmente por aciu proyeiciones del subdominiu 4, siendo les más importantes la formada pol C-terminal y un enllaz hidrofóbicu formáu por trés cuerpos nos qu'intervienen los residuos 39-42, 201-203 y 286. Pa formar parte d'un filamentu, según esti modelu, los monómeros taríen nuna configuración llamada "plana", na que los subdominios xiren ente sigo, y que tamién paez atopase nel homólogu bacterianu de la actinaMreB.[17]
Puesto que toles subunidades d'un filamentu apunten escontra'l mesmu estremu, dizse que'lpolímerupresenta polaridá na so estructura. Esti fechu da llugar a una convención: nomar al estremu que tien una subunidad d'actina esponiendo'l llugar pol que xune ATP al mediu como «estremu (-)» ente que nel opuestu, nel cual la hendidura ta dirixida a otru monómero axacente, ye'l «estremu (+)».[19]La denominación «en punta de flecha» y «barbáu» de los estremos de los microfilamentos deber al so aspeutu almicroscopiu electrónicu de tresmisióncuando se procesen por aciu una téunica denominada «decoración». Esti métodu consiste na adición d'elementos S1 de lamiosinaen texíos fitos conacedu tánico;esta miosina xune de forma polar a los monómeros d'actina, lo que da llugar a una configuración asemeyada a fleches con plumes a lo llargo de tol so fuste, onde'l fuste correspondería a la actina y les plumes a la miosina. D'esta miente, l'estremu del filamentu que queda ensin miosina sobresaliendo interprétase como la punta de la flecha, mientres l'opuestu denominar barbáu.[30]
Nelmúsculu,el filamentu helicoidal de la actina F contién tamién una molécula detropomiosina,una proteína d'un llargor de 40nanómetrosque s'endolca alredor de la héliz d'actina F. Mientres l'estáu de reposu celular, la tropomiosina anubre los sitios activos de la actina de cuenta que nun se llogra la interaición actina-miosina que produz la contraición muscular. Xuníes a lo llargo de la hebra de tropomiosina hai otres molécules proteiques, lestroponines,complexos de tres polímeru:troponina I,troponina Tytroponina C.[31]
Plegamientu
[editar|editar la fonte]
L'actina puede adquirir bonalmente una gran parte de la soestructura terciaria.[33]Sicasí, amuesa un comportamientu bien especial y cuasi únicu na forma en qu'adquier la soforma dafechu funcionala partir de la so forma nativa reciénsintetizada.La razón d'una ruta tan especial podría ser la necesidá d'evitar la presencia de monómeros d'actina mal plegaos, que seríen tóxicos yá que podríen actuar de terminadores desaparentes de la polimerización. Sía que non, ye clave pa la estabilidá del citoesqueleto, y non yá esto, sinón que podría ser un procesu esencial pa la coordinación delciclu celular.[34][35]
Pa ello emplega obligadamente un tipu dechaperonina(proteína qu'ayuda a otres a plegase)citosólicadel grupu II, la CCT, formada por un doble aniellu d'ocho subunidades distintos (heteroctamérico) que s'estrema de les demás chaperonas moleculares, y n'especial de la so homóloga n'arquiesGroELen que nun precisa d'una co-chaperona qu'actúe de tapadoria sobre'l cuévanu centralcatalítica.Acepta sustratos xuniéndose a ellos por aciu dominios específicos, polo qu'en principiu se pensó que yera esclusiva d'actina ytubulina,anque anguaño viose porinmunoprecipitaciónque siquier interactúa con un gran númberu depolipéptidos,posiblemente comosustratos.Actúa por aciu cambeos conformacionales dependientes de ATP, precisando n'ocasiones de delles rondes de lliberación y catálisis pa completar el so trabayu.[36]
Pal so correutu plegamientu, la actina y la tubulina tamién precisen específicamente del concursu d'otra proteína, laprefoldina,un complexu heterohexamérico (formáu por seis subunidades distintes), y tan específicamente qu'inclusive hancoevolucionado.Nel casu de la actina, xúnese darréu a ella mientres entá se ta traduciendo, aproximao cuando tien un llargor de 145aminoácidos,que son los correspondientes al dominiu N-terminal.[37]
Empléguense subunidades de reconocencia distintes pa la actina y la tubulina, anque asolapaes. Probablemente nel casu de la actina tratar de les subunidades PFD3 y PFD4 que se xunen a la actina en dos llugares, el I, ente los residuos 60–79 y el II, ente los residuos 170–198. L'actina reconozse, carga y entrega a la CCT en conformanza abierta pela parte interna del estremu de los "tentáculos" de la prefoldina (ver imaxe y nota al pie).[n. 1]El contautu nel momentu de la entrega ye tan curtia que nun se llega a formar un complexu ternariu, lliberar la prefoldina de momentu.[32]

Darréu, la chaperonina citosólica (CCT) efectúa'l plegamientu de la actina de forma secuencial, y formando uniones coles subunidades, en llugar d'a cencielles zarrala nel so cuévanu.[n. 2]Pa ello tien zones específiques de reconocencia nel so dominiu apical. La primer etapa del plegamientu consistiría na reconocencia de los residuos 245-249. Darréu, otros determinantes estableceríen contautu.[38]Tanto la actina como la tubulina xunir a la CCT en conformances abiertes n'ausencia de ATP. Nel casu de la actina, en cada cambéu conformacional xunir a dos subunidades, a diferencia de la tubulina, que lo fai a cuatro. L'actina tien secuencies d'unión específiques, interactuando coles subunidades CCTδ y β o bien con CCTδ y CCTε. Tres la unión de AMP-PNP a la CCT, los substratos van moviéndose pol cuévanu de la chaperonina. Paez ser tamién que nel casu de la actina precísase la proteína CAP como un posible cofactor nos estadios finales del plegamientu de la actina.[35]
Entá nun se conoz con exactitú la regulación d'esti procesu, pero sábese que la proteína PhLP3 (proteína asemeyao a lafosducina) regula la so actividá tornándola, por aciu la formación d'un complexu ternariu.[36]
Mecanismu catalíticu de la ATPasa
[editar|editar la fonte]L'actina ye unaATPasa,esto ye, unaenzimaqu'hidrolizaATP. Esti conxuntu d'enzimes carauterizar por actuar con estrema lentitú. Sábese qu'esta ATPasa se "activa", o lo que ye lo mesmo, la so velocidá aumenta unes 40 000 vegaes cuando la actina forma parte d'un filamentu.[29]Un valor de referencia pa esta tasa d'hidrólisis so ciertes condiciones ideales sería de 0,3s-1.Darréu, el Pipermanecería llargu tiempu xuníu a la actina xunto al ADP, lliberar cerca del estremu del filamentu.[39]
A día de güei nun se conocen los detalles moleculares concretos del mecanismu catalíticu. Anque esiste muncho discutiniu al respeutu, paez claro que pa la hidrólisis de ATP precísase una conformanza "zarrada", y créese qu'avera los residuos implicaes a la distancia fayadiza.[29]Unu de los residuos clave seríaGlu137,asitiáu nel subdominiu 1. La so función sería fondiar la molécula d'agua que produz unataque nucleofílicoalenllazdel fosfatu γ del ATP, mientres el nucleótido xúnese fuertemente a los subdominios 3 y 4. La lentitú del procesu catalíticu deber a la gran distancia y posición sesgada d'esta molécula d'agua con al respective de la so reactante. Con muncha probabilidá, el cambéu conformacional que se produz por rotación de dominios ente les formes G y F de la actina avera la Glu137, dexando la so hidrólisis. Según esti modelu, la polimerización y la función ATPasa taríen desacopladas nun primer momentu.[17]
Dinámica d'ensamblaxe
[editar|editar la fonte]
L'actina F combina les cualidaes de serresistencia de materiales resistentey dinámica. A diferencia d'otrospolímeros,como l'ADN,que caltienen xuníos los sos elementos constitutivos por aciuenllaces covalentes,nos filamentos d'actina los monómeros se ensamblan por enllaces más débiles de tipu non covalente. Esto, qu'en principiu debilita la estructura, yá que podría rompese porbaturiciu térmicu,solucionar por aciu los enllaces llaterales colos monómeros vecinos. Coles mesmes, los enllaces débiles caltienen la ventaya de que los estremos del filamentu pueden lliberar o incorporar fácilmentemonómeros,de manera que pueden remocicase rápido y camudar la estructura celular de la que son responsables en respuesta a estímulos ambientales. Esto últimu y el mecanismubioquímicupol que s'efectúa ye lo que se conoz como "dinámica d'ensamblaxe".[4]
- Estudiosin vitro
Los estudios de la dinámica de adición y perda de subunidades de los microfilamentos realizáronsein vitro(esto ye, nel llaboratoriu, fora de sistemes celulares) por cuenta de que'l polímeru d'actina resultante da llugar a la mesma actina F producidain vivo,onde esti procesu ta controláu por ensame de proteínes pa responder a les necesidaes celulares, de cuenta que sería bien difícil reparar les sos condiciones básiques.[40]In vitro,esti fechu producir de forma secuencial: primero, dase una fase d'activación», na que la unión ya intercambiu de cationes divalentes en llugares específicos de la actina G, xuníu a ATP, producen un cambéu conformacional, conocíu dacuando como Actina G* o monómero d'actina F, yá que ye más asemeyada a les unidaes que s'asitien nel filamentu.[26]Esto preparar pa la siguiente «fase de nucleación», na cual la actina G da llugar a pequeños fragmentos inestables d'actina F capaz de polimerizar. Primeramente fórmensedímerosy trímeros de manera inestable. Cuando'l númberu d'estos ye lo suficientemente grande, tien llugar la fase de elongación», na que'l filamentu fórmase y crez rápido por aciu la adición reversible de nuevos monómeros a dambos estremos.[41]Finalmente, nel equilibriu estacionariu», los monómeros d'actina G intercambiar nos estremos del filamentu ensin que varie'l llargor total del polímeru.[3]Nesta última fase defínese la concentración crítica Cc» como la rellación ente les constantes d'ensamblaxe y desensamblaje (trátase, pos, d'unaconstante de disociación), y representa laconcentraciónd'actina G na cual la dinámica de adición y eliminación de monómeros nun produz un cambéu nel llargor del filamentu. Nes condiciones avezaesin vitro,Ccye de 0,1 μM,[42]lo que significa qu'a valores mayores dase una polimerización y a valores menores, una despolimerización.[43]
- Papel de la hidrólisis de ATP
Un asuntu importante que s'introdució nel apartáu anterior ye'l fechu de que, anque la actina hidroliza ATP, tou paez indicar qu'esto nun intervién nel ensamblaxe, yá que, per una parte, la hidrólisis producir en gran midida nel interior del filamentu, y por otra, el ADP tamién puede polimerizar. Esto plantega la cuestión d'entender cuál ye'l procesutermodinámicamentedesfavorable que rique un gastu d'enerxíatan ingente. El llamáu "ciclu de la actina", qu'amiesta la hidrólisis a la polimerización, consiste na adición de monómeros d'Actina G-ATP preferentemente nel estremu barbáu, creando un fluxu de monómeros escontra l'estremu en punta de flecha no que se conoz como "trenzamiento" (threadmilling,n'inglés), onde los monómeros taríen en forma d'Actina F-ADP y seríen lliberaos, intercambiando darréu esti ADP por ATP y cerrando d'esa manera'l ciclu.
Poco dempués de la adición, produzse la hidrólisis del ATP de forma relativamente rápida. Esisten dos hipótesis sobre cómo se produz, la estocástica, na que la hidrólisis producir al azar influyida en ciertu mou poles molécules vecines, y la vectorial, na que namái se produciría na llende con otres molécules que yá han hidrolizado la so ATP. Sía que non, nun se lliberar el Piresultante, sinón que permanez un tiempu xuníu non covalentemente a la actina ADP, colo cual esistiríen tres especies d'actina nun filamentu: ATP-Actina, ADP+Pi-Actina y ADP-Actina.[39]El conteníu d'un filamentu en caúna d'estes especies depende del so llargor y estáu: al empiezu de la elongación, el filamentu tien una composición aproximao equivalente de monómeros con ATP y ADP+Piy una pequeña cantidá xunto al estremu (-) d'Actina ADP. A midida qu'algámase l'estáu estacionariu, la situación inviértese, tando la mayor parte del filamentu con ADP y l'estremu (+) práuticamente namái con ADP+Pi,col ATP amenorgáu al estremu.[44]
Si comparamos los filamentos d'actina-ADP puros con aquellos qu'incorporen ATP, nos primeres les constantes crítiques son similares en dambos estremos, ente que nos otros dos nucleótidos la Ccye distintu: Nel estremu (+) ye Cc+=0.1 μM, ente que nel estremu (-) ye Cc-=0.8 μM, colo cual danse les siguientes situaciones:[19]
- Pa concentraciones d'actina G-ATP menores a Cc+nun se produz la elongación del filamentu.
- Pa concentraciones d'actina G-ATP menores que Cc-pero mayores que Cc+la elongación dar nel estremu (+).
- Pa concentraciones d'actina G-ATP mayores que Cc-el filamentu crez en dambos estremos.
Por tanto, puede deducise que la enerxía de la hidrólisis utilizar pa crear un verdaderu "estáu estacionariu", esto ye, d'un fluxu en llugar d'un simple equilibriu, lo cual dota de dinamismu, polaridá y fuercia de traición al filamentu, lo que xustifica'l gastu pola ganancia de funcionesbiolóxiquesesenciales.[39]Amás, la configuración de los distintos tipos de monómeros ye detectada poles proteínes d'unión a la actina que controlen esti dinamismu, como se va ver na próxima seición.
Paez esistir una esceición na forma d'acoplamientu típica de los microfilamentos por aciu trenzado o threadmilling nosesterocilios.Nesti casu, el control del tamañu de la estructura sería totalmente apical y de dalguna manera controlada pola espresión xénica, esto ye, pola cantidá total de monómero de proteína sintetizada nun momentu dau.[45]
Proteínes acomuñaes
[editar|editar la fonte]
In vivo,el citoesqueleto d'actina nun ta compuestu puramente d'actina, sinón que pa la so xeneración, permanencia y función rique d'otres proteínes; éstes denominarproteínes d'unión a la actina(ABP,actin binding proteins) ya intervienen nel so polimerización y despolimerización, estabilidá, la so organización en fexes o redes, la so fragmentación y destrucción.[3]La diversidá d'estes proteínes ye tal, que se considera que la actina ye la proteína que participa nel mayor númberu d'interaiciones proteína-proteínade cuantes conócense.[47]Por casu, esisten elementos que secuestren la actina G, torgando la so incorporación a los microfilamentos. Otramiente, esisten proteínes qu'aguiyen la so polimerización o que doten de complexidá a les redes en resume.[19]
- Latimosina β4ye una proteína de 5 kDa capaz de xunise a la actina G-ATP nunaestequiometría1:1; esto quier dicir qu'una unidá de timosina β4 xunir a otra d'actina G, nesta proporción. El so papel ye torgar la incorporación de los monómeros al polímeru en crecedera.[48]
- Laprofilina,una proteínacitosólicade 15 kDa que tamién se xune en estequiometría 1:1 a los monómeros d'actina G-ATP, pero la so función ye distinta: facilita l'intercambiu de nucleótidos ATP por ADP. Amás, ta implicada n'otres funciones celulares, como la unión de repeticiones dePron'otres proteínes o de lípidos qu'actúen comosegundos mensaxeros.[49][50]

Otres proteínes d'unión a actina regulen el llargor de los microfilamentos realizando cortes nellos, lo que da llugar a nuevos estremos activos pa la polimerización. Esto ye, si un filamentu, que tien dos estremos a los que pueden xunise o disociarsemonómeros,ye cortáu dos vegaes, resulten trés nuevos microfilamentos con seis estremos; la nueva situación favorez la dinámica d'ensamblaxe y desensamblaje. Ente estes proteínes destaquen lagelsolinay lacofilina.Cabo resaltar que primero realicen la corte por aciu cambeos naconformanzadel monómero d'actina al que se xunen nel polímeru, quedando dempués anubriendo'l nuevu estremu (+) xeneráu, lo que torga l'agregáu o l'intercambiu de nueves subunidades d'actina G y, yá que los estremos (-) queden ensin anubrir, favorecen la despolimerización de los filamentos.[52]
Otru tipu de proteínes d'unión a actina anubren los estremos de la actina F con cuenta d'estabilizalos, ensin capacidá de rompelos. Exemplos d'estes proteínes sonCapZ(que xune los estremos (+) según los niveles deCa2+/calmodulinade la célula, niveles que dependen de señales esternes ya internes de la célula y qu'intervienen na regulación de les sos funciones biolóxiques)[53]o latropomodulina(que xune los estremos (-)). La tropomodulina ye esencial como estabilizador de la actina F presente nesmiofibrillesde lossarcómerosdelmúsculu,estructures caracterizaes pol so gran estabilidá.[54]

El complexuArp2/3atópase llargamente espublizáu en tolos organismoseucariotes.[56]Ta compuestu por siete subunidades, dalgunes de les cualos tienen unatopoloxíaclaramente rellacionada cola so función biolóxica: dos de los sos subunidades, denominaes «ARP2» y «ARP3», tienen unaestructurabien asemeyada a los mesmos monómeros d'actina. Dicha homoloxía dexa a dambes unidaes portase comoaxentes nucleantesde la polimerización de los monómeros d'actina G a actina F. Amás, esti complexu ye necesariu pa establecer estructuresdendríticasy enanastomosis(esto ye, encruciaes o en rede), por tanto más complexes, d'actina F.[57]
Inhibidores químicos
[editar|editar la fonte]
Esisten dellestoxinesqu'interfieren cola dinámica de les actines, tantu despolimerizándolas (latrunculinaycitocalasina D) como estabilizándoles (faloidina):
- La latrunculina, una toxina producida porporíferos,xunir a la actina G torgando la so unión a los microfilamentos.[58]
- La citocalasina D, unalcaloideproducíu porfungos,xunir al estremu (+) de la actina F torgando la adición de nuevos monómeros.[59]Describiéronse efeutos de la citocalasina D, me điểu s pola disrupción de la dinámica d'actines, na actividá dep53(n'animales)[60]o en respuestesgravitrópicas(enplantes).[61]
- La faloidina, una toxina aisllada del funguAmanita phalloides,xunir a la interfaz esistente ente los monómeros d'actina axacentes del polímeru d'actina F, lo qu'evita la despolimerización d'aquél.[59]
Funciones y llocalización
[editar|editar la fonte]L'actina como proteína atópase tantu nelcitoplasmacomo nelnucleu celular.[62]Felicidad llocalización ta regulada peles víes detransducción de señalesqu'integren los estímulos que la célula recibe y que dexa la reestructuración de les redes d'actina en respuesta a aquellos. EnDictyostelium,refirióse la intervención de la ruta defosfoinosítidosmediada polafosfolipasa D.[63]Los filamentos d'actina son especialmente abondosos y estables nesfibres musculares.Dientro delsarcómero(la unidá morfolóxico y fisiolóxico de les fibres musculares) la actina disponer nes bandes I y A; nesta postrera, preséntase conxuntamente cola miosina.[64]
Citoesqueleto
[editar|editar la fonte]
Los microfilamentos intervienen nel movimientu de toles célules móviles, inclusive les non musculares, pos se describió que los fármacos que desorganizan la actina F (como lescitocalasines) afecten a l'actividá de diches célules. Como proteína, la actina supón el 2% del total de proteínes enhepatocitos,el 10% enfibroblastos,el 15% n'amebesy hasta'l 50-80% enplaquetesactivaes.[65]Esisten distintos grupos d'actina, con estructura y función llixeramente distintes. D'esta miente, la actina α ye esclusiva defibres musculares,y el presente n'otres célules suel ser del tipu β y γ. Amás, la actina de tipos distintos a soler tener una alta tasa de recambiu que provoca que la mayor parte d'ella nun forme parte d'estructures permanentes. Asina, los microfilamentos nes célules non musculares apaecen de dos formes:[66]
- Redes de microfilamentos. So lamembrana plasmáticaye común encélules animalesl'apaición d'una corteza celular poblada por ensame de microfilamentos qu'esclúi la presencia d'orgánulos.Esta rede ta en rellación con abondosesreceptores celularesquetransducen señalesdel esterior de la célula.
- Fexes de microfilamentos. Estos microfilamentos, dispuestos en redes, son de mayor llargor y, n'asociación con proteínes contráctiles como lamiosina non muscular,intervienen nel desplazamientu de sustancies a nivel intracelular.
Lleldos
[editar|editar la fonte]Enlleldos,elcitoesqueletod'actina ye clave mientres los procesos d'endocitosis,citocinesis,determinación de lapolaridá celulary mientres lamorfogénesis.Estos fechos, amás de depender de la actina, impliquen a 20 o 30 proteínes acomuñaes, altamente calteníes evolutivamente, según ensame de molécules de señalización; estos elementos dexen, en combinación, un ensamblaxe espacial y temporalmente modulado que define la bioloxía celular en respuesta a estímulos internos y esternos.[67]
Los lleldos tienen trés grandes tipos d'elemento producto de l'asociación de la actina: parches, cables y aniellos que, magar detectase mientres llargos periodos de tiempu, vense sometíos a un equilibriu dinámicu por cuenta de la continua polimerización y despolimerización. Como proteínes accesories, tienen una cofilina/ADF de 16 kDa (codificada por un únicu xen, denomináuCOF1); Aip1, un cofactor de la cofilina que favorez el desensamblado de los microfilamentos; Srv2/CAP, un regulador de la dinámica rellacionáu con proteínesadenilil ciclasas;una profilina d'aproximao 14 kDa que s'acomuñar a los monómeros d'actina; y twinfilina, una proteína de 40 kDa implicada na organización de les estructures tipu parche.[67]
Plantes
[editar|editar la fonte]Los estudios dexenómicade plantes revelaron la esistencia de isovariantes proteiques dientro de la familia de xenes de la actina; dientro deArabidopsis thaliana,unadicotiledóneaemplegada comoorganismu modelu,esisten siquier diez tipos d'actines, nueve de α tubulinas, seis de β tubulinas, seis de profilinas y docenes de miosinas. Tal diversidá esplícase acordies cola necesidá evolutiva de tener variantes llixeramente distintes na so pauta d'espresión temporal y espacial; sicasí, la mayoría d'elles esprésense conxuntamente nostexíosanalizaos. El treme de redes d'actina distribuyir por tou la citoplasma de les célules cultivaesin vitro,con un refuerzu en redol al nucleu que se coneuta, por aciu radios, a la corteza celular; dichu treme ye altamente dinámicu, con un polimerizado y despolimerizado continuu.[68]

Magar les célules vexetales tienen xeneralmente unaparéque define la so morfoloxía y torga el so movimientu, los sos microfilamentos xeneren les fuercies necesaries pa delles actividaes celulares, por casu, les corrientes citoplasmátiques xeneraes polos microfilamentos y lesmiosines.Amás, la actina intervién nel movimientu de orgánulos y morfogénesis celular, procesos qu'inclúin ladivisión celular,la elongación y la diferenciación.[70]
Tocantes a les proteínes acomuñaes al citoesqueleto d'actina presentes en plantes cabo mentar:[70]lavillina,una proteína perteneciente a la familia de lagelsolina/severina,capaz de cortar microfilamentos y xunir monómeros d'actina en presencia del catión calciu; lafimbrina,un elementu capaz de reconocer y xunir monómeros d'actina y qu'intervién na formación de tremes (por aciu una regulación distinta a la mesma de célules animales y lleldos);[71]lesformines,proteínes capaces d'actuar como axente nucleante de la polimerización a actina F; lamiosina,típicu motor molecular propiu d'eucariotes que, enArabidopsis thaliana,ta codificado por 17 xenes clasificaos en dos clases distintes;CHUP1,capaz de xunir actina ya implicáu na distribución espacial de loscloroplastosna célula;KAM1/MUR3,una proteína que define la morfoloxía delcomplexu de Golgisegún la composición enxiloglucanosde la paré celular;NtWLIM1,proteína que faculta l'apaición d'estructures aovilladas d'actina; yERD10,que participa na asociación ente orgánulos delimitados pormembranesy los microfilamentos y que paez desempeñar un papel especialmente relevante en presencia d'estrés.
Contraición muscular
[editar|editar la fonte]
Nel músculu, el filamentu helicoidal de la actina F contién tamién una molécula detropomiosina,una proteína d'un llargor de 40nanómetrosque s'endolca alredor de la héliz d'actina F. Mientres l'estáu de reposu celular, la tropomiosina anubre los sitios activos de la actina de cuenta que nun se llogra la interaición actina-miosina (esta interaición da llugar a un deslizamiento ente dambos que, por coordinación de munches copies d'estos elementos dispuestos nos músculos, produz la so contraición). Xuníes a lo llargo de la hebra de tropomiosina hai otres molécules proteiques, lestroponines,complexos de tres polímeru:troponina I,troponina Tytroponina C.[31]La función moduladora de la tropomiosina depende de la interaición cola troponina en presencia d'iones de Ca2+.[72]
L'actina, xunto colamiosina,intervién na contraición y relaxación de losmúsculos,constituyendo los dos alredor del 90% de les proteínes musculares.[73]El procesu global disparar por aciu una señal esterna, típicamente por aciu unpotencial d'aiciónexcitador del músculu qu'alluga les célules especializaes riques en filamentos d'actina y miosina nel so interior. El ciclu de contraición-relaxación respuende a los siguientes pasos:[74]
- Despolarización delsarcolemay tresmisión del potencial d'aición al traviés de lostúbulos T.
- Apertura de canales deCa2+delretículo sarcoplásmico.
- Aumentu de la concentracióncitosólicade Ca2+ya interaición d'estos cationes colatroponinacausando un cambéu nel soconformanza,lo qu'alteria de la mesma la estructura de latropomiosina,qu'anubre'l sitiu activu de la actina, dexando l'establecimientu de los enllaces cruzaos miosina-actina (esta postrera presente comofilamentos delgaos).[31]
- Movimientu de les cabeces de miosina sobre los filamentos delgaos, tantu de forma independiente como dependiente de ATP. Esti últimu mecanismu, mediáu pola actividáATPasade les cabeces de miosina, provoca'l movimientu de los filamentos d'actina escontra'ldiscu Z.
- Captura del Ca2+per parte del retículo sarcoplásmico, que provoca un nuevu cambéu conformacional na tropomiosina que inhibe la interaición actina-miosina.[73]
Otros procesos biolóxicos
[editar|editar la fonte]L'estudiu clásicu de la función de la actina la circunscribe al caltenimientu del citoesqueleto y, por ello, a la organización y movimientu de losorgánulosy determinación de la forma celular.[66]Sicasí, el papel de la actina ye abondo más ampliu na fisioloxía celular eucariota; entá más, esisten elementos asemeyaos enprocariotes.
- Citocinesis.Nescélules animalesy delleldos,ladivisión celularsuel traer la separación de la célula madre en dos célules fíes por aciu la constricción de la so zona ecuatorial. Nesti procesu intervién un aniellu contráctil d'actina, miosina yα actinina.[75]Nel lleldu de fisiónSchizosaccharomyces pombe,la actina se ensambla viviegamente nel aniellu contráctil cola participación d'Arp3,laforminaCdc12,profilinayWASp,magar intervienen tamién microfilamentos preformados. Una vegada constituyíu l'aniellu, la estructura caltener nun continuu ensamblado/desensamblado que, cola ayuda del complexuArp2/3y de les forminas, apuerta nun procesu central de la citocinesis.[76]El conxuntu d'aniellu contráctil,microtúbulosdelfusu acromáticuy el material trupo periféricu denominar «cuerpu de Fleming» o «cuerpu entemediu».[66]
- Apoptosis.Mientres lamuerte celular programada,la familia de proteasas denominaes ICE/ced-3 (de la familia de les proteasas conversoras de interleuquina-1β) degradenin vivola actina en dos fragmentos de 15 kDa y 31 kDa, lo que supón unu de los mecanismos de destrucción de la viabilidá celular en que se basa la apoptosis.[77]Tamién se citó esta destrucción por aciu la proteasacalpaína;[78]tanto ye asina, que l'emplegu de inhibidores de la calpaína mengua la proteólisis de la actina y, inclusive, la degradación delADN(otru de los elementos carauterísticos de la apoptosis).[79]Per otru llau, la inducción del procesu de apoptosis por aciu unestréspasa pola reorganización del citoesqueleto d'actina (lo qu'implica tamién el so polimerización), dando llugar a les estructures denominaesfibres de estrés;esti fechu ta señalizáu por aciu la vía de lesMAP kinasas.[80]

- Adhesión celularydesarrollu.L'adhesión ente célules ye un calter de losorganismos pluricelularesque sofita la capacidá d'especializacióntisulary, por ello, l'aumentu de la complexidá d'aquellos. Les uniones celulares de losepiteliosempleguen el citoesqueleto d'actina, dientro de cada célula, y lescadherines,como elementos estracelulares, con una conexón ente dambes mediada porcatenines.[81]La interrupción de la dinámica d'actines repercute neldesenvuelvode los organismos; ello ye que la actina ye un elementu tan crucial que, xeneralmente, disponer de sistemes dexenesredundantes. Por casu, los exemplares deDictyosteliuma los que se-yos quitara del xen de laα actininao delfactor gelificantenun amosaben unfenotipuanómalu posiblemente por cuenta de que una de les proteínes podía realizar la función de la otra; sicasí, nosdobles mutantes,carentes de dambes, el desarrollu viose alteriáu.[82]
- Modulación de laespresión xénica.L'estáu de polimerización d'actina inflúi na pauta d'espresión xénica.Nel añu1997,en trabayos emplegandocélules de Schwanndetectóse que la despolimerización mediada por citocalasina D provocaba una pauta d'espresión peculiar de los xenes implicaos namielinizaciónd'esti tipu decélula nerviosa.[83]Tocantes a los organismos unicelulares, en dalguna de les sos fases vitales demostróse que la actina F tamién modifica'ltranscriptomanel funguCandida albicans.[84]Amás, proteínes asemeyaes a la actina desempeñen un papel regulador mientres laespermatogénesisnelmure[85]y, en lleldos, propúnxose un papel de proteínes asemeyaes a actina na modulaciónepixenética.[86]Ello ye que la actina ye capaz, xunto con un tipu de miosina nuclear d'interactuar conARN polimerasasy otres enzimes de la maquinaria transcripcional, d'actuar como iniciador de la trescripción.[62]
- Dinámica d'estereocilios.Dellos tipos de célules desenvuelven na so superficie unes fines evaginaciones filiformes con funciónmecanosensorialdenominaes estereocilios. Por casu, estos orgánulos son los implicaos nel sentíu deloyíunelórganu de Corti.Como carauterística principal, estes estructures tienen un llargor que puede modificar.[87]Tocantes a la so arquiteutura molecular, los estereocilios tienen un nucleu paracristalino d'actina n'equilibriu dinámicu colos monómeros presentes nelcitosolaxacente. A lo llargo d'esti nucleu dispónense miosinas de los tipos VI y VIIa, ente que la miosina XVa tar nos sos estremos y en cantidaes proporcionales al llargor del estereocilio.[88]
Patoloxía molecular
[editar|editar la fonte]Na mayoría de losmamíferosesisten seisxenesdistintos d'actina. Dos d'ellos tán rellacionaos colcitoesqueleto(ACTByACTG1) ente que les cuatro restante tar colmúsculu esqueléticu(ACTA1),músculu llisu(ACTA2), músculu llisuentérico(ACTG2) y colmúsculu cardiacu(ACTC1). Les mutaciones qu'afecten a estos xenes yeren desconocíes hasta 1998, y viose que producenmiopatíes,variaciones nel tamañu y la funcióncardiacaysordera.Asina mesmu, la actina delcitoesqueletota implicada nel mecanismu depatoxenicidáde múltiplesaxentes infeiciosos,incluyendo'lVIH.La inmensa mayoría de lesmutacionesqu'afecten a la actina son de tipu puntual y tienen unefeutu dominante,salvu siquier seis mutaciones demiopatía nemalínica.Ello ye por cuenta de qu'en munchos casos la variedá mutante del monómero d'actina actúa faciendo de "capping", esto ye, como terminador de la elongación de la actina F.[26]
Rellacionada conACTA1
[editar|editar la fonte]ACTA1ye'l xen que codifica laisoformaα de la actina humana presente principalmente nelmúsculu esqueléticu,anque tamién s'espresa nel músculu cardiacu y naglándula tiroides.[89]El sosecuenciaconsta de sieteexones,que producen cincotranscritosconocíos.[90]A fecha de 2006, el ENMC (European Neuromuscular Centre) publicara 116mutacionesrellacionaes conpatoloxíes,conocíes como actinopatías. La mayor parte d'elles consisten en sustituciones puntuales d'aminoácidos,qu'en munchos casos pueden ser acomuñaes colfenotipuque determina la severidá y el cursu de l'afección.[26][90]
Manifiéstense alteriando la estructura y la función delmúsculu esqueléticuproduciendo trés formes demiopatía:miopatía nemalínicatipu 3,miopatía conxénita con escesu de microfilamentos(CM) ymiopatía conxénita con desproporción de tipos de fibra(CFTDM). Tamién se detectó mutaciones que producen miopatía concores(zones desprovistes d'actividá oxidativa).[92]Anque los sos fenotipos son similares, amás de la miopatía nemalínica típica y la de cayaos intranucleares, dellos especialistes estremen un tipu de miopatía, llamada actínica de la miopatía nemalínica. Na primera atrópense amestaos d'actina en llugar de los típicos cayaos. Ye importante señalar qu'un paciente puede amosar más d'unu d'estosfenotiposnabiopsia.[93]Lossíntomesmás habituales consisten nuna morfoloxíafacialtípica (facies miopática), debilidá muscular y retrasu nel desarrollu motor y dificultaes respiratories. El cursu, la gravedá y la edá d'apaición son bien variables, y atópense formes de miopatía asolapaes. Na miopatía nemalínica apaecen unes estructures nonpatognomónicasen diverses llocalizaciones de lesfibres muscularestipu 1 conocíes como "cayaos nemalínicos", con una composición similar a los discos z delsarcómero.[94]
Lapatoxénesisye bien variada. Munches mutaciones dar na zona de hendidura de la actina, próximes al llugar d'unión panucleótidos,ente qu'otres danse en dominiu 2, o bien nes zones d'interaición coles proteínes acomuñaes, lo qu'esplica la gran variedá d'agregaos que se formen nestos casos, como cuerpos nemalínicos, intranucleares o cuerpos zebra.[26]Na miopatía nemalínica prodúcense cambeos nelplegamientoy nes propiedaes d'agregamientu de la actina, y tamién naespresiónd'otres proteínes acomuñaes. En delles variantes nes que s'atopen cuerpos intranucleares, el cambéu nel plegamientu despinta laseñal d'esportación nuclear,de cuenta que l'agregamientu de la forma mutante d'actina producir nelnucleu celular.[95]Sicasí, paez que nes mutaciones deACTA1que dan llugar a CFTDM ta más afeutada la función sarcomérica que la estructura en sí.[96]Trabayos recién traten d'esclariar l'aparente paradoxa de que nun esista una correllación clara ente la bayura de cayaos y la debilidá muscular. Paez ser que delles mutaciones particulares son capaces d'inducir una mayor tasa d'apoptosisnes fibres musculares tipu II.[34]

De músculu llisu
[editar|editar la fonte]Esisten dos isoformas que codifican actines delmúsculu llisu:
ACTG2codifica la isoforma más llarga d'actina, con nueveexones,unu d'ellos, l'asitiáu nel estremu 5', que non setraduz.[97]Trátase d'una γ actina que s'espresa nel músculu llisu entérico. Nun s'atoparon mutaciones que se correspuendan a patoloxíes nesti xen, anque se vio por aciumicroarraysque ye la proteína que, con diferencia, más aumenta la so espresión nos casos de resistencia a laquimioterapiaconcisplatino.[98]
ACTA2codifica una α actina alcontrada nel músculu llisu, y tamién nel músculu llisu vascular. Viose qu'una mutación, la MYH11, podría ser responsable de siquier un 14% de los casos d'aneurismas d'aorta torácicahereditaria, concretamente'l tipu 6, yá que la variante mutada produz un mal ensamblaxe de los filamentos y un amenorgamientu de la capacidá de contraición del músculu llisu vascular. Reparar nestos individuos dexeneraciónaórtica medial,con árees de desorganización yhiperplasia,yestenosisde losvasa vasorumde l'aorta.[99]El númberu d'afecciones nes que podría tar implicáu esti xen ta n'aumentu. rellacionóse-y colaenfermedá de Moyamoya,y paez ser que delles mutaciones en heterocigosis podríen conferir predisposición a munches patoloxíes vasculares, como'l aneurisma d'aorta torácica y lacardiopatía isquémica.[100]La α actina de músculu llisu tamién ye un interesante marcador pa evaluar la progresión de lacirrosis hepática.[101]
De músculu cardiacu
[editar|editar la fonte]ACTC1ye'l xen que codifica la isoforma de la α actina presente nel músculu cardiacu. Secuenciar por primer vegada por Hamada y collaboradores en1982,reparándose que taba atayáu por cinco intrones.[102]Foi'l primer xen de los seis onde s'atoparonapanfilosimplicaos en procesos patolóxicos.[103]
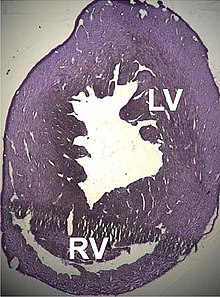
Describiéronse dellos trestornos estructurales que traen una disfuncióncardiacaacomuñaos a mutaciones puntuales nesti xen, comomiocardiopatía dilatadatipu 1R y lamiocardiopatía hipertróficatipu 11. Apocayá viose que dellos defectosatriales septalestamién podríen tar rellacionaos.[105][106]
Nel casu de la cardiomiopatía dilatada, estudiáronse dos casos nos qu'en dambos se produz una sustitución n'aminoácidosbien calteníos pertenecientes a losdominiosque se xunen a losdiscos Zy entrepolaos, tou lo cual lleva a la hipótesis de que la dilatación producir por un defectu de trasmisión de lafuercia contráctilnosmiocitos.[103][28]
Les alteraciones deACTC1son responsables de menos del 5% de les cardiomiopatías hipertrófiques.[107]Demostráronse tamién la esistencia de delles mutaciones puntuales:[108]
- Mutación Y101K: cambeos de carga neta y formación d'enllaz electrostático débil na posición d'unión de la actomiosina.
- P166A: zona d'interaición ente monómeros d'actina.
- A333P: zona d'interaición actina-miosina.
La patoxénesis paez obedecer a un mecanismu compensatoriu: les proteínes mutantes actuaríen como "tóxicu" con un efeutu dominante, menguando la capacidá decontraicióncon un rendimientu mecánicu anormal, de cuenta que la hipertrofia, que suel ser tardida, sería consecuencia d'una respuesta normal del músculu cardiacu alestrés.[109]
Apocayá atopáronse mutaciones deACTC1implicaes n'otros dos procesos patolóxicos: lamiocardiopatía restrictivaidiopática infantil,[110]y elmiocardiu ventricular esquierdu non compactu.[111]
D'actines citoplasmátiques
[editar|editar la fonte]ACTBye unlocusbien complexu. Esisten ensame depseudogenespartíos en tolxenoma,y la so secuencia contién seis exones que pueden dar llugar hasta 21 transcritos distintos porsplicing alternativu,conocíos como actines β. En congruencia con esta complexidá, tamién los sos productos tienen llocalizaciones y formen parte de procesos bien distintos (citoesqueleto,complexu NuA4histona-aciltransferasa,nucleu celular) y por lo mesmo tamién se-y acomuñó al mecanismu de gran cantidá de procesos patolóxicos (carcinomes,distoníaxuvenil, mecanismos d'infeiciones, malformaciones nelsistema nerviosuy invasividad de neoplasmas, ente otres).[112]Atopóse una nueva forma d'actina, la actina kappa, que paez sustituyir a la actina β en procesostumorales.[113]

Hasta'l momentu pudiéronse detectar tres proceso patolóxicos que se deben a una alteración direuta de la secuencia d'un xen:
- Elhemangiopericitomacon translocación t(7;12)(p22;q13) ye una afección rara, na que se produz una fusión portranslocacióndel xenACTBsobreGLI1nel cromosoma 12.[115]
- Ladistoníade debú xuvenil ye unaenfermedá dexenerativarara, con afectación sistémica delsistema nerviosu central,y especialmente d'áreesneocorticalesytalámicas,onde pueden apreciase un tipu d'inclusioneseosinofílicasen forma de cayáu. Los individuos afeutaos presenten unfenotipucon malformaciones nallinia media,perda auditivasensorial y distonía. Deber a una mutación puntual que camuda l'aminoáciduargininaen posición 183 por untriptófanu.Esto alteria la interaición de la actina col sistema ADF/cofilina,que regula la dinámica de formación del citoesqueletoneuronal.[116]
- Atopóse una mutación puntual con calter dominante que produz disfunción de losneutrófilosyinfeicionesrecurrentes. Paez ser que la mutación modifica'l dominiu d'unión colaprofilinay otres proteínes reguladores. L'afinidá pola profilina n'este apanfilo ta bien amenorgada.[117]
ACTG1ye'l locus que codifica la proteína de la γ actina citosólica responsable de la formación demicrofilamentosdel citoesqueleto. Contién 6exones,dando llugar a 22mRNAsdistintos, lo cual produz 4isoformescompletes, posiblemente espresaes d'una forma dependiente detexíu.Tamién tien dospromotor del ADN promotoresalternativos.[118]Viose que les secuencies traducíes d'esti locus y el de la β actina son más asemeyaes de lo esperao, suxiriendo una secuencia ancestral común que sufrió duplicación y conversión xénica.[119]
Dende'l puntu de vista patolóxicu, foi acomuñáu a procesos como l'amiloidosis,laretinitis pigmentosa,mecanismos d'infeición, enfermedaesrenalesy diverses perdes auditives conxénites.[118]
Rellacionaes con seis mutaciones puntuales autosómico-dominantes na secuencia, atopamos diverses formes de perdes d'audición, cuantimás la sensorineural tipu 20/26. Paez qu'afecten de forma específica a losestereociliosde lescélules ciliaesdelórganu de Corti.La β actina ye la proteína más abondoso nos texíos humanos, pero non asina nes célules ciliaes, lo qu'esplicaría la llocalización de la patoloxía. Per otra parte, paez que la mayor parte d'estes mutaciones afecten a zones d'unión con otres proteínes, cuantimás la actomiosina.[26]Dellos esperimentos suxeren que'l mecanismu patogénico d'esti tipu de sordera deber a que la actina F de los mutantes sería más sensible de lo habitual a lacofilina.[120]
Per otra parte, anque nun se tien constancia de nengún casu, sábese que la γ actina tamién s'espresa nel músculu esqueléticu, y anque en cantidaes bien pequeñes, losmodelos animalesamosaron que la so ausencia podría dar llugar amiopatíes.[121]
Otros mecanismos patolóxicos
[editar|editar la fonte]Dellos axentes infeiciosos utilicen la actina, especialmente la citoplasmática, na sociclu de vida.Enbacteriesbásicamente esisten dos formes:
- Listeria monocytogenes,delles especies deRickettsia,Shigella flexneriy otros xermes intracelulares escapen de les vacuolasfagocíticaspor aciu el recubrimientu con una cápsula curtia de filamentos d'actina. Nel casu deL. monocytogenesyS. flexneri,xeneren a partir d'ellos un cercu en forma de "cola de cometa" que dexa la so movilidá. Esisten llixeres diferencies nel mecanismu molecular de polimerización de la cola en cometa» dependiendo de la especie bacteria. Pueden reparase distintes velocidaes de desplazamientu, por casu, con un máximu paListeriayShigella.[122]Munchos esperimentos ensayaron esti mecanismuin vitro.Estos amuesen que nun s'emplega nenguna proteína motor tipu miosina, y paez que la propulsión adquirir pola presión exercida pola polimerización que tien llugar cerca de la paré del microorganismu, que primeramente s'arrodió de ABP's mesmes de la célula hospedadora, que na so configuración mínima tratar del complexu Arp2/3, proteínes Ena-VASP,cofilina,una proteína taponante y promotores de la nucleación, como'l complexu de lavinculina.Por aciu estos movimientos formen protrusiones qu'algamen les célules vecines, infectándoles de la mesma, de cuenta que'lsistema inmunolóxicunamái puede combatir la infeición por aciu la inmunidá celular. La ruta del movimientu podría ser debida al cambéu de la combadura y desramificación de los filamentos.[123]Otres especies, comoMycobacterium marinumyBurkholderia pseudomallei,tamién son capaces de polimerizar llocalmente la actina celular pa facilitar el so desplazamientu por aciu un mecanismu que pivota sobre'l complexu Arp2/3; entá más, elvirusvacunal oVaccinia virustamién emplega elementos del citoesqueleto d'actina pa la so diseminación.[124]
- Pseudomonas aeruginosaye capaz de formar unbiofilmproteutor col qu'escapa de les defenses del organismu, cuantimás de losneutrófilosy de losantibióticos,emplegandoADNy filamentos d'actina delhospedador.[125]
Amás del exemplu citáu enantes, nos pasos iniciales de la internalización de dalgunosvirus,notablemente'lVIH,aguíyase la polimerización de la actina, por casu inactivando la cofilina.[126]
Nos procesos d'invasión de les célules canceroses, les protrusiones basaes en actina desempeñen un papel entá non determináu.[127]
Evolución
[editar|editar la fonte]El citoesqueleto eucariota amuesa dellos componentes de gran semeyanza a lo llargo de laescala filoxenética,especialmente la actina y la tubulina. Por casu, la proteína codificada pol xenACTG2d'humanos tien una equivalencia absoluta colosortólogospresentes n'aguarón y mure, magar a nivel denucleótidosla identidá mengua al 92 %.[128]Sicasí, sí esisten mayores diferencies colos equivalentes en procariotas (FtsZyMreB), que, de la mesma, presenten una identidá de secuencia d'ente un 40−50% ente les distintes especies debacteriesyarquies.Dellos autores suxeren que la proteína ancestral que dio llugar al modelu básicu d'actina eucariota asemeyar a les proteínes del citoesqueleto bacterianu presentes anguaño.[129]

Dellos autores resalten que la actina, la tubulina y leshistones,un tipu de proteínes implicaes na estabilización y regulación delADN,presenten semeyances na so capacidá de xunirnucleótidosy nel so funcionamientu basáu nel aprovechamientu delmovimientu browniano;entá más, suxeren que toos ellos podríen derivar d'un ancestru común.[130]Poro, los mecanismosevolutivosdiversificaron la proteína ancestral nes variantes güei presentes, calteniendo, ente otres, les actines como molécules eficaces pa encetar procesos biolóxicos antiguos y esenciales, como laendocitosis.[131]
Equivalentes en bacteries
[editar|editar la fonte]Magar les bacteries nun tienen uncitoesqueletocomparable en complexidá al de loseucariotes,describiéronse proteínes d'alta semeyanza colos monómeros y polímeros d'actina. La proteínaMreBde bacteries polimeriza en filamentos delgaos, non helicoidales y, raramente, n'estructures helicoidales asemeyaes a la actina F.[17]Entá más, la so estructura cristalina ye bien asemeyada a la actina G (tocantes a conformanza tridimensional), ya inclusive esisten equivalencies ente los protofilamentos de MreB y la actina F. Elcitoesqueleto bacterianutamién tien ente los sos componentes les proteínesFtsZ,asemeyaes a latubulina.[132]
Poro, les bacteries tienen un citoesqueleto con elementoshomólogosa la actina (por casu, MreB, ParM, y MamK), magar la secuencia aminoacídica d'estes proteínes diverxe de los presentes en célules animales. Sicasí, MreB y ParM tienen una alta semeyanzaestructura de les proteínes estructuralcola actina eucariota. Los microfilamentos, altamente dinámicos, xeneraos por aciu agregamientu de MreB y ParM son esenciales pa la viabilidá celular y participen na morfogénesis de la célula, segregación delgenóforoy polaridá celular. ParM, un homólogu de la actina codificado nunplásmido,intervién na xestión del ADN plasmídico.[133]
Aplicaciones
[editar|editar la fonte]L'aprovechamientu de la actina nos llaboratorios de ciencia y teunoloxía deriven de la so participación como riel demotores molecularescomo la miosina (yá nel músculu, yá fora d'él), y de la so presencia necesaria pal funcionamientu celular. Tocantes a la clínica, yá que delles variantes anómales de la actina tán rellacionaes cola apaición de patoloxíes, la so detección ye un criteriu diagnósticu.
- Nanoteunoloxía.Los sistemes actina-miosina actúen como motores moleculares que dexen el tresporte de visícules y orgánulos a lo llargo de la citoplasma. Esisten esperimentos qu'aprovechen esta capacidá dinámica inclusivein vitro,esto ye, en sistemes acelulares, polo que se postuló una aplicaciónnanoteunolóxicadel sistema. La idea subxacente ye emplegar los microfilamentos comorielessobre los cualos una o másproteínes motoresesmúzanse tresportando una determinada carga; esto ye, definir un circuitu espacial pol que pueda tresportase de forma empobinada y más o menos controlada una determinada carga. Tocantes a aplicaciones xenerales, falar del tresporte empobináu de molécules pa llograr la so lliberación en llugares concretos, lo que dexaría al ensamblaxe de nanoestructuras de forma controlada.[134]Estes capacidaes podríen ser aplicaes en chips d'investigación como loslab-on-a-chip,en nanocomponentes mecánicos y en nanotransformadores d'enerxía mecánica n'eléctrica.[135]
- Control internu en téuniques debioloxía molecular,como'lwestern bloty laPCR en tiempu real.Por cuenta de que la función de la actina ye necesaria pa la sobrevivencia celular, postulóse que la so cantidá ta tan controlada a nivel de producción celular que puede asumise que la sotrescripción(esto ye, el grau d'espresión de les sosxenes) ytraducción,(que ye la xeneración de proteína) ye práuticamente constante, independientemente de les condiciones esperimentales. Por esta razón, nos estudios de cuantificación de proteínes (western blot) y detranscritos(PCR en tiempu real) suel realizase amás de la cuantificación del xen d'interés la d'un xen de referencia, como la mentada actina. Estremando la cantidá del xen d'interés pola de la actina ye posible llograr una cantidá relativa comparable ente distintos esperimentos,[136]siempres y cuando la espresión d'esta postrera nun varie; cabo destacar que la actina non siempres presenta la estabilidá deseyada na soespresión.[137]
- Clínica. Dalgunosapanfilosde la actina son causantes de patoloxíes, polo que se desenvolvieron téuniques pa la so detección. Amás, la actina puede emplegase como marcador indireutu en patoloxía quirúrxica: ye posible emplegar variaciones en pauta de llocalización nos texíos como marcadores d'invasión deneoplasies,vasculitisy otros.[138]Tamién, por cuenta de la so rellación col aparatu contráctil muscular, l'atrofiaprovoca l'amenorgamientu de los sos niveles nel músculu esqueléticu, polo que puede emplegase como marcador d'esti fenómenu.[139]
- Teunoloxía de los alimentos.La determinación de la calidá de dellos alimentos procesaos, como losembutíos,pasa pola cuantificación del so conteníu encarne.Clásicamente utilizóse un métodu basáu na detección de la3-metilhistidinan'hidrolizadosd'estos productos, pos se trata d'un compuestu presente na actina y la cadena pesada de la miosina F (dambos componentes mayoritarios del músculu). La xeneración nel animal del compuestu deber a lametilaciónde residuos dehistidinapresentes en dambes proteínes.[140][141]
Ver tamién
[editar|editar la fonte]Notes
[editar|editar la fonte]- ↑Nesti enllaz[1]reparar un modelu de la prefoldina cola actina encaxada ente los "tentáculos" de los sos subunidades.
- ↑Nel siguiente enllaz[2]d'un trabayu de Jaime Martín-Benito y José María Valpuesta, del centru nacional de Bioteunoloxía del CSIC, puede apreciase la configuración en doble aniellu de la chaperonina CCT, según les sos subunidades.
Referencies
[editar|editar la fonte]- ↑«The evolution of compositionally and functionally distinct actin filaments».Journal of Cell Science128(11): páxs. 2009-19. 2015.doi:.PMID25788699.
- ↑«In search of the primordial actin filament.».Proc Natl Acad Sci U S A.112(30): páxs. 9150-1. 2015.doi:.PMID26178194.
- ↑3,03,13,23,3Marc MailletBioloxía celular(n'español). Publicáu por Elsevier España, 2002; páx.132.ISBN 84-458-1105-3
- ↑4,04,1Albertset al(2004).Bioloxía molecular de la célula.Barcelona: Omega.ISBN 54-282-1351-8.
- ↑Halliburton, W.D. (1887). «On muscle plasma».J. Physio.(8).
- ↑«Atomic model of the actin filament»,Nature347(6288),doi:,http:// nature /nature/journal/v347/n6288/abs/347044a0.html
- ↑Szent-Gyorgyi, A. (1945) Studies on muscle. Acta Physiol Scandinav 9 (suplementu. 25)
- ↑Straub, F.B. y Feuer, G. (1950). «Adenosinetriphosphate the functional group of actin.».Biochim.Biophys. Acta..PMID 2673365.
- ↑Bárány, M., Barron, J.T., Gu, L., y Bárány, K. (2001). «Exchange of the actin-bound nucleotide in intact arterial smooth muscle».J. Biol. Chem.276(51).PMID 11602582.
- ↑10,010,1«Complete amino-acid sequence of actin of rabbit skeletal muscle»,Proceedings of the National Academy of Sciences70(9),http:// pnas.org/cgi/reprint/70/9/2687.pdf,consultáu'l 29 de xunu de 2009
- ↑11,011,1Kabsch W, Mannherz HG, Suck D, Pai EF, Holmes KC. (1990). «Atomic structure of the actin:DNase I complex.».Nature347(6288).PMID 2395459.
- ↑Holmes KC, Popp D, Gebhard W, Kabsch W (1990). «Atomic model of the actin filament».Nature347(6288).PMID 2395461.
- ↑13,013,113,213,3Domínguez, R; Otterbein LR, Graceffa P (Julio 2001)(n'inglés).The crystal structure of uncomplexed actin in the ADP state.293. páxs. 708-11.PMID11474115.
- ↑Oriol, C; Dubord, C y Landon, F (xineru 1977). «Crystallization of native striated-muscle actin»(n'inglés).FEBS Lett.73(1): páxs. 89-91.PMID320040.
- ↑Sawaya MR, Kudryashov DS, Pashkov I, Adisetiyo H, Reisler Y, Yeates TO. (2008). «Multiple crystal structures of actin dimers and their implications for interactions in the actin filament».Acta Crystallogr D Biol Crystallogr..PMID 18391412.
- ↑Narita; Takeda S, Yamashita A, Maéda Y. (payares 2006). «Structural basis of actin filament capping at the barbed-end: a cryo-electron microscopy study»(n'inglés).Embo J25(23): páxs. 5626-33.doi:.http:// nature /emboj/journal/v25/n23/pdf/7601395a.pdf.Consultáu'l 27 de xunu de 2009.
- ↑17,017,117,217,317,417,5Toshiro Oda, Mitsusada Iwasa, Tomoki Aihara, Yuichiro Maéda y Akihiro Narita (2009):The nature of the globular- to fibrous-actin transition.Nature 457, 441-445 (22 January 2009) | doi:10.1038/nature07685
- ↑«Human actin xenes are single copy for Alpha -skeletal and Alpha -cardiac actin but multicopy for β- and γ-cytoskeletal xenes: 3' untranslated regions are isotype specific but are conserved in evolution»,Molecular and Cellular Biology3(10),http://mcb.asm.org/cgi/content/abstract/3/10/1783
- ↑19,019,119,219,3Lodish et al. (2005).Bioloxía celular y molecular.Buenos Aires: Médica Panamericana.ISBN 950-06-1974-3.
- ↑Futoshi Hara, Kan Yamashiro, Naoki Nemoto, Yoshinori Ohta, Shin-ichi Yokobori, Takuo Yasunaga, Shin-ichi Hisanaga, and Akihiko Yamagishi. (2007):An Actin Homolog of the Archaeon Thermoplasma acidophilum That Retains the Ancient Characteristics of Eukaryotic Actin.Journal of Bacteriology, p. 2039-2045, Vol. 189, No. 5 doi:10.1128/JB.01454-06
- ↑21,021,1«Crystal Structure of Monomeric Actin in the ATP State: STRUCTURAL BASIS OF NUCLEOTIDE-DEPENDENT ACTIN DYNAMICS»,Journal of Biological Chemistry278(36),doi:,PMID12813032,http:// jbc.org/cgi/content/full/278/36/34172Archiváu2009-02-10 enWayback Machine
- ↑«Actin molecular structure and function»,Curr Opin Cell Biol5(1),doi:,http:// ncbi.nlm.nih.gov/pubmed/8448029
- ↑«NCBI Conserved Domains: ATP binding site»(inglés).Consultáu'l 26 d'avientu de 2008.
- ↑24,024,1Elzinga; Collins, JH (agostu 1975). «The primary structure of actin from rabbit skeletal muscle. Completion and analysis of the amino acid sequence»(n'inglés).J Biol Chem.250(15).http:// ncbi.nlm.nih.gov/pubmed/1150665?dopt=Abstract.
- ↑Elzinga; Collins JH, Kuehl WM, Adelsteiskeletal muscle.(n'inglés)Proc Natl Acad Sci U S A.70(9).https://web.archive.org/web/http:// pubmedcentral.nih.gov/picrender.fcgi?artid=427084&blobtype=pdf.
- ↑26,026,126,226,326,426,526,626,7Cristóbal G. Dos Remedios, Deepak Chhabra (2008).Actin-binding Proteins and Disease.Springer.ISBN 0-387-71747-1.Ver enGoogle books
- ↑Rould; Wan Q, Joel PB, Lowey S, Trybus KM. (ochobre 2006). «Crystal structures of expressed non-polymerizable monomeric actin in the ADP and ATP states».J Biol chem281(42).doi:.Archivado deloriginalel 2019-09-25.https://web.archive.org/web/20190925054922/http:// jbc.org/content/281/42/31909.full?view=long&pmid=16920713.Consultáu'l 2018-10-31.
- ↑28,028,1Devlin, Thomas M (2004). «23»,a+la+actina+residuu&source=bl&ots=YZZKRVRbRQ&sig=WqMv1TZlXS6hakU88tdHgNLfbt4&hl=es&ei=9yZHSrjVBuPTjAeF4aRk&sa=X&oi=book_result&ct=result&resnum=4 Bioquímica: Llibru de testu con aplicaciones clíniques,4 (n'inglés), Reverte, páx. 1021.ISBN 8429172084..
- ↑29,029,129,2Egelman; Reisler, Y (avientu 2007). «Actin structure and function: what we still do not understand».J Biol Chem282(50).doi:.Archivado deloriginalel 2009-05-25.https://web.archive.org/web/20090525031846/http:// jbc.org/cgi/content/full/282/50/36133.Consultáu'l 2018-10-31.
- ↑DA Begg, R Rodewald y LI Rebhun (1978):The visualization of actin filament polarity in thin sections. Evidence for the uniform polarity of membrane-associated filaments.The Journal of Cell Biology, Vol 79, 846-852.
- ↑31,031,131,2Arthur C. Guyton, John Y. HallTratáu de fisioloxía médica(n'español). Publicáu por Elsevier España, 2007; páx.76.ISBN 84-8174-926-5
- ↑32,032,1Simons, CT; Staes A, Rommelaere H, Ampe C, Lewis SA, Cowan NJ (febreru 2004). «Selective contribution of eukaryotic prefoldin subunits to actin and tubulin binding»(n'inglés).J Biol Chem.279(6): páxs. 4196-203.doi:.PMID14634002.Archivado deloriginalel 2019-09-25.https://web.archive.org/web/20190925054825/http:// jbc.org/content/279/6/4196.full?view=long&pmid=14634002#REF21.Consultáu'l 2018-10-31.
- ↑Martín-Benito (avientu 2002). «Structure of eukaryotic prefoldin and of its complexes with unfolded actin and the cytosolic chaperonin CCT»(n'inglés).EMBO J21(23): páxs. 6377-86.doi:.PMID12456645.https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=12456645.
- ↑34,034,1Vandamme, D; Lambert Y, Waterschoot D, Cognard C, Vandekerckhove J, Ampe C, Constantin B, Rommelaere H. (xunetu 2009). « Alpha -Skeletal muscle actin nemaline myopathy mutants cause cell death in cultured muscle cells»(n'inglés).Biochim Biophys Acta.1793(7): páxs. 1259-71.PMID19393268.
- ↑35,035,1Brackley; Grantham J (xineru 2009). «Activities of the chaperonin containing TCP-1 (CCT): implications for cell cycle progression and cytoskeletal organisation»(n'inglés).Cell Stress Chaperones14(1): páxs. 23-31.doi:.PMID18595008.https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=18595008.
- ↑36,036,1Stirling, PC; Cuéllar J, Alfaro GA, El Khadali F, Beh CT, Valpuesta JM, Melki R, Leroux MR (marzu 2006). «PhLP3 modulates CCT-mediated actin and tubulin folding via ternary complexes with substrates»(n'inglés).J Biol Chem281(11): páxs. 7012-21.doi:.PMID16415341.Archivado deloriginalel 2019-09-25.https://web.archive.org/web/20190925054825/http:// jbc.org/content/281/11/7012.full?view=long&pmid=16415341.Consultáu'l 2018-10-31.
- ↑Hansen, WJ; Cowan NJ, Welch WJ. (abril 1999). «Prefoldin-nascent chain complexes in the folding of cytoskeletal proteins»(n'inglés).J Cell Biol.(265-7) (145): p. 2.PMID10209023.https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=10209023.
- ↑Neirynck; Waterschoot D, Vandekerckhove J, Ampe C, Rommelaere H (xineru 2006). «Actin interacts with CCT via discrete binding sites: a binding transition-release model for CCT-mediated actin folding».J Mol Biol.355(1): páxs. 124-38.PMID16300788.
- ↑39,039,139,2Vavylonis, D; Yang Q, O'Shaughnessy B. (xunu 2005). «Actin polymerization kinetics, cap structure, and fluctuations»(n'inglés).Proc Natl Acad Sci U S A.102(24): páxs. 8543-8.doi:.PMID15939882.https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=15939882.
- ↑«Electron Microscopic Particle Length of F-Actin Polymerized in vitro»,Journal of Biochemistry67(3),http://jb.oxfordjournals.org/cgi/content/abstract/67/3/437
- ↑Cooper, Geoffrey M.; Robert Y. Hausman (2007). «Chapter 12: The Cytoskeleton and Cell Movement»,The cell: a molecular approach(n'inglés). ASM Press, Washington.ISBN 0878932194.
- ↑«Tabla de les constantes d'asociación y disociación de les distintes especies de monómeros al filamentu d'actina, según la lliteratura científica.». Archiváu dende l'orixinal,el 2013-08-01.
- ↑«Implications of treadmilling for the stability and polarity of actin and tubulin polymers in vivo»,The Journal of Cell Biology86(1),PMID6893454,http:// jcb.org/cgi/reprint/86/1/330.pdf
- ↑Lewin, Benjamin (2006).Cells(Googlebooks) (n'inglés), Jones & Bartlett Publishers.ISBN 9780763739058.
- ↑Zhang, Duan-Sun; Valeria Piazza, Benjamin J. Perrin, Agnieszka K. Rzadzinska, J. Collin Poczatek, Mei Wang, Haydn M. Prosser, James M. Ervasti, David P. Corey, Claude P. Lechene (15 de xineru de 2012). «Multi-isotope imaging mass spectrometry reveals slow protein turnover in hair-cell stereocilia»(n'inglés).Nature481(7382): páxs. 520-524.doi:.http:// nature /doifinder/10.1038/nature10745.Consultáu'l 27 de xineru de 2012.
- ↑THE STRUCTURE OF CRYSTALLINE PROFILIN-BETA-ACTINProtein Data Bank
- ↑Domínguez, R (payares 2004).Actin-binding proteins--a unifying hypothesis..29. páxs. 572-8.PMID15501675.
- ↑«The control of actin nucleotide exchange by thymosin β 4 and profilin. A potential regulatory mechanism for actin polymerization in cells»,Molecular Biology of the Cell3(9),http:// molbiolcell.org/cgi/content/abstract/3/9/1015
- ↑Witke, W., Podtelejnikov, A., Di Nardo, A., Sutherland, J., Gurniak, C., Dotti, C., and M. Mann (1998) In Mouse Brain Profilin I and Profilin II Associate With Regulators of the Endocytic Pathway and Actin Assembly. The EMBO Journal 17(4): 967-976Plantía:Entrez Pubmed
- ↑Carlsson L, Nyström -Y, Sundkvist I, Markey F, Lindberg O. (1977) Actin polymerizability is influenced by profilin, a low molecular weight protein in non-muscle cells. J. Mol. Biol. 115:465-483Plantía:Entrez Pubmed
- ↑Kiselar, J., Janmey, P., Almo, S., Chance, M. (2003). «Visualizing the Ca2+-dependent activation of gelsolin by using synchrotron footprinting».PNAS100(7): páxs. 3942-3947.doi:.PMID12655044.http:// pnas.org/cgi/content/full/100/7/3942.
- ↑«Gelsolin and ADF/cofilin enhance the actin dynamics of motile cells»,Proceedings of the National Academy of Sciences of the United States of America97(13),doi:,PMID10860951,http:// pnas.org/cgi/content/full/pnas;97/13/6936
- ↑«Effects of CapZ, an actin-capping protein of muscle, on the polymerization of actin»,Biochemistry28(21),doi:,http://pubs.acs.org/doi/abs/10.1021/bi00447a036
- ↑«Tropomodulin caps the pointed ends of actin filaments»,The Journal of Cell Biology127(6),doi:,PMID7798317,http:// jcb.org/cgi/reprint/127/6/1627.pdf
- ↑Robinson RC, Turbedsky K, Kaiser DA, Marchand JB, Higgs HN, Choe S, Pollard TD. (2001)Crystal structure of Arp2/3 complex(n'inglés). Science 294(5547):1679-84.
- ↑Mullins, R. D.; Pollard, T.D. (abril de 1999). «Structure and function of the Arp2/3 complex».Current Opinion in Structural Biology(Elsevier)9(2): páxs. 244-249.doi:.http:// ingentaconnect /content/els/0959440x/1999/00000009/00000002/art80034?token=00431ce3643f038fde4775686f2357275c277b422c40465d483f2544446y7b6dea2.Consultáu'l 3 d'ochobre de 2007.
- ↑Laura M Machesky; Kathleen L Gould (Febreru de 1999). «The Arp2/3 complex: a multifunctional actin organizer».Current Opinion in Cell Biology11(1): páxs. 117-121.doi:.http:// sciencedirect /science?_ob=ArticleURL&_udi=B6VRW-3W8SD3R-G&_user=10&_rdoc=1&_fmt=&_orig=search&_sort=d&view=c&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=c399y9d447df11d385cbefe9b44056d7.
- ↑«Latrunculin alters the actin-monomer subunit interface to prevent polymerization»,Nature Cell Biology2(6),doi:,http:// era.lib.ed.ac.uk/retrieve/1796/Mclaughlin.pdf
- ↑59,059,1«Effects of cytochalasin and phalloidin on actin»,The Journal of Cell Biology105(4),doi:,http:// jcb.org/cgi/reprint/105/4/1473.pdf
- ↑«Disruption of actin microfilaments by cytochalasin D leads to activation of p53»,FEBS Letters430(3),doi:,http://linkinghub.elsevier /retrieve/pii/S0014579398006929
- ↑«Cytochalasin D does not inhibit gravitropism in roots»,American Journal of Botany84(11),doi:,http:// amjbot.org/cgi/reprint/84/11/1530.pdf
- ↑62,062,1«Actin and myosin as transcription factors»,Current opinion in genetics & development16(2),doi:,https://web.archive.org/web/http://linkinghub.elsevier /retrieve/pii/S0959437X06000232
- ↑«Phospholipase D activity is essential for actin localization and actin-based motility in Dictyostelium»,Biochemical Journal389(Pt 1),doi:,https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?artid=1184553
- ↑Randall, D.; Burggren, W. et French, K..Eckert Fisioloxía animal,4ª.ISBN 84-486-0200-5.
- ↑Pujol-Moix (2001).Trombocitopenias,2da,Elsevier,España, páx. 25.ISBN 8481745952.
- ↑66,066,166,2Paniagua, R.; Nistal, M.; Sesma, P.; Álvarez-Uría, M.; Fraile, B.; Anadón, R. y José Sáez, F. (2002).Citoloxía ya histoloxía vexetal y animal.McGraw-Hill Interamericana d'España, S.A.U..ISBN 84-486-0436-9.
- ↑67,067,1«The Yeast Actin Cytoskeleton: from Cellular Function to Biochemical Mechanism»,Microbiology and Molecular Biology Reviews70(3),doi:,PMID16959963,https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?artid=1594590
- ↑«Isovariant Dynamics Expand and Buffer the Responses of Complex Systems: The Diverse Plant Actin Gene Family»,The Plant Cell Online11(6),http:// plantcell.org/cgi/content/full/11/6/995
- ↑Entrada PDBe pa 1unc.EBI.
- ↑70,070,1«Actin microfilament dynamics and actin side-binding proteins in plants»,Current Opinion in Plant Biology10(6),doi:,http://lmbiologia.campusnet.unito.it/didattica/att/a29a.1275.file.pdf(enllaz rotudisponible n'Internet Archive;ver l'historialy laúltima versión).
- ↑«AtFim1 is an actin filament crosslinking protein from Arabidopsis thaliana»,The Plant Journal24(5),doi:
- ↑Antonio Bayés de Lluna,VV Staff, José López-Sendón, Fause Attie, Eduardo Allegría EzquerraCardioloxía Clínica(n'español). Publicáu porElsevierEspaña, 2002; páx.páx.19.ISBN 84-458-1179-7
- ↑73,073,1John W. Baynes, Marek H. DominiczakBioquímica médica(n'español). Publicáu porElsevierEspaña, 2007; páx.268.ISBN 84-8174-866-8
- ↑Randall, D.; Burggren, W. et French, K..Eckert Fisioloxía animal,4ª.ISBN 84-486-0200-5.
- ↑«Alpha-actinin localization in the cleavage furrow during cytokinesis»,The Journal of Cell Biology79(1),doi:,PMID359574,http:// jcb.org/cgi/reprint/79/1/268.pdf
- ↑«Actin dynamics in the contractile ring during cytokinesis in fission yeast»,Nature419(6902),http://adsabs.harvard.edu/abs/2002Natur.419...82P
- ↑«Actin cleavage by CPP-32/apopain during the development of apoptosis»,Oncogene14(9),doi:,http:// nature /onc/journal/v14/n9/abs/1200919a.html
- ↑«Calpain and caspase: can you tell the difference?»,Trends in Neurosciences23(1),doi:,http:// mbi.ufl.edu/ctbis/wang/Wang71TINS2000.pdf(enllaz rotudisponible n'Internet Archive;ver l'historialy laúltima versión).
- ↑«Calpain inhibitors, but not caspase inhibitors, prevent actin proteolysis and DNA fragmentation during apoptosis»,Journal of Cell Science111(6),http://jcs.biologists.org/cgi/reprint/111/6/713.pdf
- ↑«SAPK2/p38-dependent F-Actin Reorganization Regulates Early Membrane Blebbing during Stress-induced Apoptosis»,The Journal of Cell Biology143(5),http:// jcb.org/cgi/content/full/143/5/1361
- ↑«Quantitative analysis of cadherin-catenin-actin reorganization during development of cell-cell adhesion»,The Journal of Cell Biology135(6),doi:,PMID8991100,http:// jcb.org/cgi/reprint/135/6/1899.pdf
- ↑«Redundancy in the microfilament system: abnormal development of Dictyostelium cells lacking two F-actin cross-linking proteins»,Cell68(1),http:// ncbi.nlm.nih.gov/pubmed/1732064
- ↑«Actin Plays a Role in Both Changes in Cell Shape and Gene- Expression Associated with Schwann Cell Myelination»,Journal of Neuroscience17(1),http:// jneurosci.org/cgi/content/full/17/1/241
- ↑«Role of Actin Cytoskeletal Dynamics in Activation of the Cyclic AMP Pathway and HWP1 Gene Expression in Candida albicans»,Eukaryotic Cell6(10),doi:,PMID17715368,https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?artid=2043390
- ↑«Novel Actin-Like Proteins T-ACTIN 1 and T-ACTIN 2 Are Differentially Expressed in the Cytoplasm and Nucleus of Mouse Haploid Germ Cells»,Biology of Reproduction69(2),doi:,PMID12672658,http:// biolreprod.org/cgi/reprint/69/2/475.pdf(enllaz rotudisponible n'Internet Archive;ver l'historialy laúltima versión).
- ↑«Epigenetic effects on yeast transcription caused by mutations in an actin-related protein present in the nucleus»,Xenes & Development10(5),doi:,http:// genesdev.org/cgi/reprint/10/5/604.pdf
- ↑«Dynamic length regulation of sensory stereocilia»,Seminars in Cell and Developmental Biology19(6),http://linkinghub.elsevier /retrieve/pii/S1084952108000451,consultáu'l 20 de xunu de 2009
- ↑«An actin molecular treadmill and myosins maintain stereocilia functional architecture and self-»,Journal of Cell Biology164(6),http://jcb.rupress.org/cgi/content/full/164/6/887,consultáu'l 20 de xunu de 2009
- ↑El so AI, Wiltshire T, Batalov S, Lapp H, Ching KA, Block D, Zhang J, Soden R, Hayakawa M, Kreiman G, Cooke MP, Walker JR, Hogenesch JB (2004). «A gene atlas of the mouse and human protein-encoding transcriptomes».Proc Natl Acad Sci U S A.101(16).PMID 15075390.http:// pnas.org/content/101/16/6062.full.
- ↑90,090,1«Uniprot ACTA1»(inglés).Consultáu'l 26 d'avientu de 2008.
- ↑91,091,1Friederike S Bathe, Heidi Rommelaere y Laura M Machesky (2007):Phenotypes of Myopathy-related Actin Mutants in differentiated C2C12 Myotubes.BMC Cell Biology, 8:2. doi:10.1186/1471-2121-8-2
- ↑Kaindl AM, Rüschendorf F, Krause S, Goebel HH, Koehler K, Becker C, Pongratz D, Müller-Höcker J, Nürnberg P, Stoltenburg-Didinger G, Lochmüller H, Huebner A. (2004). «Missense mutations of ACTA1 cause dominant congenital myopathy with cores».J Med Genet.41(11).PMID 15520409.
- ↑Sparrow, JC; Nowak KJ, Durling HJ, Beggs AH, Wallgren-Pettersson C, Romero N, Nonaka I, Laing NG. (setiembre 2003). «Muscle disease caused by mutations in the skeletal muscle Alpha -actin gene (ACTA1)».Neuromuscul Disord.13(8): páxs. 519-31.PMID12921789.
- ↑North, Kathryn (2002). «Nemaline Myopathy».Gene Reviews.PMID.http:// ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=nem.
- ↑Ilkovski B, Nowak KJ, Domazetovska A, Maxwell AL, Clement S, Davies KE, Laing NG, North KN, Cooper ST. (2004). «Evidence for a dominant-negative effect in ACTA1 nemaline myopathy caused by abnormal folding, aggregation and altered polymerization of mutant actin isoforms».Hum. Mol. Genet.13(16).PMID 15198992.http://hmg.oxfordjournals.org/cgi/content/full/13/16/1727.
- ↑Clarke NF, Ilkovski B, Cooper S, Valova VA, Robinson PJ, Nonaka I, Feng JJ, Marston S, North K (2007). «The pathogenesis of ACTA1-related congenital fiber type disproportion».Ann Neurol61(6).PMID 17387733.
- ↑«Structure, chromosome location, and expression of the human smooth muscle (enteric type) γ-actin gene: evolution of six human actin gen».Mol Cell Biol.11(6). 1991.PMID 1710027.https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=1710027.
- ↑Watson MB, Lind MJ, Smith L, Drew PJ, Cawkwell L. (2007). «Expression microarray analysis reveals xenes associated with in vitro resistance to cisplatin in a cell line model».Acta Oncol.46(5).PMID 17562441.
- ↑Guo DC, Pannu H, Tran-Fadulu V, Papke CL, Yu RK, Avidan N, Bourgeois S, Estrera AL, Safi HJ, Sparks Y, Amor D, Ades L, McConnell V, Willoughby CE, Güelu D, Willing M, Lewis RA, Kim DH, Scherer S, Tung PP, Ahn C, Buja LM, Raman CS, Shete SS, Milewicz DM. (2007). «Mutations in smooth muscle Alpha -actin (ACTA2) lead to thoracic aortic aneurysms and dissections».NatureGenet.39(12).PMID 17994018.
- ↑Guo; Papke CL, Tran-Fadulu V, Regalado YE, Avidan N, Johnson RJ, Kim DH, Pannu H, Willing MC, Sparks Y, Pyeritz RE, Singh MN, Dalman RL, Grotta JC, Marian AJ, Boerwinkle EA, Frazier LQ, LeMaire SA, Coselli JS, Estrera AL, Safi HJ, Veeraraghavan S, Muzny DM, Wheeler DA, Willerson JT, Yu RK, Shete SS, Scherer SE, Raman CS, Buja LM, Milewicz DM. (mayu 2009). «Mutations in smooth muscle Alpha -actin (ACTA2) cause coronary artery disease, stroke, and Moyamoya disease, along with thoracic aortic disease»(n'inglés).Am J Human Genet84(5): páxs. 617-27.PMID19409525.
- ↑Akpolat N, Yahsi S, Godekmerdan A, Yalniz M, Demirbag K (2005). «The value of Alpha -SMA in the evaluation of hepatic fibrosis severity in hepatitis B infection and cirrhosis development: a histopathological and immunohistochemical study».Histopathology47(3).PMID 16115228.
- ↑Hamada H, Petrino MG, Kakunaga T. (1982). «Molecular structure and evolutionary origin of human cardiac muscle actin gene».Proc Natl Acad Sci U S A.79(19).PMID 6310553.https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=6310553.
- ↑103,0103,1Olson TM, Michels VV, Thibodeau SN, Tai YS, Keating MT. (1998). «Actin mutations in dilated cardiomyopathy, a heritable form of heart failure.».Science280(5364).PMID 9563954.
- ↑Xia X-G, Zhou H, Samper Y, Melov S, Xu Z (2006)Pol II–Expressed shRNA Knocks Down Sod2 Gene Expression and Causes Phenotypes of the Gene Knockout in Mice. PLoS Genet 2(1): y10. doi:10.1371/journal.pgen.0020010
- ↑«OMIM 102540»(inglés).Consultáu'l 27 d'avientu de 2008.(enllaz rotudisponible n'Internet Archive;ver l'historialy laúltima versión).
- ↑Matsson H, Eason J, Bookwalter CS, Klar J, Gustavsson P, Sunnegårdh J, Enell H, Jonzon A, Vikkula M, Gutiérrez I, Granados-Riveron J, Pope M, Bu'Lock F, Cox J, Robinson TE, Song F, Brook DJ, Marston S, Trybus KM, Dahl N. (2008). «Alpha-cardiac actin mutations produz atrial septal defects.».Hum Mol Genet.17(2).PMID 17947298.
- ↑Kabaeva, Kabaeva,Z. «Genetic analysis in hypertrophic cardiomyopathy: missense mutations in the ventricular myosin regulatory light chain gene»(inglés).Universidá Humboldt de Berlín.Consultáu'l 27 d'avientu de 2008.
- ↑Olson TM, Doan TP, Kishimoto NY, Whitby FG, Ackerman MJ, Fananapazir L.Inherited and de novo mutations in the cardiac actin gene cause hypertrophic cardiomyopathy(n'inglés). J Mol Cell Cardiol 2000; 32:1687-1694.
- ↑Ramírez, Carlos Darío. «Cardiomiopatía hipertrófica familiar: Xenes, mutaciones y modelos animales. Revisión.». Invest. clín, mar. 2004, vol.45, non.1, p.69-100. Consultáu'l 15 de xunetu de 2009.
- ↑Kaski JP, Syrris P, Burch M, Tomé-Esteban MT, Fenton M, Christiansen M, Andersen PS, Sebire N, Ashworth M, Deanfield JE, McKenna WJ, Elliott PM. (2008). «Idiopathic restrictive cardiomyopathy in children is caused by mutations in cardiac sarcomere protein gen».Heart94(11).PMID 18467357.
- ↑Klaassen S, Probst S, Oechslin Y, Gerull B, Krings G, Schuler P, Greutmann M, Hürlimann D, Yegitbasi M, Pons L, Gramlich M, Drenckhahn JD, Heuser A, Berger F, Jenni R, Thierfelder L. (2008). «Mutations in sarcomere protein genes in left ventricular noncompaction».Circulation117(22).PMID 1850600.
- ↑«ACEVieW:Homo sapiens complex locus ACTB, encoding actin, β.»(inglés).Consultáu'l 28 de xunu de 2008.
- ↑Chang KW, Yang PY, Lai HY, Yeh TS, Chen TC, Yeh CT. (2006). «Identification of a novel actin isoform in hepatocellular carcinoma».Hepatol Res.36(1).PMID 16824795.
- ↑Kristy L Williams, Masuma Rahimtula yKaren M Mearow.Hsp27 and axonal growth in adult sensory neurons in vitroBMC Neuroscience 2005, 6:24doi:10.1186/1471-2202-6-24
- ↑«Pericytoma with t(7;12)». Atlas of Genetics and Cytogenetics in Oncology and Haematology. Consultáu'l 28 d'avientu de 2008.
- ↑Procaccio V, Salazar G, Ono S, Styers ML, Gearing M, Dávila A, Jiménez R, Xuncos J, Gutekunst CA, Meroni G, Fontanella B, Sontag Y, Sontag JM, Faundez V, Wainer BH. (2006). «A mutation of β -actin that alters depolymerization dynamics is associated with autosomal dominant developmental malformations, deafness, and dystonia».Am J Hum Genet78(6).PMID 16685646.https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=16685646#RF21.
- ↑Nunoi H, Yamazaki T, Tsuchiya H, Kato S, Malech HL, Matsuda I, Kanegasaki S. (1999). «A heterozygous mutation of β-actin associated with neutrophil dysfunction and recurrent infection».Proc Natl Acad Sci U S A.96(15).PMID 10411937.https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=10411937.
- ↑118,0118,1«ACEVIEW ACTG1»(inglés).Consultáu'l 29 d'avientu de 2008.
- ↑Erba HP, Gunning P, Kedes L. (1986). «Nucleotide sequence of the human γ cytoskeletal actin mRNA: anomalous evolution of vertebrate non-muscle actin xenes.».Nucleic Acids Res.14(13).PMID 373740.https://web.archive.org/web/http:// pubmedcentral.nih.gov/pagerender.fcgi?artid=311540&pageindex=2#page.
- ↑Bryan, KE; Rubenstein, PA (xunetu 2009). «Allele-specific Effects of Human Deafness {γ}-Actin Mutations (DFNA20/26) on the Actin/Cofilin Interaction»(n'inglés).J Biol Chem.284(27): páxs. 18260-9.PMID19419963.
- ↑Sonnemann KJ, Fitzsimons DP, Patel JR, Liu Y, Schneider MF, Moss RL, Ervasti JM. (2006). «Cytoplasmic γ-actin is not required for skeletal muscle development but its absence leads to a progressive myopathy.».Dev Cell11(3).PMID 16950128.
- ↑«A comparative study of the actin-based motilities of the pathogenic bacteria Listeria monocytogenes, Shigella flexneriand Rickettsia conorii»,Journal of Cell Science112(11),https://journals.biologists /jcs/article/112/11/1697/25636/A-comparative-study-of-the-actin-based-motilities
- ↑Lambrechts, A; Gevaert K, Cossart P, Vandekerckhove J, Van Troys M. (mayu 2008). «Listeria comet tails: the actin-based motility machinery at work»(n'inglés).Trends Cell Biol.18(5): páxs. 220-7.PMID18396046.
- ↑«Actin-based motility of intracellular pathogens»,Current Opinion in Microbiology8(1),http://linkinghub.elsevier /retrieve/pii/S1369527404001675
- ↑Parks, QM; Young RL, Poch KR, Malcolm KC, Vasil ML, Nick JA. (abril 2009). «Neutrophil enhancement of Pseudomonas aeruginosa biofilm development: human F-actin and DNA as targets for therapy».J med microbiol:páxs. 492-502 pmid=19273646.doi:.https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=19273646.
- ↑Liu; Belkina NV, Shaw S. (abril 2009). «HIV infection of T cells: actin-in and actin-out»(n'inglés).Sci Signal.2.PMID19366992.
- ↑Machesky LM; Tang HR (xunetu 2009). «Actin-Based Protrusions: Promoters or Inhibitors of Cancer Invasion?».Cancer Cell.16(1): páxs. 5-7.PMID19573806.
- ↑«The nucleotide sequence of a human smooth muscle (enteric type) γ-actin cDNA.»,Molecular and Cellular Biology11(6),https://web.archive.org/web/http:// pubmedcentral.nih.gov/picrender.fcgi?artid=360182
- ↑«Evolution of the cytoskeleton»,BioEssays: news and reviews in molecular, cellular and developmental biology29(7),https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?artid=2630885
- ↑«Are histones, tubulin, and actin derived from a common ancestral protein?»,Protoplasma233,doi:
- ↑«Actin and endocytosis: mechanisms and phylogeny»,Current Opinion in Cell Biology21,doi:,https://web.archive.org/web/http://linkinghub.elsevier /retrieve/pii/S0955067409000076
- ↑«Prokaryotic origin of the actin cytoskeleton»,Nature413,doi:,https://web.archive.org/web/http://www2.mrc-lmb.cam.ac.uk/ss/Amos_L/group/PDF/MreB%20Nature.pdf
- ↑«The Bacterial Actin-Like Cytoskeleton»,Microbiology and Molecular Biology Reviews70(4),doi:,PMID17158703,https://web.archive.org/web/http:// pubmedcentral.nih.gov/articlerender.fcgi?artid=1698507
- ↑«Light-controlled molecular shuttles made from motor proteins carrying cargu on engineered surfaces»,Nano Letters1(5),doi:
- ↑«Actin-Based Molecular Motors for Cargu Transportation in Nanotechnology—Potentials and Challenges»,IEEE Transactions on Advanced Packaging28(4),http://ieeexplore.ieee.org/xpls/abs_all.jsp?arnumber=1528636
- ↑Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F (2002)Accurate normalisation of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genArchiváu2020-05-27 enWayback Machine.Xen. Biol. 3: 1–12.
- ↑«ß-Actin»,Molecular and cellular Probes15(5),https://web.archive.org/web/http://linkinghub.elsevier /retrieve/pii/S0890850801903767,consultáu'l 7 de xunetu de 2009
- ↑«Immunohistochemical localization of actin: Applications in surgical pathology.»,The American Journal of Surgical Pathology5(1),http:// ajsp /pt/re/ajsp/abstract.00000478-198101000-00013.htm,consultáu'l 19 d'abril de 2009
- ↑«Atrophy responses to muscle inactivity. II. Molecular markers of protein deficits»,Journal of Applied Physiology95(2),http://jap.physiology.org/cgi/content/full/95/2/791,consultáu'l 19 de marzu de 2009Archiváu2009-10-21 enWayback Machine
- ↑«Current advances in proteomic analysis and its use for the resolution of poultry meat quality»,World's Poultry Science Journal62(01),http:// animalscience /uploads/additionalFiles/QualityOfPoultryMeat/27.pdf,consultáu'l 7 de xunetu de 2009
- ↑M.L., «Methods and Instruments in Applied Food Analysis»,Handbook of Food Analysis.,http://orton.catie.ac.cr/cgi-bin/wxis.exe/?IsisScript=BFHIA.xis,consultáu'l 7 de xunetu de 2009Archiváu2016-08-12 enWayback Machine
Enllaces esternos
[editar|editar la fonte]- Videu de la polimerización de la actina(n'inglés)
- Videu de la interaición actina-miosina(n'inglés)
- MMDB ID 50538 Modelu molecular de G-actina xunida a ATP por Domínguez.
- MMDB ID 69126 Modelu molecular de F actina por T. Oda
