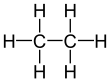
ইথেন
| |||
| |||
| নামসমূহ | |||
|---|---|---|---|
| ইউপ্যাক নাম
ইথেন[১]
| |||
| শনাক্তকারী | |||
ত্রিমাত্রিক মডেল (জেমল)
|
|||
| বেইলস্টেইন রেফারেন্স | 1730716 | ||
| সিএইচইবিআই | |||
| সিএইচইএমবিএল | |||
| কেমস্পাইডার | |||
| ইসিএইচএ ইনফোকার্ড | ১০০.০০০.৭৪১ | ||
| ইসি-নম্বর |
| ||
| এমইএসএইচ | ইথেন | ||
পাবকেমCID
|
|||
| আরটিইসিএস নম্বর |
| ||
| ইউএনআইআই | |||
| ইউএন নম্বর | 1035 | ||
কম্পটক্স ড্যাশবোর্ড(EPA)
|
|||
| |||
| |||
| বৈশিষ্ট্য | |||
| C2H6 | |||
| আণবিক ভর | ৩০.০৭ g·mol−১ | ||
| বর্ণ | বর্ণহীন গ্যাস | ||
| গন্ধ | গন্ধহীন | ||
| ঘনত্ব | |||
| গলনাঙ্ক | −১৮২.৮ °সে; −২৯৬.৯ °ফা; ৯০.৪ K | ||
| স্ফুটনাঙ্ক | −৮৮.৫ °সে; −১২৭.৪ °ফা; ১৮৪.৬ K | ||
| ৫৬.৮ mg L−1[৩] | |||
| বাষ্প চাপ | ৩.৮৪৫৩ MPa (at ২১.১ °C) | ||
| কেএইচ | ১৯ nmol Pa−১kg−১ | ||
| অম্লতা(pKa) | ৫০ | ||
| Basicity(pKb) | -৩৬ | ||
| তাপ রসায়নবিদ্যা | |||
| তাপ ধারকত্ব,C | ৫২.৪৯ J K−1mol−১ | ||
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তনΔfH |
−৮৪ kJ mol−১ | ||
| দহনে প্রমান এনথ্যাল্পির পরিবর্তনΔcH |
−১৫৬১.0–−১৫৬০.৪ kJ mol−১ | ||
| ঝুঁকি প্রবণতা | |||
| জিএইচএস চিত্রলিপি | 
| ||
| জিএইচএস সাংকেতিক শব্দ | বিপজ্জনক | ||
| জিএইচএস বিপত্তি বিবৃতি | H220 | ||
| জিএইচএস সতর্কতামূলক বিবৃতি | P210,P410+403 | ||
| এনএফপিএ ৭০৪ |  | ||
| ফ্ল্যাশ পয়েন্ট | −১৩৫ °সে (−২১১ °ফা; ১৩৮ K) | ||
| বিস্ফোরক সীমা | ২.৯–১৩% | ||
| সম্পর্কিত যৌগ | |||
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদেরপ্রমাণ অবস্থা(২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |||
| তথ্যছক তথ্যসূত্র | |||
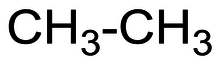
ইথেন(/ˈɛθeɪn/অথবা/ˈiːθeɪn/) হচ্ছে একটি রাসায়নিক উপাদান যাররাসায়নিক সংকেতহচ্ছে C2H6।আদর্শ তাপমাত্রা ও চাপেইথেন বর্ণ, গন্ধহীন গ্যাসীয় পদার্থ। ইথেনপ্রাকৃতিক গ্যাসথেকে সংশ্লেষন করা হয়। তৈল সংশোধনাগারে বাইপ্রোডাক্ত বা দ্বিতীয় পণ্য হিসেবে ইথেন গ্যাস উৎপন্ন হয়। এটা প্রধানতইথিলিনপ্রস্তুতিতে ব্যবহার করা হয়। একটিঅ্যালকেনশ্রেণীরঅ্যালিফ্যাটিক হাইড্রোকার্বন।
হাইড্রোজেন পরমাণুকে অন্যকার্যকরী গোষ্ঠীরসাথে প্রতিস্থাপন করে সম্পর্কিত যৌগগুলি গঠিত হতে পারে; ইথেনঅংশকেইথাইল গ্রুপবলা হয়। উদাহরণস্বরূপ,হাইড্রক্সিলগ্রুপের সাথে যুক্ত একটি ইথাইল গ্রুপইথানল,যা পানীয়ের অ্যালকোহল।
ইতিহাস[সম্পাদনা]
পটাশিয়াম এসিটেটদ্রবণের উপরতড়িৎ বিক্রিয়াপরিচালনা করেমাইকেল ফ্যারাডে১৮৩৪ সালে সর্বপ্রথম ইথেন সংশ্লেষন করেন। তিনি উৎপন্নহাইড্রোকার্বনপদার্থকে মিথেন ভেবে ভুল করেন এবং এটা নিয়ে আর কোন গবেষণা করেন নাই।[৪]
১৮৪৭-১৮৪৯ সালের দিকেহারম্যান কোবএবংএডওয়ার্ড ফ্রাংল্যান্ডপটাশিয়ামধাতুর সাথে প্রোপিওনাইট্রাইল (ইথাইল সায়ানাইড) বিয়োজন করে ইথেন প্রস্তুত করেন।[৫]তারাও এটাকেমিথাইলর্যাডিক্যাল ভেবে ভুল করেন। ১৮৬৪ সালে কার্ল স্কোর্ল্যামার এই ভুল সংশোধন করেন। তিনি প্রমাণ করেন এই সকল বিক্রিয়া ইথেনের জন্যই সংঘটিত হচ্ছে।.[৬]
অজৈব রসায়নের IUPAC নামকরণ পদ্ধতি অনুসারে ইথেনের নামকরণ করা হয়েছে। ইথেন শব্দটি ইথ+এন দ্বারা গঠিত। ইথ দ্বারা অণুতে দুটি কার্বনের উপস্থিতি এবং এন দ্বারা তাদের মধ্যে একটি একক বন্ধন বোঝানো হয়েছে।
বৈশিষ্ট্য[সম্পাদনা]
আদর্শ তাপমাত্রা এবং চাপে, ইথেন একটি বর্ণহীন, গন্ধহীন গ্যাস। এটির স্ফুটনাঙ্ক −৮৮.৫ °সে (−১২৭.৩ °ফা) এবং গলনাঙ্ক −১৮২.৮ °সে (−২৯৭.০ °ফা) । কঠিন ইথেন বিভিন্ন পরিবর্তনে বিদ্যমান।[৭]স্বাভাবিক চাপে ঠাণ্ডা হলে, প্রথম পরিবর্তনটি প্রদর্শিত হবে একটিপ্লাস্টিকের স্ফটিক,কিউবিক সিস্টেমে স্ফটিক। এই ফর্মে, হাইড্রোজেন পরমাণুর অবস্থান স্থির নয়; অণুগুলি দীর্ঘ অক্ষের চারপাশে অবাধে ঘুরতে পারে। এই ইথেনকে ca. ৮৯.৯ K (−১৮৩.২ °সে; −২৯৭.৮ °ফা) নিচে ঠাণ্ডা করলে এটি মনোক্লিনিক মেটাস্টেবল ইথেন ২ (স্পেস গ্রুপP 21/n) এ পরিবর্তিত হয়।[৮]ইথেন পানিতে খুব কম দ্রবণীয়।
ইথেনের বন্ড প্যারামিটারগুলি মাইক্রোওয়েভ স্পেকট্রোস্কোপি এবং ইলেক্ট্রন ডিফ্র্যাকশন দ্বারা উচ্চ নির্ভুলতা পরিমাপ করা হয়েছে:rC−C= 1.528(3) Å,rC−H= 1.088(5) Å, এবং ∠CCH = 111.6(5)° মাইক্রোওয়েভ দ্বারা এবংrC−C= 1.524(3) Å,rC−H= 1.089(5) Å, এবং ∠CCH = 111.9(5)° ইলেকট্রন বিচ্ছুরণ দ্বারা (বন্ধনীতে থাকা সংখ্যাগুলি চূড়ান্ত অঙ্কের অনিশ্চয়তাকে উপস্থাপন করে)।[৯]
বায়ুমণ্ডলীয় এবং বহির্জাগতিক[সম্পাদনা]
পৃথিবীর বায়ুমণ্ডলেইথেন একটি ট্রেস গ্যাস হিসাবে পাওয়া যায়। বর্তমানেসমুদ্রপৃষ্ঠে০.৫পিপিবিএর ঘনত্ব রয়েছে,[১০]যদিও আজকের বায়ুমণ্ডলে ইথেনের একটি উল্লেখযোগ্য অনুপাত থেকে এর প্রাক-ইন্ডাস্ট্রিয়াল ঘনত্ব প্রতি বিলিয়নের প্রায় ০.২৫ অংশ হওয়ার সম্ভাবনা রয়েছে যাজীবাশ্ম জ্বালানীহিসাবে উদ্ভূত হতে পারে। বৈশ্বিক ইথেনের পরিমাণ সময়ের সাথে সাথে পরিবর্তিত হয়েছে, সম্ভবতপ্রাকৃতিক গ্যাস ক্ষেত্রগুলিতেজ্বলে উঠারকারণে।[১১]১৯৮৪ থেকে ২০১০ সাল পর্যন্ত বিশ্বব্যাপী ইথেন নির্গমনের হার হ্রাস পেয়েছে,[১১]যদিও মার্কিন যুক্তরাষ্ট্রেরবেকেন ফর্মেশনেশেল গ্যাসেরউৎপাদন বৃদ্ধি অর্ধেক হ্রাসকে আটকে দিয়েছে।[১২][১৩]
যদিও ইথেন একটিগ্রিনহাউস গ্যাস,এটি মিথেনের তুলনায় অনেক কম পরিমাণে, এক দশকের তুলনায় মাত্র কয়েক মাসের জীবনকাল[১৪]এবং ভরের তুলনায় বিকিরণ শোষণে কম দক্ষ। প্রকৃতপক্ষে, ইথেনেরগ্লোবাল ওয়ার্মিং সম্ভাবনামূলত বায়ুমণ্ডলে মিথেনে রূপান্তরের ফলে।[১৫]একে চারটিদৈত্য গ্রহেরবায়ুমণ্ডলে এবংশনিরচাঁদটাইটানেরবায়ুমণ্ডলে একটি ট্রেস উপাদান হিসাবে সনাক্ত করা হয়েছে।[১৬]
মিথেন গ্যাসের উপর সূর্যের আলোকরাসায়নিকক্রিয়া থেকে বায়ুমণ্ডলীয় ইথেন পাওয়া যায়। এছাড়াও এই বায়ুমন্ডলে উপস্থিত রয়েছে: ১৬০এনএমএর চেয়ে ছোটতরঙ্গদৈর্ঘ্যেরঅতিবেগুনীফোটন মিথেন অণুকেমিথাইলর্যাডিকেল এবং একটিহাইড্রোজেনপরমাণুতে ফটো-ডিসোসিয়েট করতে পারে। যখন দুটি মিথাইল র্যাডিকেল পুনরায় একত্রিত হয়, ফলাফলটি ইথেন হয়:
- CH4→ CH3• + • H
- CH3• + •CH3→ C2H6
পৃথিবীর বায়ুমণ্ডলে,হাইড্রোক্সিল র্যাডিকেলইথেনকেমিথানলবাষ্পে রূপান্তরিত করে যার অর্ধ-জীবন প্রায় তিন মাস।[১৭]
ধারণা করা হয় যে টাইটানে এই পদ্ধতিতে উত্পাদিত ইথেন আবার চাঁদের পৃষ্ঠে বৃষ্টিপাত করে এবং সময়ের সাথে সাথে হাইড্রোকার্বন সমুদ্রে জমা হয়ে চাঁদের মেরু অঞ্চলের বেশিরভাগ অংশকে আবৃত করে। ২০০৭ সালের ডিসেম্বরেক্যাসিনি প্রোবটাইটানের দক্ষিণ মেরুতে অন্তত একটি হ্রদ খুঁজে পেয়েছিল, যাকে এখনঅন্টারিও ল্যাকাসবলা হয় কারণ হ্রদটি পৃথিবীরঅন্টারিও হ্রদেরঅনুরূপ এলাকা (প্রায় ২০,০০০ কিমি২) জুড়ে অবস্থিত। জুলাই ২০০৮ সালে উপস্থাপিত ইনফ্রারেড স্পেকট্রোস্কোপিক ডেটার আরও বিশ্লেষণ[১৮]অন্টারিওল্যাকাসে তরল ইথেনের উপস্থিতির জন্য অতিরিক্ত প্রমাণ পাওয়া যায়। ক্যাসিনি দ্বারা সংগৃহীত রাডার ডেটা ব্যবহার করে টাইটানের উত্তর মেরুতে আবিষ্কৃত হয়েছিল বেশ কয়েকটি উল্লেখযোগ্য বড় হাইড্রোকার্বন হ্রদ যা মধ্যেলিজিয়া মেরএবংক্রাকেন মেরেহচ্ছে দুটি বৃহত্তম হ্রদ। এই হ্রদগুলি প্রাথমিকভাবে তরল ইথেন এবং মিথেনের মিশ্রণে ভরাট বলে মনে করা হয়।
১৯৯৬ সালে,ধূমকেতু হায়াকুটাকেইথেন সনাক্ত করা হয়েছিল, এবং তারপর থেকে অন্য কিছুধূমকেতুতেসনাক্ত করা হয়েছে। এই দূরবর্তী সৌরজগতের উপাদানগুলিতে ইথেনের অস্তিত্ব ইথেনকেসৌর নীহারিকারএকটি আদি উপাদান হিসাবে নিহিত করতে পারে যা থেকে সূর্য এবং গ্রহগুলি গঠিত হয়েছে বলে বিশ্বাস করা হয়।
২০০৬ সালে, NASA/Ames রিসার্চ সেন্টারের ডেল ক্রুইকশ্যাঙ্ক (একজননিউ হরাইজনসসহ-তদন্তকারী) এবং তার সহকর্মীরাপ্লুটোরপৃষ্ঠে ইথেনের বর্ণালী আবিষ্কারের ঘোষণা করেছিলেন।[১৯]
রসায়ন[সম্পাদনা]

রসায়নাগারে কোব ইলেকট্রোলাইসিসের মাধ্যমে ইথেন প্রস্তুত করা হয়। এই পদ্ধতিতে এসিটেট লবণের জলীয় দ্রবণে তড়িৎবিশ্লেষণ চালনা করা হয়। এনোডেএসিটেটঅক্সিডাইজড হয়েকার্বন ডাই অক্সাইডএবংমিথাইলমুক্তমূলক উৎপাদন করে এবং এই উচ্চ শক্তি সম্পন্ন মিথাইল মুক্তমূলক পরস্পর যুক্ত হয়ে ইথেন তৈরী করে: −
আরেকটি পদ্ধতিতেএসেটিক এনহাইড্রাইডকেপার অক্সাইডদ্বারা বিয়োজিত করে ইথেন প্রস্তুত করা হয়]]
যেহেতু হ্যালোজেনেটেড ইথেনগুলি আরও ফ্রি র্যাডিকাল হ্যালোজেনেশনের মধ্য দিয়ে যেতে পারে, এই প্রক্রিয়াটির ফলে বেশ কয়েকটি হ্যালোজেনেটেড উৎপাদের মিশ্রণ ঘটে। রাসায়নিক শিল্পে, কোনো নির্দিষ্ট দুই-কার্বন হ্যালোআলকেন উৎপাদনের জন্য আরও নির্দিষ্ট রাসায়নিক বিক্রিয়া ব্যবহার করা হয়।
দহন[সম্পাদনা]
ইথেনের পূর্ণাঙ্গ দহনের ফলে ১৫৫৯.৭ kJ/mol বা ৫১.৯ kJ/g তাপ এবংকার্বন ডাই অক্সাইডওপানিউৎপন্ন হয়।
এই বিক্রিয়া ধাপে ধাপে সংঘটিত হয়ঃ
দহন একটি জটিল সিরিজ ফ্রি-র্যাডিকাল বিক্রিয়া দ্বারা ঘটে। ইথেন দহনেররাসায়নিক গতিবিদ্যারকম্পিউটার সিমুলেশনেশত শত বিক্রিয়া অন্তর্ভুক্ত করা হয়েছে। ইথেন দহনে বিক্রিয়ার একটি গুরুত্বপূর্ণ সিরিজ হলঅক্সিজেনেরসাথে একটি ইথাইল র্যাডিক্যালের সংমিশ্রণ, এবং পরবর্তীতেপারঅক্সাইডেরইথক্সি এবং হাইড্রক্সিল র্যাডিকেলে পরিণত হওয়া।
অসম্পূর্ণ দহনের ফলেএসিটাল্ডিহাইড,মিথেন,মিথানলএবংইথানলউৎপন্ন হয়।
বাধা[সম্পাদনা]
একটি মোচড়ানো বন্ধন সম্পর্কে একটি আণবিক অবকাঠামো ঘোরানোর জন্য সাধারণত শক্তির প্রয়োজন হয়। একটি ৩৬০° বন্ধন ঘূর্ণন উত্পাদন করার জন্য সর্বনিম্ন শক্তিকেঘূর্ণন বাধাবলা হয়।
ইথেন এই ধরনের একটি ঘূর্ণন বাধার একটি ক্লাসিক, সহজ উদাহরণ দেয়, কখনও কখনও একে "ইথেন বাধা" বলা হয়। এই বাধার প্রথম দিকের পরীক্ষামূলক প্রমাণের মধ্যে ইথেনের এনট্রপি মডেলিং করে পাওয়া যায়।[২০]তাত্ত্বিক পদ্ধতিগুলি যেগুলি একটি উপযুক্ত সূচনা বিন্দু (অর্থোগোনাল অরবিটাল) ব্যবহার করে খুঁজে পায় যে হাইপারকনজুগেশন হল ইথেন ঘূর্ণন বাধার উৎপত্তির সবচেয়ে গুরুত্বপূর্ণ কারণ।[২১][২২]
১৮৯০-৯১ সাল পর্যন্ত, রসায়নবিদরা পরামর্শ দিয়েছিলেন যে ইথেন অণুগুলি একে অপরের থেকে অণুর দুটি প্রান্তের সাথে স্তব্ধ রূপকে পছন্দ করে।[২৩][২৪][২৫][২৬]
উৎপাদন[সম্পাদনা]
মিথেনেরপরে, ইথেনপ্রাকৃতিক গ্যাসেরদ্বিতীয় বৃহত্তম উপাদান। বিভিন্ন গ্যাস ক্ষেত্র থেকে প্রাপ্ত প্রাকৃতিক গ্যাস ইথেনের পরিমাণ ০১% কম থেকে থেকে ০৬% এর বেশি হতে পারে। ১৯৬০ এর আগে, ইথেন এবং বৃহত্তর অণুগুলি সাধারণত প্রাকৃতিক গ্যাসের মিথেন উপাদান থেকে আলাদা করা হত না, তবে মিথেনের সাথে জ্বালানী হিসাবে পুড়িয়ে ফেলা হত। বর্তমানে, ইথেন একটি গুরুত্বপূর্ণপেট্রোকেমিক্যালফিডস্টকএবং বেশিরভাগ উন্নত গ্যাস ক্ষেত্রে প্রাকৃতিক গ্যাসের অন্যান্য উপাদান থেকে আলাদা করা হয়। ইথেনকেপেট্রোলিয়াম গ্যাসথেকেও আলাদা করা যেতে পারে, যাপেট্রোলিয়াম পরিশোধনেরউপজাত হিসাবে উত্পাদিত বায়বীয় হাইড্রোকার্বনের মিশ্রণ।
ইথেনকে ক্রায়োজেনিক তাপমাত্রায় তরলীকৃত করে মিথেন থেকে সবচেয়ে দক্ষতার সাথে আলাদা করা হয়। বিভিন্ন হিমায়ন কৌশল বিদ্যমান: বর্তমানে ব্যাপক ব্যবহারে সবচেয়ে লাভজনক প্রক্রিয়া একটিটার্বোএক্সপ্যান্ডারনিয়োগ করে এবং প্রাকৃতিক গ্যাসের ৯০% এরও বেশি ইথেন পুনরুদ্ধার করতে পারে। এই প্রক্রিয়ায়, একটিটারবাইনেরমাধ্যমে ঠাণ্ডা গ্যাস প্রসারিত হয়, যা তাপমাত্রাকে প্রায় −১০০ °সে (−১৪৮ °ফা) এ কমিয়ে দেয়। । এই নিম্ন তাপমাত্রায়, বায়বীয় মিথেনকেপাতনেরমাধ্যমে তরলীকৃত ইথেন এবং ভারী হাইড্রোকার্বন থেকে আলাদা করা যায়। আরও পাতন তারপরপ্রোপেনএবং ভারী হাইড্রোকার্বন থেকে ইথেনকে আলাদা করে।
ব্যবহার[সম্পাদনা]
রাসায়নিক কারখানাগুলোতেইথিন(ইথিলিন) উৎপাদনে ইথেন ব্যবহার করা হয়। ইথেনের প্রধান ব্যবহার হলবাষ্প ক্র্যাকিংদ্বারাইথিলিন(ইথিন) উৎপাদন করা। যখন বাষ্প দিয়ে মিশ্রিত করা হয় এবং খুব উচ্চ তাপমাত্রায় (৯০০ °C বা তার বেশি) ভারী হাইড্রোকার্বন হালকা হাইড্রোকার্বনে ভেঙে যায় এবংস্যাচুরেটেড হাইড্রোকার্বনঅসম্পৃক্তহয়ে যায়। ইথেন ইথিলিন উৎপাদনের জন্য অনুকূল কারণ ইথেনের বাষ্প ক্র্যাকিং ইথিলিনের জন্য মোটামুটি নির্দিষ্ট, যখন ভারী হাইড্রোকার্বনের বাষ্প ক্র্যাকিং একটি ক্ষীণ পণ্যের মিশ্রণ ইথিলিন পাওয়া যায় এবং ভারীঅ্যালকেনেস (ওলেফিন)সমৃদ্ধ, যেমনপ্রোপেন (প্রপিলিন,কিন্তু) এবংসুগন্ধি হাইড্রোকার্বনে।
পরীক্ষামূলকভাবে, ইথেন অন্যান্য পণ্য রাসায়নিকের জন্য একটি ফিডস্টক হিসাবে তদন্তাধীন। ইথেনেরঅক্সিডেটিভক্লোরিনেশন দীর্ঘকাল ধরে ইথিলিন ক্লোরিনেশনের চেয়েভিনাইল ক্লোরাইডেরজন্য একটি সম্ভাব্য অধিক লাভজনক পথ বলে মনে হয়েছে। এই বিক্রিয়া তৈরির জন্য অনেক প্রক্রিয়াপেটেন্ট করাহয়েছে, কিন্তুভিনাইল ক্লোরাইডএবংক্ষয়কারীবিক্রিয়া অবস্থার জন্য দুর্বল নির্বাচনযোগ্যতা (বিশেষত, ৫০০ °C-এর বেশি তাপমাত্রায়হাইড্রোক্লোরিক অ্যাসিডধারণকারী বিক্রিয়া মিশ্রণ) তাদের বেশিরভাগের বাণিজ্যিকীকরণকে নিরুৎসাহিত করেছে। বর্তমানে,INEOSজার্মানিরWilhelmshaven-এ ১০০০ t/a (বার্ষিকটন) ইথেন-টু-ভিনাইল ক্লোরাইড পাইলট প্ল্যান্ট পরিচালনা করে।
একইভাবে,সৌদি আরবেরফার্মসাবিকইয়ানবুতেইথেন অক্সিডেশনের মাধ্যমেঅ্যাসিটিক অ্যাসিডতৈরি করতে ৩০,০০০ টন/বছর প্ল্যান্ট নির্মাণের ঘোষণা দিয়েছে। এই প্রক্রিয়ার অর্থনৈতিক কার্যকারিতা সৌদি তেলক্ষেত্রের কাছে পাওয়া ইথেনের কম খরচের উপর নির্ভর করতে পারে এবং এটি বিশ্বের অন্য কোথাওমিথানল কার্বনাইলেশনেরসাথে প্রতিযোগিতামূলক নাও হতে পারে।
ক্রায়োজেনিক রেফ্রিজারেশন সিস্টেমে ইথেনকে রেফ্রিজারেন্ট হিসাবে ব্যবহার করা যেতে পারে। অনেক ছোট স্কেলে, বৈজ্ঞানিক গবেষণায়, তরল ইথেনক্রিও-ইলেক্ট্রন মাইক্রোস্কোপিরজন্য পানি-সমৃদ্ধ নমুনাগুলিকেভিট্রিফাই করতেব্যবহৃত হয়। পানির একটি পাতলা ফিল্ম দ্রুত তরল ইথেনে −১৫০ °C এ নিমজ্জিত হয় বা তার চেয়ে বেশি ঠাণ্ডা পানির স্ফটিকের জন্য খুব দ্রুত জমে যায়। ধীরে ধীরে হিমায়িত করার পদ্ধতিগুলি ঘন বরফের স্ফটিক তৈরি করতে পারে, যা নমুনাগুলিকে ক্ষতিগ্রস্ত করেনরম কাঠামোকেব্যাহত করতে পারে এবং ডিটেক্টরে পৌঁছানোর আগে ইলেক্ট্রন রশ্মিকে ছড়িয়ে দিয়ে ছবির গুণমান হ্রাস করতে পারে।
ম্যান এনার্জি সলিউশনসবর্তমানে টু-স্ট্রোক ডুয়াল ফুয়েল ইঞ্জিন (B&W ME-GIE) তৈরি করে যাসামুদ্রিক ডিজেল তেলএবং ইথেন উভয়েই চলতে পারে।
স্বাস্থ্য ঝুঁকি[সম্পাদনা]
ঘরের তাপমাত্রায়, ইথেন একটি অত্যন্ত দাহ্য গ্যাস। আয়তনের ভিত্তিতে ৩.০%-১২.৫% এ বাতাসের সাথে মিশালে এটি একটিবিস্ফোরকমিশ্রণ তৈরি করে।
যেখানে ইথেন একটি ক্রায়োজেনিক তরল হিসাবে সংরক্ষণ করা হয় সেখানে কিছু অতিরিক্ত সতর্কতা প্রয়োজন। তরল ইথেনের সাথে সরাসরি যোগাযোগের ফলে মারাত্মকহিমদংশনহতে পারে। যতক্ষণ না তারা ঘরের তাপমাত্রায় উষ্ণ হয়, তরল ইথেন থেকে আসা বাষ্পগুলি বাতাসের চেয়ে ভারী হয় এবং মেঝে বা মাটি বরাবর প্রবাহিত হতে পারে, নিচু জায়গায় জড়ো হতে পারে; যদি বাষ্পগুলি একটি ইগনিশন উত্সের মুখোমুখি হয় তবে রাসায়নিক বিক্রিয়াটি ইথেনের উত্সে ফিরে যেতে পারে যেখান থেকে তারা বাষ্পীভূত হয়েছিল।
ইথেনঅক্সিজেনকেস্থানচ্যুত করতে পারে এবংশ্বাসরোধেরঝুঁকিতে পরিণত হতে পারে। ইথেন কোন পরিচিত তীব্র বা দীর্ঘস্থায়ীবিষাক্তঝুঁকি তৈরি করে না। এটি একটিকার্সিনোজেননয়।[২৭]
তথ্যসূত্র[সম্পাদনা]
- ↑কখ"Ethane – Compound Summary"।PubChem Compound। USA: National Center for Biotechnology Information। ১৬ সেপ্টেম্বর ২০০৪। সংগ্রহের তারিখ ৭ ডিসেম্বর ২০১১।
- ↑Lide, D. R., সম্পাদক (২০০৫)।CRC Handbook of Chemistry and Physics(86th সংস্করণ)। Boca Raton (FL): CRC Press। পৃষ্ঠা 3.22।আইএসবিএন0-8493-0486-5।
- ↑Lide, D. R., সম্পাদক (২০০৫)।CRC Handbook of Chemistry and Physics(86th সংস্করণ)। Boca Raton (FL): CRC Press। পৃষ্ঠা 8.88।আইএসবিএন0-8493-0486-5।
- ↑Faraday, Michael (১৮৩৪)। "Experimental researches in electricity: Seventh series" ।Philosophical Transactions।124:77–122।ডিওআই:10.1098/rstl.1834.0008।
- ↑Frankland, Edward (১৮৫০)। "On the isolation of the organic radicals" ।Journal of the Chemical Society।2(3): 263–296।ডিওআই:10.1039/QJ8500200263।
- ↑Schorlemmer, Carl (১৮৬৪)।Annalen der Chemie।132:234।
|শিরোনাম=অনুপস্থিত বা খালি (সাহায্য) - ↑Van Nes, G.J.H.; Vos, A. (১৯৭৮)।"Single-crystal structures and electron density distributions of ethane, ethylene and acetylene. I. Single-crystal X-ray structure determinations of two modifications of ethane"(পিডিএফ):1947।ডিওআই:10.1107/S0567740878007037।
- ↑"Ethane as a solid"। সংগ্রহের তারিখ ২০১৯-১২-১০।
- ↑Harmony, Marlin D. (১৯৯০-১১-১৫)। "The equilibrium carbon–carbon single‐bond length in ethane" (ইংরেজি ভাষায়): 7522–7523।আইএসএসএন0021-9606।ডিওআই:10.1063/1.459380।
- ↑Trace gases(archived).
- ↑কখSimpson, Isobel J.; Sulbaek Andersen, Mads P. (২০১২)।"Long-term decline of global atmospheric ethane concentrations and implications for methane":490–494।ডিওআই:10.1038/nature11342।পিএমআইডি22914166।
- ↑Kort, E. A.; Smith, M. L. (২০১৬)। "Fugitive emissions from the Bakken shale illustrate role of shale production in global ethane shift": 4617–4623।ডিওআই:10.1002/2016GL068703
 ।
।
- ↑"One oil field a key culprit in global ethane gas increase"। University of Michigan। এপ্রিল ২৬, ২০১৬।
- ↑Aydin, Kamil Murat; Williams, M.B. and Saltzman, E.S.; ‘Feasibility of reconstructing paleoatmospheric records of selected alkanes, methyl halides, and sulfur gases from Greenland ice cores’;Journal of Geophysical Research;volume 112, D07312
- ↑Hodnebrog, Øivind; Dalsøren, Stig B. and Myrhe, Gunnar; ‘Lifetimes, direct and indirect radiative forcing, and globalwarming potentials of ethane (C2H6), propane (C3H8),and butane (C4H10)’;Atmospheric Science Letters;2018;19:e804
- ↑Brown, Bob (২০০৮)।"NASA Confirms Liquid Lake on Saturn Moon"। NASA Jet Propulsion Laboratory। ৫ জুন ২০১১ তারিখেমূলথেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৮ জুন ২০২৩।
- ↑Aydin, Kamil Murat; Williams, M.B. and Saltzman, E.S.; ‘Feasibility of reconstructing paleoatmospheric records of selected alkanes, methyl halides, and sulfur gases from Greenland ice cores’;Journal of Geophysical Research;volume 112, D07312
- ↑Brown, R. H.; Soderblom, L. A. (২০০৮)। "The identification of liquid ethane in Titan's Ontario Lacus": 607–10।ডিওআই:10.1038/nature07100।পিএমআইডি18668101।
- ↑Stern, A.(নভেম্বর ১, ২০০৬)।"Making Old Horizons New"।The PI's Perspective। Johns Hopkins University Applied Physics Laboratory। আগস্ট ২৮, ২০০৮ তারিখেমূলথেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০০৭-০২-১২।
- ↑Kemp, J. D.; Pitzer, Kenneth S. (১৯৩৭)। "The Entropy of Ethane and the Third Law of Thermodynamics. Hindered Rotation of Methyl Groups": 276।ডিওআই:10.1021/ja01281a014।
- ↑Pophristic, V.; Goodman, L. (২০০১)। "Hyperconjugation not steric repulsion leads to the staggered structure of ethane": 565–8।ডিওআই:10.1038/35079036।পিএমআইডি11385566।
- ↑Schreiner, P. R. (২০০২)। "Teaching the right reasons: Lessons from the mistaken origin of the rotational barrier in ethane": 3579–81, 3513।ডিওআই:10.1002/1521-3773(20021004)41:19<3579::AID-ANIE3579>3.0.CO;2-S।পিএমআইডি12370897।
- ↑Bischoff, CA (১৮৯০)।"Ueber die Aufhebung der freien Drehbarkeit von einfach verbundenen Kohlenstoffatomen":623।ডিওআই:10.1002/cber.18900230197।
- ↑Bischoff, CA (১৮৯১)।"Theoretische Ergebnisse der Studien in der Bernsteinsäuregruppe":1074–1085।ডিওআই:10.1002/cber.189102401195।
- ↑Bischoff, CA (১৮৯১)।"Die dynamische Hypothese in ihrer Anwendung auf die Bernsteinsäuregruppe":1085–1095।ডিওআই:10.1002/cber.189102401196।
- ↑Bischoff, C.A.; Walden, P. (১৮৯৩)।"Die Anwendung der dynamischen Hypothese auf Ketonsäurederivate":1452।ডিওআই:10.1002/cber.18930260254।
- ↑Vallero, Daniel (জুন ৭, ২০১০)। "Cancer Slope Factors" ।Environmental Biotechnology: A Biosystems Approach। Academic Press। পৃষ্ঠা 641।আইএসবিএন9780123750891।ডিওআই:10.1016/B978-0-12-375089-1.10014-5।
উদ্ধৃতি ত্রুটি:<references>-এ সংজ্ঞায়িত "Mumma" নামসহ<ref>ট্যাগ পূর্ববর্তী লেখায় ব্যবহৃত হয়নি।
<references>-এ সংজ্ঞায়িত "Kolbe" নামসহ<ref>ট্যাগ পূর্ববর্তী লেখায় ব্যবহৃত হয়নি।আরো পড়ুন[সম্পাদনা]
- Kolbe, Hermann (১৮৫০)।"Researches on the electrolysis of organic compounds"।Journal of the Chemical Society।2(2): 157–184।ডিওআই:10.1039/QJ8500200157।