Neon
| Neon uperiodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element,Simbol,Atomski broj | Neon, Ne, 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Plemeniti gasovi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa,Perioda,Blok | 18, 2,p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | bezbojni plin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 5 · 10-7[1]% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 20,1797[2][3]u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus(izračunat) | (38) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 58 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | 154 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [He]2s22p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektronauenergetskom nivou | 2, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 2080,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 3952,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. energija ionizacije | 6122 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. energija ionizacije | 9371 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. energija ionizacije | 12177 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. energija ionizacije | 15238 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7. energija ionizacije | 19999,0 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8. energija ionizacije | 23069,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | kubična plošno centrirana | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 0,9002[4]kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | dijamagnetičan (= −3,8 · 10−9)[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 24,56 K (-248,59°C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 27,15[6]K (-246°C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | (čvrst)13,23 · 10-6m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 1,9[6]kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 0,34 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | 435[5]m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična toplota | 1031 J/(kg · K) kod 298 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 0,0491 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | 1,[7]0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrodni potencijal | ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | - (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Oznake upozorenja
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R:nema oznaka upozorenja R S:9-23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste seosnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Neon(grčki:νέον– nov) jestehemijski elementsasimbolomNeiatomskim brojem10. Uperiodnom sistemustoji u8. glavnoj grupi(18. grupa) i stoga se ubraja u plemenite gasove. Kao i ostali plemeniti gasovi, neon je bezbojni, izrazito nereaktivni, jednoatomni gas. Po mnogim osobinama kao što su tačka topljenja, ključanja i gustoća, stoji između lakšeghelijai težegargona.
Usvemiru,neon spada među najčešće elemente, ali je naZemljirelativno rijedak, jer je poput helija, njegov najveći dio tokom vremena ispario u svemir. Uglavnom se nalazi u višim slojevima Zemljineatmosfere,a vrlo malehne količine su zarobljene u stijenama.
Kao ikriptoniksenon,neon su također otkriliWilliam RamsayiMorris William Travers1898. godine frakcijskomdestilacijomtečnogzraka.Najpoznatija upotreba ovog gasa ogleda se u svjetlećim cijevima, takozvanim neonskim lampama, u kojima se neon pomoću električnog pražnjenja dovodi do isijavanja tipične narandžasto-crvene svjetlosti.
Historija
[uredi|uredi izvor]
Prvi plemeniti gas koji je otkriven bio je argon, koga su 1894. otkrili lord Rayleigh iWilliam Ramsay.Ramsay je godinu kasnije, 1895. je uspio izoliratihelijiz uranijeve rude, gas koji je ranije bio poznat samo u Sunčevom spektru. Iz pravilnosti periodnog sistema, zaključio je da bi između helija i argona trebao postojati neki element sa atomskom masom od oko 20u.Stoga je od 1896. počeo proučavati različitemineraleimeteorite,te gasove koji se otpuštaju pri njihovim zagrijavanjem ili rastvaranjem. Ramsay, zajedno sa svojim saradnikomTraversom,nisu bili uspješni sa potragom, međutim uspjeli su izolirati helij i rijetki gas argon. Također, ni ispitivanja vrelih gasova izCauteretsau Francuskoj i saIslanda,nisu dovela do rezultata.[8]
Napokon, nakon što je iz tečnog zraka izolirao 15 litara sirovog argona, počeo ga je ispitivati, te nakon što ga je preveo u tečno stanje, počeo je izdvajati druge supstance putem frakcijske destilacije. Pri tom postupku, prvo je izdvojiokripton,koji je dokazao u spektru plamena, a zatim 13. juna 1898. godine napokon su uspjeli izolirati lakše elemente iz frakcije sa nižom tačkom ključanja sirovog argona. Ramsay i Travers su taj element nazvalineon,iz grčkog naziva νέοςneos„nov “. Ubrzo nakon tog otkrića, uspjelo im je iz frakcije koja je sadržavala kripton, izdvojiti još jedan element,ksenon.[8]
Prvi vid upotrebe novootkrivenih gasova razvio je 1910. godine FrancuzGeorges Claude,koji je razvio neonsku lampu, napunivši staklenu cijev neonom te je propuštajući električnu struju visokog napona kroz nju, doveo neon do emitiranja svjetlosti.[9]
Osobine
[uredi|uredi izvor]Fizičke
[uredi|uredi izvor]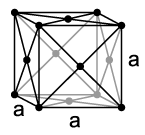

Pri normalnim uslovima, neon je jednoatomni, bezbojni gas, bez ukusa i mirisa. Pri temperaturi od 27 K (−246 °C)kondenziraa pri temperaturi od 24,57 K (−248,59 °C) prelazi u čvrsto stanje, što znači da on ima najuži temperaturni opseg od svih elemenata u kojem je u tečnom stanju. Kao i drugi plemeniti gasovi, osim helija, neon se kristalizira ukubičnom gusto pakovanom kuglastom sistemusa parametrom rešetke oda= 443 pm.[10]
Kao i svi drugi plemeniti gasovi, neon također ima popunjene sve elektronske ljuske (konfiguracija plemenitog gasa). Zbog toga se može objasniti njegovo prisustvo kao jednoatomnog elementa i odsustvo bilo kakve reaktivnosti. Sa gustoćom od oko 0,9 kg/m3pri temperaturi od 0 °C i pritisku 1013 hPa, neon je nešto lakši odzraka,te se diže gore. Ufaznom dijagramutrojna tačkase nalazi na 24,56 K i 43,37 kPa[11],a kritična tačka na 44,4 K, 265,4 kPa, dok kritična gustoća iznosi 0,483 g/cm3.[12]
Uvodi,neon je vrlo slabo rastvorljiv. U jednoj litri vode pri temperaturi od 20 °C može se rastvoriti najviše 10,5 ml neona.[12]Kao i drugi plemeniti gasovi, pri električnom pražnjenju neon također pokazuje karakteristične spektarske linije. Pošto su te linije u vidljivom dijela spektra pretežno u crvenom i žutom području, pri takvom pražnjenju gas emitira tipičnu crveno-narandžastu boju.
Hemijske
[uredi|uredi izvor]Kao tipičan plemeniti gas, neon je izrazito nereaktivan, kao ihelij,do danas nisu poznati njegovi spojevi. Čak i klatrati, koji su kod drugih plemenitih gasova fizički uklopljeni u druge spojeve, međutim nisu poznati kod neona. Prema teoretskim proračunima, neon je najmanje reaktivan element. Tako izračunataentalpijadisocijacije za spojeve tipa NgBeO (gdje jeNgplemeniti gas), kod spojeva neona je najmanja. Utvrđeno je da, i pored najstabilnijeg spoja helija HHeF, koji je najbliži analog neona, nije potvrđeno postojanje sličnog spoja kod neona. Moguće objašnjenje za ovaj rezultat je da se izmeđufluoraivodikanalazi najveći razmak u vezi te se stoga javlja vrlo slaba veza privlačenja iona HNe+za razliku od helijevog iona, ili se javlja sila odbijanja u neonovim kationima zbog p-π izmjeničnog djelovanja.[13]
Iz ispitivanjamasenom spektrometrijom,poznati su nekiioniu kojima je zastupljen neon. U njih spadaju ion Ne+i neki ioni elemenata poput ArNe+,HeNe+i HNe+.[5]
Izotopi
[uredi|uredi izvor]Postoji ukupno 18 poznatihizotopaneona između16Ne i34Ne. Među njima, tri su stabilna:20Ne,21Ne i22Ne i javljaju se u prirodi. Najčešći izotop je20Ne i ima udio u prirodnom neonu od 90,48%. Izotop21Ne sa udjelom od 0,27% je najrjeđi na Zemlji, a na izotop22Ne u prirodnoj smjesi izotopa na Zemlji otpada 9,25%. Svi ostali izotopi imaju veoma kratka vremena poluraspada, od najviše 3,38 minuta kod izotopa24Ne.[14]
S obzirom na gubljenje neona sa Zemlje u svemir i formiranje u nuklearnim reakcijama, izotopski omjer između neona20Ne/22Ne i21Ne/22Ne, koji je zarobljen u stijenama i nema kontakt sa atmosferom, nije isti. Iz tog izotopskog omjera mogu se izvući zaključci o njegovom porijeklu i nastanku. Tako je udio neona21Ne u stijenama, u kojima je on nastao u reakcijama spalacije, nešto povećan. U primordijalnom neonu, koji je bio zarobljen u stijenama idijamantimaprije gubitka većeg dijela neona, s druge strane, veći udio čini izotop20Ne.[15]
Rasprostranjenost
[uredi|uredi izvor]Usvemiru,neon se ubraja među najčešće i najrasprostranjenije elemente, samo suvodik,helij,kisik,ugljikidušikviše rasprostranjeni od njega. Međutim, naZemlji,poput helija, je relativno rijedak, a njegov ukupan udio u Zemljinoj kori iznosi samo oko 0,005 dijelova na milion (ppm) (0,0000005%).[1]Najveći dio neona nalazi se uatmosferi,sa prosječnim udjelom od oko 18,18 ppm, te je poslije argona, najčešći plemeniti gas na Zemlji.[16]Na osnovu različitog udjela lakših i težih izotopa neona na Zemlji i naSuncumože se zaključiti da je od postanka Zemlje najveći dio neona napustio njenu atmosferu te su ostali teži izotopi21Ne i22Ne.
U vrlo malehnim količinama, neon se javlja i u sastavu stijena. Dokazan je u sastavugranita,bazaltnihstijena,dijamantaivulkanskihgasova. Zbog različitog udjela njegovih izotopa smatra se da ovaj neon ima tri različita izvora nastanka: primordijalni neon, čiji izotopni sastav odgovara onom na Suncu te je zarobljen u dijamantima ili u Zemljinom plaštu bez kontakta sa atmosferom, zatim atmosferski neon te neon koji je nastao putem reakcija spalacije kosmičkim zračenjem.[15]
Na gasovitim planetama poputJupitera,neon ne može pobjeći u svemiru zbog velikegravitacije,tako da tamo izotopski sastav neona odgovara onom iz vremena stvaranja planeta. Prema podacima sa svemirske sondeGalileo,odnos udjela izotopa20Ne prema22Ne odgovara onom na Suncu, što daje naznake o uslovima pri kojima su nastale planete.[17]
Nukleosinteza
[uredi|uredi izvor]Neon, a prije svega njegov izotop20Ne, jeste važan međuproizvod unukleosintezikoja se odvija uzvijezdama,a nastaje tek nakon nuklearnog "izgaranja" ugljika. Tokom nuklearnogsagorijevanjahelija pri temperaturi od oko 200 · 108Kne nastaje izotop20Ne zbog malehnog presjeka hvatanja alfa čestica kod16O,a iz težeg izotopa18O mogu nastati teži izotopi21Ne i22Ne. Znatnim povećanjem temperature i gustoće neke zvijezde nakon što potroši sav helij, dolazi do "izgaranja" ugljika, pri čemu se spajaju dva atoma ugljika u jedan pobuđeni izotopmagnezija24Mg*. Iz njega putemα-raspadanastaje neon20Ne.
Pri daljnjem porastu temperature i pritiska započinje reakcija "izgaranja" neona, pri kojoj20Ne uz alfa-raspad reagira do16O odnosnofuzionirase sa nastalim jezgrom helija dajući24Mg.
Ovaj proces se odvija zbog velikeosjetljivostiizotopa20Ne u poređenju sa16O na gama zrake, umjesto očekivanih reakcija lakših jezgara kisika. Tek nakon što se završi "izgaranje" neona, započinje nuklearno "izgaranje"kisika,pri kojem iz16O nastaju teži elementi poputsilicija,fosforaisumpora.[18][19]
Upotreba
[uredi|uredi izvor]Zbog svoje rijetkosti i otežanog dobijanja, te s tim povezanih visokih troškova i cijena u odnosu prema sličnom gasu argonu, neon se koristi samo u vrlo malehnim količinama. Neon se koristi kao gas za punjenje svijetlećih cijevi idioda,u kojima se putem električnog pražnjenja gas dovodi do emitiranja tipične narandžasto-crvene svjetlosti. Također, neon se upotrebljava i kao gas za punjenje stroboskopskih i bljeskajućih lampi.[12]
Helij-neon laser,u kojem se koristi mješavina helija i neon, ubraja se među važnije lasere. Neophodnainverzija populacijelaserapostiže se pobuđivanjem helija i prenosom elekrona na neon. Stimulirana emisija kod neona nastaje pri dužini talasa od 632,8 nm (crvena) kao i pri 1152,3 nm i 3391 nm (infracrvena). Ostali laserski prelazi su moguće i to u zelenom spektarskom području pri 543,3 nm.[12]Tečni neon može se koristiti kao sredstvo za hlađenje. U poređenju sa helijem ivodikomima prednost u 40 puta većem efektu hlađenja od tečnog helija, i tri puta većem od vodika.[20]
Neon se može koristiti u mješavini sa kisikom kao gas za disanje pri ronjenju u velikim dubinama. Međutim, relativno rijetko se upotrebljava, jer u poređenju sa sličnim helijem ima mnogo višu cijenu i uzrokuje dosta veći otpor pri disanju.[21][22]
Biološki značaj
[uredi|uredi izvor]Kao i drugi plemeniti gasovi, ni neon nema biološki značaj zbog svoje hemijske inertnosti. Nije otrovan. U velikim koncentracijama može dovesti do gušenja, ali samo uslijed nedostatka kisika.[23]Pri pritisku od preko 110 bara djelujenarkotizirajuće.[24]
Reference
[uredi|uredi izvor]- ^abHarry H. Binder:Lexikon der chemischen Elemente,S. Hirzel Verlag, Stuttgart 1999,ISBN3-7776-0736-3.
- ^Michael E. Wieser i Tyler B. Coplen:Atomic weights of the elements (IUPAC Technical Report)u: Pure and Applied Chemistry Vol. 83, No. 2, 2011, str. 359–396.
- ^IUPAC, Standard Atomic Weights Revised 2013
- ^Gestis[mrtav link],baza podataka supstanci
- ^abcWeast, Robert C. (gl. ur.):CRC Handbook of Chemistry and Physics.CRC (Chemical Rubber Publishing Company), Boca Raton 1990. str. E-129 do E-145.ISBN0-8493-0470-9.
- ^abYiming Zhang, Julian R. G. Evans, Shoufeng Yang:Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks.u: Journal of Chemical & Engineering Data. 56, 2011, str. 328–337,doi:10.1021/je1011086
- ^HNe,NIST Chemistry WebBook
- ^abWilliam Ramsay:The Rare Gases of the Atmosphere.govor povodom dodjele Nobelove nagrade, 12. decembar 1904.
- ^PatentUS1125476Arhivirano16. 2. 2012. naWayback MachineSystem of illuminating by luminescent tubes.prijavljen 8. oktobra 1911, objavljen 19. januara 1915, izumitelj: Georges Claude.
- ^K. Schubert:Ein Modell für die Kristallstrukturen der chemischen Elemente.u:Acta Crystallographica.1974, 30, str. 193–204,doi:10.1107/S0567740874002469
- ^J. Ancsin:Vapor Pressure and Triple Point of Neon and the Influence of Impurities on these Properties.u:Metrologica.1978, 4, 1, str. 1 (NIST webbook).
- ^abcdRömppOnline:Neon,19. juni 2014
- ^Errol G. Lewars:Modeling Marvels: Computational Anticipation of Novel Molecules.Springer Verlag, 2008,ISBN978-1-4020-6972-7,str. 69–80.
- ^G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra:The NUBASE evaluation of nuclear and decay propertiesArhivirano23. 9. 2008. naWayback Machine(PDF).u:Nuclear Physics.2003, Bd. A 729, str. 3–128.
- ^abAlan P. Dickin:Radiogenic isotope geology.2. izd., Cambridge University Press, 2005,ISBN978-0-521-82316-6,str. 303–307.
- ^David R. Williams:Earth Fact Sheet.NASA,Greenbelt, stanje 20. maj 2009.
- ^P. R. Mahaffy, H. B. Niemann, A. Alpert, S. K. Atreya, J. Demick, T. M. Donahue, D. N. Harpold, T. C. Owen:Noble gas abundance and isotope ratios in the atmosphere of Jupiter from the Galileo Probe Mass Spectrometer.u:J. Geophys. Res.2000, 105, str. 15061–15071 (Abstract).
- ^S. E. Woosley, A. Heger:The evolution and explosion of massive stars.u:Rev. Mod. Phys.2002, 74, str. 1015–1071,doi:10.1103/RevModPhys.74.1015.
- ^L. R. Buchmann, C. A. Barnes:Nuclear reactions in stellar helium burning and later hydrostatic burning stages.u:Nuclear Physics A.2006, 777, str. 254–290,doi:10.1016/j.nuclphysa.2005.01.005.
- ^P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger:Noble Gases.u:Ullmann's Encyclopedia of Industrial Chemistry.Wiley-VCH, Weinheim 2006,doi:10.1002/14356007.a17_485.
- ^Alfred A. Bove, Jefferson Carroll Davis:Bove and Davis' diving medicine.4. izd., Elsevier, 2004,ISBN978-0-7216-9424-5,str. 121.
- ^SAD Patent 3815591,Heinz Schreiner, Robert Hamilton, Arthur Francis, "Diving gas mixtures and methods of deep diving", izdan 28.4.1972, dodijeljen Union Carbide Co.
- ^Sicherheitsdatenblatt(PDF), Linde AG, stanje 4. august 2006.
- ^Walter J. Moore, Dieter O. Hummel:Physikalische Chemie.4. izd., de Gruyter, 1986,ISBN978-3-11-010979-5,str. 284.
Vanjski linkovi
[uredi|uredi izvor]- Neonna straniciThe Periodic Table of Videos(Univerzitet u Nottinghamu)
- WebElements.com – Neon.
- It's Elemental – Neon(en)
- USGS periodni sistem – Neon(en)
- Atomski spektar neona(en)
- Muzej neona u Las Vegasu(en)





