GALT
| N-terminalnidomen galaktoza-1-fosfat uridil-transferaze | |
|---|---|
| Identifikatori | |
| Simbol | GalP_UDP_transf |
| C-terminalnidomen galaktoza-1-fosfat uridil-transferaze | |
|---|---|
 Struktura nukleotidiltransferaze kompleksirane saUDP-galaktozom | |
| Identifikatori | |
| Simbol | GalP_UDP_tr_C |
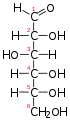
Galaktoza-1-fosfat uridililtransferaza–GALTiliG1PUT– jeenzim(EC 2.7.7.12) odgovoran za pretvaranje unesenegalaktozeuglukozu.[5]
Galaktoza-1-fosfat uridilililtransferaza (GALT) katalizira drugi korakLeloirputametabolizmagalaktoze:
- UDP-glukoza+galaktoza 1-fosfatglukoza 1-fosfat+UDP-galaktoza
- EkspresijaGALT -a kontrolira se djelovanjem genaFOXO3.Nedostatak ovog enzima dovodi do klasičnegalaktozemijekod ljudi i može biti smrtonosan u dobi novorođenčadi ako selaktozane ukloni iz prehrane. Patofiziologija galaktozemije nije jasno definirana.[5]
Aminokiselinska sekvenca
[uredi|uredi izvor]Dužinapolipeptidnoglanca je 379aminokiselina,аmolekulska težina43.363Da.[6]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MSRSGTDPQQ | RQQASEADAA | AATFRANDHQ | HIRYNPLQDE | WVLVSAHRMK | ||||
| RPWQGQVEPQ | LLKTVPRHDP | LNPLCPGAIR | ANGEVNPQYD | STFLFDNDFP | ||||
| ALQPDAPSPG | PSDHPLFQAK | SARGVCKVMC | FHPWSDVTLP | LMSVPEIRAV | ||||
| VDAWASVTEE | LGAQYPWVQI | FENKGAMMGC | SNPHPHCQVW | ASSFLPDIAQ | ||||
| REERSQQAYK | SQHGEPLLME | YSRQELLRKE | RLVLTSEHWL | VLVPFWATWP | ||||
| YQTLLLPRRH | VRRLPELTPA | ERDDLASIMK | KLLTKYDNLF | ETSFPYSMGW | ||||
| HGAPTGSEAG | ANWNHWQLHA | HYYPPLLRSA | TVRKFMVGYE | MLAQAQRDLT | ||||
| PEQAAERLRA | LPEVHYHLGQ | KDRETATIA |
Strukturne studije
[uredi|uredi izvor]Trodimenzijsku strukturu pri rezoluciji 180pm(kristalografija rendgenskih zraka) GALT-a odredili su Wedekind, Frey i Rayment, a njihovom strukturnom analizom utvrđeno je da su ključneaminokiselinebitne za funkciju GALT. Među njima suLeu4,Phe75,Asn77,Asp78,Phe79iVal108,koji su u skladu s ostacima koji su uključeni, kako u eksperimente stačkastom mutacijom,tako i u klinički skrining koji imaju ulogu u ljudskoj galaktozemiji.[7]
Mehanizam
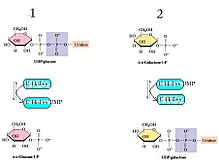
[uredi|uredi izvor]GALT katalizira drugu reakciju Leloirovog puta metabolizma galaktoze,kinetikommodela ping pong bi-bi, mehanizmomdvostruki pomak.[8]To znači da se neto reakcija sastoji od dva reaktanta i dva produkta (vidi gore navedenu reakciju), a odvija se prema sljedećem mehanizmu: enzim reagira s jednimsupstratom,stvarajući jedanproizvodi modificirani enzim, koji nastavlja reagirati s drugim supstrata za stvaranje drugog proizvoda, uz regeneraciju izvornogenzima.[9]U slučaju GALT-a, ostatak His166 djeluje kao moćannukleofilkako bi olakšao prijenosnukleotidaizmeđu UDP-heksoza i heksoza-1-fosfata.[10]
- UDP-glukoza + E-Hisglukoza-1-fosfat + E-His-UMP
- Galaktoza-1-fosfat + E-His-UMPUDP-galaktoza + E-His[10]
Klinički značaj
[uredi|uredi izvor]Nedostatak GALT uzrokujeklasičnu galaktozemiju.Galaktozemijaje autosomno recesivninasljedni poremećajkoji se može otkriti kod novorođenčadi i u djetinjstvu.[12]Javlja se otprilike 1/40.000 – 60.000 živorođene djece.Klasična galaktozemija(G/G) uzrokovana je nedostatkom GALT aktivnosti, dok su češće kliničke manifestacije,Nedostatak galaktoza-1-fosfat uridililtransferaze Duarte (D/D) i Duarte/klasična varijanta (D/G)uzrokovane su slabljenjem aktivnosti GALT-a.[13]Simptomi uključuju otkazivanjejajnika,razvojni poremećaj koordinacije(poteškoće u korektnom i konzistentnomgovoru),[14]inervnenedostatke.[13]Jednamutacijau bilo kojem od nekoliko parova baza može dovesti do nedostatka aktivnosti GALT-a.[15]Naprimjer, jednamutacijaiz A u G uegzonu6 gena GALT mijenja Glu188 uarginin,a mutacija iz A u G u egzonu 10 pretvara Asn314 uaspartat.[13]Ove dvije mutacije također dodaju nova rezna mjestarestrikcijskih enzima,koja omogućuju detekciju i opsežni skrining populacije pomoćuPCR-a (lančana reakcija polimeraze).[13]Skriningom je uglavnom eliminirana neonatusna smrt uzrokovana G /G galaktozemijom, ali je bolest, zbog uloge GALT-a u biohemijskommetabolizmuunesenegalaktoze(koja je otrovna pri akumulaciji) energetski korisnaglukoza,svakako može biti smrtonosna.[12][16]Međutim, oboljeli od galaktozemije mogu živjeti relativno normalnim životom izbjegavajući mliječne proizvode i bilo što drugo što sadrži galaktozu (jer se ne može metabolizirati), ali još uvijek postoji potencijal za probleme u neurološkom razvoju ili druge komplikacije, čak i kod onih koji izbjegavaju galaktozu.[17]
Baza podataka bolesti
[uredi|uredi izvor]Galactosemia (GALT) Mutation Database
Reference
[uredi|uredi izvor]- ^abcGRCh38: Ensembl release 89: ENSG00000213930-Ensembl,maj 2017
- ^abcGRCm38: Ensembl release 89: ENSMUSG00000036073-Ensembl,maj 2017
- ^"Human PubMed Reference:".National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^"Mouse PubMed Reference:".National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ab"Entrez Gene: GALT galactose-1-phosphate uridylyltransferase".
- ^"UniProt, P07902".Pristupljeno 8. 9. 2021.
- ^Seyrantepe V, Ozguc M, Coskun T, Ozalp I, Reichardt JK (1999)."Identification of mutations in the galactose-1-phosphate uridyltransferase (GALT) gene in 16 Turkish patients with galactosemia, including a novel mutation of F294Y. Mutation in brief no. 235. Online".Human Mutation.13(4): 339.doi:10.1002/(SICI)1098-1004(1999)13:4<339::AID-HUMU18>3.0.CO;2-S.PMID10220154.
- ^Wong LJ, Frey PA (septembar 1974). "Galactose-1-phosphate uridylyltransferase: rate studies confirming a uridylyl-enzyme intermediate on the catalytic pathway".Biochemistry.13(19): 3889–94.doi:10.1021/bi00716a011.PMID4606575.
- ^"Archived copy".Arhivirano soriginala,3. 3. 2016.Pristupljeno 19. 5. 2010.CS1 održavanje: arhivirana kopija u naslovu (link)
- ^abWedekind JE, Frey PA, Rayment I (septembar 1995). "Three-dimensional structure of galactose-1-phosphate uridylyltransferase from Escherichia coli at 1.8 A resolution".Biochemistry.34(35): 11049–61.doi:10.1021/bi00035a010.PMID7669762.
- ^"Archived copy".Arhivirano soriginala,4. 12. 2008.Pristupljeno 19. 5. 2010.CS1 održavanje: arhivirana kopija u naslovu (link)
- ^abFridovich-Keil JL (decembar 2006). "Galactosemia: the good, the bad, and the unknown".Journal of Cellular Physiology.209(3): 701–5.doi:10.1002/jcp.20820.PMID17001680.S2CID32233614.
- ^abcdElsas LJ, Langley S, Paulk EM, Hjelm LN, Dembure PP (1995). "A molecular approach to galactosemia".European Journal of Pediatrics.154(7 Suppl 2): S21-7.doi:10.1007/BF02143798.PMID7671959.S2CID11937698.
- ^"Archived copy".Arhivirano soriginala,28. 2. 2006.Pristupljeno 19. 5. 2010.CS1 održavanje: arhivirana kopija u naslovu (link)
- ^Dobrowolski SF, Banas RA, Suzow JG, Berkley M, Naylor EW (februar 2003)."Analysis of common mutations in the galactose-1-phosphate uridyl transferase gene: new assays to increase the sensitivity and specificity of newborn screening for galactosemia".The Journal of Molecular Diagnostics.5(1): 42–7.doi:10.1016/S1525-1578(10)60450-3.PMC1907369.PMID12552079.
- ^Lai K, Elsas LJ, Wierenga KJ (novembar 2009)."Galactose toxicity in animals".IUBMB Life.61(11): 1063–74.doi:10.1002/iub.262.PMC2788023.PMID19859980.
- ^"Arhivirana kopija".Arhivirano soriginala,29. 5. 2013.Pristupljeno 8. 9. 2021.CS1 održavanje: arhivirana kopija u naslovu (link)
Dopunska literatura
[uredi|uredi izvor]- Reichardt JK (1993). "Genetic basis of galactosemia".Human Mutation.1(3): 190–6.doi:10.1002/humu.1380010303.PMID1301925.S2CID504197.
- Tyfield L, Reichardt J, Fridovich-Keil J, Croke DT, Elsas LJ, Strobl W, Kozak L, Coskun T, Novelli G, Okano Y, Zekanowski C, Shin Y, Boleda MD (1999). "Classical galactosemia and mutations at the galactose-1-phosphate uridyl transferase (GALT) gene".Human Mutation.13(6): 417–30.doi:10.1002/(SICI)1098-1004(1999)13:6<417::AID-HUMU1>3.0.CO;2-0.PMID10408771.
- Reichardt JK, Belmont JW, Levy HL, Woo SL (mart 1992). "Characterization of two missense mutations in human galactose-1-phosphate uridyltransferase: different molecular mechanisms for galactosemia".Genomics.12(3): 596–600.doi:10.1016/0888-7543(92)90453-Y.PMID1373122.
- Leslie ND, Immerman EB, Flach JE, Florez M, Fridovich-Keil JL, Elsas LJ (oktobar 1992). "The human galactose-1-phosphate uridyltransferase gene".Genomics.14(2): 474–80.doi:10.1016/S0888-7543(05)80244-7.PMID1427861.
- Reichardt JK, Levy HL, Woo SL (juni 1992). "Molecular characterization of two galactosemia mutations and one polymorphism: implications for structure-function analysis of human galactose-1-phosphate uridyltransferase".Biochemistry.31(24): 5430–3.doi:10.1021/bi00139a002.PMID1610789.
- Reichardt JK, Packman S, Woo SL (oktobar 1991)."Molecular characterization of two galactosemia mutations: correlation of mutations with highly conserved domains in galactose-1-phosphate uridyl transferase".American Journal of Human Genetics.49(4): 860–7.PMC1683190.PMID1897530.
- Reichardt JK, Woo SL (april 1991)."Molecular basis of galactosemia: mutations and polymorphisms in the gene encoding human galactose-1-phosphate uridylyltransferase".Proceedings of the National Academy of Sciences of the United States of America.88(7): 2633–7.Bibcode:1991PNAS...88.2633R.doi:10.1073/pnas.88.7.2633.PMC51292.PMID2011574.
- Flach JE, Reichardt JK, Elsas LJ (august 1990). "Sequence of a cDNA encoding human galactose-1-phosphate uridyl transferase".Molecular Biology & Medicine.7(4): 365–9.PMID2233247.
- Reichardt JK, Berg P (april 1988). "Cloning and characterization of a cDNA encoding human galactose-1-phosphate uridyl transferase".Molecular Biology & Medicine.5(2): 107–22.PMID2840550.
- Bergren WG, Donnell GN (juli 1973). "A new variant of galactose-1-phosphate uridyltransferase in man: the Los Angeles variant".Annals of Human Genetics.37(1): 1–8.doi:10.1111/j.1469-1809.1973.tb01808.x.PMID4759900.S2CID22699183.
- Shih LY, Suslak L, Rosin I, Searle BM, Desposito F (novembar 1984). "Gene dosage studies supporting localization of the structural gene for galactose-1-phosphate uridyl transferase (GALT) to band p13 of chromosome 9".American Journal of Medical Genetics.19(3): 539–43.doi:10.1002/ajmg.1320190316.PMID6095663.
- Ashino J, Okano Y, Suyama I, Yamazaki T, Yoshino M, Furuyama J, Lin HC, Reichardt JK, Isshiki G (1995). "Molecular characterization of galactosemia (type 1) mutations in Japanese".Human Mutation.6(1): 36–43.doi:10.1002/humu.1380060108.PMID7550229.S2CID23500152.
- Elsas LJ, Langley S, Paulk EM, Hjelm LN, Dembure PP (1995). "A molecular approach to galactosemia".European Journal of Pediatrics.154(7 Suppl 2): S21-7.doi:10.1007/BF02143798.PMID7671959.S2CID11937698.
- Elsas LJ, Langley S, Steele E, Evinger J, Fridovich-Keil JL, Brown A, Singh R, Fernhoff P, Hjelm LN, Dembure PP (mart 1995)."Galactosemia: a strategy to identify new biochemical phenotypes and molecular genotypes".American Journal of Human Genetics.56(3): 630–9.PMC1801164.PMID7887416.
- Fridovich-Keil JL, Langley SD, Mazur LA, Lennon JC, Dembure PP, Elsas JL (mart 1995)."Identification and functional analysis of three distinct mutations in the human galactose-1-phosphate uridyltransferase gene associated with galactosemia in a single family".American Journal of Human Genetics.56(3): 640–6.PMC1801186.PMID7887417.
- Davit-Spraul A, Pourci ML, Ng KH, Soni T, Lemonnier A (novembar 1994). "Regulatory effects of galactose on galactose-1-phosphate uridyltransferase activity on human hepatoblastoma HepG2 cells".FEBS Letters.354(2): 232–6.doi:10.1016/0014-5793(94)01133-8.PMID7957929.S2CID45242645.
- Lin HC, Kirby LT, Ng WG, Reichardt JK (februar 1994)."On the molecular nature of the Duarte variant of galactose-1-phosphate uridyl transferase (GALT)".Human Genetics.93(2): 167–9.doi:10.1007/BF00210604.PMID8112740.S2CID42558872.
- Elsas LJ, Dembure PP, Langley S, Paulk EM, Hjelm LN, Fridovich-Keil J (juni 1994)."A common mutation associated with the Duarte galactosemia allele".American Journal of Human Genetics.54(6): 1030–6.PMC1918187.PMID8198125.
- Reichardt JK, Novelli G, Dallapiccola B (mart 1993). "Molecular characterization of the H319Q galactosemia mutation".Human Molecular Genetics.2(3): 325–6.doi:10.1093/hmg/2.3.325.PMID8499924.
Vanjski linkovi
[uredi|uredi izvor]- Galactose-1-P-UridyltransferasenaUS National Library of MedicineMedical Subject Headings(MeSH)
- GeneReviews/NIH/NCBI/UW entry on Galactosemia
- Galactosemia (GALT) Mutation Database
- GALT Protein DatabaseArhivirano9. 11. 2012. naWayback Machine
- PDBe-KBprovides an overview of all the structure information available in the PDB for Human Galactose-1-phosphate uridylyltransferase