Enzim
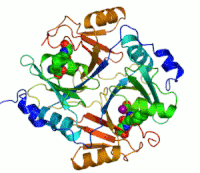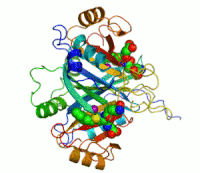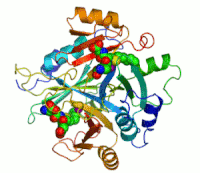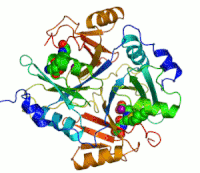
Dva ionacinkakoji su potrebni peilikom djelovanja enzima, prikazani su kao ljubičaste kuglice.Inhibitor enzimaS-heksiglutationje prikazan kao prostorno-popunjavajući modul, u dvaaktivna mjesta.
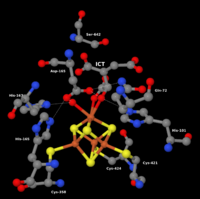
Struktura dijelamitohondrijskeakonitaze:katalitski centar sa Fe4S4klasterom (sredina, dolje) izocitrata (ICT) (Enzim prstenasto okružuje narednu aminokiselinu enzima).

Smatra se da je TIM katalitski savršen enzim (pogledajte odjeljak kinetika ovog članka).
Enzim(grč.ένζυμο,énsimo= kvasac) je svakiproteinsposoban da katalizira nekubiohemijskureakciju u živim organizmima.[1]
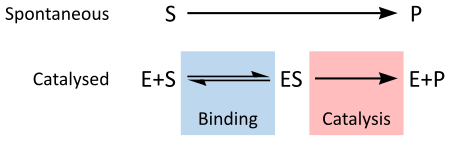
Reakcije koje se dešavaju u organizmu ne mogu uvijek same de se završe, a u tom slučaju im pomažu enzimi. Svaka biohemijska reakcija ima svoj posebni enzim, mada postoje i enzimi koji mogu katalizirati (pomoći, ubrzati) par reakcija više. Enzimi su prema reakcijama koje kataliziraju podijeljeni u šest grupa i svi oni imaju svoju oznaku u međunarodno prihvaćenom indeksu. Za enizme se često upotrijebljava i nazivfermenti.Nauka koja proučava enzime označava se kaoenzimologija.[2][3][4][5]

Aktivno mjesto ostatka (crveno), maltozni supstrat (crno) i kofaktor NAD (žuto).
Dijagram glikozidaze sa strelicom koja pokazuje cijepanje maltoznog šećernog supstrata u glukozne proizvode.
Prisutnost enzima omogućuje složene hemijske cikluse u organizmima uključujući i one koje organizmi koriste zametabolizam.Naprimjer,pepsinitripsinse koriste u procesu probaveproteina.
Poznato je da enzimi kataliziraju više od 5.000 vrsta biohemijskih reakcija. Većina enzima su proteini, iako ih je nekoliko u kategoriji katalitskih molekulaRNK.Posebnost enzima potiče iz njihove jedinstvene trodimenzionalne strukture.
Kao i svikatalizatori,enzimi povećavaju stopu reakcije, smanjenjem svoje aktivacijskeenergije.Neki enzimi mogu pretvaranjesupstratau proizvod učiniti na milione puta bržim. Ekstremni primjer jeorotidin 5'-fosfat dekarboksilaza,koja omogućava reakciju koja bi inače trajala milione godina da se obavi u milisekundi. Hemijski, enzimi su kao i svaki katalizator i ne troše se u hemijskim reakcijama, niti se njima mijenja ravnoteža reakcije. Enzimi se razlikuju od većine drugih katalizatora tako što djeluju mnogo konkretnije. Aktivnost enzima može biti pod utjecajem drugih molekula:inhibitorisu molekule koje smanjuju aktivnost enzima, aaktivatorisu molekule koje povećavaju aktivnost. Mnogilijekoviiotrovisu inhibitori enzima. Izvan njihove optimalnetemperatureipH,aktivnost enzima se znatno smanjuje.[6][7][8][9] [10]
Neki enzimi se koriste u komercijalne svrhe, naprimjer, u sinteziantibiotika.Neki proizvodi za domaćinstvo imaju enzime koji pomažu u ubrzanju hemijske reakcije: enzimi u biološkim prašcima za pranje razgrađuju mrlje na odjeći koje potiču odproteina,skrobailimasti,a proteine u mesu, profesionalna hemija enzimima razbija u manje molekule, pa ga je lakše žvakati.
Etimologija i historija
[uredi|uredi izvor]
Do kraja 17. i početkom 18. vijeka, bila je poznataprobavamesa u želudačnoj tečnosti i djelovanje biljnih ekstrakata ipljuvačkepri pretvaranjuškrobaušećere,ali mehanizmi pomoću kojih se to događa nisu još otkriveni.
FrancuskihemičarAnselme Payenje bio prvi koji je otkrio enzim,dijastazu,1833.Nekoliko desetljeća kasnije, kada je proučavaofermentacijušećera ualkoholpomoćukvasca,Louis Pasteurje zaključio da je ova fermentacija uzrokovanavitalnom silomkoja se nalazi u ćelijama kvasca, pod nazivom "fermenti", za koje se mislilo da djeluju samo unutar živih organizama. On je napisao da je "alkoholna fermentacija čin međuodnosa sa životom i organizacije ćelije kvasca, a ne sa smrću ili truljenjem ćelija.[11][12]
U1877., njemački fiziologWilhelm Kühne(1837.-1900.) prvi je koristio terminenzim,koji dolazi izgrčkogνζυμον = kvasac, koji opisuje ovaj proces. Riječ enzim je kasnije koristi i kada se tiče neživih materija, kao što supepsin,a riječfermentacijailipreviranjese koristi kada se odnosi na hemijske aktivnosti u produkciji živih organizama.
Eduard Buchnerje1897.objavio prvi rad na proučavanju kvaščevih ekstrakata. U nizu eksperimenata na Univerzitetu u Berlinu, otkrio je da je šećer fermentira je čak i kad nije bilo svakodnevnog prisustva ćelija kvasca u u smjesi. Enzim koji je izazvao fermentaciju saharoze označio je kao "zimaza".Godine1907., dobio jeNobelovu nagradu za hemijuza "njegovo otkriće fermentacije bez ćelija". Nakon Buchnerovog primjera, enzimi se obično nazvaju prema reakciji koju obavljaju, uzsufiks–aza,u kombinaciji s imenompodloge(npr.laktazaje enzim koji cijepalaktozu) ili na vrstu reakcije (npr.DNK polimerazakatalizira sintezu DNK polimera). U ranim 1900-im, biohemijski identitet enzima je i dalje nepoznat. Mnogi naučnici su primijetili da je enzimska aktivnost bila povezana sa proteinima, ali drugi (kao što je dobitnik Nobelove nagradeRichard Willstätter) su tvrdili da su proteini samo nosioci za prave enzime i da proteinipo sebinisu bili sposobni za katalizu. Godine1926.,James B. Sumnerje pokazao da je enzimureazabila čisti protein ikristaliziraoga, a isto je učinio i za enzimomkatalaz,1937.Da čisti proteini mogu biti enzimi pokazali suJohn Howard NorthropiWendell Meredith Stanley,koji su radili naprobavnimenzimima:pepsinu(1930.),tripsinuihimotripsinu.Ova tri naučnika1946.godine dobili suNobelovu nagradu za hemiju.[13][14]He named the enzyme that brought about the fermentation of sucrose "zymase".[15][16]
Otkriće da enzimi mogu biti kristalizirani omogučilo je da se struktura eventualno može upoznati pomoćukristalografije X-zrakama.Ovo je prvi put učinjeno salizozimom,enzimom koji se nalazi usuzama,pljuvački ibjelancetukoji razlaže bris nekihbakterija.Strukturu je riješila istraživačka grupa koju je predvodioDavid Chilton Phillips,a objavljena je1965.Ova struktura visoke rezolucije lizozima označila je početak područjastrukturne biologijei napora da se shvati kako enzimi djeluju na razini atomskih detalja.
Struktura
[uredi|uredi izvor]
Primjer organizacije strukture enzima ilizozima.
Vezivanja su u plavoj, crvenoj boji, a katalitsko mjesto na peptidoglikanskoj podlozi su u crnoj boji. (PDB9LYZ 9LYZ)

S heksozakinazaima veliko inducirano prilagodbeno mjesto koje zatvara preko podlogeadenozintrifosfataiksiloze.
Vezivanja su u plavoj, podloge u crnoj aMg2+kofaktor u žutoj boji (PDB2E2N)
Enzimi su uglavnom globuloliki (loptasti)proteini,a djeluju samostalno ili u većim jedinjenjima. Kao i svi proteini, enzimi su linearni lanciaminokiselinakoji presavijanjem dobijajutrodimenzionalnu strukturu.Sekvenca aminokiselina određuje strukturu koja zauzvrat određuje katalitsku aktivnost enzima. Iako struktura određuje ulogu enzima, a njegova aktivnost se još ne može predvidjeti samo iz njegova strukture. Pri zagrijavanju ili izlaganju djelovanja hemijskih agenasa, enzimske strukture su podložnedenaturacijii taj poremećaj strukture obično dovodi do gubitka aktivnosti. Denaturacija enzima je normalno povezana satemperaturamaiznad normalne razine vrsta. Kao rezultat toga, enzimi izbakterijakoje žive uvulkanskimsredinama, kao što suvruća vrelasu cijenjeni od strane industrijskih korisnika, zbog njihove sposobnosti da djeluju na visokim temperaturama. To omogućava ovako kataliziranim reakcijama da se odvijaju po vrlo visokoj stopi.
Molekule enzima su obično mnogo veća od molekula njihove podloge. Veličine se kreću u rasponu od samo 62 ostatkaaminokiselina,za monomer4-oksalokrotonat tautomerazu,do više od 2,500 ostataka u sintezi životinjskihmasnih kiselina.Samo mali dio njihove strukture (oko 2-4 aminokiseline) su direktno uključene u katalizu: katalitsko mjesto, koje se nalazi pored jednog ili višemjesta vezivanja,gdje ostaci orijentiraju podlogu. Katalitsko mjesto i obavezujuće mjesto zajedno čineaktivno mjestoenzima. Preostali veći dio strukture enzima služi za održavanje precizne orijentacije i dinamike djelovanja aktivnog mjesta.
Neki enzimi poput neaminokiselina su direktno uključene u katalizator. Umjesto toga, enzim sadrži mjesta vezivanja i orijentacije katalitskogkofaktora.Struktura enzima može sadržavatialosterne lokacije,gdje vezivanje male molekule izazivakonformacijsku promjenu,koja povećava ili smanjuje aktivnost. Postoji mali broj molekulaRNK,koje se na osnovu sposobnosti biološke katalize nazivajuribozimi,koji mogu djelovati samostalno ili zajedno sa proteinima. Najčešći od njih jeribosom,koji je jedinjenje proteina i katalitske komponenteRNK.
Mehanizam
[uredi|uredi izvor]
Vezivanje podloge
[uredi|uredi izvor]Prije nego što počnu katalizirati bilo kojuhemijsku reakciju,enzimi se moraju vezivati za njihovu podlogu. Enzimi su obično vrlo specifični za određene podloge, za koje se vežu a zatim kataliziraju hemijske reakcije. Specifičnost se postiže obavezujućom prazninom (usjekom) koji je komplementarnog oblika, za popunjenjavanje ihidrofilnom/hidrofobnomizbočinom podloge. Enzimi stoga mogu razlikovati vrlo slične molekule materijala koji suhemoselektivne,regioselektivneistereospecifične.[2][2][17][18][19][20][21][22][23][24][25]
Neki od enzima pokazuju najveću specifičnost i tačnost kada su uključeni u kopiranje i izgradnju novoggenoma.Neki od ovih enzima se pojavljuju u mehanizmima "lekture".Tako, enzim kao što jeDNK polimerazakatalizira reakciju u prvom koraku, a zatim u drugom koraku, te provjerava da li je proizvod ispravan. Ovaj proces u dva koraka dovodi do prosječne stope greške manje od 1/100 miliona reakcija kod polimerazesisara.Slični mehanizmi popravke se također nalaze i kodRNK polimeraza,aminoacil-tRNK sintetazeiribosoma. Nasuprot tome, neki enzimi ispoljavaju ipromiskuitet enzima,koji imaju široku specifičnost i djeluju na niz različitih fiziološki relevantnih podloga. Mnogi enzimi imaju mala mjesta aktivnosti koja su nastala slučajno (tj.neutralno), što može biti polazište za evolucijski izbor nove uloge.[26][27][28][29]
Na osnovu najpodobnije podloge, enzimi mogu mijenjati oblik, da bi se vezali prilikom stvaranja kompleksa enzim-supstrat.
Model "brave i ključa"
[uredi|uredi izvor]Da bi objasnio dosljednost specifičnosti enzima,1894.,Emil Fischerje predložio da i enzim i supstrat posjeduju posebne komplementarnegeometrijskeoblike koji se međusobno uklapaju jedan u drugi. Ovo se često naziva model "ključa", gdje se ranim modelom objašnjava specifičnost enzima, ali ne i stabilizacija stanja prilikom promjena koje enzimi ostvaruju.
Model indukcije
[uredi|uredi izvor]Godine1958.Daniel Koshlandje predložio izmjenu modela brava-ključ: pošto su enzimi prilično prilagodljive strukture, aktivno mjesto stalno preoblikuje međudejstva s podlogom kao i podloga u međudejstvima s enzimom. Kao proizvod toga, za podlogu se aktivno mjesto ne veže čvrsto; aminokiseline subočnim lancima(koji čine aktivna mjesta) su ukalupljene u precizna mjesta koje enzimu omogućavaju da obavlja svoju katalitsku ulogu. U nekim slučajevima, kao što jeglikosidaza,molekulasupstrata također neznatno mijenja oblik kako bi ušla u aktivno mjesto. Tu se nastavlja mijenjati dok se supstrat ne veže potpuno, kada se određuje konačni oblik punjača. Indukcija najpovoljnijeg oblika može povećati vjerodostojnost molekulskog prepoznavanja u prisustvu konkurencije i događaja u mehanizmu konformacijske korekture.
Kataliza
[uredi|uredi izvor]Enzimi mogu ubrzati reakcije na više načina, koje ograničavajuenergiju aktivacije(ΔG ‡,Gibbsove energije).
1. Stabilizacija stanja tranzicije uključuje:
o Stvaranje povoljnog okruženja s prelaznim punjačem za smanjenje svoje energije.
2. Pružajući alternativni pravac reakcije:
o Privremeno reagira s podlogom, stvarajući kovalentno srednje za stvaranje nižeg energetskog stanja u tranziciji.[30]
3. Destabilizaciju stanja podloge:
o Iskrivljuju vezane podloge supstrata u njihov prelazni obrazac stanja, kako bi se smanjila energija potrebna da se postigne stanje u tranziciji.[31]
o Orijentišući podloge u produktivne aranžmana za smanjenje reakcije entropija promjena.[31]Doprinos ovog mehanizma za katalizu je relativno mali.[32]
Enzimi mogu koristiti nekoliko ovih mehanizama istovremeno. Naprimjer,proteazekao što jetripsinobavljaju kovalentnu katalizu pomoćukatalitske trijade,stabilizirajući stanja nagomilavanja u tranziciji pomoćuoksianionskih rupa,kompletnuhidrolizupomoću usmjeravanja vode na podlogu.[33]
Dinamika
[uredi|uredi izvor]Enzimi nisu krute, statične strukture, nego imaju složene untrašnje dinamične pokrete, tj. pokrete dijelova strukture enzima, kao što su pojedinačni aminokiselinski ostaci. To je grupa ostataka koji stvarajuproteinsku petljuili jedinice sekundarne strukture ili čak čitavu proteinsku domenu. Ovi pokreti dovode do konformacijskih grupnih, malo drugačijih struktura koje se međusobno mijenjaju ostajući pri tom u ravnoteži. Različita stanja u okviru ove cjeline mogu biti povezana s različitim aspektima uloge enzima. Naprimjer, različite reakcije podrške enzimadihidrofolat reduktazasu povezane s vezanjem katalizirane podloge, katalizom, otpuštanjem kofaktora i koracima otpuštanje proizvoda katalitskog ciklusa.
Alosterna modulacija
[uredi|uredi izvor]Alosterna mjesta su džepovi (urezi) na enzimima, za razliku od aktivnog mjesta, koji se vežu za molekule u ćelijskom okruženju. Ove molekule dovode do promjena u podršci ili dinamici enzima koji se ubacuju na aktivna mjesta i na taj način utiču na brzinu reakcije enzima. Na taj način, alosterna interakcija može ili inhibirati ili aktivirati enzime. Alosterne interakcije sa metabolitima u uzvodnnim ili nizvodnim metaboličkim putevima uzrokuju povratne informacije enzima, izmjenu aktivnosti enzima prema ostatku procesa.
Kofaktori
[uredi|uredi izvor]Za ispoljavanje pune aktivnosti, neki enzimi ne trebaju dodatne komponente. Ostalima je za djelovanja neophodno vezanje neproteinske molekule kofaktora. Kofaktori mogu bitineorganski(npr.metalniionii klasterželjezo-sumpor) iliorganski spojevi(npr.flavinihem). Organski kofaktori mogu bitikoenzimi,koji su otpušteni iz aktivnog mjesta enzima tokom reakcije iliprotetske grupe,koje su usko vezane za enzim. Organske protetske grupe mogu biti vezane kovalentno (npr.biotinu enzimima kao što jepiruvat karboksilaza).
Primjer enzima koji sadrži kofaktor jekarboanhidraza(što je prikazano u dijagramu gore) sacinkovimvezanim kofaktorom, kao dijelom svog aktivnog mjesta. Ovi čvrsto vezani ioni ili molekule se obično nalaze u aktivnom mjestu i uključene su u katalizu. Naprimjer, kofaktori flavin i hem su često uključeni uredoksnereakcije.
Enzimi kojima je potreban kofaktor, ali nemaju granica nazivaju seapoenzimiliapoproteini.Enzimi zajedno sa kofaktorom, koji su potrebni za aktivnost nazivaju seholoenzimi(ili haloenzimi). Nazivholoenzimse može primijeniti na enzime koji sadrže više proteinskih podjedinica, kao što jeDNK polimeraza,gdje cijelo holoenzimsko jedinjenje sadrži sve podjedinice potrebne za aktivnost.
Koenzim
[uredi|uredi izvor]

Koenzimi su male organske molekule koje mogu biti slabo ili čvrsto vezane za enzim. Koenzimska hemijska grupa je prenosiva sa jednog enzima u drugi. Primjeri uključujuNADH,NADPHiadenozin trifosfat(ATP). Neki koenzimi, kao što suriboflavin,tiaminifolna kiselina,suvitaminiili jedinjenja koja se ne mogu sintetizirati u organizmu i moraju se unositi putem ishrane. Hemijske grupe koje uključujuhidridni ion (H -) nosiNADiliNADP+,fosfate(adenozin trifosfat), a grupu acetil nosekoenzimiA, formil, metenil ili metil grupefolna kiselinai metil grupaS-adenozila. Koenzimi se hemijski mijenjaju kao posljedica djelovanja enzima, a treba razmotriti koenzime za posebnu klasu podloga ili druge podloge, koje su zajedničke za više različitih enzima. Naprimjer, poznato je oko 1000 enzima koji koriste koenzime NADH.
Koenzimi se obično stalno obnavljaju i njihova koncentracija se unutar ćelije održava na stabilnoj razini. Naprimjer, NADPH se obnavlja prekopentoza fosfatai S –adenozilmetionina pomoćumetionin adenozil transferaze.Ovo stalno obnavljanje znači da se male količine koenzima mogu koristiti vrlo intenzivno. Npr., ljudsko tijelo u metabolizmuATP,dnevno obrće kompletnu vlastitu težinu.
Termodinamika
[uredi|uredi izvor]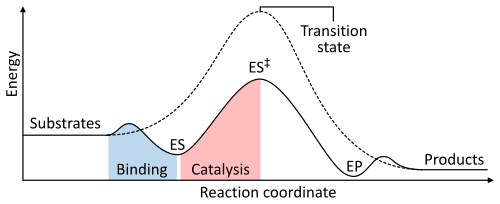
Kao i svi katalizatori, enzimi ne mijenjaju stanje hemijske ravnotežne reakcije. U prisustvu enzima, reakcija teče u istom smjeru kao što bi i bez prisustva enzima, samo brže. Naprimjer,karboanhidrazakatalizira svoju reakciju u oba smjera, ovisno o koncentraciji svojih reaktanata:
- (u tkivu; visoka koncentracijaCO2)
- (uplućima;niska koncentracija CO2).
Stopa reakcije zavisi odenergije aktivacijepotrebne da se stvoristanje tranzicije,koji onda razgrađuje podlogu u proizvode. Enzimi povećavaju stope reakcija smanjenjem energetskog stanja tranzicije. Prvo, vezanje stvara niskoenergetski kompleks enzim-supstrat (ES). Drugo, enzim stabilizira stanje tranzicije tako da zahtijeva manje energije u odnosu na jednokatalitsku reakciju (ES ‡). Na kraju se kompleks enzim-proizvod (EP) disocira da oslobodi proizvod.
Enzimi mogu obaviti dvije ili više reakcija, tako da se termodinamički povoljna reakcija može koristiti u "pogonu", dok je termodinamički nepovoljna u kombinaciji kada je energija proizvoda niža od one kod podloge. Naprimjer, hidrolizaATPse često koristi za pogon druge hemijske reakcije.
Kinetika
[uredi|uredi izvor]Istraživanja kinetike enzima su išla u pravcu odgovora na pitanje kako se vežu za podloge i pretvaraju ih u proizvode. Podaci o stopama koje se koriste u takvim analizama se obično dobijaju uenzimskim testovima.Godine1913.Leonor MichaelisiMaud Leonora Mentensu predložili kvantitativnu teoriju kinetike enzima, koja se nazivaMichaelis-Menten kinetika.Najveći doprinos Michaelisa i Mentena je u tome da se enzimska reakcija odvija u dvije faze. U prvoj, podloga se veže reverzibilno za enzim, stvarajući kompleks enzim-supstrat. To se ponekad (u njihovu čast) naziva Michaelis-Menten kompleks. Enzim zatim katalizira hemijski korak u reakciji koja oslobađa proizvod. Ovaj rad su dodatno razviliGeorge Edward BriggsiJohn Burdon Sanderson Haldane,od kojih potiču kinetičke jednačine koje su još uvijek i do danas u širokoj upotrebi.
Enzimske stope ovise o uslovima rastvora i koncentracije podloge. Za određivanje maksimalne brzine jedne enzimske reakcije, koncentracija supstrata se povećava po stalnoj stopi do vidljivog stvaranja proizvoda. Ovo je prikazano na krivulji zasićenja na desnoj strani. Zasićenje se događa jer, kako se povećava koncentracija supstrata, sve više i više slobodnog enzima se pretvara u ES kompleks njegovim vezanjem za podlogu. Na maksimalnu brzinu reakcije (Vmax) enzima, sva aktivna mjesta enzima su vezana za podlogu, a iznos ES kompleksa je isti kao i ukupan iznos enzima.
Vmaxje samo jedan od nekoliko važnih kinetičkih parametara. Količina podloge koja je potrebna za postizanje određene stope reakcije je također važna.Michaelis-Menten konstanta(Km), predviđa koja je koncentracija supstrata potrebna za enzim do ispunjenja jedne polovine svoje maksimalne brzine reakcije. Uglavnom, svaki enzim ima posebanKmza datu podlogu. Još jedna korisna konstanta jekcat,koja se naziva ibroj prometa,što je broj molekula supstrata razgrađenih po jednom aktivnom mjestu, u sekundi.
Efikasnost enzima može se izraziti u smislukcat/Km.To se također zove specifična konstanta i uključuje stopu konstante za sve korake u reakciji do prvog ireverzibilnog koraka, uključujući i njega. Budući da specifična konstanta odražava i afinitet i katalitičke sposobnosti, korisna je za uporedno poređenje različitih enzima ili poređenje istog enzima na različitim podlogama. Teorijski maksimum za specifičnu konstantu se zove granica difuzija, koja je 108do 109(M−1s−1). U ovom trenutku svaki sudar enzima sa svojim supstratom će dovesti do katalize, a stopa stvaranje proizvoda nije ograničena brzinom reakcije, ali jeste stopom difuzije. Enzimi sa ove pozicije se nazivajukatalitsko savršenstvoilikinetički savršeni.Primjer takvih enzima su:trioza-fosfat izomeraza,karboanhidraza,acetilholinesteraza,katalaza,fumaraza,β-laktamazaisuperoksid dismutaza.Promet takvih enzima može doseći do nekoliko miliona reakcija u sekundi.
Michaelis-Mentenova kinetikase oslanja nazakon masovne akcije,koji je izveden iz pretpostavki o slobodnojdifuzijii termodinamičkim prelazima slučajnim sudarom. Mnogibiohemijskiili mobilni procesi značajno odstupaju od ovih uslova, zbog makromolekulske gužve i ograničenog molekulskog kretanja. Novijim pokušajima se proširuje model kompleksa za ispravku tih efekata.
Inhibicija
[uredi|uredi izvor]Dihidrofolat reduktazainhibirametotreksat,koji sprečava vezivanje svoje podloge,folne kiseline.
Vezivanja su prikazana u plavoj, inhibitor u zelenoj, a podloge u crnoj boji. (PDB4QI9)
Zato je methotreksat kompeticijski inhibitor mnogih enzima koji upotrebljavaju folate
Stope enzimskih reakcija mogu biti smanjene različitim vrstamainhibitora enzima.
Načini inhibicije
[uredi|uredi izvor]Konkurentna
[uredi|uredi izvor]Kompetitivni inhibitorii podloge se ne mogu vezati na enzim u isto vrijeme. Često konkurentni inhibitori jako podsjećaju na pravi supstrat enzima. Naprimjer, lijekmetotreksatje kompetitivni inhibitor enzimadihidrofolat reduktaza,koji katalizira redukcijudihidrofolatau tetrahidrofolat. Sličnost između strukture dihidrofolata i ovog lijeka su prikazane na priloženoj slici. Ova vrsta inhibicije može se prevazići visokom koncentracijom podloge. U nekim slučajevima inhibitor se može vezati na neko drugo mjesto, nego na uobičajenom mjestu podloge i izazvatialosterni efektpromjenom oblika uobičajenih vezivanja na licu mjesta.
Nekompetitivna
[uredi|uredi izvor]Nekompetitivni inhibitorse veže i na drugo, osim za supstratno mjesto. Podloga i dalje obavezuje svojim uobičajenim afinitetom i stogaKmostaje isti. Međutim, inhibitor smanjuje katalitsku efikasnost enzima, tako da jeVmaxsmanjen. Za razliku od konkurentske inhibicije, nekonkurentna se ne može prevazići visokom koncentracijom podloge.
Nekonkurentna
[uredi|uredi izvor]Jedannekonkurentni inhibitorse ne može vezati na slobodni enzim, samo da stvori kompleks enzim-supstrat; ova vrsta inhibitora je najefikasnija u visokoj koncentraciji supstrata. U prisustvu inhibitora, kompleks enzim-supstrat je neaktivan. Ovakva inhibicija je relativno rijetka
Mješovita
[uredi|uredi izvor]Mješoviti inhibitorveže alosterna mjesta, a vezivanja supstrata i inhibitora utiču jedni na druge. Uloga enzima se smanjuje, ali ne izostaje kad su vezani za inhibitor. Ova vrsta inhibitora ne prati Michaelis-Menten jednadžbu.
Nepovratna
[uredi|uredi izvor]Nepovratan inhibitortrajno inaktivira enzim, obično stvaranjemkovalentne vezeu proteinu.Peniciliniaspirinsu uobičajeni lijekovi koji djeluju na ovaj način.
Uloge inhibitora
[uredi|uredi izvor]U mnogim organizmima, inhibitori mogu djelovati kao dio povratnih mehanizama. Ako enzim proizvodi prevelike količine jedne supstance u organizmu, a ta supstanca može djelovati kao inhibitor enzima na početak puta stvaranja proizvoda. Time uzrokuje sporiju proizvodnju supstance ili njen prekid kada postoji dovoljna količina proizvoda. Ovo je oblik negativne povratne informacije. Glavni metabolički putevi, kao što jeciklus limunske kiselinekoriste ovaj mehanizam. Pošto inhibitori mijenjaju uloge enzima, često se koriste kao lijekovi. Mnogi od njih su dvojaki konkurentni inhibitori koji nalikuju izvornom supstratu za enzim, sličnometotreksatu.Drugi dobro poznati primjeri uključujustatine,koji se koriste za liječenje visoke masnoće (holesterola), a tu su iinhibitor proteazekoje se koriste za liječenjeretrovirusnihinfekcija kao što jeHIV.Čest primjer nepovratnog inhibitora koji se koristi kao lijek jeaspirin,koji inhibiraCOX-1iCOX-2enzime koji proizvode upale glasnika prostaglandina.
Drugi inhibitori enzima su otrovi. Naprimjer, otrovcijanidje nepovratni inhibitor enzima koji se kombinira sa bakrom i željezom u aktivnom mjestu enzimacitohrom C oksidazei blokirajućelijsko disanje.
Biološka funkcija
[uredi|uredi izvor]Enzimi imaju širok spektar funkcija unutar živih organizama. Oni su neophodni za signalnu regulacijuj u ćeliji, često prekokinazaifosfataza.Oni također stvaraju pokret,miozinahidrolizirajućiATPi uzrokujućimišićnaskupljanja, a također su opterećeni i oko ćelije, kao dijela citoskeleta. Druge ATPaze u ćelijskoj membrani suionske pumpeuključene uaktivni transport.Enzimi su također učestvuju i u više egzotičnih uloga, kao što jefluciferazakoja dovodi do stvaranja svjetlosti kod (insekata) svitaca.Virusitakođer mogu sadržavati enzime za inficiranje ćelija, kao što suaHIVintegrazeireverzna transkriptazaili za oslobađanje ćelija od virusa, kao što je virusgripa–neuraminidaza.
Važna uloga enzima je uprobavnom traktuživotinja. Enzimi kao što suamilazaiproteazarazbijaju velike molekule (skrobiliproteine) na manje. Na taj način se u crijevima mogu apsorbirati. Škrobne molekule su prevelike da bi se apsorbirale direktno iz crijeva, ali enzimi hidrolizuju njihove lance u manje molekule, kao što sumaltozai na krajuglukoza,koja se može upijati. Različiti enzimi vare različite supstance iz hrane.Preživari,koji uzimajubiljojednuhranu, prekomikroorganizamau crijevima proizvode enzim, koji razlažecelulozućelijskih zidova biljnih vlakana.
Metabolizam
[uredi|uredi izvor]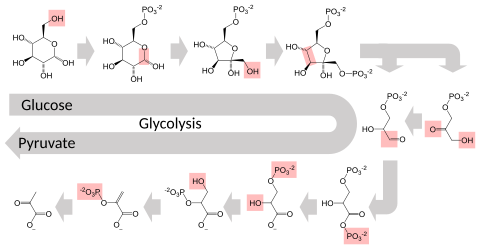
Metabolički putglikolizeoslobađa energiju pretvaranjemglukozeupiruvat,preko niza prelaznihmetabolita.Svaku hemijsku promjenu (crvena kutija na slici) obavlja drugi enzim. Nekoliko enzima u određenom redoslijedu mogu djelovati zajedno, stvarajući tako metaboličkie puteve. U metaboličkom putu jedan enzim uzima proizvod drugog, prethodnog enzima kao supstrat. Nakon katalitske reakcije, proizvod se zatim prenosi za djelovanje narednog enzima. Ponekad više od jednog enzima može katalizirati istu reakciju paralelno, što može dovesti do složenijeg toka. Tako naprimjer, stalno niska aktivnost jednog enzima dovodi do indukcijske visoke aktivnosti drugog enzima.[34][35][36][37][38][39] Bez enzima nemoguće je govoriti o metabolizmu, kao ni napretku kroz njegove korake i ne može biti uređenosti sistema za potrebe ćelije. Veći dio središnjeg metabolizma podešen je na nekoliko ključnih koraka, obično putem enzima, čija djelatnost uključuje hidrolizuATP-a. Zbog toga što ova reakcija proizvodi toliko energije, druge reakcije koje sutermodinamički nepovoljnemogu biti spojene sa hidrolizom ATP i ukupnim nizom povezanih metaboličkih reakcija.[40]
Kontrola aktivnosti
[uredi|uredi izvor]Postoje najčešće upotrebljavani načini kontrole aktivnosti enzima u ćeliji.
Uređivanje
[uredi|uredi izvor]Enzimi mogu pomoću drugih molekula biti ili aktivirani ili inhibirani. Naprimjer, krajnji proizvodi metaboličkih puteva su često inhibitori jednog od prvih enzima u njemu. Obično je prvi korak nepovratan, a naziva se "sveti korak" ). Time se podešava količina krajnjeg proizvoda odgovarajućeg puta. Takav mehanizam podešavanja se nazivanegativni mehanizam povratne informacije,jer je iznos krajnjeg proizvoda proizveden podešavanjem prema vlastitim koncentracijama. Negativni mehanizam povratne informacije može učinkovito prilagoditi brzinu sinteze povezujućih metabolita, prema zahtjevima ćelijskih potreba. Ovo pomaže efikasnom izdvajanju materijala u ekonomiji energije, a to sprečava višak proizvodnje gotovih proizvoda kao i drugihhomeostaznihpodešavanja. Kontrola enzimskih akcija pomaže održavanju stabilnog unutrašnjeg okruženja u živim organizmima.
Posttranslacijske promjene
[uredi|uredi izvor]U primjereposttranslacijskih promjenaspadaju:fosforilacija,miristilacijaiglikolizacija.[41]Naprimjer, u odgovoru nainsulinprilikom fosforilacije učestvuje više enzima, među kojima je iglikogenskasintaza,koja pomaže u kontroli sinteze ili raspadu glikogena. Također, omogućuje i ćelijski odgovor na promjene količinešećeraukrvi.[42]Još jedan primjer posttranslacijskih promjena je razgradnja polipeptidnih lanacahimotripsinom,probavnomproteazom,koja se proizvodi u neaktivnom obliku kaohimotripsinogenugušteračii prelazi uželudacgdje ee aktivira. Ovo zaustavlja enzim izpankreasaili drugih tkiva prije nego što uđe u probavu. Ova vrsta neaktivnih prethodnica enzima je poznata kaozimogeniili proenzimi.
Količina
[uredi|uredi izvor]Proizvodnju enzima (transkripcija) itranslacijaodgovarajućihgenaćelija može se povećati ili umanjiti, kao odgovor na promjene u njenom okruženju. Ovaj oblikregulacije genase zoveindukcija enzima.Naprimjer,bakterijemogu postatiotpornenaantibiotikekao što jepenicilin,jer enzim pod nazivom beta-laktamazaizazva hidrolizu ključnogbeta-laktamskog prstenaunutar molekule penicilina.[43]Drugi primjer dolazi od enzima ujetrikoji se nazivacitohrom P450 oksidaza,koji su važni umetabolizmulijekova. Unošenje ili inhibicija ovih enzima može izazvati međudejstva kod lijekova. Razina enzima može biti podešena promjenom stope raspada enzima.[44]
Subćelijska raspodjela
[uredi|uredi izvor]Enzimi mogu djelovati u procesima diobe u cijeloj ćeliji ili u različitim putevima metabolizma koji se javljaju u različitim ćelijskim dijelovima i strukturama. Naprimjer,masne kiselinesintetiziraju jednu grupu enzima u citosolu,endoplazmatskom retikulumuiGolgijevom aparatu.Pri tom koriste različite skupove enzima kao izvore energije umitohondrijama,putemβ-oksidacije.[45]Kod ljudi, različitih enzimi mogu promijeniti stepenprotonacije(ucitoplazmibivaju neutralni, a ulizosomimakiseli) ili oksidativne upotrebe. Dobar primjer je njihova oksidacija uperiplazmiili njihovo ograničavanje ucitoplazmi,što opet utiče na aktivnost enzima.
Specijalizirani organi
[uredi|uredi izvor]Kodvišećelijskih eukariota,ćelije u različitim organima i tkivima imaju različite obrasceekspresije gena.Zbog toga imaju različite skupove enzima (poznate kaoizoenzimi), koji su na raspolaganju prilikommetaboličkih reakcija.Ovo daje mehanizam za podešavanje ukupnog metabolizma u organizmu. Naprimjer,heksozakinazakoja je prvi enzim uglikoliznom putu,ima posebni oblik koji se zoveglukokinaza,izražena ujetriigušterači,a ima i niži afinitet za glukozu.[46]Međutim, još uvijek je osjetljiviji na količinu glukoze. Ovaj enzim je uključen u kontrolušećera u krvii podešavanje prilikom proizvodnjeinsulina.[47]
Dejstvo kod liječenja raznih bolesti
[uredi|uredi izvor]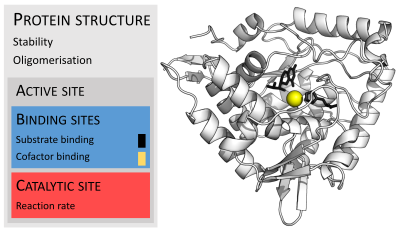
Fenilalanin hidroksilazaima preko 300 različitih vrsta mutacija u cijeloj strukturi, a uzrok jefenilketonurije.
Fenilalaninskepodloge itetrahidrobiopterinskikoenzim(crno) i Fe2+kofaktor (žuto)
Pošto su enzimi od suštinske važnosti za strogu kontrolu aktivnosti za održavanjehomeostaze,bilo koji kvar (mutacija,hiperprodukcija, nedovoljna ilidelecija) jednog kritičnog enzima može dovesti do nasljednih bolesti. Kvar samo jedne vrste enzima, od hiljada vrsta koje su prisutne u ljudskom tijelu, može biti fatalan. Primjer fatalnegenetskiuslovljene bolesti zbog enzimskog kvara jeTay-Sachsova bolest,u kojoj pacijenti nemaju enzimheksosaminidazu.
Nedostatak enzima je najćešći kod fenilketonurije. Mnoge različite mutacije jedne aminokiseline u enzimufenilalanin hidroksilaza,koji katalizira prvi korak u degradacijifenilalanina,dovodi do nagomilavanja fenilalanin ai srodnih proizvoda. Neke mutacije u aktivnom mjestu neposredno ometaju vezivanje i katalizu, ali mnoge su daleko od aktivnog mjesta i smanjuju aktivnost i destabilizaciju strukture proteina ili utiču na pravilnu oligomerizaciju. To može izazvati intelektualnu invalidnost, ako se bolest pravovremeno ne liječi. Drugi primjer je nedostatakpseudoholinesteraze,pri kojem je umanjena sposobnost organizma da razgrađujeholin esterskelijekove. Oralna primjena enzima može da se koristi za liječenje nekih funkcijskih nedostataka enzima, kao što jeinsuficijencija pankreasainetolerancija laktoze.[48][49]
Drugi način poremećaja uloge enzima može uzrokovati bolesti koje su posljedicageminativnih mutacijagenakoji kodiraju enzime prilikomreparacije DNK.Nedostatak ovih enzima izazva rak, jer ćelije su manje sposobne da poprave mutacije u njihovomgenomu.To uzrokuje sporo akumuliranje mutacija, a rezultat ovoga je razvojraka.Jedan primjer nasljednog sindroma jeXeroderma pigmetosum,što dovodi do razvojaraka kože,u odgovoru čak i na najmanje izlaganjeultraljubičastom svjetlu.
Konvencijsko imenovanje
[uredi|uredi izvor]Imenovanje enzima standardno potiče iz naziva podloge ili katalizirane hemijske reakcije uzsufiks–aza.Primjeri su:laktaza,alkohol dehidrogenazaiDNK polimeraza.Različiti enzimi koji kataliziraju iste hemijske reakcije nazivaju se izoenzimi. Međunarodna unija za biohemiju i molekularnu biologijuje razvila nomenklaturu za enzime, poEC brojevima.Svaki enzim je opisan nizom od četiri broja kojima prethodi "EC". Prvi broj dijeli enzime na osnovu njihovog mehanizma djelovanja. Podjela na najvišem nivou je:
- EC 1,Oksidoreduktaze:kataliziraju reakcije oksidacije/redukcije;
- EC 2,Transferaze:premještaju funkcijske grupe (npr. metil ili fosfatnu grupu);
- EC 3,Hidrolaze:kataliziraju hidrolize različitih veza;
- EC 4,Lijaze:Cijepaju razne veze, osim hidrolize i oksidacije;
- EC 5,Izomeraze:kataliziraju izomerizacijske promjene u okviru jedne molekule;
- EC 6,Ligaze:Kataliziraju spajanje dvije molekule s kovalentnim vezama.
Ove sekcije su podijeljene po drugim karakteristikama, kao što su: podloge, proizvodi i hemijski mehanizmi. Enzim u potpunosti određuju četiri numeričke oznake. Naprimjer,heksozakinaza(EC 2.7.1.1) jetransferaza(EC 2) koja dodaje fosfatnu grupu (EC 2.7) na heksozni šećer, molekulu koja sadrži alkoholnu grupu (EC 2.7.1).
Industrijska primjena
[uredi|uredi izvor]Enzimi se koriste u hemijskoj industriji kao i u drugim industrijskim granama, kada su potrebni posebni katalizatori. Enzimi su općenito ograničeni po broju reakcija koje su evoluirale za katalizu, kao i nedostatku stabilnosti u organskim otapalima i na visokim temperaturama. Kao posljedica toga,proteinsko inženjerstvoje aktivno područje istraživanja i objedinjuje pokušaje stvaranja novih enzima sa širokim svojstvima, bilo po racionalnom dizajnu ili evolucijiin vitro.[50][51]Ti napori su sve uspješniji, a nekoliko enzima sada su dizajnirani "od nule" da kataliziraji reakcije koje se ne javljaju u prirodi.[52]
- Uobičajene oblasti primjene enzima u industriji i domaćinstvu
Također pogledajte
[uredi|uredi izvor]Reference
[uredi|uredi izvor]- ^Kornberg A. (1989): For the love of enzymes – The Odyssay of a biochemist. Harvard University Press, Cambridge (Mass.), London,ISBN0-674-30775-5,ISBN0-674-30776-3.
- ^abcdStryer L, Berg JM, Tymoczko JL (2002).Biochemistry(5th izd.). San Francisco: W.H. Freeman.ISBN0-7167-4955-6.CS1 održavanje: više imena: authors list (link)
- ^Schomburg I. et al. (2013): BRENDA in 2013: integrated reactions, kinetic data, enzyme function data, improved disease classification: new options and contents in BRENDA. Nucleic Acids Research, 41: Database issue: D764-72.
- ^Radzicka A., Wolfenden R. (1995): A proficient enzyme. Science, 267 (5194): 90–931.
- ^Callahan B. P., Miller B- G. (2007): OMP decarboxylase — An Enigma persists. Bioorganic Chemistry, 35 (6): 465–469.
- ^Bugg T. (1997): An introduction to enzyme and coenzyme chemistry. Blackwell Science, Oxford,ISBN0-86542-793-3.
- ^Alberts B. (2002)ː Molecular biology of the cell Garland Science, New York,ISBN0-8153-3218-1.
- ^Lindhorst T. (2007): Essentials of carbohydrate chemistry and biochemistry. Wiley-VCH, 3527315284}}
- ^Robyt F. (1997): Essentials of carbohydrate chemistry. Springer,ISBN0387949518.
- ^Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo,ISBN9958-9344-1-8.
- ^de Réaumur R. A. (1752): Observations sur la digestion des oiseaux. Histoire de l'academie royale des sciences, 1752: 266, 461.
- ^http://etext.lib.virginia.edu/toc/modeng/public/Wil4Sci.html:Williams H. S. (1904): A history of science: in five volumes, IV: Modern Development of the Chemical and Biological Sciences, Harper and Brothers.
- ^Holmes, Frederic Lawrence (2003)."Enzymes".u Heilbron, John L. (ured.).The Oxford Companion to the History of Modern Science.Oxford: Oxford University Press. str. 270.Upotreblja se zastarjeli parametar
|chapterurl=(pomoć);Nepoznati parametar|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^"Eduard Buchner".Nobel Laureate Biography.Nobelprize.org.Pristupljeno 23. 2. 2015.
- ^"Eduard Buchner – Nobel Lecture: Cell-Free Fermentation".Nobelprize.org.1907.Pristupljeno 23. 2. 2015.
- ^Duclaux E (1899).Traité de microbiologie: Diastases, toxines et venins[Microbiology Treatise: diastases, toxins and venoms] (jezik: French). Paris, France: Masson and Co.CS1 održavanje: nepoznati jezik (link)See Chapter 1, especially page 9.
- ^Jaeger KE, Eggert T (august 2004). "Enantioselective biocatalysis optimized by directed evolution".Current Opinion in Biotechnology.15(4): 305–13.doi:10.1016/j.copbio.2004.06.007.PMID15358000.
- ^Shevelev IV, Hübscher U (maj 2002). "The 3' 5' exonucleases".Nature Reviews Molecular Cell Biology.3(5): 364–76.doi:10.1038/nrm804.PMID11988770.
- ^Zenkin N, Yuzenkova Y, Severinov K (juli 2006). "Transcript-assisted transcriptional proofreading".Science.313(5786): 518–20.doi:10.1126/science.1127422.PMID16873663.
- ^Ibba M, Soll D. "Aminoacyl-tRNA synthesis".Annual Review of Biochemistry.69:617–50.doi:10.1146/annurev.biochem.69.1.617.PMID10966471.
- ^Rodnina MV, Wintermeyer W. "Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms".Annual Review of Biochemistry.70:415–35.doi:10.1146/annurev.biochem.70.1.415.PMID11395413.
- ^Khersonsky O, Tawfik DS. "Enzyme promiscuity: a mechanistic and evolutionary perspective".Annual Review of Biochemistry.79:471–505.doi:10.1146/annurev-biochem-030409-143718.PMID20235827.
- ^O'Brien PJ, Herschlag D (april 1999). "Catalytic promiscuity and the evolution of new enzymatic activities".Chemistry & Biology.6(4): R91–R105.doi:10.1016/S1074-5521(99)80033-7.PMID10099128.
- ^Fischer E (1894)."Einfluss der Configuration auf die Wirkung der Enzyme"[Influence of configuration on the action of enzymes].Berichte der Deutschen chemischen Gesellschaft zu Berlin(jezik: German).27(3): 2985–93.doi:10.1002/cber.18940270364.CS1 održavanje: nepoznati jezik (link))
- ^Cooper GM (2000)."Chapter 2.2: The Central Role of Enzymes as Biological Catalysts".The Cell: a Molecular Approach(2nd izd.). Washington (DC ): ASM Press.ISBN0-87893-106-6.Upotreblja se zastarjeli parametar
|chapterurl=(pomoć) - ^Koshland DE (februar 1958)."Application of a Theory of Enzyme Specificity to Protein Synthesis".Proceedings of the National Academy of Sciences of the United States of America.44(2): 98–104.doi:10.1073/pnas.44.2.98.PMC335371.PMID16590179.
- ^Vasella A, Davies GJ, Böhm M (oktobar 2002). "Glycosidase mechanisms".Current Opinion in Chemical Biology.6(5): 619–29.doi:10.1016/S1367-5931(02)00380-0.PMID12413546.
- ^Boyer, Rodney (2002). "Chapter 6: Enzymes I, Reactions, Kinetics, and Inhibition".Concepts in Biochemistry(2nd izd.). New York, Chichester, Weinheim, Brisbane, Singapore, Toronto.: John Wiley & Sons, Inc. str.137–8.ISBN0-470-00379-0.OCLC51720783.Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^Savir Y, Tlusty T (2007). Scalas E (ured.)."Conformational proofreading: the impact of conformational changes on the specificity of molecular recognition"(PDF).PLOS ONE.2(5): e468.doi:10.1371/journal.pone.0000468.PMC1868595.PMID17520027.Arhivirano soriginala(PDF),14. 5. 2011.Pristupljeno 26. 1. 2016.Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^Cox, Michael M.; Nelson, David L. (2013). "Chapter 6.2: How enzymes work".Lehninger Principles of Biochemistry(6th izd.). New York, N.Y.: W.H. Freeman. str.195.ISBN978-1464109621.Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^abBenkovic SJ, Hammes-Schiffer S (august 2003). "A perspective on enzyme catalysis".Science.301(5637): 1196–202.Bibcode:2003Sci...301.1196B.doi:10.1126/science.1085515.PMID12947189.
- ^Villa J, Strajbl M, Glennon TM, Sham YY, Chu ZT, Warshel A (oktobar 2000)."How important are entropic contributions to enzyme catalysis?".Proceedings of the National Academy of Sciences of the United States of America.97(22): 11899–904.Bibcode:2000PNAS...9711899V.doi:10.1073/pnas.97.22.11899.PMC17266.PMID11050223.
- ^Polgár, L. (7. 7. 2005). "The catalytic triad of serine peptidases".Cellular and Molecular Life Sciences(jezik: engleski).62(19–20): 2161–2172.doi:10.1007/s00018-005-5160-x.ISSN1420-682X.PMID16003488.
- ^Voet D., Voet J. (1995): Biochemistry, 2nd Ed. Wiley,http:// wiley /college/math/chem/cg/sales/voet.html.
- ^Laidler K. J. (1978): Physical chemistry with biological applications. Benjamin/Cummings, Menlo Park,ISBN0-8053-5680-0.
- ^Kapur Pojskić L., Ed. (2014): Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo,ISBN978-9958-9344-8-3.
- ^Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo,ISBN9958-10-222-6.
- ^Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000,ISBN0-12-361811-8.
- ^Nelson D. L., Cox M. M. (2013): Lehninger principles of biochemistry. W. H. Freeman and Co.,ISBN978-1-4641-0962-1.
- ^Hall J. E., Guyton A. C. (2006): Textbook of medical physiology, 11th edition. Elsevier Saunders, St. Louis, Mo,ISBN0-7216-0240-1.
- ^"Chapter 8: Control of Enzyme Activity".How Enzymes Work: From Structure to Function.Boca Raton, FL: CRC Press. 2015. str. 141–69.ISBN978-981-4463-92-8.Zanemaren tekst "Suzuki H" (pomoć)
- ^"GSK-3: tricks of the trade for a multi-tasking kinase".Journal of Cell Science.116(Pt 7): 1175–86. april 2003.doi:10.1242/jcs.00384.PMC3006448.PMID12615961.Zanemaren tekst "Doble BW, Woodgett JR" (pomoć)
- ^"Molecular basis of beta-lactamase induction in bacteria".Antimicrob. Agents Chemother.37(2): 153–8. 1993.doi:10.1128/aac.37.2.153.PMC187630.PMID8452343.Zanemaren tekst "Bennett PM, Chopra I" (pomoć)
- ^"Chapter 3: Induction and Inhibition of Drug Metabolism".Introduction to Drug Metabolism(3 izd.). Cheltenham, UK: Nelson Thornes Publishers. 2001. str.87–118.ISBN978-0748760114.Zanemaren tekst "Skett P, Gibson GG" (pomoć)
- ^"Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling".The Biochemical Journal.323(Pt 1): 1–12. april 1997.doi:10.1042/bj3230001.PMC1218279.PMID9173866.Zanemaren tekst "Faergeman NJ, Knudsen J" (pomoć)
- ^"Structural basis for allosteric regulation of the monomeric allosteric enzyme human glucokinase".Structure.12(3): 429–38. mart 2004.doi:10.1016/j.str.2004.02.005.PMID15016359.Zanemaren tekst "Kamata K, Mitsuya M, Nishimura T, Eiki J, Nagata Y" (pomoć)
- ^"Familial hyperglycemia due to mutations in glucokinase. Definition of a subtype of diabetes mellitus".The New England Journal of Medicine.328(10): 697–702. mart 1993.doi:10.1056/NEJM199303113281005.PMID8433729.Zanemaren tekst "Froguel P, Zouali H, Vionnet N, Velho G, Vaxillaire M, Sun F, Lesage S, Stoffel M, Takeda J, Passa P" (pomoć)
- ^"Enzyme replacement therapy for pancreatic insufficiency: present and future".Clinical and Experimental Gastroenterology.4:55–73. 2011.doi:10.2147/CEG.S17634.PMC3132852.PMID21753892.Zanemaren tekst "Fieker A, Philpott J, Armand M" (pomoć)
- ^"Lactose malabsorption and intolerance: pathogenesis, diagnosis and treatment".United European Gastroenterology Journal.1(3): 151–9. juni 2013.doi:10.1177/2050640613484463.PMC4040760.PMID24917953.Zanemaren tekst "Misselwitz B, Pohl D, Frühauf H, Fried M, Vavricka SR, Fox M" (pomoć)
- ^"Rational design of thermally stable proteins: relevance to bionanotechnology".Journal of Nanoscience and Nanotechnology.5(11): 1759–1767. novembar 2005.doi:10.1166/jnn.2005.441.PMID16433409.Zanemaren tekst "Renugopalakrishnan V, Garduño-Juárez R, Narasimhan G, Verma CS, Wei X, Li P" (pomoć)
- ^Hult K, Berglund P (august 2003). "Engineered enzymes for improved organic synthesis".Current Opinion in Biotechnology.14(4): 395–400.doi:10.1016/S0958-1669(03)00095-8.PMID12943848.
- ^"De novo computational design of retro-aldol enzymes".Science.319(5868): 1387–91. mart 2008.Bibcode:2008Sci...319.1387J.doi:10.1126/science.1152692.PMC3431203.PMID18323453.Zanemaren tekst "Jiang L, Althoff EA, Clemente FR, Doyle L, Röthlisberger D, Zanghellini A, Gallaher JL, Betker JL, Tanaka F, Barbas CF, Hilvert D, Houk KN, Stoddard BL, Baker D" (pomoć)
- ^ab"Hydrolysis of lignocellulosic materials for ethanol production: a review".Bioresource Technology.83(1): 1–11. maj 2002.doi:10.1016/S0960-8524(01)00212-7.PMID12058826.Zanemaren tekst "Sun Y, Cheng J" (pomoć)
- ^ab"Industrial enzyme applications".Current Opinion in Biotechnology.13(4): 345–351. august 2002.doi:10.1016/S0958-1669(02)00328-2.Zanemaren tekst "Kirk O, Borchert TV, Fuglsang CC" (pomoć)
- ^abBriggs, Dennis E. (1998).Malts and Malting(1st izd.). London: Blackie Academic.ISBN978-0412298004.Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^"Improved performances and control of beer fermentation using encapsulated Alpha -acetolactate decarboxylase and modeling".Biotechnology Progress.16(6): 958–65.doi:10.1021/bp000128k.PMID11101321.Zanemaren tekst "Dulieu C, Moll M, Boudrant J, Poncelet D" (pomoć)
- ^Tarté, Rodrigo (2008).Ingredients in Meat Products Properties, Functionality and Applications.New York: Springer. str.177.ISBN978-0-387-71327-4.Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć) - ^"Chymosin - GMO Database".web.archive.org.4. 12. 2016. Arhivirano s originala 4. 12. 2016.Pristupljeno 3. 8. 2023.CS1 održavanje: bot: nepoznat status originalnog URL-a (link)
- ^"Review: Compounds Involved in the Flavor of Surface Mold-Ripened Cheeses: Origins and Properties".Journal of Dairy Science.79(2): 169–184. februar 1996.doi:10.3168/jds.S0022-0302(96)76348-8.Zanemaren tekst "Molimard P, Spinnler HE" (pomoć)
- ^"Amylolytic enzymes and products derived from starch: a review".Critical Reviews in Food Science and Nutrition.35(5): 373–403. septembar 1995.doi:10.1080/10408399509527706.Provjerite vrijednost parametra
|doi=(pomoć).PMID8573280.Zanemaren tekst "Guzmán-Maldonado H, Paredes-López O" (pomoć) - ^ab"Protease – GMO Database".GMO Compass.European Union. 10. 7. 2010. Arhivirano soriginala,24. 2. 2015.Pristupljeno 28. 2. 2015.Referenca sadrži prazan nepoznati parametar:
|coauthors=(pomoć)CS1 održavanje: nepreporučeni parametar (link) - ^"Industrial applications of pectic enzymes: a review".Process Biochemistry.33(1): 21–28. januar 1998.doi:10.1016/S0032-9592(97)00046-0.Zanemaren tekst "Alkorta I, Garbisu C, Llama MJ, Serra JL" (pomoć)
- ^"Application of enzymes in the pulp and paper industry".Biotechnology Progress.15(2): 147–157. mart 1999.doi:10.1021/bp990013k.PMID10194388.Zanemaren tekst "Bajpai P" (pomoć)
- ^"An analysis of contact lens enzyme cleaners".Journal of the American Optometric Association.61(3): 190–4. mart 1990.PMID2186082.Zanemaren tekst "Begley CG, Paragina S, Sporn A" (pomoć)
- ^Farris, Paul L. (2009). "Economic Growth and Organization of the U.S. Starch Industry". u BeMiller, James N.; Whistler, Roy L. (ured.).Starch Chemistry and Technology(3rd izd.). London: Academic.ISBN9780080926551.Nepoznati parametar
|name-list-format=zanemaren (prijedlog zamjene:|name-list-style=) (pomoć)
Vanjski linkovi
[uredi|uredi izvor]- http:// chem.qmul.ac.uk/iubmb/IUBMB – Verzeichnis und Nomenklatur der Enzyme]
- http:// brenda-enzymes.org/BRENDA] umfangreiche Enzymdatenbank
- http:// enzyme-database.org/index.phpExploreEnz – The Enzyme Database]
- http:// expasy.org/enzyme/Enzymdatenbank mit Suchmaschine]
- http:// genome.ad.jp/kegg/pathway.html#aminoKEGG Metabolic Pathway Database (graphische Darstellungen der biochemischen Reaktionen mit den dazugehörigen, systematisch identifizierten Enzymen)]