Hidrogenacija
Hidrogenacijailihidrogenizacija– za liječenjevodikom– jehemijska reakcijaizmeđu molekulskog vodika (H2) i drugog spoja ili elementa, obično u prisustvukatalizatorakao što su:nikl,paladijiliplatina.Proces se obično odvijaredukcijomilizasićenjemorganskih jedinjenja.Hidrogenacija obično predstavlja dodatak parova atomavodika,kada nastaje nova molekula, koja je običnoalken. Za ovu reakciju potrebni su i korisnikatalizatori,a nekatalizirana hidrogenacija se odvija samo na vrlo visokim temperaturama. Hidrogenacija smanjuje0dvostrukeitrostrukeveze uugljikovodicima.[1][2][3][4]
Zbog važnosti vodika, brojne hemijske reakcije su povezane i razvijene za njegovu upotrebu. Većina hidrogenacija koristi plinoviti vodik (H2), ali neke uključuju i alternativne izvore vodika, a ne H2:ovi procesi se nazivajutransferne hidrogenacije.Obrnuta reakcija prilikom koje dolazi do uklanjanja vodika iz molekula, zove sedehidratacija.Reakcija u kojoj se razlažu veze, a dodaje vodik zove sehidrogenolizai predstavlja reakciju u kojoj može nastati veza ugljik-ugljik i ugljik-heteroatom (kisik,dušikilihalogen). Hidrogenacija se razlikuje odprotonacijeilihidrida.Tokom hemijske reakcije hidrogenacije, proizvodi imaju isti električni naboj kao ireaktanti.
Hidrogenacijaneztasićenih mastiproizvodizasićene masti.U slučaju djelimične hidrogenacije, mogu nastatitrans masti.
Proces
[uredi|uredi izvor]Hidrogenacija ima tri komponente unezasićenimpodlogama, vodiku (ili izvor vodiku) i po pravilu je katalizator.Redukcijskareakcija se provodi na različitim temperaturama i pritiscima, u zavisnosti od podloge i aktivnosti katalizatora.
Podloge
[uredi|uredi izvor]Adicija H2na alkene daje jedanalkanu prototipskoj reakciji:
Hidrogenacija je osjetljiva na prostorne prepreke, što objašnjava selektivnost za reakciju saegzocikličnimdvostrukim vezama, ali ne i unutrašnjim dvostrukim vezama. Dobar primjer hidrogenacije je reakcija dodavanja vodika umaleinsku kiselinutokom koje nastajesukcinska kiselina.Brojne su važne primjene ove hemijske reakcije u:petrohemijskojfarmaceutskoj i prehrambenoj industriji.
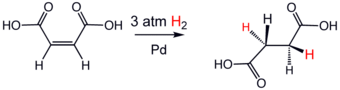
Važna karakteristika hidrogenacije alkena i alkina, te homogeno i heterogeno katalizirane verzije, je da se vodik javlja kod "sin adicije",sa vodikom koji ulazi iz najmanje ometane strane..[5]
- Podloge i proizvodi hidrogenacije
| Podloge | Proizvod | Komentar |
| Alken,R2C=CR'2 | Alkan,R2CHCHR'2 | Mnogi katalizatori, jedna od primjena jemargarin. |
| Alkin,RCCR | Alken, cis-RHC=CHR ' | Više-hidrogenacije pri čemu alkan može biti problematičan. |
| Aldehid,RCHO | Primarnialkohol,RCH2OH | Lahke podloge. |
| Keton,R2CO | Sekundarnialkohol,R2CHOH | Više izazovno nego Rcho, prohiralni za nesimetrični keton. |
| Ester,RCO2R' | Dva alkohola, RCH2OH + R'OH | Izazovne podloge. |
| Imin,RR'CNR " | Amin, RR'CHNHR " | Lahke podloge, često koriste transfer hidrogenaciju, stvarni prekursor je N-protoniziran. |
| Amid,RC(O)NR'2 | Amin, RCH2NR'2 | Izazovne podloge. |
| Nitril,RCN | Primarni amin, RCH2NH2 | U nekim slučajevima, proizvod amin reaktivan je prema prekursoru nitrilu. |
| Nitro,RNO2 | Amin, RNH2 | Komercijalne primijene pri korištenju heterogenih Ni i Ru katalizatora, a glavna primjena jeanilin. |
Također pogledajte
[uredi|uredi izvor]Reference
[uredi|uredi izvor]- ^Atkins P., de Paula J. (2006): Physical chemistry, 8th Ed. W. H. Freeman, San Francisco,ISBN0-7167-8759-8
- ^Binder H. H. (1999): Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart,ISBN3-7776-0736-3.
- ^Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo,ISBN9958-9344-1-8.
- ^Kapur Pojskić L., Ed. (2014): Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo,ISBN978-9958-9344-8-3.
- ^Advanced Organic ChemistryJerry March 2nd Edition
- ^Whitten K.W., Gailey K. D. and Davis R. E. (1992): General chemistry, 4th Ed. Saunders College Publishing, Philadelphia,ISBN0-03-072373-6.
- ^Petrucci R.H., Harwood W.S. and Herring F.G. (2002): General Chemistry, 8th Ed. Prentice-Hall, New York,ISBN0-13-014329-4.
- ^Laidler K. J. (1978): Physical chemistry with biological applications. Benjamin/Cummings, Menlo Park,ISBN0-8053-5680-0.
Vanjski linkovi
[uredi|uredi izvor]- Primjeri hidrogenacije iz Organic sinteze:
- http://orgsynth.org/orgsyn/pdfs/CV7P0226.pdforganske sinteze, Coll. Vol. 7, p. 226 (1990).]
- http://orgsynth.org/orgsyn/pdfs/CV8P0609.pdforganske sinteze, Coll. Vol. 8, p. 609 (1993).]
- http://orgsynth.org/orgsyn/pdfs/CV5P0552.pdforganske sinteze, Coll. Vol. 5, p. 552 (1973).]
- http://orgsynth.org/orgsyn/pdfs/CV4P0603.pdforganske sinteze, Coll. Vol. 3, p. 720 (1955).]
- http://orgsynth.org/orgsyn/pdfs/CV6P0371.pdforganske sinteze, Coll. Vol. 6, p. 371 (1988).]
- https://books.google /books?id=4OIDAAAAMBAJ&pg=-PA107"Magija Hydro"

