Diborà
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 27,7 Da |
| Estructura química | |
| Fórmula química | B₂H₆ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Punt de fusió | −165 °C −165,5 °C |
| Punt d'ebullició | −93 °C (a 760 Torr) −87,55 °C (a 101,325 kPa) |
| Entropia molar estàndard | 232 J/(mol K) |
| Entalpia estàndard de formació | 36,4 kJ/mol |
| Pressió de vapor | 39,5 atm (a 17 °C) |
| Capacitat calorífica | 56,7 J/(mol K) |
| Perill | |
| Límit inferior d'explosivitat | 0,8 vol% |
| Límit superior d'explosivitat | 88 vol% |
| Límit d'exposició mitjana ponderada en el temps | 0,1 mg/m³ (10 h,Estats Units d'Amèrica) |
| IDLH | 17 mg/m³ |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response() | |
| Altres | |
| gas inflamable | |
Eldiborà,diborà(6)ohexahidrur de dibor,és un compost químic de la família delsborans(el més senzill en estat pur) amb la fórmula.A temperatura ambient és un gas incolor amb una olor dolça repulsiva. El diborà es barreja fàcilment amb l'aire, formant mescles explosives.
Història
[modifica]
Els hidrurs de bor se sintetitzaren i caracteritzar per primera vegada de forma sistemàtica el període del 1912 al 1937 pel químic alemanyAlfred Stock(1876–1846). Els anomenà «borans» per analogia amb elsalcanso hidrocarburs saturats, els hidrurs de carboni, que és el veí del bor a lataula periòdica.Com que elsboransmés lleugers eren volàtils, sensibles a l'aire i la humitat i tòxics, Stock desenvolupà mètodes i aparells d'alt buit per estudiar-los. El treball nord-americà sobre els borans començà l'any 1931, realitzat perHermann I. Schlesinger(1882–1960) iAnton B. Burg(1904–2003).[1]
El 1943,Hugh Christopher Longuet-Higgins(1923–2004), quan encara era estudiant a laUniversitat d'Oxford,fou el primer a explicar l'estructura i l'enllaç dels borans conjuntament amb el seu tutorRonald Percy Bell(1907-1996).[2]Poc després, el 1948, la teoria de Longuet-Higgins fou confirmada en un estudi del diborà d'espectroscòpia infrarojaper W.C. Price de laUniversitat de Chicago.[3]L'estructura del diborà fou confirmada de nou per mesura dedifracció d'electronsel 1951 per Kenneth Hedberg i Verner Schomaker.[4]William Nunn Lipscomb Jr.(1919–2011) confirmà l'estructura molecular dels borans mitjançantcristal·lografia de raigs Xa la dècada de 1950 i desenvolupà teories per explicar la seva unió. ElPremi Nobel de Químicade 1976 fou atorgat a Lipscomb "pels seus estudis sobre l'estructura dels borans que il·luminen els problemes d'enllaç químic".[5]
Estructura
[modifica]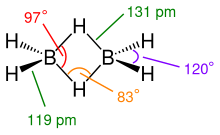
El diboràté l'estructura de la figura del costat. Aquesta estructura implica un enllaç de pont de tres centres, en què un parell d'electrons es comparteix entre tres (en lloc de dos) àtoms: dos àtoms de bor i un àtom d'hidrogen. La longitud d'aquests enllaçosés superior a la dels enllaços,131 pm enfront de 119 pm, i també l'angled'aquests enllaços és inferior (97°) al dels enllaços terminals (120°). La capacitat del bor per formar aquests enllaços a més dels enllaços covalents normals condueix a la formació de borans polièdrics complexos.[6]
Al diborà hi ha 12 electrons de valència per formar enllaços químics (B en té 3 i H en té 1, per tant, 2xB + 6xH =12). Cada enllaçterminal és unenllaç σestàndard amb dos electrons cadascun, i n'hi ha quatre, la qual cosa suposa un total de vuit electrons. Això deixa un total de quatre electrons per compartir entre els dos ponts d'hidrogen. En conseqüència, es formen dos enllaços pont,cadascun dels quals consta de només dos electrons, formant el que s'anomenen enllaços de tres centres de dos electrons (és a dir, 3 àtoms comparteixen 2 electrons), de vegades anomenats «enllaços banana», ja que no són lineals sinó corbats.[7]Cada àtom B empra orbitals híbridssp²,disposats en un pla i separats 120°. Dos d'aquests orbitals s'usen en la formació d'enllaços σ amb els àtoms d'hidrogen terminals, explicant-se l'angle observat. La combinació lineal del tercer orbital híbridsp²i l'orbitalpzno utilitzat permet obtenir dos orbitals híbrids semblants als orbitals híbridssp3,però amb major contribució de l'orbitalpz.Són aquests orbitals híbrids els que es fan servir en la formació de l'enllaç de tres centres. Un d'aquests orbitals híbrids conté un electró i l'altre és buit. Un àtom de B dona el seu electró de valència que li queda a un pont, i l'altre àtom B dona a l'altre. Cada pont, per tant, té dos electrons.[8]
Propietats
[modifica]Propietats físiques
[modifica]A temperatura ambient, el diborà és un gas incolor, amb un punt de fusió de –165 °C i un d'ebullició de –92,5 °C. La seva densitat és 0,96 vegades la de l'aire. Elpunt d'inflamacióés de –90 °C.[9]
Propietats químiques
[modifica]
El diborà, com tots els borans, és un compost endotèrmic, això és, la sevaentalpia de formació= 36,4 kJ/mol és positiva, i també la sevaenergia lliure de formació= 87,6 kJ/mol.[9]Lesenergies dels enllaçossón:(bor-hidrogen terminal) 380 kJ/mol,440 kJ/mol,330 kJ/mol i380 kJ/mol, inferiors en tots els casos a l'energia de l'enllaç,que és de 436 kJ/mol. Aquestes baixes energies expliquen la inestabilitat del diborà i dels borans en general.[10]Si s'escalfa, es descomponen en bor i hidrogen:
Reacció amb oxigen, aigua i àlcalis
[modifica]El diborà s'inflama espontàniament a l'aire i crema amb una flama verda característica. La temperatura d'autoignició es troba entre 38 °C i 52 °C. Forma mescles explosives en l'aire a partir d'una concentració del 0,8 % fins al 88 %. La reacció del diborà amb l'oxigen desprèn 2 008 kJ/mol i dona òxid de bori aigua:
S'hidrolitza fàcilment i desprenen hidrogen i produeixenàcid bòric:
Tots els borans reaccionen amb àlcalis actuant com a àcids monopròtics, excepte del diborà que es descompon en borat de sodi i hidrogen:
Piròlisis
[modifica]
A partir del diborà se sintetitzen la resta de borans escalfant entre 373 K i 523 K. Controlant la temperatura i la concentració del reactiu es poden obtenir els diferents borans.[11]Així, per exemple, el decaborà(14)s'obté escalfant diborà(6) entre 453 K i 490 K. Les reaccions dels primers borans segueixen les següents etapes que passen per la dissociació del diborà(6) en borà:[12]
Reacció amb tetrahidridoborat de sodi
[modifica]
Les reaccions del diborà amb tetrahidridoborat de sodis'empra per preparar borans d'alta massa molecular. Cada borà es pot sintetitzar canviant les condicions de temperatura i dissolvent. En primer lloc, s'obtenen els borats de sodi, per tant, aquesta primera etapa es pot fer servir si es volen sintetitzar els anions borat. Una segona etapa permet obtenir els borats fent reaccionar els borats de sodi amb àcid clorhídric.[13]
Hidroboració
[modifica]La hidroboració és una reacció d'addició extraordinàriament fàcil del borà,generat a partir de diborà, acomposts orgànicsinsaturats (és a dir,alquensialquins) dissolts enèter etílica temperatura ambient per produir organoborans de forma quantitativa (és a dir, en una reacció que s'acaba completament, o gairebé totalment). La reacció d'hidroboració, al seu torn, obrí noves vies d'investigació en l'àrea de la síntesi orgànica estereoespecífica.[14]

Síntesi
[modifica]Alfred Stockobtingué per primera vegada mescles de borans de baix rendiment tractantborur de magnesiambàcid clorhídric.El diborà es prepara més fàcilment amb un alt rendiment mitjançant la reacció de iodeamb tetrahidridoborat de sodi(comunament anomenat borohidrur de sodi) endiglimacom a dissolvent:[1]
o per reacció d'un borohidrur sòlid, és a dir, una sal que conté l'anió,amb un àcid anhidre,
Aplicacions
[modifica]El diborà s'utilitza habitualment a la indústria electrònica per al dopatge desemiconductorsbarrejant petites concentracions ambsilàen la fase gasosa abans de la descomposició. Quan reacciona amb silà i oxigen, el diborà també produeix les capes de revestiment de guies d'ones per afibra òpticaper deposició de vapor químic.[15]

Altres usos del diborà inclouen la preparació denitrur de bormitjançant la reacció del diborà ambamoníac,com acatalitzadorper a lapolimeritzaciói per a la conversió d'olefinesen trialquil borans. També s'usa en la conversió d'aminesen aminoborans i com aagent reductorselectiu amb compostos carbonílics comaldehidsicetonesper formaralcohols.[15]
Toxicitat
[modifica]No s'ha trobat que la toxicitat del diborà tingui efectes significatius sobre la pell i les mucoses, però les concentracions elevades poden causar irritació ocular i el contacte amb el líquid pot causar cremades. L'exposició crònica a concentracions baixes de diborà pot causar mal de cap, mareig, fatiga, debilitat muscular i tremolors. L'exposició repetida pot produir dificultat respiratòria crònica, especialment en individus susceptibles. Una dermatitis existent també es pot empitjorar amb l'exposició repetida al líquid. No s'ha demostrat que el diborà tingui efectes cancerígens, reproductius o de desenvolupament en humans.[16]
Referències
[modifica]- ↑1,01,1Kauffman,George B. «borane» (en anglès).Encyclopedia Britannica,15-08-2018. [Consulta: 17 febrer 2022].
- ↑Longuet-Higgins,H. C.;Bell,R. P. «64. The structure of the boron hydrides» (en anglès).Journal of the Chemical Society (Resumed),0, 01-01-1943, pàg. 250–255.DOI:10.1039/JR9430000250.ISSN:0368-1769.
- ↑Price,W. C. «The Absorption Spectrum of Diborane».The Journal of Chemical Physics,16, 9, 01-09-1948, pàg. 894–902.DOI:10.1063/1.1747028.ISSN:0021-9606.
- ↑Hedberg,Kenneth;Schomaker,Verner «A Reinvestigation of the Structures of Diborane and Ethane by Electron Diffraction 1,2» (en anglès).Journal of the American Chemical Society,73, 4, 1951-04, pàg. 1482–1487.DOI:10.1021/ja01148a022.ISSN:0002-7863.
- ↑«The Nobel Prize in Chemistry 1976» (en anglès americà). [Consulta: 7 març 2022].
- ↑Huheey,James E.Química inorgánica: principios de estructura y reactividad.2d ed. Mexico [D.F.]: HARLA, 1981.ISBN 968-6034-13-7.
- ↑Burrows,Andrew.Chemistry³: introducing inorganic, organic and physical chemistry.Second edition, 2013.ISBN 978-0-19-969185-2.
- ↑Gutiérrez Ríos,Enrique.Química inorgánica.2. ed., revisada. Barcelona: Reverté, 1994.ISBN 84-291-7215-7.
- ↑9,09,1CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data..93rd ed., 2012-2013. Boca Raton, Fla.: CRC, 2012.ISBN 978-1-4398-8049-4.
- ↑Maurya,Ram Charitra.Inorganic Chemistry Some New Facets..Berlin/Boston: Walter de Gruyter GmbH, 2021.ISBN 978-3-11-072728-9.
- ↑Inorganic and bio-inorganic chemistry.Oxford: Eolss Publishers, 2009.ISBN 978-1-84826-664-3.
- ↑Baylis,Anthony B.;Pressley,George A.;Stafford,Fred E. «Mass Spectrometric Investigation of the Pyrolysis of Boranes. IV. Diborane1».Journal of the American Chemical Society,88, 11, 01-06-1966, pàg. 2428–2433.DOI:10.1021/ja00963a013.ISSN:0002-7863.
- ↑Wiberg,Egon.Inorganic chemistry.1st English ed.. San Diego: Academic Press, 2001.ISBN 0-12-352651-5.
- ↑Kauffman,George B. «borane» (en anglès).Encyclopedia Britannica,15-08-2018. [Consulta: 17 febrer 2022].
- ↑15,015,1Compressed Gas Association.Handbook of Compressed Gases..Third edition. Boston, MA: Springer US, 1990.ISBN 978-1-4613-0673-3.
- ↑«Use of Diborane Gas». Department of Chemistry. National University of Singapore. [Consulta: 7 març 2022].























![{\displaystyle {\ce {[B12H12]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/afcb6dabd83cc0156f7de767a0f8b52af0836355)

![{\displaystyle {\ce {1/2 B2H6 + NaBH4 ->[273 K][polieter] NaB2H7}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e5a8154cdf77ccd204f897beaa602f5fbaa52c9e)
![{\displaystyle {\ce {B2H6 + NaBH4 ->[373 K][diglima] NaB3H8 + H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8dffd18e14782d101d995ee38189f7972315369)
![{\displaystyle {\ce {5 B2H6 + 2 NaBH4 ->[373-453 K][NEt_3] Na2B12H12 + 13 H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f83693ca8467a52950e2780718db59727305f2a)




![{\displaystyle {\ce {[BH4]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/869b819686a0036078cf1c62426a9588305e026e)


