Titani
| Titani | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
22Ti
| ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||
Gris-blanc argentat metàl·lic Titani sòlid  Línies espectrals del titani | ||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||
| Nom,símbol,nombre | Titani, Ti, 22 | |||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||||||||||||||
| Grup,període,bloc | 4,4,d | |||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 47,867(1) | |||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 4s23d2 2, 8, 10, 2 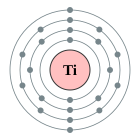
| |||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de lat. a.) |
4,506 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en elp. f. |
4,11 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.941K, 1.668 °C | |||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.560 K, 3.287 °C | |||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 14,15kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 425 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,060 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 4,3, 2, 1[1] (òxidamfòter) | |||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,54 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 658,8 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.309,8 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.652,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 147pm | |||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 160±8pm | |||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal
| |||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic | |||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 420 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 21,9 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 8,6 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so(barra prima) | (t. a.) 5,090 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 116 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 44 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 110 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,32 | |||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 6,0 | |||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 970 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 716 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-32-6 | |||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||
| Article principal:Isòtops del titani | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
Eltitaniés l'element químicde símbolTiinombre atòmic22. En la natura, es troba únicament en forma d'òxid.Es pot reduir per produir unmetall de transicióargentat, lluent, de baixadensitati alta resistència que resisteix lacorrosióenaigua de mar,aigua règiaiclor.
Se situa en el grup 4 de lataula periòdica dels elements.És abundant en l'escorça terrestre,on es troba, en forma d'òxid,en l'escòriade certsmineralsde ferro i en cendres d'animalsiplantes.Elmetallés de color gris fosc, de gran duresa, resistent a la corrosió i de propietats físiques semblants a les de l'acer; s'usa en la fabricació d'equips per a la indústria química i,aliatamb el ferro i altres metalls, s'empra en la indústriaaeronàuticaiaeroespacial.
Història
[modifica]
El primer mineral de titani fou descobert el 1791 en una remota vila deCornualla,al sud-oest d'Anglaterra,pel reverendWilliam Gregor(1761-1817), que era el vicari de Creed. Gregor observà que una sorra negra que havia trobat al costat d'un rierol a la parròquia veïna de Manaccan era atreta per un imant. L'analitzà tan bé com pogué i deduí que estava composta per dos òxids metàl·lics, un l'òxid de ferro, que explicava les propietats magnètiques, i un altre que no ho era atret, i que no pogué identificar. Gregor conclogué que havia descobert un metall desconegut fins aleshores i ho comunicà a la Royal Geological Society of Cornwall, i també a l'edició de 1791 de la revista alemanya de ciència,Crell's Annalen,on suggerí anomenar el nou mineralmanaccanita,en honor del nom de la parròquia on l'havia trobat. És unmineralposteriorment anomenatilmenita.Si hagués estat capaç d'aïllar el metall, i demostrar que era un element «nou», es diu que hauria pensat a anomenar-lomanaccin.[2]

Quatre anys més tard, el 1795, l'eminent científic alemanyMartin Heinrich Klaproth(1743–1817), de Berlín, redescobrí el mateix element, i l'anomenà titani, derivat delsTitans,fills d'UràiGea,de lamitologia grega.Elegí aquest nom perquè en si mateix no tenia cap significat, per tant, «no podia donar lloc a cap idea errònia». Klaproth obtingué l'òxid metàl·lic d'una mostra derútil,que li havien enviat des d'Hongria. Quan li parlaren del descobriment anterior de Gregor, investigà una mostra d'ilmenita i confirmà que també contenia el mateix òxid metàl·lic.[2][3]

Tot i que Klaproth intentà de forma persistent reduir l'òxid, no ho aconseguí. De fet, és impossible extreure el titani del seu òxid mitjançant l'escalfament amb carbó, ja que mentre que aquest reacciona per eliminar l'oxigen, també reacciona amb el titani per produir carbur de titani.[2]El neozelandèsMatthew Albert Hunter(1878–1961) preparà per primera vegada, l'any 1910,[4]titani metàl·lic pur (amb una puresa del 99,9 %) escalfanttetraclorur de titaniambsodientre 700 °C i 800 °C en un reactor d'acer,amb un procés que seria conegut com a procés Hunter.[3]
El titani com a metall s'emprà fora del laboratori fins que el1946William Justin Kroll(1889–1973), un metal·lúrgic luxemburguès, desenvolupà un mètode per a poder produir-lo comercialment mitjançant lareducciódel tetraclorur de titani ambmagnesia 800-850 °C, i aquest és el mètode utilitzat avui en dia (procés de Kroll).[5]
Abundància i obtenció
[modifica]
El titani com a metall no es troba lliure en la naturalesa, però és el novè element en abundància en l'escorça terrestrei el quart metall més abundant,[3]present en la majoria de lesroques ígniesi sediments derivats d'elles. El titani també és present enmeteoritsi en el Sol. Les roques obtingudes durant la missió lunarApollo 17de laNASAvan mostrar una presència del 12,1 % d'òxid de titani(IV). Les anàlisis de les roques obtingudes durant missions anteriors delprograma Apollomostren percentatges més baixos. Les bandes d'òxid de titani són prominents en l'espectred'estels de tipus M onanes rojes,els estels més abundants a l'univers.[6]
Es coneixen quatre-cents trenta-set minerals que contenen titani. Els que el tenen amb més d'un 50 % són:osbornita(77,37 %), hongquiïta(74,95 %),tistarita(63,77 %),anatasa,brookita,IMA2007-058irútil(cadascun 59,94 %).[7]

De tots els minerals que contenen titani només lailmenita,elleucoxèi el rútil tenen una significativa importància econòmica. Els principals productors mundials són laXinaamb 3 400 t d'ilmenita el 2022,Moçambicamb 1 200 t,Sud-àfricaamb 900 t iAustràliaamb 600 t. Les reserves mundial d'ilmenita es calculen en 650 000 t i de rútil 49 000 t.[8]
El titani metall es produeix comercialment per mitjà de la reducció detetraclorur de titaniambmagnesia uns 800 °C sota atmosfera d'argó(si no reaccionaria amb l'oxigen i el nitrogen de l'aire); aquest procés fou desenvolupat el 1946 pel metal·lúrgic estatunidenc d'origen luxemburguèsWilliam Justin Kroll(1889-1973) i es continua coneixent com aprocés de Kroll.[3]D'aquesta manera s'obté un producte porós conegut com a esponja de titani que posteriorment es purifica i compacta per a obtenir el producte comercial.
A fi de pal·liar el gran consum energètic del procés Kroll (de l'orde d'1,7 vegades el requerit per l'alumini) es troben en desenvolupament procediments d'electròlisien sals foses (clorurs o òxids) que encara no han trobat aplicació comercial.[9]
Si és necessari obtindre titani més pur es pot emprar un mètode, només aplicable en petites quantitats (a escala de laboratori) per mitjà del mètode de van Arkel i de Boer. Aquest mètode es basa en la reacció de titani ambiodea una determinada temperatura per a donartetraiodur de titanii la seva posterior descomposició a una temperatura distinta per a tornar a donar el metall.[10]
Propietats
[modifica]
Propietats físiques
[modifica]El titani és un element metàl·lic amb un punt de fusió de 1 668 °C, un punt d'ebullició de 3 287 °C i una densitat de 4,51 g/cm³.[6]Presenta unaestructura hexagonal compacta,és dur,refractarii bon conductor de l'electricitat i la calor. Quan és pur, és un metall fort, brillant i blanc metàl·lic d'una relativa baixa densitat. Posseeix excel·lents propietats mecàniques i a més té l'avantatge, enfront d'altres metalls de propietats mecàniques semblants, de ser relativament lleuger. De fet té la major proporció duresa-densitat de tots els metalls.[3]
Propietats químiques
[modifica]
El titani presenta elsestats d'oxidació2, 3 i 4 i la sevaconfiguració electrònicaés [Ar]3d24s2.Exposat a l'aire queda recobert d'una capa d'òxid que normalment el fa inactiu (passivació) i és, per tant, resistent a lacorrosió.Tanmateix, una vegada que el titani comença a cremar a l'aire, es crema amb una espectacular flama blanca per formaròxid de titani(IV)initrur de titani.El titani fins i tot crema en nitrogen pur per formar nitrur de titani.[11]
El titani reaccionarà amb el vapor d'aigua formant l'òxid de titani(IV) i l'hidrogen, segons la reacció:[11]

Elshalògensreaccionen amb el titani en escalfar-se per formar halogenurs de titani(IV). La reacció amb fluor requereix escalfar a 200 °C. Les reaccions són:[11]
A temperatures elevades pot reaccionar fàcilment també amb l'hidrogen,elbori altresno metalls.
És resistent a temperatura ambient a l'àcid sulfúricdiluït i a l'àcid clorhídricdiluït, així com a altres àcids orgànics; també és resistent a lesbases,fins i tot a altes temperatures. No obstant es pot dissoldre en àcids en calent. Així mateix, es dissol bé enàcid fluorhídrico amb fluorurs en àcids. L'àcid fluorhídric aquós diluït reacciona amb el titani per formar l'anió complexjuntament amb l'hidrogen. La reacció és:[11]
Isòtops
[modifica]Es troben cincisòtopsestables en la naturalesa: Ti-46, Ti-47, Ti-48, Ti-49 i Ti-50, sent el Ti-48 el més abundant (73,8%). S'han caracteritzat vint-i-tresradioisòtopsque van del de nombre màssic 38 al 63, sent els més estables el titani 44, amb unperíode de semidesintegracióde t½= 60,25 anys i es desintegra percaptura electrònica;i el titani 45 amb t½= 184,8 minuts, que es desintegra peremissió d'un positró(desintegració β+). Per a la resta, els seus períodes de semidesintegració són inferiors als 6 minuts, i la majoria de menys de mig segon.[12]
Aplicacions
[modifica]
Indústria metal·lúrgica
[modifica]
A causa de la seva força, baixa densitat i el que pot aguantar temperatures relativament altes, els aliatges de titani s'empren en avions i míssils. També es troba en diferents productes de consum, com a pals de golf, bicicletes, etcètera.[3]El titani es mescla generalment ambalumini,ferro,manganès,molibdèi altres metalls.A causa de la seva gran resistència a la corrosió es pot aplicar en casos en què estarà en contacte amb l'aigua del mar, per exemple, en aparells o hèlices. També es pot emprar en plantes dessalinitzadores.

Indústria química
[modifica]Aproximadament el 95% del titani es consumeix com a òxid de titani(IV), unpigmentblanc permanent que s'empra en pintures, pasta de dents, medicaments, plàstics i, fins i tot, en menjars com salses o formatges. En pintures s'utilitzen en reflectors pel fet que reflecteixen molt bé la radiació infraroja. Aixímateix es fa servir per aconseguir un color blanc brillant en els focs artificials.[3]
Construcció
[modifica]
El diòxid de titani absorbeix lallum ultraviolada,alliberantions hidròxid(OH), que actuen com aradicals lliures,pel que s'utilitzen en superfícies autonetejables com finestres de vidre ivernísper a rajoles d'hospitals, reduint les taxes d'infecció perbacterisletals. Per aquest mateix motiu s'utilitza en cremes solars.També s'han emprat làmines primes de titani per a recobrir alguns edificis, com per exemple elMuseu Guggenheim de Bilbao.[3]
Medicina
[modifica]Es considera que és fisiològicamentinert,per la qual cosa el metall s'empra enpròtesisde titani, consistents en caragols de titani pur que han estat tractats superficialment per a millorar la sevaoseointegració;per exemple, s'utilitza en lacirurgia maxil·lofaciala causa d'aquestes bones propietats. S'utilitza per a implants mèdics, per a bombes percors artificialsi per caixes demarcapassos.[3]Alguns compostos de titani poden tenir aplicacions en tractaments contra elcàncer.Per exemple, el clorur de titanocè en el cas detumorsgastrointestinals i de mama.
Altres
[modifica]S'empra per a obtenir pedres precioses artificials.També pel fet de ser inert i a més poder-se pintar, s'empra com a material depírcings.El clorur de titani(IV) s'usa per a irisar el vidre i pel fet que en contacte amb l'aire forma molt de fum, s'empra per a formar artificialment pantalles de fum.
Generalment, els isòtops dedubniactualment són produïts per bombardeig d'isòtops debismut209 amb projectils detitani,per exemple l'isòtop dubni 258:[13]
Precaucions
[modifica]La pols metàl·lica del titani éspirofòrica.D'altra banda, es creu que les seves sals no són especialment perilloses. No obstant això, els seus clorurs, com clorur de titani(III) o clorur de titani(IV), es consideren corrosius. El titani té també la tendència a acumular-se en els teixits biològics. En principi, no s'observa que desenvolupi cap paper biològic.[14]
Referències
[modifica]- ↑Andersson, N.et al.«Emission spectra of TiH and TiD near 938 nm».J. Chem. Phys.,118, 2003, pàg. 10543.Bibcode:2003JChPh.118.3543A.DOI:10.1063/1.1539848.
- ↑2,02,12,2Emsley,John.Nature's building blocks: an A-Z guide to the elements.Oxford: Oxford University Press, 2001.ISBN 0-19-850341-5.
- ↑3,03,13,23,33,43,53,63,73,8Challoner,Jack.Los elementos. La nueva guía ilustrada de los componentes básicos del universo.(en castellà). Alcobendas: LIBSA, 2018, p. 41,42.ISBN 9788466236669.
- ↑Hunter,M.A. «The Preparation of Pure Titanium».Journal of the Institute of Metals,3, 4, 1910, pàg. 414-425.
- ↑Kloprogge,J. Theo.The periodic table: nature's building blocks. An introduction to the naturally occurring elements, their origins and their uses.Amsterdam: Elsevier, 2021.ISBN 978-0-12-821538-8.
- ↑6,06,1William M. Haynes.CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data..95th edition. Boca Raton, Florida: CRC Press, 2014.ISBN 978-1-4822-0867-2.
- ↑Barthelmy,David. «Mineral Species sorted by the element Ti Titanium».Mineralogy Database,1997-2014. [Consulta: 19 abril 2023].
- ↑«Titanium Statistics and Information» (en anglès). U.S. Geological Survey, Gener 2023. [Consulta: 19 abril 2023].
- ↑Dring,K.;Rosenkilde,C. «Production of titanium and titanium alloys by electrochemical reduction of oxide precursors» (en anglès).Materials Technology,22, 2, 2007-09, pàg. 62–65.DOI:10.1179/175355507X214050.ISSN:1066-7857.
- ↑van Arkel,A. E.;de Boer,J. H. «Darstellung von reinem Titanium-, Zirkonium-, Hafnium- und Thoriummetall» (en alemany).Zeitschrift für anorganische und allgemeine Chemie,148, 1, 25-09-1925, pàg. 345–350.DOI:10.1002/zaac.19251480133.ISSN:0863-1786.
- ↑11,011,111,211,3Winter,Mark. «Titanium. The essentials».WebElements.The University of Sheffield and WebElements Ltd, 1993-2023. [Consulta: 19 abril 2023].
- ↑«Z = 22».NuDat 3.National Nuclear Data Center (NNDC) at Brookhaven National Laboratory. [Consulta: 19 abril 2023].
- ↑Moody,K.J.. «Synthesis of Superheavy Elements». A: Matthias Schädel, Dawn Shaughnessy.The Chemistry of Superheavy Elements(en anglès). 2a edició. Berlín: Springer Science & Business Media, 2014.ISBN 978-3-642-37466-1.
- ↑Kim,Kyeong Tae;Eo,Mi Young;Nguyen,Truc Thi Hoang;Kim,Soung Min «General review of titanium toxicity» (en anglès).International Journal of Implant Dentistry,5, 1, 2019-12, pàg. 10.DOI:10.1186/s40729-019-0162-x.ISSN:2198-4034.PMC:PMC6409289.PMID:30854575.
Enllaços externs
[modifica]- webelements.com - Titani(anglès)
- environmentalchemistry.com - Titani(anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||











![{\displaystyle {\ce {Ti(s) + 2F2(g) -> TiF4(s) \; [blanc]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/92bce90447edffc78750c2a7c649b4732fe27eea)
![{\displaystyle {\ce {Ti(s) + 2Cl2(g) -> TiCl4(l) \; [incolor]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6aa03228e7122dec898c1f83c141b692fee2e1dd)
![{\displaystyle {\ce {Ti(s) + 2Br2(g) -> TiBr4(s) \; [taronja]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ef2d9b2e68808e1c2138e558d67616b243a71076)
![{\displaystyle {\ce {Ti(s) + 2I2(g) -> TiI4(s) \; [marro \; fosc]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b99d9aacc9556bc4ba52757ad50aed46a34c6e6)
![{\displaystyle {\ce {[TiF6]^3-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5af7a6c712c53760bd8d1d23a70ad8b9141177b1)
![{\displaystyle {\ce {2Ti(s) + 12HF(aq) -> 2[TiF6]^{3-}(aq) + 3H2(g) + 6H+(aq)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7edbf6b9d0695a13f30af3c8fc7eea74b960856)

