Níquel
| Níquel | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
28Ni
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||
Brillant, metàl·lic, platejat amb un matís daurat  Línies espectrals del níquel | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom,símbol,nombre | Níquel, Ni, 28 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grup,període,bloc | 10,4,d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 58,6934(4)(2) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 4s23d8o [Ar] 4s13d9(vegeu text) 2, 8, 16, 2 o bé 2, 8, 17, 1 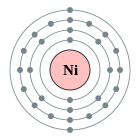
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de lat. a.) |
8,908 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en elp. f. |
7,81 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.728K, 1.455 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.186 K, 2.913 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 17,48kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 377,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 26,07 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 4[1],3,2,1[2],-1 (òxidbàsicfeble) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,91 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 737,1 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.753,0 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 3.395 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 124pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 124±4pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 163pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Ferromagnètic | ||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 69,3 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 90,9 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 13,4 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so(barra prima) | (t. a.) 4.900 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 76 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 4,0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 638 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 700 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-02-0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal:Isòtops del níquel | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Elníquelés l'element químicde símbolNiinombre atòmic28.[3]Forma part del grup 10 de lataula periòdica dels elements.
Història[modifica]
L'ús del níquel es remunta aproximadament al segleivaC, generalment junt amb el coure, ja que apareix ben sovint en elsmineralsd'aquest metall;bronzesoriginaris de l'actualSíriatenen continguts de níquel superiors al 2 %. Manuscritsxinesossuggereixen que el «coure blanc» s'utilitzava a Orient cap a 1400-1700 aC, no obstant la facilitat de confondre les menes de níquel amb les d'argentindueix a pensar que en realitat l'ús del níquel fou posterior, cap al segleivaC.

Els minerals que contenen níquel, com laniquelina,s'havien emprat, en confondre'ls amb mineral decobalt,per a pintar elvidre.[4]AAlemanya,a lesmuntanyes Metal·líferesels miners anomenaven despectivamentKupfernickel‘coure de níquel’ a lesmenesque semblaven decoure,però de les quals no s'obtenia aquest metall.[5]

El1751el químic suecAxel Fredrik Cronstedt(1722-1765), intentant determinar quins metalls d'interès contenien lesmenesde les mines sueques deLos(a l'època, Loos),Hälsingland,estudià el mineralniquelinaNiAs i obtingué un metall que donava un color groc en dissoldre'l enàcid nítric.Inicialment, pensà que havia trobat coure, i hi afegíferroesperant que la reacció prevista donaria coure vermell, però això no succeí. Després de molts experiments aconseguí aïllar el metall.[6]
Cronstedt publicà el seu descobriment a lesTransaccions de la Reial Acadèmia Sueca de les Ciències(Kungliga Svenska Vetenskapsakademiens Handlingar) el 1751 i el 1754.[7]Anomenà el nou elementnickel,abreviació del sueckopparnickel,traduït de l'alemanyKupfernickel,compost deKupfer‘coure’ iNickel‘gnomde les mines’, diminutiu deNikolaus(relacionat ambsant Nicolaui els costums relacionats amb la seva festivitat a Alemanya).[8][9]Molts científics reconegueren el descobriment del nou element, però d'altres mantenien que el níquel era una barreja decobalt,ferro,ar sắc nici coure. Tots aquests dubtes s'esvaïren el 1775 quan el suecTorbern Olof Bergman(1735-1784) demostrà que les barreges d'aquest elements, en qualsevol proporció, no presentaven les propietats del níquel.[6]
Abundància i obtenció[modifica]

S'estima que el níquel és present a l'escorça terrestreen una proporció d'entre el 0,01 i el 0,02 %[10]o 84ppm(g/t),[11]essent el 22è[10]o 23è[11]element més abundant. Hom suposa que és molt més abundant alnuclide laTerra,que estaria compost fonamentalment deferroi níquel.[10]El níquel també apareix en forma de metall en alguns delsmeteoritsque cauen a la Terra, junt amb elferro,formantaliatgescom lakamacitao lataenita.

Lesmenesmés habituals entre les que contenen níquel són lapentlandita(Ni,Fe)9S8,una pirita magnètica amb més del 5 % de níquel anomenadapirrotinaFe1–xS i lagarnierita(Ni,Mg)6(OH)8Si4O10.Altresmineralsserien lagersdorffitaNiAsS, laannabergitaNi₃(AsO4)2•8H2O, laniquelinaNiAs o lanepouïtaNi3Si2O5(OH)4.[10][11]
La producció mundial de níquel el 2023 fou de 3,6 milions de tones, essent els principals productors:Indonèsia(1,8 milions de tones), lesFilipines(400 000 t),Nova Caledònia(230 000 t),Rússia(200 000 t), elCanadà(180 000 t),Austràlia(160 000 t) i laXina(110 000 t). Les reserves mundials conegudes superen les 130 milions de tones, que es troben majoritàriament a Indonèsia (55 milions de tones), Austràlia (24 milions de tones), elBrasil(16 milions de tones), Rússia (8,3 milions de tones) i Nova Caledònia (7,1 milions de tones).[12]
Característiques principals[modifica]
Propietat físiques[modifica]
És unmetall de transicióde color blanc platejat, amb un punt de fusió de 1 455 °C, un punt d'ebullició de 2 730 °C i una densitat de 8,912 g/cm³.conductorde l'electricitat i de la calor, és dúctil imal·leablepel que es pot laminar, polir i forjar fàcilment, i presenta certferromagnetisme.
Propietats químiques[modifica]
El seuestat d'oxidaciómés normal és +2. Pot presentar-ne altres, s'han observat estats d'oxidació 0, +1 i +3 en complexos, però no en són gens característics.
El níquel metall no reacciona amb l'aire en condicions ambientals, però finament dividit hi reacciona fàcilment i en aquesta forma pot ser pirofòric. A temperatures més altes, la reacció entre el níquel metall i l'oxigen sembla que no es completa, però dona una mica d'òxid de níquel(II) NiO. Tampoc reacciona amb l'aigua en condicions habituals.[13]

El níquel metall reacciona amb el fluor F2lentament, per la qual cosa s'empra en recipients per contenir-lo. Els altres halògens si que reaccionen donant els corresponents halurs de níquel(II):[13]
El níquel metall no reacciona amb hidròxids i es dissol lentament enàcid sulfúricdiluït per formar solucions que contenen l'ió Ni(II) aigua juntament amb el gas hidrogen H2.A la pràctica, el Ni(II) està present com a ió complex [Ni(OH2)6]2+.[13]
Isòtops[modifica]
En la naturalesa es troben cincisòtopsestables: Ni-58, Ni-60, Ni-61, Ni-62 i Ni-64, sent el més lleuger el més abundant (68,077 %), el segueix el Ni-60 (26,223 %), el Ni-62 (3,635 %), el Ni-61 (1,140 %) i, finalment el Ni-64 (0,926 %).[14]
S'han caracteritzat a més vint-i-sisisòtops radioactiusdels que els més estables són el Ni-59, el Ni-63 i el Ni-56 ambperíodes de semidesintegracióde 76 000 anys, 100,1 anys i 6,077 dies respectivament. Els altres radioisòtops, ambnombres màssicsdes de 48 a 78, tenen períodes de semidesintegració inferiors a 60 hores i la majoria no arriben els 30 segons. El níquel té a més un estatmetaestable.[14]
El Ni-56 es produeix en grans quantitats ensupernovesde tipus II corresponent la forma de lacorba de lluma la desintegració del Ni-56 enCo-56 i aquest enFe-56. El Ni-59 és un isòtop de llarga vida obtingut per cosmogènesi. Aquest isòtop ha trobat diverses aplicacions en ladatació radiomètricademeteoritsi en la determinació de l'abundància de pols extraterrestre engelsisediments.El Ni-60 és fill del Fe-60 (període de semidesintegració d'1,5 milions d'anys) la persistència del qual en elsistema solaren concentracions prou altes ha pogut causar variacions observables en la composició isotòpica del Ni-60, d'aquesta manera, l'anàlisi de l'abundància de Ni-60 en materials extraterrestres pot proporcionar informació sobre l'origen del sistema solar i la seua història primordial.
Aplicacions[modifica]
Indústria metal·lúrgica[modifica]
Majoritàriament, el níquel es destina a la fabricació d'acers inoxidables austenítics(amb més d'un 7 % de níquel). També són important altres aliatges, les més importants són a continuació:
Aliatges amb coure[modifica]

El níquel proporciona a l'aliatgeamb coure, anomenacuproníqueli que generalment conté menys del 50 % de níquel i petites quantitats deferro(0,5-0,6 %) i demanganès(0,3-1 %), una millor resistència a lacorrosiómarina, a la contaminació biològica i una millorductilitat.S'usa àmpliament tant en aplicacions marines com en canalitzacions, en la fabricació de revestiments de plataformes i cascs dels vaixells, en gàbies per als peixos utilitzades en aqüicultura i també enbescanviadors de calori condensadors.
El monel és unaliatgeconstituït per níquel (66-68 %),coure(27-30 %) iferro(1,5-3 %), de color blanc, d'unadensitatde 8,82 g/cm³ i amb unpunt de fusióde 1 360 °C. Té una gran resistència a la tracció, un bon allargament i resisteix remarcablement l'acció corrosiva de l'aigua de mar, del vapor d'aigua i dels àcids (excepte elnítric). L'addició d'alumini,Al, osilici,Si, permet de millorar-ne les característiques mecàniques. És utilitzat en la fabricació de tubs de condensador, hèlices, paletes de turbina, aparells químics, instal·lacions sanitàries i de la indústria alimentària, etc.[16]

Aliatges amb crom[modifica]
És el principal component dels aliatgesinconel,nom d'un grup d'uns vint-i-cincaliatges,de níquel (50-72 %),crom(14-23 %) i altres metalls (coure,manganèsimolibdè,entre d'altres). La combinació de níquel i crom proveeix resistència tant a solucions corrosives reductores com oxidants. El níquel i el crom actuen també en conjunt per resistir l'oxidació, carburització i altres formes de deteriorament a altes temperatures. Aquests aliatges no es tornen trencadisses a temperatures criogèniques, tenen bona resistència a la tracció i a la fatiga a temperatures moderades, i presenten excel·lents propietats de resistència al flux i trencament a altes temperatures.[17]
Elnicromés un metall obtingut com un aliatge de níquel,cromiferro.Amb aquest material es poden fer cables que dissipen una gran quantitat de calor, procés que és aprofitat, per exemple, per lestorradores de pa(per assecar l'aigua de les llesques de pa) i per a lapasteurització.Es fon a 500 °C, depenent de la concentració relativa dels seus components.
Aliatges amb ferro[modifica]
Supermalloyés el nom d'unaliatgecompost pernickel(75 %),ferro(20 %) imolibdè(5 %). Es tracta d'un material magnètic del tipustou(és a dir, de baixacoercitivitat). Laresistivitatd'aquest aliatge és de 0,6Ω·mm²/m. Té unapermeabilitat magnèticaextremadament alta (aproximadament 800 000 N/A²) i una baixa coercitivitat.
Elpermaloyés unaliatgedeferroi níquel d'elevadapermeabilitat magnèticai feblehistèresi magnètica,que és emprat en la fabricació de cables submarins, de nuclis de bobina, d'elements de màquines elèctriques sotmesos a l'acció de camps magnètics alterns, etc.
Aliatges amb alumini[modifica]
L'alumelés unaliatgeconstituït pel 94%, aproximadament, de níquel i de petites quantitats ben controlades desilici,aluminiimanganès.És molt resistent a la corrosió en medi oxidant, àdhuc per damunt de 1 000 °C. És emprat principalment com a element negatiu determoparells.La seva resistivitat elèctrica és 0,294 μΩ·m i la seva conductivitat tèrmica 30 W/m/K.
Alnicoés un grup d'aliatgesde ferro amb quantitats variables (8-12 %) d'alumini,de níquel (14-28 %) i decobalt(5-24 %).[18]Alguns contenen, a més, petites quantitats decourei detitani.Segons la seva composició hom distingeix uns dotze tipus d'alnico. Tots ells són caracteritzats per llurs propietats ferromagnètiques i usats en la fabricació d'imantspermanents.[19]
Aliatges amb titani[modifica]
Elnitinolés un metall format per l'aliatgede níquel ititanien quasi la mateixa proporció (per exemple el nitinol 60 té un 60 % de níquel), i presenta unes propietats estranyes respecte als altres aliatges, ja que és capaç de recuperar de manera «intel·ligent» la forma original després d'haver estat deformat, sempre que s'escalfi a la temperatura de transformació.[20][21]Per les seves propietats de material superelàstic, s'han desenvolupat dispositius d'aplicació en medicina, com cilindres - malles autoexpansibles per mantenir la permeabilitat de vasos sanguinis (stents), o dispositius per a oclusió de defectes cardíacs. També s'empren en elements que han de recuperar la seva forma original després d'una severa deformació, com muntures d'ulleres per a nens o antenes de telèfons mòbils (ja en desús). La recuperació de la forma original es pot emprar per a la generació de moviment o per a la fabricació d'acoblaments en conduccions espacials (conduccions en la indústria aeronàutica o conduccions submarines).
Indústria de bateries[modifica]

La primera bateria que emprà níquel fou la deníquel i ferroinventada el 1899 perThomas Alva Edison.És una bateria molt robusta que tolera la sobrecàrrega, sobredescàrrega i el curtcircuit,[22]però és de fabricació cara i altres tipus de bateries l'han desplaçat.[23]Tanmateix en aplicacions especials el seu ús s'ha incrementat.[24][25][26]
L'hidròxid de níquel s'utilitzava en la producció debateries recarregables de níquel i cadmi(Ni-Cd), però eren pesants i no podien emmagatzemar tanta energia, com lespiles de níquel i hidrur metàl·lic(Ni-MH), que les han substituït perquè són més barates i menys contaminants. El níquel s'utilitza en la fabricació de bateries de sodi i níquel (bateries zebra) que treballen a altes temperatures.
Unacumulador de níquel hidrogen(NIH₂ o Ni-H₂) és una font de potència electroquímica recarregable obtinguda a partir de níquel i hidrogen.[27]Aquest tipus de bateria utilitza cel d'hidrogen pressuritzat a més de 82,7 bar.[28]
Altres camps[modifica]
Es fa servir en recobriments electrolítics antioxidants (niquelat).
Rol biològic[modifica]
Molteshidrogenasescontenen níquel, especialment aquelles la funció de les quals és oxidar l'hidrogen.Sembla que el níquel pateix canvis en el seu estat d'oxidació el que indicaria que el nucli de níquel és la part activa de l'enzim.
El níquel està també present en l'enzim metil com a reductasa i en bacteris metanògens.
Precaucions[modifica]
|
|
Aquest article o secció nocita les fontso necessita més referències per a la sevaverificabilitat. |
L'exposició al níquel metall i els seus compostos solubles no ha de superar els 0,05mg/cm³mesurats en nivells de níquel equivalent per a una exposició laboral de 8 hores diàries i 40 setmanals. Els vapors i la pols desulfur de níquelse sospita que poden sercancerígens.
El carbonil de níquel (Ni(CO)₄), generat durant el procés d'obtenció del metall, és un gas extremadament tòxic.
Les persones sensibilitzades poden manifestaral·lèrgiesal níquel. La quantitat de níquel admissible en productes que puguin entrar en contacte amb la pell està regulada per laUnió Europea;tot i així, la revistaNatureva publicar el2002un article en què investigadors afirmaven haver trobat en monedes d'1 i 2eurosnivells superiors als permesos, es creu que a causa d'una reacció galvànica.
Referències[modifica]
- ↑M. Carneset al.«A Stable Tetraalkyl Complex of Nickel(IV)».Angewandte Chemie International Edition,48, 2009, pàg. 3384.DOI:10.1002/anie.200804435.
- ↑S. Pfirrmannet al.«A Dinuclear Nickel(I) Dinitrogen Complex and its Reduction in Single-Electron Steps».Angewandte Chemie International Edition,48, 2009, pàg. 3357.DOI:10.1002/anie.200805862.
- ↑«níquel».Gran Enciclopèdia Catalana.Grup Enciclopèdia Catalana.[Consulta: 7 agost 2021].
- ↑Enghag, 2008,p. 689.
- ↑Trifonov, 1982,p. 62.
- ↑6,06,1Trifonov, 1982,p. 63.
- ↑Enghag, 2008,p. 690.
- ↑«níquel».Gran Diccionari de la Llengua Catalana.Barcelona:Grup Enciclopèdia Catalana.[Consulta: 15 febrer 2024].
- ↑Harper,Douglas. «nickel» (en anglès).Online Etymology Dictionary.[Consulta: 16 febrer 2024].
- ↑10,010,110,210,3Newton, 2010,p. 377.
- ↑11,011,111,2Enghag, 2008,p. 685.
- ↑«NICKEL» (PDF) (en anglès).Mineral Commodity Summaries.U.S. Geological Survey, gener 2024, pàg. 2.
- ↑13,013,113,2Winter,Mark. «Nickel. Reactions of elements».WebElements.The University of Sheffield and WebElements Ltd. [Consulta: 19 febrer 2024].
- ↑14,014,1Gray,Theodore. «Technical data for the element Nickel».Periodictable.[Consulta: 16 febrer 2024].
- ↑Callister,William D.;Rethwisch,David G.Materials science and engineering: an introduction: SI Version.10th edition, global edition. Hoboken: Wiley, 2020.ISBN 978-1-119-45391-8.
- ↑«Níquel».Gran Enciclopèdia Catalana.Barcelona:Grup Enciclopèdia Catalana.
- ↑«Inconel ALEACIONES NIQUEL-CROMO». American Special Metalls. [Consulta: 3 gener 2012].
- ↑Dawes,Chester L.Electricidad industrial(en castellà). vol.2. Reverte, 1982, p. 172.ISBN 8429130209.
- ↑«Níquel».Gran Enciclopèdia Catalana.Barcelona:Grup Enciclopèdia Catalana.
- ↑Materials and Coatings for Medical Devices: Cardiovascular.ASM International, 1 gener 2009, p. 95–.ISBN 978-1-61503-135-1.
- ↑Alan R. Pelton.SMST 2003: Proceedings of the International Conference on Shape Memory and Superelastic Technologies.ASM International, 2004, p. 183–.ISBN 978-1-61503-107-8.
- ↑David Linden, Thomas B. Reddy (ed).Handbook Of Batteries 3rd Edition,McGraw-Hill, Nova York, 2002ISBN 0-07-135978-8,Chapter 25
- ↑Ian Soutar. «Nickel Iron Battery Association HomePage», 01-07-2010. [Consulta: 30 octubre 2011].
- ↑Mother Earth News Issue #62 - March/April 1980
- ↑«nickel iron battery information». [Consulta: 24 desembre 2017].
- ↑Home Power Magazine Issue #80 December 2000/Jan 2001
- ↑«Un model simplificat d'una bateria níquel-hidrogen». Arxivat de l'originalel 2016-03-03. [Consulta: 28 juliol 2010].
- ↑«Instruccions d'emmagatzematge i maneig de bateries aeroespaciles de níquel-hidrogen». Arxivat de l'originalel 2012-10-23. [Consulta: 28 juliol 2010].
Bibliografia[modifica]
- Enghag,Per.Encyclopedia of the Elements(en anglès). WILEY-VCH Verlag GmbH, 2008, p. 76.ISBN 3-527-30666-8.
- Newton,David E.Chemical Elements(en anglès). Segona. Gale, 2010.ISBN 9781414476087.
- Trifonov,D. N.;Trifonov,V. D.Chemical Elements - How They Were Discovered(en anglès). Moscou: MIR, 1982.
Vegeu també[modifica]
Enllaços externs[modifica]
- L'origen del nomArxivat2004-03-14 aWayback Machine.(castellà)
- Los Alamos National Laboratory - NíquelArxivat2004-06-12 aWayback Machine.(anglès)
- webelements - Níquel(anglès)
- environmentalchemistry - Níquel(anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||

![{\displaystyle {\ce {Ni(s)\ +Cl2(g)->NiCl2(s)\quad [groc]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05f1d1e26911bbfaf14502fefc35eba057ed4e36)
![{\displaystyle {\ce {Ni(s)\ +Br2(g)->NiBr2(s)\quad [groc]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/40debe5ad5adf1dfb50bfd58bdba499e1e9e4dbe)
![{\displaystyle {\ce {Ni(s)\ +I2(g)->NiI2(s)\quad [negre]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1f31f6911b91dd02d4f7f16bd311ec381f43f64a)


