Nitrat
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 61,988 Da |
| Rol | metabòlit primari |
| Estructura química | |
| Fórmula química | NO₃⁻ |
| SMILES canònic | |
| Identificador InChI | Model 3D |
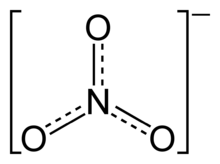
Enquímica inorgànica,unnitratés unanióderivat perdescomposicióde l'àcid nítric,format per un àtom denitrogeni tres d'oxigen(NO3–). Enquímica orgànicas'anomenen nitrats alsèstersde l'àcid nítrici diversosalcohols.El nitrat és una espècia iònica natural que forma part delcicle del nitrogende la Terra. Existeixen en l’ambient en formes solubles en aigua, en associació amb altres ions com ara el sodi i el potassi. Les sals es dissocien completament en ambients aquàtics. Generalment, el nitrat és estable en l’ambient; no obstant això, pot ser reduït a nitrit mitjançant processos biològics que involucren plantes, microbis, etc. A la natura, les plantes utilitzen el nitrat com a element nutritiu essencial. En el comerç, la major part del nitrat s'utilitza en adobs inorgànics. Altres usos comercials del nitrat són la preservació d’aliments i la manufactura de municions i explosius.
Estat natural
[modifica]
Els anions nitrat es troben en sòls i aigües com a part delcicle del nitrogende la Terra. El nitrat es forma de forma natural com a producte final de la descomposició de restes animals i vegetals, fet que converteix aquest procés en la font principal d’anions nitrat en el medi terrestre i en l'aquàtic. El nitrat també pot ser alliberat a l’aire, a l’aigua i al sòl en llocs on es produeixen o s'utilitzenadobso productes similars. Els residus d'éssers humans i d’animals també són fonts importants d’amoníacNH3.En ambients aeròbics, elsbacterisoxiden ràpidament l’amoníac anitritNO2–i aquest a nitrat. És un procés de dues etapes que es coneix com anitrificació.[1]
Les fonts humanes i naturals contribueixen a la pre sắc ncia d’aerosolsde nitrat a l’atmosfera. El nitrat s’ha detectat enaigües superficials,aigua potable(fins i tot en pous públics i privats) i enaigües subterrànies.El nitrat constitueix la major part de la quantitat total de nitrogen disponible en les aigües superficials. La contaminació de les aigües és causada per aigües de desguàs agrícoles (per ús d’adobs químics o animals) i descàrregues des de sistemes sắc ptics i plantes de tractament d’aigües residuals municipals. A la natura, hom pot trobar el nitrat enroques ígniesivolcàniques.El nitrogen es troba en sòls lligat a matèria orgànica i mineral del sòl. Les formes disponibles de nitrogen, inclòs el nitrat, es troben presents en el sòl en concentracions de pocs quilograms perhectàrea.El nitrat forma part normal de la dieta dels éssers humans i es pot trobar en vegetals, fruites, carns curades, peix, productes làctics, cerveses i cereals. El nitrat es converteixen en l'aparell digestiuhumà ennitrit,que reacciona amb lesaminesper a formarnitrosaminescarcinogèniques.[1]
Estructura
[modifica]La geometria de l'anió nitrat és trigonal plana i està centrada en el nitrogen que es troba enllaçat als tres oxígens mitjançant enllaços covalents (un de doble i dos de simples). El nitrogen empraorbitals híbridssp2per formarenllaços σamb els oxígens, i l'orbital p que queda no hibridat és perpendicular al pla que conté tots els àtoms i permet formar unenllaç πentre el nitrogen i els oxígens. Aquests enllaços σ es troben formant angles de 120°. Com que s'observa que els tres enllaços són equivalents, Les distàncies d'enllaç són totes de 126 pm, cal visualitzar aquesta estructura mitjançant tres formes ressonants (l'ordre d'enllaç és 1,5):[2]

Reactivitat
[modifica]
L'anió nitrat conté nitrogen enestat d'oxidació+5, la qual cosa fa que sigui un bonagent oxidant.En funció de la seva concentració i de la naturalesa de l'agent reductor,el nitrogen pot reduir-se als estats +4, +3, +2, +1, 0 i –3. Les semireaccions són:
Les dues més freqüents són les que el nitrogen es redueix a diòxid de nitrogen (la primera) que té un potencial de reduccióE0= 0,78 V; i la tercera, que dona monòxid de nitrogen, amb un potencial de reduccióE0= 0,96 V.[2]
Composts
[modifica]Nitrat de potassi
[modifica]
Elnitrat de potassi,també conegut com a salnitre[3]o salpetre,[4]és un compost químic inorgànic de fórmula,una sal constituïda per anions nitrati cations potassienllaçats mitjançantenllaç iònic.Fins a la fixació artificial del nitrogen amb elmètode Haberel salnitre cristal·litzat de certes coves era la principal font de nitrogen. La seva principal aplicació històrica és com a component principal de lapólvora.Mesclat amb altres nitrats s'empra enfertilitzants,amb contingut de nitrogen i potassi amb la fórmula de riquesa 13-0-44 que indica 13%, 0%, i 44% de nitrogen, fòsfor i potassi en pes, respectivament. En certs aquaris es fa servir com a font de nitrat i potassi per a les plantes. S'ha usat, en farmàcia, com adiürètic.Es fa servir també en la conservació de les carns i enxarcuteria.És l'additiuE252. Reacciona i produeixnitritsimonòxid de nitrogenque transforma lamioglobinavermella en la color rosada típica delpernili delsalami.
Nitrat de sodi
[modifica]
Elnitrat de sodiés un compost químic inorgànic de fórmula,una sal constituïda per anions nitrati cations sodienllaçats mitjançant enllaç iònic. Aquesta sal també es coneix amb el nom de salpetre de Xile o salnitre de Xile perquè pràcticament només existeixen grans dipòsits naturals al desert d'Atacama al nord deXile.[5]El salpetre ordinari és elnitrat de potassi.La forma mineral també es coneix com anitratina.El nitrat de sodi és un sòlid blanc molt soluble en aigua. És una font de fàcil accés de l'anió nitrat, útil en diverses reaccions realitzades a escala industrial per a la producció d'adobs, pirotècnia i bombes de fum, vidre i esmalts de ceràmica, conservant d'aliments i propulsor sòlid de coets. Ha estat minat àmpliament amb aquests propòsits.
Nitrat d'amoni
[modifica]
Elnitrat d'amoniés uncompost químicinorgànic, una sal constituïda per cationsamonii anionsnitrat,la qual fórmula és.Es tracta d'un compost sòlid, blanc i cristal·lí. És altament soluble en aigua ihigroscòpicen el seu estat sòlid, però no formahidrats.La seva aplicació principal és en l'agricultura,com afertilitzantric ennitrogen,i comexplosiud'aplicacions civils.[6][7]La seva producció global està estimada en uns 16.7 milions de tones el 2021.[8]Molts països estan reduint progressivament el seu ús en aplicacions de consum preocupats pel seu potencial mal ús.[9]Les explosions accidentals per nitrat d'amoni han matat milers de persones des de principis del seglexx.[9]
Toxicitat
[modifica]Els nitrats poden entrar al cos per l'aire que es respira; no obstant això, és molt improbable que la gent s'exposi a quantitats de nitrat en l'aire que puguin produir efectes nocius. També és improbable que els nitrats del sòl entrin al cos. Els anions nitrat entren al cos quan es beu aigua o s'ingereixen aliments que els contenen. El nitrat també està present en productes de tabac de mastegar. Alguns bacteris i fongs en aquests productes poden convertir el nitrat en nitrit, la qual cosa pot eventualment formarnitrosaminescarcinogèniques. Certa quantitat de nitrat entra al cos a través del cicle normal de nitrogen en els éssers humans i, també, poden ser produïts dins del cos. Una part del nitrat en el cos es desplaça de la sang a lesglàndules salivalson una part es transforma en nitrit. El nitrit en la sang pot reaccionar amb l'hemoglobina (la proteïna que transporta oxigen als teixits) i reduir la capacitat de l'hemoglobina per transportar oxigen. La major part del nitrat en el cos és eliminat en l'orina el mateix dia que entra al cos. Certa quantitat de nitrat a l'estómac forma altres substàncies, algunes de les quals poden ser nocives.
Els nadons menors de sis mesos semblen ser especialment sensibles als efectes del nitrit sobre l'hemoglobinadesprés de beure llet preparada amb aigua potable que tenia nivells de nitrat més alts que el límit recomanat. La causa és lametahemoglobinèmia(un canvi en l'hemoglobina que redueix la seva capacitat per transportar oxigen als teixits).
L'Agència Internacional de Recerca sobre el Càncer(IARC) va determinar que "la ingestió de nitrat sota condicions que resulten en nitrosació endògena és probablement carcinogènica en éssers humans (Grup 2A)." La IARC va indicar que:
- el cicle de nitrogen endogen en éssers humans inclou la conversió de nitrat a nitrit;
- agents nitrosants derivats de nitrit produït en l'ambient àcid de l'estómac poden reaccionar amb compostos nitrosants com amines i amides secundàries per generar compostos N-nitroso;
- les condicions de nitrosació augmenten amb la ingestió addicional de nitrat i nitrit o de compostos que poden ser nitrosats; i
- alguns compostos N-nitroso se sap que són carcinogènics.
Nitrats en hortalisses
[modifica]Els nitrats es troben de manera natural en els vegetals especialment en leshortalissesde fulla verda com elsespinacs,lesbledesi elsenciams.La llum afavoreix el metabolisme dels vegetals i limita l'acumulació de nitrats en ells, per això els espinacs d'hiverns tenen més contingut de nitrats que els espinacs d'estiu i els d'hivernacle més que els de l'aire lliure. Els nitrats són poc tòxics, però sí que ho són elsnitritsque es formen dins del cos humà a partir dels nitrats ingerits. L'emmagatzemament, en males condicions (temperatura ambient) de vegetals amb nitrats pot portar a la conversióin situdels nitrats en nitrits. Els nitrits a altes concentracions poden originarmetahemoglobinèmia,i la corresponentcianosi(síndrome del nadó blau). A la Unió Europea el Reglament 1881/2006 estableix el nivell de contaminants màxims en certs aliments. En infants es considera que el contingut de nitrats en les fulles d'enciams no representen perill però s'hauria de controlar el consum d'espinacs en els menors de 7 anys.[10]
Quantitats de nitrats trobades
[modifica]Segons l'EFSA,organisme sanitari de la Unió Europea, ha determinat les quantitats presents d'aquest compost en aliments:[11]A més s'ha de tenir en compte que els continguts de nitrats en espinacs frescos són més elevats que en els congelats.
- Bledes1.690 mg/kg
- Remolatxahortícola 1.379 mg/kg
- Enciam1.324 mg/kg (enciamiceberg875 mg/kg)
- Api1.103 mg/kg
- Espinacs1.066 mg/kg
- Carbassó416 mg/kg
- Mongetatendra 323 mg/kg
- Pastanaga296 mg/kg
- Cogombre185 mg/kg
- Patata168 mg/kg
- Ceba164 mg/kg
- Pebrot108 mg/kg
- Tomàquet43 mg/kg
- Pèsol30 mg/kg
Referències
[modifica]- ↑1,01,1«Resumen de Salud Pública: Nitrato y Nitrito (Nitrate/Nitrite)» (en castellà).Resúmenes de Salud Pública (PHS).Agencia para Sustancias Tóxicas y el Registro de Enfermedades, 25-01-2021. Arxivat de l'originalel 2024-08-06. [Consulta: 4 agost 2024].
- ↑2,02,1Gillespie,R.J.;Humphreys,D.;Baird,N.C.;Robinson,E.A..Química(en castellà). Reverte, 1988-08.ISBN 978-84-291-7188-4.Arxivat2024-08-02 aWayback Machine.
- ↑ salnitreaOptimot
- ↑ salpetreaOptimot
- ↑Mutic,Anja «The ghost towns of northern Chile».Washington Post,26-10-2012 [Consulta: 6 abril 2020].Arxivat27 de maig 2019 aWayback Machine.
- ↑Gracià,O. «Què és el nitrat d'amoni, la substància que ha provocat la tragèdia a Beirut?».Ara,05-08-2020. Arxivat de l'originalel 9 d’agost 2020. [Consulta: 7 agost 2020].
- ↑Zapp,Karl-Heinz. «Ammonium Compounds». A:Ullmann's Encyclopedia of Industrial Chemistry(en anglès). Wiley, 2003-03-11.DOI10.1002/14356007.a02_243.ISBN 978-3-527-30385-4.Arxivat2018-03-05 aWayback Machine.
- ↑«Ammonium nitrate production by country, 2021» (en anglès americà). Arxivat de l'originalel 2024-07-08. [Consulta: 6 agost 2024].
- ↑9,09,1«Ammonium nitrate sold by ton as U.S. regulation is stymied» (en anglès americà).The Dallas Morning News,28-02-2018. Arxivat de l'originalel 2018-02-28. [Consulta: 6 agost 2024].
- ↑«Recomendaciones de consumo por la presencia de nitratos en hortalizas» (
 PDF) (en castellà). Agencia Española de Seguridad Alimentaria y Nutrición, 14-04-2011. Arxivat de l'originalel 2012-12-09. [Consulta: 6 agost 2024].
PDF) (en castellà). Agencia Española de Seguridad Alimentaria y Nutrición, 14-04-2011. Arxivat de l'originalel 2012-12-09. [Consulta: 6 agost 2024].
- ↑EFSAJournal number, 689;1-79
Vegeu també
[modifica]













