Plutoni
| Plutoni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
94Pu
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Blanc argentat, agafa un to gris fosc en contacte amb l'aire  Línies espectrals del plutoni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom,símbol,nombre | Plutoni, Pu, 94 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Actínids | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup,període,bloc | n/d,7,f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | (244) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Rn] 5f⁶ 7s² 2, 8, 18, 32, 24, 8, 2 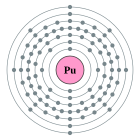
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de lat. a.) |
19,816 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en elp. f. |
16,63 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 912,5K, 639,4 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.505 K, 3.228 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 2,82kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 333,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 35,5 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 8, 7, 6, 5,4,3, 2, 1 (òxidamfòter) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,28 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia d'ionització | 1a: 584,7 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 159pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 187±1 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Monoclínic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (0 °C) 1,460 µΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 6,74 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 46,7 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so | 2.260m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 96 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 43 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,21 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-07-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal:Isòtops del plutoni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Elplutoniés l'element químicde símbolPuinombre atòmic94. Es tracta d'unmetallactinoidede color grisargentatque perd elllustreen contacte amb l'aire i forma una capa mat enoxidar-se.Com a regla general, es presenta en sisal·lòtropsi quatreestats d'oxidació.Reacciona amb elcarboni,elshalògens,elnitrogen,elsilicii l'hidrogen.L'exposició a l'aire humit condueix a la formació d'òxidsihidrursque poden augmentar el volum de la mostra un 70% i es desprenen en forma de polspirofòrica.La sevaradioactivitati tendència a acumular-se alsossosen fan una matèria perillosa.
En manipular-lo sense la protecció adequada pot produirmutacionscel·lulars que poden desembocar encàncero altres malalties. Rep el seu nom delplaneta nanPlutó.El plutoni existeix de formanaturalperò només en petitíssimes quantitats. Gairebé sempre és creat de forma artificial mitjançant el bombardeig d'urani 238 ambneutrons.El plutoni 239 s'empra com a combustible enarmes nuclearsi enreactors nuclearsper la seva capacitat defissionar-se,i el plutoni 238 engeneradors termoelèctrics per radioisòtopsdesondes espacialsper la calor que emet en desintegrar-se.
Història
[modifica]
El físic italiàEnrico Fermi(1901–1954) i un equip de científics de laUniversitat de Roma La Sapienzael 1934 comunicaren el descobriment de l'element denombre atòmic93. L'anomenarenausoni(símbolAo) per l'antiga regió italiana d'Ausònia.[3]El mateix equip atribuí el nomhesperia l'element 94, provinent d'Hespèria,una manera poètica de referir-se a Itàlia.[4]Tanmateix, aquell mateix any, la física alemanyaIda Noddack(1896–1978) presentà unes explicacions alternatives.[5]Després del descobriment de lafissió nuclearel 1938, hom comprovà que el descobriment de Fermi era en realitat una mescla debari,criptói altres elements.[4][6]

El plutoni fou produït per primera vegada el1941perGlenn T. Seaborg,Edwin McMillan,J.W. Kennedy i A.C. Wahl utilitzant elciclotródelLaboratori Nacional Lawrence de Berkeley(EUA).[7][8][9]Irradiaren nuclis d'urani 238 ambdeuteronsproduintneptuni238, que es desintegra en plutoni 238 amb emissió d'unapartícula β:Les reaccions són:[10]

L'anomenaren plutoni seguint el criteri d'anomenat els darrers elements com els darrers planetes:uranid'Urà,neptunideNeptúi plutoni dePlutó,descobert el 1930.[11]El descobriment fou mantingut en secret fins al final de laSegona Guerra Mundial,el1945.La producció de plutoni en quantitats útils per primera vegada fou una part important delProjecte Manhattandurant la Segona Guerra Mundial que desenvolupà les primeres bombes atòmiques. Lesbombes Fat Man,utilitzades a la prova nuclear deTrinityel juliol de 1945 i al bombardeig deNagasakiel9 d'agostde 1945, tenien nuclis de plutoni.[12]
Després de la guerra, es dugueren a terme experiments de radiació humana que estudiaven el plutoni sense el consentiment informat i es produïren diversos accidents de gravetat, alguns letals.
Estat natural i obtenció
[modifica]El plutoni és l'element amb elnombre atòmicmés alt que es pot trobar a la natura, malgrat que sigui en molt petites quantitats. Se'n produeixen traces en dipòsits naturals d’urani 238 quan l’urani 238 capta elsneutronsemesos per la desintegració d’altres àtoms d’urani 238.

El plutoni interessa per a la fabricació d'armes nuclears. En concret es produeix l'isòtop plutoni 239 perquè és l'isòtop fissionable. S'obté amb les següents reaccions:[11]
L'eliminació de residus de plutoni de les centrals nuclears i les armes nuclears desmantellades construïdes durant laGuerra Fredaés un problema de proliferació nuclear i mediambiental. Altres fonts de plutoni al medi ambient són conseqüències de nombroses proves nuclears sobre el terreny, ara prohibides.
Propietats físiques i químiques
[modifica]
A temperatura ambient éssòlid.El seu punt de fusió és 640 °C i la sevadensitat19.816 kg/m³.
L'element presenta normalment sisal·lòtropsi quatre estats d’oxidació. Reacciona ambcarboni,halògens,nitrogen,siliciihidrogen.Quan s’exposa a l’aire humit, formaòxidsihidrursque poden expandir la mostra fins a un 70% en volum, que al seu torn s’escampa com una polspirofòrica.Ésradioactiui es pot acumular en ossos, cosa que fa perillosa la seva manipulació.
Isòtops
[modifica]El plutoni té vint-i-unradioisòtopsconeguts ambnombres màssicsque van del 228 al 247. El més important, que no el més estable, és el plutoni 239, amb unaperíode de semidesintegracióde t½= 24.110 anys. El que té el període de semidesintegració més llarg és el plutoni 244 (t½= 8 × 107anys).[13]
Aplicacions
[modifica]
Indústria armamentística
[modifica]Tant el plutoni 239 com el plutoni 241 són fissibles, és a dir, que poden suportar unareacció en cadenanuclear, donant lloc a aplicacions enarmes nuclears.El plutoni 239 d'una riquesa del 93% és el que es destina en la fabricació d'armes nuclears.[14]
Producció d'energia
[modifica]
Tant el plutoni 239 com el plutoni 241 poden emprar-se enreactors nuclearsen forma dediòxid de plutoni,per a fercombustible nuclearMOX(7% de plutoni i 93% d'urani), per a algunescentrals nuclearsde producció d'energia elèctrica.El plutoni 240 presenta una elevada taxa defissió espontània,augmentant el flux de neutrons de qualsevol mostra que el contingui. La pre sắc ncia de plutoni 240 limita la utilitat de les mostres de plutoni per a les armes o la seva qualitat com a combustible del reactor, i el percentatge de plutoni 240 determina el seu grau (grau d’armes, combustible o reactor).[14]
El plutoni 238 té una vida mitjana de 87,7 anys i emetpartícules α.És una font de calor delsgeneradors termoelèctrics per radioisòtops,que s’utilitzen per alimentar algunessondes espacials.El fet que dos metalls diferents en contacte produeixin unaforça electromotriud'unió, permet generarenergia elèctrica.L'inconvenient per a la majoria de les aplicacions pràctiques és el baix valor de la força electromotriu que és de l'ordre de 10–6 V/K, per la qual cosa per obtenir un voltatge de sortida pràctic sovint es combinen en sắc rie aquestes unions i es col·loquen en un ambient de molt alta temperatura. Una de les principals aplicacions ha estat al programa espacial, on es necessita ungenerador elèctricsense parts mòbils i que subministri energia durant la llarga durada de lesmissions espacials.El programa espacial dels EUA ha emprat la calor generada per la desintegració del plutoni 238 aplicat a una col·lecció d'unions en el que s'anomena unGenerador termoelèctric per radioisòtops(RTG). Els RTG han estat utilitzats per laNASAen moltes missions, incloent-hiApollo,Pioneer,Viking,Voyager,GalileuiCassini-Huygens.[15]
Toxicologia
[modifica]Ésquímicamenttòxici també ésradiotòxic,especialment per inhalació.[16]
És extraordinàriament tòxic; d’una banda, emet partícules, i de l’altra, l'element s’absorbeix específicament a lamedul·la òssia.[17]La seva màxima concentració permissible en l’atmosfera és de 3 × 1011g/m³ i la seva dosi màxima és, per a l’home, de 6 × 10–7g.[17]
Referències
[modifica]- ↑Magnetic susceptibility of the elements and inorganic compoundsArxivat2012-01-12 aWayback Machine., aLide, D. R.CRC Handbook of Chemistry and Physics(en anglès). 86a edició. CRC Press, 2005.ISBN 0-8493-0486-5.
- ↑Magurno, B.A.; Pearlstein, S. (eds.)Workshop on nuclear data evaluation methods and procedures,Upton, Nova York, EUA, 22 setembre 1980, vol. II (1981), pp. 835 ff (en anglès)
- ↑Fermi,Enrico «Possible Production of Elements of Atomic Number Higher than 92».Nature,133, 3372, 16-06-1934, pàg. 898–899.DOI:10.1038/133898a0.
- ↑4,04,1Sime,Ruth LewinPhysics in Perspective,2, 1, 01-01-2000, pàg. 48.DOI:10.1007/s000160050036.
- ↑Noddack,Ida «Über das Element 93».Angewandte Chemie,47, 37, 15-09-1934, pàg. 653–655.DOI:10.1002/ange.19340473707.
- ↑Holden,Norman E. «A Short History of Nuclear Data and Its Evaluation».51st Meeting of the USDOE Cross Section Evaluation Working Group.Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory, 2001. [Consulta: 3 gener 2009].
- ↑Seaborg, Glenn T. «An Early History of LBNL: Elements 93 and 94». Advanced Computing for Science Department, Lawrence Berkeley National Laboratory. Arxivat de l'originalel 5 de novembre 2014. [Consulta: 17 setembre 2008].
- ↑Glenn T. Seaborg. «The plutonium story». Lawrence Berkeley Laboratory, University of California.
- ↑E. Segrè, A Mind Always in Motion, University of California Press, 1993, pp 162-169
- ↑Laboratory,Los Alamos National. «A History of Plutonium | Discover Los Alamos National Laboratory}» (en anglès). [Consulta: 15 febrer 2023].
- ↑11,011,1Emsley,John.Nature's building blocks: an A-Z guide to the elements.Oxford: Oxford University Press, 2001.ISBN 0-19-850341-5.
- ↑Sklar, 1984,p. 22–29.
- ↑«Z = 94».NuDat 3.0.National Nuclear Data Center (NNDC) at Brookhaven National Laboratory. [Consulta: 15 febrer 2023].
- ↑14,014,1«Reactor-Grade and Weapons-Grade Plutonium in Nuclear Explosives». [Consulta: 16 febrer 2023].
- ↑«Thermocouples». [Consulta: 16 febrer 2023].
- ↑Perfil toxicològic del plutoniDepartament de Salut dels Estats Units, novembre de 2010(anglès)
- ↑17,017,1«Plutoni».Gran Enciclopèdia Catalana.Barcelona:Grup Enciclopèdia Catalana.
Bibliografia
[modifica]- Sime,Ruth LewinPhysics in Perspective,2, 1, 2000, pàg. 48.DOI:10.1007/s000160050036.(anglès)
- Sklar,Morty.Nuke-Rebuke: Writers & Artists Against Nuclear Energy & Weapons.The Spirit That Moves Us Press, 1984.(anglès)
Vegeu també
[modifica]Enllaços externs
[modifica]- Enrico Fermi,Artificial radioactivity produced by neutron bombardment,Lectura dels premis Nobel, 12 desembre 1938.(anglès)
- Etimologies d'elements químics(anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||







