Krvetvorba


Krvetvorba(hematopoéza,hemopoéza,hemopoesa) je tvorbakrevníchbuněčných komponent. Formované krevní elementy jsou diferencované a dále se již nedělí. Procesem krvetvorby se zajišťuje jejich neustálá obnova.[1][2]
Hematopoetické kmenové buňky[editovat|editovat zdroj]
Hematopoetické kmenové buňkyobývajíkostní dřeňa mají unikátní schopnost dát vzniku všem krevním elementům. Jsou to buňky schopné sebeobnovy. To znamená, že při dělení zůstávají nadále některé dceřinébuňky kmenové,zatímco jiné se diferencují. Díky tomu nedochází k vyčerpání zásob kmenových buněk během obnovy krevních elementů. Tomuto fenoménu se říkáasymetrické buněčné dělení. [3] Buňky, které dále diferencují, dávají vzniku specializovanýmbuněčným typům,které ztrácí schopnost sebeobnovy. Důležité je zmínit, že zásoba hematopoetických kmenových buněk není homogenní populací. Můžeme je rozdělit na buňky, které jsou schopné se obnovovat dlouhodobě a buňky, které jsou schopné sebeobnovy pouze krátkodobě. Obnova hematopoetických buněk je jedním z hlavních vitálních procesů v lidském těle. [4]
Všechny krevní buňky se mohou rozdělit do hlavních tří linií:
- erytroidní linie,která zprostředkovává transport kyslíku do tkání a patří semErytrocytya Retikulocyty.
- lymfoidní linie,která je zásadní pro tvorbu adaptivní imunitní odpovědi. Jejíž vývoj zahrnuje společného předka nazývaného společný lymfoidní progenitor. Patří seT-buňky,B-buňkya jejich blízcí příbuzní.
- myeloidní linie,která umožňuje vrozenou imunitní odpověď a podílí se na odpovědi adaptivní. Jejíž vývoj zahrnuje společného předka nazývaného společný myeloidní progenitor. Patří sem granulocyty amakrofágy.
- Do žádné ze skupin jsem nezařadilmegakaryocyty,které se účastnísrážení krve.Tyto buňky jsou velmi často přesouvány mezi jednotlivými liniemi a doporučuji si vždy znovu najít současný pohled.
Místa, kde dochází ke krvetvorbě[editovat|editovat zdroj]
Ve vyvíjejícím se embryu se krevní elementy vyvíjejí v krevních shlucích a vežloutkovém váčku.Během probíhajícího vývoje dochází k přesunu krvetvorby dosleziny,jateralymfatických uzlin.Po vyvinutíkostní dřeněse sem přesune většina krvetvorby, ale během poslední fáze vývoje jsou umístěny do sekundárních lymfatických orgánů jako jebrzlík,slezina či lymfatické uzliny. V raném dětství se většina krvetvorby odehrává vdlouhých kostecha během dospívání se přesouvá do plochých kostí a páteře.[6]
Extramedulární krvetvorba
V některých případech je krvetvorba přesunuta do jater, brzlíku nebo sleziny. Děje se tak, pokud je z nějakých důvodů nemožné krvetvorbu realizovat v kostní dřeni.
Důsledkem extramedulární krvetvorby dochází ke zvětšení těchto orgánů. Přirozenou formou extramedulární krvetvorby může být zvětšení jater během fetálního období, neboť ještě nedošlo k vývoji kostní dřeně.[7]
Ostatní obratlovci
Zvláště u nižších obratlovců dochází ke krvetvorbě v jiných místech, než je kostní dřeň. Místa krvetvorby sdílí některé vlastnosti, a to jsou řídké vazivo a pomalý průtok krve. Například to jsou ledviny, slezina nebostřevo.[8]
Diferenciacekrevních buněk[editovat|editovat zdroj]
Během diferenciace procházejí buňky postupnými změnami, které reflektují změny v transkripci. Dochází ke změněexpresepovrchových proteinů, které jsou využívány pro detekci jednotlivých stádií vývoje. Vývoj je řízen růstovými a transkripčními faktory.Jako kýžený produkt vystupuje plně diferenciovaná specializovaná buňka.
Determinace vývoje
Existují dva odlišné pohledy na věc. Pro kmenové buňky a nediferenciované krevní buňky je determinace vývoje vysvětlována deterministickou teorií, která říká, že kolonie stimulující a další faktory ovlivňující determinaci, jako je specifická nika okolního prostředí, určují typ (směr) diferenciace krevních buněk. Toto je klasický pohled, ale existuje i jiná alternativní teorie, která se nazývá stochastická. Ta říká, že nediferencované kmenové buňky se diferencují zcela náhodně, ale v průběhu vývoje jsou ovlivňovány mikroprostředím, v kterém se vyvíjí a růstovými faktory, které dávají buňkám signály nutné k přežití, nebo je odsuzují k apoptóze. Pomocí takových signálů organismus reguluje vývoj buněk, které jsou v daný okamžik potřeba.[9]
Hematopoetickérůstové faktory

Vývoj červených a bílých krvinek je u zdravého člověka precizně regulován
pomocí plejády růstových faktorů. Nejenom diferenciace, ale i schopnost sebeobnovy kmenových buněk je regulovaná růstovými faktory. Jedním z klíčových hráčů pro sebeobnovu a udržování zásob kmenových buněk je stem cell factor (SCL). Nepřítomnost tohoto faktoru je letální.[12]Ale existuje velká řada dalších glykoproteinových růstových faktorů, které ovlivňují proliferacia maturaci, jako jsou například Interleuktiny IL-2,3,6,7. Tři další příklady látek, které stimulují produkci diferencovaných buněk, jsou faktory z rodiny colony-stimulating factors (CSF) a patří sem granulocyte-macrophage CSF (GM-CSF), granulocyte CSF (G-CSF) a macrophage CSF (M-CSF). Stimulují granulopoézu a působí nejen na progenitorové buňky, ale i na diferencované buňky.[13]
Erytropoetin směřuje vývoj směrem k erytrocytům atrombopoetinnaopak směřuje vývoj k megakaryocytům, které následně uvolňují fragmenty cytoplazmy, nazývanékrevní destičky.Další příklady působení jednotlivých růstových faktorů jsou ukázány na obrázku.[14][15]
Transkripční faktory
Signalizace přes růstové faktory vede k aktivaci či de-represi transkripčních faktorů. Signál, který buňka obdrží, nemá digitální charakter. To znamená, že buňka je schopna rozlišit dobu, množství i frekvenci stimulů. Například dlouhodobá exprese transkripčního faktoruPU.1vede k progresi směrem k myeloidní linii, zatímco přechodná exprese vede k vývoji nezralýcheozinofilů.[16]
Prvním klíčovým hráčem v diferenciaci z kmenových buněk na multipotentní progenitory je transkripční faktor CCAAT-enhancer binding protein alfa (C/EBPalfa). Mutace v C/EBP alfa jsou asociované sakutní myeloidní leukémií.[17]Poté je nutné rozdělit diferenciaci do dvou základních větví. První z nich je společná erytrocytům a megakaryocytům a druhá vede k lymfoidním a myeloidním prekurzorům. Zde se objevují další dva velmi důležité transkripční faktory PU.1 aGATA-1.PU.1 směřuje vývoj směrem k erytrocytům a megakaryocytům a GATA-1 směrem k lymfoidním a myeloidním prekurzorům.[18]
Dalšími transkripčními faktory jsouIkaros, Gfi1neboIRF8.Krvetvorba je ovlivňována dvěma fenomény. Prvním fenoménem je to, že se stejné transkripční faktory objevují vícekrát během ve vývoji. Například C/EBP alfa ve vývoji neutrofilů nebo PU.1 ve vývoji monocytů adendritických buněk.Druhým fenoménem je, že vývoj není jednosměrný.
Příkladem může být faktorPAX5.Je známo, že PAX5 hraje roli při vývoji B-buněk a že je asociovaný slymfomy.[19]Překvapením bylo, že pokud je v myši vyřazen tento transkripční faktor, dochází kdediferenciaci periferních B-buněk. Toto zjištění velmi změnilo pohled na úlohu transkripčních faktorů v diferenciaci. Dnes můžeme na transkripční faktory pohlížet nejenom jako na iniciátory diferenciace, ale spíše jako na důležité faktory, které udržují stav diferenciace daného buněčného typu.[20]
Mutace v transkripčních faktorech jsou úzce spjaty s rakovinami krve, jako je akutní myeloidní leukémie nebo akutní lymfoidní leukémie. Například Ikaros je znám jako regulátor mnohých biologických událostí. Myš, která nemá Ikaros, má zablokován vývoj T i B-buněk a NK buněk.[21]Ikaros má 6 domén, které jsou nazývanézinkové prsty.Čtyři z nich jsou zodpovědné za vazbu na DNA a dvě za dimerizaci.[22]Zajímavé je, že vazba na různá specifická místa na DNA je zprostředkovaná různými zinkovými prsty, což má za následek pleiotropní působení tohoto faktoru. A tak mutace v různých doménách mají odlišný efekt na onemocnění. Ikaros je asociován především s pacienty, které majíBCR-Abltranslokaci. V medicíně je používán jako znamení špatné prognózy.[23]
Erytropoéza, vznik červených krvinek[editovat|editovat zdroj]
Červené krvinkyjsou neplnohodnotné buňky, postrádající jádro. Vznikají diferenciací z prekursorové buňky, která se nazýváproerytroblast.
Proerytroblast | | Basofilní erytroblast | | Polychromatofilní erytroblast | | Ortochromatický erytroblast | | Retikulocyt | | Erytrocyt

Proerytroblast je buňka kulovitého tvaru, 15–20 μm velká. Dělením vznikají erytroblasty. Ubasofilního erytroblastuzačíná syntézahemoglobinu.Upolychromatofilního erytroblastuje již v buňce tolik hemoglobinu, že cytoplasma ztrácí basofilii.Ortochromatický erytroblastse už dále nedělí. Vyvržením jádra mimo buňku (enukleace) vzniká z erytroblastu retikulocyt.
Retikulocytje nezralá forma červených krvinek, která je už schopná plnit funkci erytrocytu. V oběhu je za normálních okolností určité množství retikulocytů, jejich podíl se může v případě nutnosti zvyšovat (např. krvácení). Za 3 dny retikulocyt uzraje ve zralou červenou krvinku.
Vývoj erytrocytů trvá asi 7 dní. Erytropoéza je ovlivňována hormony (erytropoetin,tyroxin,testosteron,estrogen,somatotropní hormon) a je při ní důležitéželezo,vitamín B12akyselina listová.
Leukopoéza, vznik bílých krvinek[editovat|editovat zdroj]
Každý typbílé krvinkyvzniká ze samostatné prekursorové buňky.Lymfocytyjsou jediné krevní elementy, které vznikají diferenciací lymfoidní multipotentní buňky, ostatní bílé krvinky vznikají v myeloidní řady.
Lymfopoéza, vývoj lymfocytů[editovat|editovat zdroj]
Část populace lymfoidních multipotentních buněk migruje dobrzlíku,kde se dále diferencují naT-lymfocyty.Zbytek lymfoidní řady zůstává v kostní dřeni a dává vzniknoutB-lymfocytům.B- a T-lymfocyty se od sebe liší jen povrchovými antigeny na buněčných membránách.
Prekursorovou buňkou jelymfoblast,ten se diferencuje na prolymfocyty. Ty se již dále nedělí a dozrávají vlymfocyty.
- lymfoblast → prolymfocyt → lymfocyt
Monocytopoéza, vznik monocytů[editovat|editovat zdroj]
Prekursorovou buňkou promonocytyjemonoblast.Ten se diferencuje na promonocyty, které se dále dělí a diferencují se na zralé monocyty. Monocyty cirkulují v krvi asi 8 hodin, potom vstupují dovaziva,kde se mění vmakrofágy.
- monoblast → promonocyt → monocyt
Granulopoéza, vývoj granulocytů[editovat|editovat zdroj]
Granulocytyvznikají z prekursorových buněk,myeloblastů.Během diferenciace granulocytů jsou syntetizována specifická granula. U myelocytů již můžeme rozlišit typ vznikajícího granulocytu (neutrofilní, basofilní, eosinofilní). Metamyelocyt se již dále nedělí a dozrává v granulocyty. Granulopoéza je ovlivňovánaendotoxinyaglukokortikoidy.
- myeloblast → promyelocyt → myelocyt → metamyelocyt → granulocyt
-
neutrofilní granulocyt
Trombopoéza, vznik krevních destiček[editovat|editovat zdroj]
Krevní destičky,trombocyty, nejsou buňkami, pouze fragmenty cytoplasmy obrovských buněk, megakaryocytů. Megakaryocyty se nacházejí v kostní dřeni. Vznikly z prekurzorové buňky, která se nazývá megakaryoblast.
Megakaryoblast → megakaryocyt → trombocyty
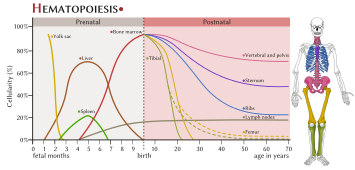
Prenatální a postnatální hematopoéza[editovat|editovat zdroj]
Shrnutí[editovat|editovat zdroj]
Při vývojiembryazačíná krvetvorba vkrevních ostrůvcíchvežloutkovém váčku,pak vjátrecha v oblasti zvanéAGM(název pro myši) a nakonec vkostní dřeni.
Hematopoéza probíhá u (dospělého) člověka v myeloidní tkáni vkostní dřenia v lymfatické tkáni vlymfatických uzlináchnebo veslezině.
Obecně se dá prenatální krvetvorba rozdělit na tři pediody:
- Mezoblastová perioda– probíhá ve žloutkovém váčku embrya
- Hepatolienální perioda– probíhá v základu jater a sleziny
- Medulární (medulolymfatická) perioda– probíhá v kostní dřeni, lymfopoéza probíhá ve slezině a lymfatických uzlinách
Embryonální vývoj[editovat|editovat zdroj]
16. den – tvorbakrevních ostrůvků(to jsou shluky krevních buněk) vežloutkovém váčku.V krevních ostrůvcích probíhá hematopoéza nejdříve. Primitivní erytrocyty (= megablasty) ve žloutkovém váčku syntetizují embryonálníhemoglobinξε.
ExpreseCD34na hematopoetických buňkách a na přilehlýchendotelovýchbuňkách. CD34 označuje předpokládanýhemangioblastv nediferencovaném žloutkovém váčku ještě dříve, než dojde ke tvorběcév(tvorba cév =angiogeneze). (U křepelky se CD34 exprimuje nejprve na endotelových buňkách a z nich se vyvinou hematopoetické buňky.)
před 19. dnem nebyly nalezeny v embryu krevní buňky (= důkaz, že krevní buňky pocházejí ze žloutkového váčku a dostanou se do embrya až cirkulací)
19. den –splanchnopleurajiž obsahuje buňky, které se vyvinou na hematopoetické (intraembryonální) kmenové buňky (dokázáno na buněčných kulturách). Pouze kmenové buňky intraembryonálního původu (později ve vývoji) dávají vznik T a B lymfocytům, kolonizují játra ve „2. kolonizaci jater “a zakládají trvalou hematopoézu.
19. den – nejvyšší frekvence krvetvorných endotelových buněk ve žloutkovém váčku.
21. den (3somitové stadium) – začíná cirkulace krve a začíná fungovatoběhová soustava. 21. den – v srdeční dutině detekovány primitivní erytrocyty (megablasty) obsahujícíglykophorin A(= důkaz, že 21. den nastává cirkulace).
22. den (10somitové stadium) – začátek vývojejater.Játra netvoří hematopoetické progenitory, ale osídlují je hematopoetické buňky ze žloutkového váčku.
23. den (12somitové stadium) – začátek krvetvorby v játrech (první kolonizace jater hematopoetickými kmenovými buňkami). Embrynální hemoglobin ξ je nahrazen fetálním hemoglobinem α. Embrynální hemoglobin ε je nahrazen fetálním hemoglobinem γ. Rozptýlené CD34 negativní buňky v játrech.
před 25. dnem potvrzeny ve žloutkovém váčku progenitory erythroidní a granulopoetické. Progenitory buněk jsou potvrzeny až už krev cirkuluje (cirkuluje od 21. dne), takže původ progenitorových buněk může býtteoretickyjak ve žloutkovém váčku tak v embryu.
27. den – na vnitřní straněendoteluaortyse objevují hematopoetické buňky (aorta má v té době dvě části) a také roztroušeně v oblasti pupečníkových (umbilikálních) artériíarteriae umbilicales.
30. den – růst shluků hematopoetických buněk v aortě a jejich výskyt také v omfalomezenterické artériiarteria omphalomesentrica.
30. den – druhá kolonizace jater hematopoetickými kmenovými buňkami.CD34(pozitivní) buňky potvrzeny v játrech.
4. týden – angio-hematopoetické progenitoryFlk-1 aVEGF-R2migrují ze splanchnopleury do subaortálního mezodermu.
4. týden – proteinBB9zjištěn na povrchu endotelových buněk aorty. Tento protein by mohl být prvním markerem hematopetických kmenových buněk (HSC) nebohemangioblastu.(Protein BB9 mají na povrchu HSC v dospělé kostní dřeni.)
4,5 týdne – ve žloutkovém váčku potvrzeny progenitory buněk CFU-GEMM, BFU-E, CFU-E a CFU-GM. Množství prgenitorů potom výrazně poklesne a úplně zmizí po 6. týdnu.
4,5 až 5. týden – pokles počtu magaloblastů v játrech. Ty jsou průběžně nahrazeny makrocyty.
35.–36. den – maximální rozvoj shluků hematopetických buněk v arteriích embrya.
5. týden – redukce počtu BFU-E ve žloutkovém váčku a zároveň vzestup počtu v játrech a v krevním řečišti
konec prvníhotrimestrua později – je detekováno více primitivních progenitorů CFU-GEMM a HPP-CFC (anglicky:high-proliferative colony forming cells)
40. den – po 40. dnu zmizí shluky hematopetických buněk v arterích
60. den – zmizení hematopoézy ve žloutkovém váčku
11. týden (od 10,5 týdne) – začíná krvetvorba vkostní dřenive specializovaných mezodermových strukturách (anglicky:primary logettes) vdiafýze.První krevní buňky v kostní dřeni jsouCD15+ myeloidní buňky a posléze takéglykoforinA+ erytrocyty. (V kostní dřeni nejsouCD34+ buňky.)
S vývojem kostní dřeně se tvoří postupně většinaerytrocytůagranulocytův kostní dřeni.
Později nastává krvetvorba ve slezině a lymfatických uzlinách. Tyto lymfoidní orgány postupně produkují většinulymfocytůamonocytů,přestože lymfoidní progenitorové buňky pocházejí z kostní dřeně.
Většina krvetvorby probíhá u dospělců v kostní dřeni vestehenní kostia také vžebrechahrudní kosti.Krvetvorba však může v případě nezbytnosti pokračovat také v játrech, brzlíku a slezině. Je to tzv. extramedulární = mimodřeňová hematopoéza. Může být příznakem závažných onemocnění, jako jeleukémie.
Hematopoéza umyši domácí[editovat|editovat zdroj]
Shrnutí:
Mezi 7–11 dnem se tvoří erythroidní a částečně také myeloidní (unipotentní) prekurzory ve žloutkovém váčku. Erytrocyty ze žloutkového váčku mají jádro (embryoblasty) a embryonálníhemoglobin.Mezi 8,5–12,5 dnem se tvořímultipotentní HSCv oblasti zvané AGM, nejdříve v tzv. sub-aortic patches. Odtudteoretickymigrují do jater a odtud takéteoretickyosidlují aortic clusters. Pak osidlují další krvetvorné orgány (brzlík, slezinu, kostní dřeň).
Chronologie:
- 7,5. den – začátek krvetvorby ve žloutkovém váčku. Žloutkový váček tvoří erythroidní a myeloidní linii. Není schopen (ani později) tvořit lymfoidní progenitory.
- 8. den – cirkulace krve mezi žloutkovým váčkem a tělem
Jak se vyvíjí krvetvorné oblasti uvnitř embrya:
- před 8. dnem – kaudální intraembryonální splanchnoleura (caudal intraembryonic splanchnoleura) (potvrzena lymfopoéza a v menší míře také myelopoéza) →
- → 8,5–10. den – anglicky: para-aortic splanchnopleura →
- → 10.–12. den – AGM. V AGM je aktivita CFU-S.
- 8,5–12,5. den –sub-aortic patches(= „sub-aortální plošky “) jsou na ventrální straně aorty a jsou umístěny přednostně pod aortic lusters. Lze je detekovat 10,5–11,5. den lépe než aortic clusters, protože sub-aortální plošky exprimujíGATA-3aAA4.1.
- 9. den – vznikjaterjako výchlipka. Játra neiniciují krvetvorbu, ale jsou (stejně jako u člověka) kolonizovány a slouží jako rezervoár hematopoetických buněk vzniklých v dřívější fázi.
- 10. den (28–32 párůsomitů) – kolonizace jater
- 10,5–11,5. den –aortic clusters(= „aortální shluky “) jsou na straně nejblíže coelomové dutiny, jsou vložené mezi endotelové buňky, např. na ventrální straně dorzální aorty. ExprimujíCD34aAA4.1(podobně jako endotelové buňky, ale postrádajívon Willebrandův faktor)
- 11. den (40–45 párů somitů) – kolonizacebrzlíku
- 11. den – konec hematopoetické činnosti ve žloutkovém váčku
- po 12. dnu je brzlík již vždy lymfoidní
- 13. den – kolonizaceslezinypomocí HSC z jater krevním oběhem
- 15. den – hematopoetické buňky kolonizujíkostní dřeňihned, jakmile se objevívaskularizacekostí.Ale jsou to progenitory pozdní fáze hematopoézy a uplatňují se až 4–5 dní po narození myši. Z nich vznikají linie pro dlouhodobou hematopoézu.
- (27. den – narození myši)
U myší hematopoetickéaortic clustersexprimujeCD45jenom několik buněk (na rozdíl od ptáků a lidí, kde jsou CD45+všechny buňky v těchto aortálních shlucích).
Odkazy[editovat|editovat zdroj]
Reference[editovat|editovat zdroj]
V tomto článku byl použitpřekladtextu z článkuHaematopoiesisna anglické Wikipedii.
- ↑Semester 4 medical lectures at Uppsala University 2008 by Leif Jansson
- ↑Parslow,T G.;Stites, DP.; Terr, AI.; and Imboden JB.Medical Immunology(1 ed.).ISBN0-8385-6278-7.
- ↑Morrison, J.; Judith Kimble.1) Asymmetric and symmetric stem-cell divisions in development and cancer.DOI:10.1038.
- ↑Morrison, SJ; Weissman, IL (1994 Nov). "The long-term repopulating subset of hematopoietic stem cells is deterministic and isolatable by phenotype.".Immunity1(8): 661–73.PMID7541305.
- ↑"http://www.ebioscience.com/resources/pathways/hematopoiesis-from-pluripotent-sem-cells.htm".Retrieved 3 February 2014.
- ↑Fernández, KS; de Alarcón, PA (2013 Dec). "Development of the hematopoietic system and disorders of hematopoiesis that present during infancy and early childhood.".Pediatric clinics of North America60(6): 1273–89.PMID 24237971.
- ↑Georgiades, CS; Neyman, EG; Francis, IR; Sneider, MB; Fishman, EK (2002 Nov). "Typical and atypical presentations of extramedullary hemopoiesis.".AJR. American journal of roentgenology179(5): 1239–43.PMID 12388506.
- ↑Zon, LI (1995 Oct 15). "Developmental biology of hematopoiesis.".Blood86(8): 2876–91.PMID 7579378.
- ↑Alenzi, FQ; Alenazi, BQ; Ahmad, SY; Salem, ML; Al-Jabri, AA; Wyse, RK (2009 Mar). "The haemopoietic stem cell: between apoptosis and self renewal.".The Yale journal of biology and medicine82(1): 7–18.PMID 19325941.
- ↑[[erytrocyt|Molecular cell biology. Lodish, Harvey F. 5. ed.: - New York: W. H. Freeman and Co., 2003, 973 s. b ill.ISBN0-7167-4366-3]]
- ↑*For the growth factors also mentioned in previous versionFile:Hematopoiesis (human) cytokines.jpg:Molecular cell biology. Lodish, Harvey F. 5. ed.: - New York: W. H. Freeman and Co., 2003, 973 s. b ill.ISBN0-7167-4366-3
- ↑Broudy, VC (1997 Aug 15). "Stem cell factor and hematopoiesis.".Blood90(4): 1345–64.PMID 9269751.
- ↑Ketley, N. J.; A. C. Newland. "Haemopoietic growth factors.".Postgrad Med J.
- ↑Molecular cell biology. Lodish, Harvey F. 5. ed.: - New York: W. H. Freeman and Co., 2003, 973 s. b ill.ISBN0-7167-4366-3
- ↑^Hauke, Ralph; Stefano R. Tarantolo (NOVEMBER 200 0). "Hematopoietic Growth Factors".LABORATORY MEDICINE.
- ↑^Engel, I; Murre, C (1999 Oct). "Transcription factors in hematopoiesis.".Current opinion in genetics & development9(5): 575–9.PMID 10508690.
- ↑^Ho, PA; Alonzo, TA; Gerbing, RB; Pollard, J; Stirewalt, DL; Hurwitz, C; Heerema, NA; Hirsch, B; Raimondi, SC; Lange, B; Franklin, JL; Radich, JP; Meshinchi, S (2009 Jun 25). "Prevalence and prognostic implications of CEBPA mutations in pediatric acute myeloid leukemia (AML): a report from the Children's Oncology Group.".Blood113(26): 6558–66.PMID 19304957.
- ↑^Fiedler, Katja; Cornelia Brunner.Mechanisms Controlling Hematopoiesis.
- ↑O'Brien, P; Morin P, Jr; Ouellette, RJ; Robichaud, GA (2011 Dec 15). "The Pax-5 gene: a pluripotent regulator of B-cell differentiation and cancer disease.".Cancer research71(24): 7345–50.PMID 22127921.
- ↑Cobaleda, C; Jochum, W; Busslinger, M (2007 Sep 27). "Conversion of mature B cells into T cells by dedifferentiation to uncommitted progenitors.".Nature449(7161): 473–7.PMID 17851532.
- ↑Wang, JH; Nichogiannopoulou, A; Wu, L; Sun, L; Sharpe, AH; Bigby, M; Georgopoulos, K (1996 Dec). "Selective defects in the development of the fetal and adult lymphoid system in mice with an Ikaros null mutation.".Immunity5(6): 537–49.PMID 8986714.
- ↑Sun, L; Liu, A; Georgopoulos, K (1996 Oct 1). "Zinc finger-mediated protein interactions modulate Ikaros activity, a molecular control of lymphocyte development.".The EMBO journal15(19): 5358–69.PMID 8895580.
- ↑^Schjerven, H; McLaughlin, J; Arenzana, TL; Frietze, S; Cheng, D; Wadsworth, SE; Lawson, GW; Bensinger, SJ; Farnham, PJ; Witte, ON; Smale, ST (2013 Oct). "Selective regulation of lymphopoiesis and leukemogenesis by individual zinc fingers of Ikaros.".Nature immunology14(10): 1073–83.PMID 24013668.
Literatura[editovat|editovat zdroj]
- Dzierzak E., Medvinsky A. & Bruijn M. de:Qualitative and quantitative aspects of haematopoietic cell development in the mammalian embryo.– Immunology Today, 19(5): 228–236 (1998).
- Godin I. & Cumano A.:Of birds and mice: hematopoietic stem cell development.– Int. J. Dev. Biol. 49: 251–257 (2005).
- Tavian M. & Péault B.:Embryonic development of the human hematopoietic system.– Int. J. Dev. Biol. 49: 243–250 (2005).
- Histologie: Cytologie a obecná histologie, Fakulta veterinárního lékařství, Brno 2000
Související články[editovat|editovat zdroj]
Externí odkazy[editovat|editovat zdroj]
 Obrázky, zvuky či videa k tématuKrvetvorbanaWikimedia Commons
Obrázky, zvuky či videa k tématuKrvetvorbanaWikimedia Commons- Tulane(anglicky)