Vigabatrin
| Vigabatrin | |
|---|---|
 | |
 | |
| Název (INN) | Sabril |
| Název podleIUPAC | (RS)-4-aminohex-5-enoic acid |
| Další názvy | γ-Vinyl-GABA |
| Kódy | |
| Číslo CAS | 60643-86-9 |
| Klasifikace ATC | N03AG04 |
| ChEMBL ID | CHEMBL89598 |
| ChemSpider ID | 5463 |
| PubChem | 5665 |
| Chemie | |
| Sumární vzorec | C6H12NO2 |
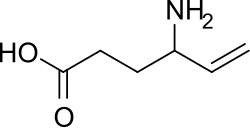
| SMILES | C=CC(CCC(=O)O)N |
| InChI | InChI=1S/C6H11NO2/c1-2-5(7)3-4-6(8)9/h2,5H,1,3-4,7H2,(H,8,9) |
| Molární hmotnost | 129.157 g/mol |
| Farmakologie | |
| Kontraindikace | Přecitlivělost na Vigabatrin, mikrokrystalickou celulosu, povidon, sodnou sůl karboxymethylškrobu, magnesium-stearát, hypromelosu, oxid titaničitý nebo makrogol 8000. |
| Cesty podání | orální |
| Biodostupnost | 80-90% |
| Vazba naproteiny | 0% |
| Metabolismus | nemetabolizovaný |
| Vylučování | renální |
| Biologický poločas | 5-8 hodin u dospívajících, u starších lidí 12-13 hodin |
| Další informace | |
| Registrace v ČR | 21/ 566/94-C |
| Dostupnost v ČR | na lékařský předpis |
| Některá data mohou pocházet zdatové položky. | |
Vigabatrin,prodávaný pod obchodní značkouSabril,je lék používaný k léčběepilepsie.Jakogenerický lékse objevil v roce 2019.[1]
Účinkuje tak, že zabraňujerozkladukyselinyy-aminomáselné(GABA). Vigabatrin, také znám jakoy-vinyl-GABA,jestrukturním analogemGABA, ale neváže se nareceptory GABA.
Lékařské využití[editovat|editovat zdroj]
Epilepsie[editovat|editovat zdroj]
V Kanadě je vigabatrin schválen pro použití v doplňkové léčbě (s jinými léky) při léčbě rezistentníepilepsie,komplexních parciálních záchvatů,sekundárních generalizovaných záchvatůa pro monoterapii přiinfantilních křečíchuWestova syndromu.
V roce 2003 byl v Mexiku vigabatrin schválen pro léčbu epilepsie, která není dostatečně kontrolována konvenční terapií (pomocná terapie nebo monoterapie), nebo k léčbě na nedávno diagnostikovaných pacientech, kteří nezkoušeli jiné prostředky (monoterapie).[2]
Rovněž bylo naznačeno využití Vigabatrinu k monoterapeutickému použití u sekundárně generalizovanýchtonicko-klonických záchvatů,parciálních záchvatůa infantilních křečích v důsledku Westova syndromu.
21. srpna 2009 společnost Lundbeck oznámila, že americká správa potravin a léčiv schválila pro vigabatrin dvě aplikace nového léku. Lék je indikován jako monoterapie u dětských pacientů ve věku jeden měsíc až dva roky sinfantilními křečemi,u nichž potenciální přínosy převažují nad potenciálním rizikem ztráty zraku, a jako přídavná (doplňková) terapie u dospělých pacientů s neustupujícími komplexními parciálními záchvaty (CPS), kteří nereagovali adekvátně na několik alternativních léčebných postupů a u nichž potenciální přínosy převažují nad rizikem ztráty zraku.
V roce 1994 Feucht a Brantner-Inthaler uvedli, že vigabatrin snížil záchvaty o 50–100% u 85% dětí sLennox-Gastautovým syndromem,které měly špatné výsledky svalproátem sodným.
Další[editovat|editovat zdroj]
Vigabatrin u zdravých dobrovolníků, kromě zvýšení hladinkortizoluaACTH,rovněž snížil příznakypanické poruchyvyvolanécholecystokinin tetrapeptidem.
Vigabatrin se také používá k léčbě záchvatů udeficitu sukcinální semialdehyddehydrogenázy(SSADHD), což je vrozený defektGABAmetabolizmu, který způsobujementální postižení,hypotonii,záchvaty,poruchy řečiaataxiihromaděním kyseliny y-hydroxybutyrové (GHB). Vigabatrin pomáhá snižovat hladiny GHB prostřednictvíminhibiceGABAtransaminázy. To se však děje pouze v mozku, na periferní GABA transaminázu nemá Vigabatrin žádný vliv, takže se GHB v těle stále hromadí a nakonec se dostane až do mozku.[3]
Vedlejší účinky[editovat|editovat zdroj]
Centrální nervový systém[editovat|editovat zdroj]
Ospalost(12,5%),bolest hlavy(3,8%), závratě (3,8%), nervozita (2,7%),deprese(2,5%), poruchy paměti (2,3%),diplopie(2,2%), agrese (2,0%),ataxie(1,9%),vertigo(1,9%),hyperaktivita(1,8%), ztráta zraku (1,6%) (viz níže),zmatení(1,4%),nespavost(1,3%), narušená koncentrace (1,2%),problémy s osobností(1,1%). Z 299 dětí se 33 (11%) stalo hyperaktivních.
U některých pacientů se během léčby vigabatrinem vyvinulapsychóza,která je častější u dospělých než u dětí. K tomu může dojít i u pacientů bez předchozího výskytu psychózy. K dalším vzácným vedlejším účinkům na CNS patří úzkost,emoční labilita,podrážděnost, třes, abnormálníchůzeaporucha řeči.
Trávicí soustava[editovat|editovat zdroj]
Bolesti břicha (1,6%), zácpa (1,4%), zvracení (1,4%) a nevolnost (1,4%).Dyspepsiea zvýšená chuť k jídlu se vyskytla u klinických studií u méně než 1% subjektů.
Celé lidské tělo[editovat|editovat zdroj]
Únava (9,2%), přibrání na hmotnosti (5,0%),astenie(1,1%).
Teratogenita[editovat|editovat zdroj]
Teratologickástudie provedená na králících zjistila, že dávka 150mg/kg/den způsobilrozštěp patrau 2 % mláďat a dávka 200mg/kg/den to způsobila v 9 %. Podle studie zveřejněné v březnu 2001 to může být způsobeno snížením hladinmethioninu.V roce 2005 byla zveřejněna studie provedená na University of Catania, která uvádí, že krysy, jejichž matky konzumovaly 250–1000mg/kg/den měly horší výkon vevodním bludištia naotevřeném poli,krysy ve skupině 750mg se narodily s podváhou a nedohnaly kontrolní skupinu a krysy ve skupině 1000mg nepřežily těhotenství.
U lidí dosud neexistují žádná kontrolovaná teratologická data.
Smysly[editovat|editovat zdroj]
V roce 2003 Frisén a Malmgren prokázali vretrospektivnístudii 25 pacientů vigabatrin v nevratně difúzníatrofiivláken nervovésítěsítnice.[4]To má největší vliv na vnější oblast (na rozdíl odmakulárnínebo centrální oblasti) sítnice.[5]Poruchy zorného pole byly hlášeny již v roce 1997 ve Velké Británii Tomem Ekem a dalšími. Někteří autoři, včetně Comaishe a dalších věří, že ztráta zorného pole a elektrofyziologické změny mohou být prokazatelné až u 50 % uživatelů vigabatrinu.
Retinální toxicitu vigabatrinu lze připsat snížení množstvítaurinu.[6]
Vzhledem k problémům s bezpečností je FDA vigabatrinovým programemREMSpovinen zajistit informovaná rozhodnutí před zahájením a zajistit odpovídající užívání tohoto léku.[7]
Interakce[editovat|editovat zdroj]
Studie publikovaná v roce 2002 zjistila, že vigabatrin způsobujestatisticky významnézvýšeníplazmatickéhoodbouráváníkarbamazepinu.[8]
V roce 1984 pánové Dr.Rimmer a Dr.Richens z University of Wales uvedli, že podávání vigabatrinu sfenytoinemsnížilo koncentraci fenytoinu v séru u pacientů s epilepsií rezistentní na léčbu.[9]O pět let později stejní dva vědci uvedli pokles koncentrace fenytoinu o 23% během pěti týdnů, a to v článku popisujícím jejich neúspěšný pokus objasnit mechanismus této interakce.[10]
Farmakologie[editovat|editovat zdroj]
Vigabatrin je nevratnýna mechanismu založený inhibitorgama-aminomáselné kyseliny aminotransferázy(GABA-AT),enzymuzodpovědném zakatabolismusGABA,který zvyšuje hladinuGABAv mozku.[11]Vigabatrin jeracemickásloučenina a jeho [S]-enantiomerje farmakologicky aktivní.
Farmakokinetika[editovat|editovat zdroj]
U většiny léčiv je eliminační poločas užitečným předvídačem dávkovacích plánů a doby potřebné k dosaženírovnovážného stavu.V případě vigabatrinu se však zjistilo, že poločas biologické aktivity je mnohem delší než poločas eliminace.
U vigabatrinu neexistuje žádné rozmezí cílových koncentrací, protože vědci nezjistili žádný rozdíl mezi hladinami sérových koncentrací respondentů a hladinami neodpovídajících. Místo toho se předpokládá, že doba působení je více funkcí rychlosti resyntézy GABA-T; hladiny GABA-T se obvykle nevracejí do normálního stavu až do šesti dnů po ukončení léčby.
Historie[editovat|editovat zdroj]
Vigabatrin byl vyvinut v 80. letech se zvláštním cílem zvýšit koncentrace GABA v mozku za účelem zastavení epileptického záchvatu. Za tímto účelem bylo léčivo navrženo tak, aby nenávratně zastavovalo GABA transaminázu, která degraduje substrát GABA. Přestože byl tento lék schválen pro léčbu ve Spojeném království v roce 1989, povolené použití vigabatrinu americkým úřadem pro potraviny a léčiva bylo ve Spojených státech do roku 2009 dvakrát odloženo. V roce 1983 to bylo zpožděno, protože pokusy na zvířatech vyvolaly intramyelinický edém, avšak účinky nebyly při pokusech na lidech zřejmé, takže konstrukce léčiv pokračovala. V roce 1997 byly zkoušky dočasně pozastaveny, protože byly spojeny s poruchami periferního zorného pole u lidí.
Společnost a kultura[editovat|editovat zdroj]
Obchodní názvy[editovat|editovat zdroj]
Vigabatrin se prodává jako Sabril v Kanadě[12]Mexiku, a ve Spojeném království.[13]Obchodní značka v Dánsku je Sabrilex. Sabril byl schválen ve Spojených státech 21. srpna 2009 a v současné době je na trhu v USA prodáván společností Lundbeck Inc., která získala v březnu 2009 amerického sponzora Ovation Pharmaceuticals. V České republice se prodává rovněž pod názvem Sabril.
Generické ekvivalenty[editovat|editovat zdroj]
Dne 16. ledna 2019FDAschválil první generickou verzi Sabrilu (vigabatrinu) ve Spojených státech.[1]
Reference[editovat|editovat zdroj]
V tomto článku byl použitpřekladtextu z článkuVigabatrinna anglické Wikipedii.
- ↑abDostupné online.
- ↑DEF Mexico: SabrilArchivováno14. 9. 2005 naWayback Machine.Diccionario de Especialdades Farmaceuticas.Edicion 49, 2003.
- ↑Dostupné online.
- ↑Frisén L, Malmgren K. Characterization of vigabatrin-associated optic atrophy.Acta Ophthalmologica Scandinavica.2003, s. 466–73.DOI10.1034/j.1600-0420.2003.00125.x.PMID14510793.
- ↑Buncic JR, Westall CA, Panton CM, Munn JR, MacKeen LD, Logan WJ. Characteristic retinal atrophy with secondary "inverse" optic atrophy identifies vigabatrin toxicity in children.Ophthalmology.2004, s. 1935–42.DOI10.1016/j.ophtha.2004.03.036.PMID15465561.
- ↑GAUCHER D; ARNAULT E; HUSSON Z. Taurine deficiency damages retinal neurones: cone photoreceptors and retinal ganglion cells.Amino Acids.November 2012, s. 1979–1993.DOI10.1007/s00726-012-1273-3.PMID22476345.
- ↑Dostupné online.[nedostupný zdroj]
- ↑SANCHEZ-ALCARAZ, Agustín; QUINTANA MB; LOPEZ E; RODRIGUEZ I; LLOPIS P. Effect of vigabatrin on the pharmacokinetics of carbamazepine.Journal of Clinical Pharmacology and Therapeutics.2002, s. 427–30.DOI10.1046/j.1365-2710.2002.00441.x.PMID12472982.
- ↑Rimmer EM, Richens A. Double-blind study of gamma-vinyl GABA in patients with refractory epilepsy.Lancet.1984, s. 189–90.DOI10.1016/S0140-6736(84)92112-3.PMID6141335.
- ↑Rimmer EM, Richens A. Interaction between vigabatrin and phenytoin.British Journal of Clinical Pharmacology.1989, s. 27S–33S.DOI10.1111/j.1365-2125.1989.tb03458.x.PMID2757906.
- ↑Long, Phillip W."Vigabatrin."Archivováno23. 4. 2006 naWayback Machine.Internet Mental Health. 1995–2003.
- ↑drugs.com Vigabatrin Drug Information
- ↑Treatments for Epilepsy - VigabatrinNorfolk and Waveney Mental Health Partnership NHS Trust
Externí odkazy[editovat|editovat zdroj]
 Obrázky, zvuky či videa k tématuvigabatrinnaWikimedia Commons
Obrázky, zvuky či videa k tématuvigabatrinnaWikimedia Commons
