Interferon



Interferony(IFN) jsou skupinoucytokinů,konkrétně patří mezi cytokiny druhé třídy spolu s interleukinem-10, interleukinem-19, interleukinem-20 a dalšími cytokiny. Hrají důležitou roli v regulacích imunitního systému,buněčné proliferaceadiferenciace,čiangiogeneze.Jedná se oglykoproteinyprodukované především buňkami imunitního systému, ale i jinými buněčnými typy jako jsou napříkladfibroblasty.Jejich syntéza je vyvolánapatogenními,nádorovýmiči mitogenními podněty. Existují tři skupiny interferonů, přičemž všechny interferony se do určité míry podílejí na antivirové odpovědi imunitního systému a svým působením na buňky v nich vyvolávají antivirový stav. Vzájemně se ale liší proteinovou sekvencí i receptorem.
Jako první byly objeveny interferony prvního typu a to v roce1957jako biomolekuly se silnou antivirovou aktivitou[1].
Typy interferonů a jejich funkce[editovat|editovat zdroj]
Byly definovány tři skupiny interferonů:interferony typu I,interferony typu IIa nedávno popsanéinterferony typu III.
Interferony typu I[editovat|editovat zdroj]
U lidí je 18 různých interferonů I. prvního typu. Největší podkupinu tvoříIFN-α,který má celkem 13 podtypů – IFN-α1, IFN-α2, IFN-α4, IFN-α5, IFN-α6, IFN-α7, IFN-α8, IFN-α10, IFN-α13, IFN-α14, IFN-α16, IFN-α17 a IFN-α21. Dále jsou u lidí IFN-β, IFN-ε, IFN-κ a IFN-ω. Geny, které je kódují jsou v lidském genomu na 9. chromosomu. Všichni členové jsoumonomerya mají silné antivirové schopnosti zahrnující inhibicivirové replikace,stimulaci aktivityNK buněk,zvýšení povrchové expreseMHC I molekula tím i prezentace antigenů cytotoxickým T buňkám (CD8+ T buňky).[2][3][4]Jejich produkce je primárně vyvolaná virovou infekcí, ale může být stimulovaná také infekcí bakteriální, zánětlivými reakcemi, UV zářením apod.[5]IFN-αaIFN-βjsou důležitými regulátoryTH2aTH17odpovědí, což může hrát důležitou roli při léčběatopiíaautoimunitních reakcí.[6]
- Rodina interferonu α(IFN-α)
Jedná se o skupinu 13glykoproteinůsyntetizovanýchleukocytypo antigenní stimulaci. Jsou kódovány bezintronovýmigenyležícími na lidskémchromozomu9 a myšímchromozomu4. Členové této rodiny mají důležitou roli v inhibici virové replikace, mají antiproliferativní schopnosti a mohou vyvolávathorečku.StimulujíNK buňkya indukují expresiMHC I molekul.Jsou většinou druhově specifické. Receptor proIFN-α(aIFN-β) je složen ze dvou podjednotek, IFNAR1 a IFNAR2.
- Interferon β(IFN-β)
Tentoglykoproteinje produkovanýfibroblastyv přímé odpovědi na virovou infekci. Jeho aminokyselinová sekvence a struktura je velmi podobnáIFN-α,sdílejí stejnýreceptora indukují v podstatě stejnésignály.Gen,který jej kóduje, se nalézá stejně jakogenyproINF-αna lidskémchromozomu9 a myšímchromozomu4. Stejně jakoIFN-αmá antivirové vlastnosti a vyznačuje se schopností navodit v buňkách virovou rezistenci.[2][3]
Interferony typu II[editovat|editovat zdroj]
Skupina interferonů typu II je tvořena pouze jedním členem, a toIFN-γ.V lidském genomu je kódován na 12. chromozomu. Jedná se ohomodimerníglykoprotein, jehož produkce cytotoxickým T buňkami,TH1buňkami neboNK buňkamije spíše než virovými stimuly indukována rozpoznáním infikované nebo atypické buňky. Jeho sekrece z buněk je výrazně zvýšená v přítomnostiIL-12aIL-18,produkovanými aktivovanými antigen-prezentujícími buňkami (APC). Stejně jakointerferony typu Imá antiproliferativní a antivirové účinky, ale na rozdíl od předchozí skupiny je schopen nejen stimulovat expresiMHC I molekul,ale u řady buněk stimuluje i expresimolekul MHC IIa tím zvyšovat prezentaci antigenů pomocným T buňkám (CD4+ T buňky). Aktivuje mononukleárnífagocytya zvyšuje jejich schopnost ničit intracelulární mikroorganismy anádorové buňky,stimulujeNK buňky,neutrofilya vaskulární endoteliální buňky.[2][3][4][7]HladinaINF-γje snížená přichronické lymfocytární leukémii,lymfomua IgA deficienci, také u lidí infikovanýchzarděnkami,EBVacyt Omega lovirem.Je kódovanýgenemna lidskémchromozomu12 a na myšímchromozomu10.ReceptorINF-γjeheterotetramerskládající se zhomodimerníchpodjednotek IFNGR1, která je důležitá pro vazbuINF-γ,a IFNGR2, jež zprostředkovává signalizaci. IFNGR byl identifikován na všech buňkách kroměerytrocytů.Dokonce ikrevní destičkyjej nesou na svém povrchu.
Interferony typu III[editovat|editovat zdroj]
Zahrnují rodinuIFN-λ(také IL-28/29), která má podobné antivirové vlastnosti jakointerferony typu I.Byla identifikována na přelomu 2002/2003. V závislosti na jejich struktuře,receptorecha biologické aktivitě se dělí na tři typy:IL-29,IL-28AaIL-28B.Všechny typy mají vliv jak na vrozenou, tak na adaptivní odpověď, a jsou produkoványleukocytyspolečně sinterferony typu Iv přímé reakci na virovou infekci.[8][9]
Funkčně jsou velmi podobnéinterferonům typu I,ale mají odlišnýreceptorageny,které je kódují, mají jinou strukturu.ReceptorIFN-λjeheterodimernía skládá se z unikátního IFN-λR1 řetězce a IL-10R2 řetězce, jenž se nachází také vreceptorovýchkomplexech proIL-10,IL-22aIL-26.Expresereceptoruje tkáňově specifická.Genykódující členy rodinyIFN-λleží na lidskémchromozomu19 a myšímchromozomu7 a na rozdíl odgenůprointerferony typu Iobsahujíintrony.Stejně jakointerferony typu Izvyšují expresiMHC I molekula mají antiproliferativní účinky.
Jejich imunomodulační funkce ještě nebyly jasně definovány, nicméně jsou důležitýmimediátoryantivirové odpovědi ve tkáníchsliznicaepitelůa hrají významnou roli v ochraněepitelugastrointestinálního traktu.Jsou aktivní v plicnímepitelua hrají významnou roli v odpovědích na respirační virové infekce.
| typ IFN | molekula | Receptorové podjednotky | Signální dráha |
|
I. |
IFN-α |
IFN-αR1, IFN-αR2 |
Jak1, Tyk2 |
| IFN-β | Stat1, Stat2, Stat3 | ||
| IFN-ε | PI3K | ||
| IFN-κ | Akt | ||
| IFN-ω | MAPK | ||
|
II. |
IFN-γ |
IFN-γR1, IFN-γR2 |
Jak1, Jak2, Stat1, Stat3, Stat5, PI3K, Akt, NFκB, MAPK |
|
III. |
IFN-λ1 |
IL-28R1, IL-10R2 |
Stat5 |
| IFN-λ2 | Jak1, Tyk2 | ||
| IFN-λ3 | Stat1, Stat2, Stat3 | ||
| IFN-λ4 |
Signalizace[editovat|editovat zdroj]
Po vazbě na své specifickéreceptoryna povrchu buněk spouští interferony kaskádu reakcí, jejichž výsledkem je stimulace exprese IFN-inducibilníchgenů,které jsou za normálních okolností umlčené nebo jsou exprimované ve velmi nízkých hladinách.Signalizační dráhyzapojené do reakcí indukovaných interferony jsou známé jakoJak/STAT dráhy.[2][4]
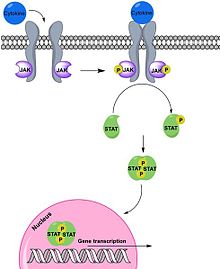
Interferony prvního typu se vážou natransmembránový receptorsložený ze dvou podjenotek[11].IFNα/β se naváže nejprve na podjednotku IFNαR2, ke které má větší afinitu a teprve poté dojde k vazbě i na druhou podjednotku. Podjednotky receptoru IFNAR pak asociují a přenáší signál dál. Transaktivují receptorové kinázytyrosin kinázTyk 2aJak 1.Ty fosforylují a tím aktivují transkripční faktorySTAT1aSTAT2(z anglického signal transducer and activator of transcription). Aktivované proteiny poté dimerizují a translokují dojádraza současného navázání DNA vázajícího proteinup48(také znám jakoIRF 9,Interferon regulatory factor 9) a vznikáheterotrimerníkomplexISGF3(Interferon stimulated gene factor 3). Komplex se váže na regulační sekvenciISRE(Interferon-sensitive response element), která se nachází ve většiněgenůindukovaných IFNα/β, a dochází ke spuštění expresegenovýchproduktů. Kromě homodimerů STAT1 a heterofimerů STAT1-STAT2 mohou při signalizaci interferonů prvního typu vznikaj i další kombinace dimerů: STAT1–STAT1, STAT3–STAT3, STAT4–STAT4, STAT5–STAT5, STAT6–STAT6, STAT1–STAT3, STAT1–STAT4, STAT1–STAT5, STAT2–STAT3 a STAT5–STAT6. Dimery se také přemisťují do jádra a tam se vážou na část promotoru ISGs zvanou interferonem gama aktivovaný element a také dochází ke spuštění exprese genových produktů.
SignalizaceIFN-γpřes receptor IFNGR je obdobná. Po vazběligandudochází kdimerizacireceptoru,transaktivacireceptorovýchtyrosin kinázJak1aJak2,kteréfosforylacídalších členůsignální kaskádyumožňují aktivaciSTAT1molekul. Následně dochází khomodimerizaciSTAT1za vzniku faktoruGAF(Gamma activated factor), disociaci odreceptorua přechodu do jádra, kde se váže naGAS(Gamma activation sequence),regulační sekvencigenůindukovanýchIFN-γ,a stimuluje expresigenovýchproduktů. IFN-λsignalizační dráhyjsou velmi podobné s drahami indukovanými IFNα/β.
Význam v léčbě[editovat|editovat zdroj]
Díky svým antivirovým vlastnostem a imunomodulačním schopnostem jsou interferony využívané v klinické praxi pro léčbu některých nemocí s větší či menší úspěšností.[7]
IFN-αse využívá při léčběhepatitidy typu CaBa má spoustu různých využití v terapiinádorů,např. v léčběB buněčné leukemie(Hairy cell leukemia),chronické myeloidní leukémieneboKaposiho sarkomu.Obchodní název léčiva je Roferon nebo Intron-A. Léčba má ovšem řaduvedlejších efektůvčetně chřipkových příznaků, depresí až sebevražd, supraventrikulární tachykardii a může dokonce dojít i k úbytkukostní dřeněa městnavému selhánísrdce.
IFN-βbyl jedním z prvních léčiv schopných navodit klinické zlepšení uroztroušené sklerózy.Obchodní názevIFN-β1apoužívaného pro léčbu je Avonex. Stejně jakoIFN-αi léčbaIFN-βmá mnohé vedlejší účinky, mezi nejčastějčí patří chřipkové symptomy, potenciálně se pak mohou vyskytnout např. poruchy nálad,alergie,křeče nebo srdeční potíže.[12]
IFN-γse používá pro léčbuchronické granulomatózní choroby(CGD), při níž nejsou schopnyfagocytyzabíjet pohlcené mikroorganismy. Má také příznivý efekt při léčběosteoporózya byl s různým stupněm účinnosti využíván k léčběHodgkinova lymfomu,kožního T buněčného lymfomuamnohočetného myelomu.Obchodní název léčiva užívaného při léčběCGDaosteoporózyje Actimmune. Tak, jako uIFN-αaIFN-βterapie, i v případě léčbyIFN-γse objevují vedlejší účinky. Běžné jsou chřipkové symptomy, mohou se ale vyskytnout závažnější poruchy včetně kardiovaskulárních onemocnění, neurologických poruch, poškozeníkostní dřeněnebo jaterních poruch.[13]
PEGylovanýIFN-λv současné době procházíklinickými studiemizaměřenými na léčbuchronické hepatitidy typu C.Bylo také prokázáno, žeIFN-λinhibujereplikaciviruhepatitidy typu Bv různých typech myších hepatocytárních linií. Díky tkáňově specifické expresi jehoreceptorůse předpokládá, že by mohl mít při podání pacientům slabší vedlejší účinky vyskytující se v mnohem menší míře než je tomu např. u terapieIFN-α.Mezi další možné aplikaceIFN-λv klinické praxi je léčba a/nebo prevence respirativních a gastrointestinálních virových onemocnění a možná iastmatu.Potenciálně by mohl být také využit pro léčbu malignit, jelikož v myšíchnádorovýchmodelech i liniíchmelanomůakolorektálního karcinomuvykazoval protinádorovou aktivitu.[8][9]
Antivirová odpověď a rezistence virů k interferonům[editovat|editovat zdroj]
V odpovědi na virovou infekci produkují buňky ovlivněné interferony předevšímprotein kinázu K(PKR) aendoribonukleázu L(RNázu L), dále molekuly regulujícíbuněčný cyklusaapoptózu.Jakokofaktorpro spuštění exprese IFN-inducibilníchproteinůfungujedsRNA.[8][9]
PKRjedimerníenzym,který po aktivacidsRNApůsobí natranslační faktorybuňky a v konečném důsledku dochází k inhibicitranslace.Podílí se také na zvýšené aktivacitranskripčního faktoruNF-κB,což vede ke zvýšené produkcicytokinů,chemokinůaMHC I molekul.Má roli i v indukci apoptotických dějů v buňce. Sám o sobě nestačí ke vzniku plnohodnotné antivirové odpovědi.
RNáza Lkatalyzuje štěpeníssRNA(včetněmRNA) a28S rRNA,čímž následně dochází k inhibicitranslaceinaktivacíribozomůa inhibicí syntézyproteinů.Hraje roli v indukciapoptózy.
Mezi dalšíenzymyuplatňující se v antivirové odpovědi patří např. také IFN-inducibilníMx proteiny,které interferují s virovou replikací,kaspázy,hrající roli v indukciapoptózy,neboADAR(dsRNA-dependentní adenosin deamináza), která vyměňuje vdsRNAadenosinzainosina tím způsobuje její rozplétání.[2]
Nedílnou roli v antivirové odpovědi mají také antiproliferativní vlastnosti interferonů. Interferony jsou schopny inhibovat růst buněk a tím ireplikaciněkterýchvirůzvýšením hladiny inhibitorůcyklin-dependentní kinázyp21, která hraje významnou roli při přechodu buňky zG1doS fáze,a důsledkem toho dochází k blokacibuněčného cyklu.
Jako další zbraň, kterou mohou interferony použít v boji proti virové nákaze je indukceapoptózybuď prostřednictvímPKRaRNázy L,nebo indukcíkaspázy 1,3,7a8.IFN-γje schopen také indukovat expresiFasaFasLmolekul.
Virová rezistence k interferonům[editovat|editovat zdroj]
Řadavirův odpovědi na IFN-indukovanou imunitní odpověď vyvinula specifické mechanismy interferující s produkcí a aktivitou interferonů. Nicméně, tato protiopatření nejsou ve většině případu schopna absolutně blokovat aktivitu interferonů a konečný výsledek reakce mezi infekcí a IFN-indukovanou odpovědí záleží na rychlosti a efektivitě, s jakou danývirusIFN-indukovanou odpověď obchází a na rychlosti vývoje a nástupu adaptivní odpovědi v těle hostitele.[2]
Jako jeden z mechanismů inhibice indukce interferonové odpovědi je u některýchvirůprodukceproteinůvázajícíchdsRNAa tím inhibice dsRNA-dependentní aktivace antivirovýchenzymů,jako jsouPKRneboRNáza L,a dsRNA-dependentní aktivace apoptotických dějů v buňce. Jinéviryzase produkují inhibitorytranskripčních faktorůpodílejících se nasignalizačních draháchinterferonů (např.NF-κB), inhibitoryapoptózy,mohou snižovat produkci hostitelskémRNAa tím inhibovat syntézuproteinůvčetně interferonů.
Další možnostívirůje inhibice interferonové signalizace. Děje se tak sekrecí virových solubilníchreceptorůpro interferony, které je vážou a blokují jejich funkce, snižováním hladinJak tyrosinových kináz,cílenímSTATmolekul k degradaci vproteasomuapod.
Reference[editovat|editovat zdroj]
- ↑Virus interference. I. The interferon.Proceedings of the Royal Society of London. Series B - Biological Sciences.1957-09-12, roč. 147, čís. 927, s. 258–267.Dostupné online[cit. 2020-01-25].ISSN2053-9193.DOI10.1098/rspb.1957.0048.
- ↑abcdefGoodbour, S., Didcock, L., Randall, R.E. (2000): Interferons: Cell Signalling, Immuno Modulation, Antiviral Responses and Virus Countermeasures.Journal of general virology,81:2341-2364.[1]PMID10993923.
- ↑abcCruse, J.M., Lewis, R.E. (2003): Atlas of immunology, 2nd edition. CRC press.ISBN0-8493-1567-0.
- ↑abcWilliams, P.E. (2003): Fundamental immunology, 5th edition. Lippincott Williams & Wilkins.ISBN0-7817-3514-9.
- ↑De Maeyer, E., De Maeyer-Guignard, J. (1998): Type I interferons.International Reviews of Immunology,17:53-73.PMID9914943.
- ↑Huber, J.P., Tartar, J.D. (2011): Regulation of effector and memory T-cell functions by type I interferon.Immunology,132:466-74.[2]PMID2132.
- ↑abGoldsby, R.A., Kindt, T.J., Osborne, B.A., Kuby, J. (2002): Immunology, 5th edition. W. H. Freeman.ISBN0-7167-4947-5.
- ↑abcKotenko, S.V. (2011): IFN-λs.Current Opinion in Immunology,23:583-90.PMID21840693.
- ↑abcLasfar, A., Abushahba, W., Murugabaskar, B., Cohen-Solal, K.A. (2011): Interferon Lambda: A new sword in cancer immunotherapy.Clinical and Developmental Immunology,2011:349575.[3]PMID22190970.
- ↑PESTKA, Sidney; KRAUSE, Christopher D.; WALTER, Mark R. Interferons, interferon-like cytokines, and their receptors.Immunological Reviews.2004-12, roč. 202, čís. 1, s. 8–32.Dostupné online[cit. 2020-01-25].ISSN0105-2896.DOI10.1111/j.0105-2896.2004.00204.x.
- ↑PLATANIAS, Leonidas C. Mechanisms of type-I- and type-II-interferon-mediated signalling.Nature Reviews Immunology.2005-05, roč. 5, čís. 5, s. 375–386.Dostupné online[cit. 2020-01-25].ISSN1474-1733.DOI10.1038/nri1604.
- ↑http:// avonex
- ↑http:// actimmune
