MHC glykoprotein II. třídy
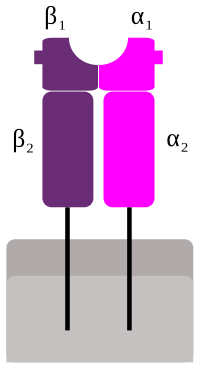
MHC glykoproteiny II. třídy(MHCII) jsou povrchovéMHCglykoproteinybílých krvinek,uplatňující se při zahájení specifickéimunitní reakce.Hlavní funkcí molekul MHCII je prezentovatT-lymfocytuexogennípeptid,odvozený od pohlcenéhoantigenu,tím T-lymfocyt aktivovat, a spustit tedy imunitní odpověď proti tomuto antigenu.
Genová exprese MHCII
[editovat|editovat zdroj]MHC glykoproteiny II. třídy jsouexprimoványpředevším profesionálnímiantigen prezentujícími buňkami(APC), mezi které patřídendritické buňky,makrofágyaB-lymfocyty.Inducibilně mohou MHCII exprimovat neprofesionální APC, např. buňkyendotelové,epitelové,nádorové a T-lymfocyty. Geny kódující MHC glykoproteiny II. třídy se nachází v hlavním histokompatibilním komplexu, který se u lidí nachází na VI. a u myší na XVII.chromosomu.Lidé exprimují tři izotypy MHCII (HLA-DP, HLA-DQ a HLA-DR), zatímco myši pouze dva (I-A a I-E).
Struktura
[editovat|editovat zdroj]MHCII se skládá ze dvou řetězců, α a β. Na rozdíl od podjednotekMHC I,oba jsou přibližně stejně velké, okolo 30kDa.Oba dva jsou také zakotveny vmembráněa spolu vytvářejí vazebné místo pro peptid, jejž prezentují. Toto MHC II dokáží vázat peptid obvykle o délce 15-35aminokyselin,ale i delší, což je podstatně více, než u MHCI. To je dáno tím, že žlábek, do nějž se peptid váže, není na koncích uzavřený, ale otevřený, takže peptid může na koncích přesahovat ven.[1]Samotná vazba peptidu se odehrává na srovnatelné délce peptidu.
Antigenní prezentace
[editovat|editovat zdroj]Na molekulách MHCII jsou prezentovány hlavně peptidy exogenního původu. Antigeny, ze kterých tyto peptidy vznikají, jsouendocytoványa na MHCII se vážou v buňce. Mezi mechanizmy endocytózy, využívané antigen prezentujícími buňkami, patřífagocytóza,makropinocytóza,endocytóza zprostředkovaná receptorema endocytóza závislá naklathrinunebokaveolinu.Endocytovaný antigen je transportován do specializovaných pozdníchendozómů,zvaných také MIIC kompartmenty (MHCII rich compartments). Sem také zGolgiho aparátupřichází MHCII molekuly v komplexu s dalším transmembránovým proteinem, zvaným invariantní řetězec (Ii), který se na ně navázal už vendoplasmatickém retikulu.Funkcí Ii je bránit navázání endogenních peptidů na MHCII během jeho cestysekretorickou drahou.V MIIC kompartmentu jsou pohlcený antigen a Iiproteolyticky štěpenya zbytek Ii na MHCII je za pomoci proteinu HLA-DM vyměněn za peptidový fragment, pocházející z antigenu. Komplex peptid-MHCII je následně transportován na povrch buňky, kde je antigen prezentován na THlymfocytu. Na MHCII mohou být však kromě exogenních peptidů vystavovány i peptidy endogenního původu. Může se jednat o peptidy, pocházející z proteinů rezidentních v endozomálním systému nebo z proteinů, transportovaných tímto systémem dolyzozómů.Na MHCII se také mohou dostat organizmu vlastní peptidy, pocházející z fagocytovanýchapoptotických tělísekneboautofagozómů.[2]
Interakce
[editovat|editovat zdroj]Pro aktivaci T-lymfocytů je zásadní interakce MHCII sT-buněčným receptorem(TCR) a s jeho koreceptoremCD4(pro MHCI je toCD8). TCR rozeznává MHC v místě navázaného peptidu. Pro úspěšnou aktivaci T-lymfocytu tak musí specificky rozeznat nejen MHC, ale i peptid exogenního původu, což je principem reakce napatogenyv organismu. CD4 se na MHCII váže bez ohledu na navázaný peptid a umožňuje, aby na MHCII reagovala jen ta podmnožina T-lymfocytů, která CD4exprimuje,tedypomocné T-lymfocyty(THlymfocyty, CD4+T-lymfocyty). Navíc je k aktivaci T-lymfocytu potřeba ještěkostimulacepomocíCD28,který exprimují pouze APC aktivované signálem nebezpečí, například pomocíToll-like receptorů.Bez této kostimulace T-lymfocyt přechází doanergieneboapoptózy.
Imunologická synapse
[editovat|editovat zdroj]Rozezná-li CD4+ T-lymfocyt pomocí svého antigenního receptoru (TCR) komplex MHCII s peptidem na povrchu APC, dojde k jejich vazbě a následnému vzniku molekulární struktury mezi APC a T-lymfocytem, která se nazývá imunologická synapse (IS). IS lze rozdělit centrální a periferní oblast, respektive cSMAC a pSMAC (supramolecullar activation cluster). Ústředními molekulami cSMAC jsou MHCII a TCR s koreceptorem CD4. Dále je zde molekulaCD40na APC straně IS a její ligandCD40L(= CD154) na T-lymfocytární straně. V cSMAC na T-lymfocyty se také nachází kostimulační molekula CD28, která interaguje s molekulouCD80neboCD86na povrchu APC. Periferii IS (pSMAC) tvoří kruh adhezivních molekulICAMaLFA-1,důležitých pro stabilitu IS. Součástí IS jsou takécytoplasmatickémolekuly lokalizované pod membránou. Patří mezi ně proteiny účastnící sesignalizace,vedoucí z receptorů v IS (např.protein kináza Cθ neboLck), a regulacecytoskeletu(v T-lymfocytu je do IS orientovánomikrotubulyorganizující centrum– MTOC).[3][4]
IS může být strukturou různě stabilní (interakce trvá několik minut až hodin), což je ovlivněno mírou zralosti T-lymfocytu, druhem APC, množstvím antigenu prezentovaného na MHCII a komplexitou prostředí, kde se interakce odehrává. IS může být také do různé míry uspořádaná. Nejvyšší uspořádaností se vyznačuje stabilní monocentrická synapse s přesně vymezeným cSMAC a pSMAC. Od monocentrické IS je pak odvozena sekreční synapse, v jejímž středu se kromě cSMAC nachází další doména, kde probíháexocytózaaktivních molekul, jako jsoucytokinynebogranzymyaperforiny.Sekreční synapse je například mezi B-lymfocytem a pomocným T-lymfocytem, který sekretuje cytokiny přispívající k vývoji B-lymfocytu vplazmatickou buňkuprodukujícíprotilátky.Mezi T lymfocytem a APC mohou dále vznikat méně uspořádané synapse, tzv. multicentrické IS, nebo synapse, kde rozdělení molekul do cSMAC a pSMAC chybí.[5]
Signalizace MHCII
[editovat|editovat zdroj]Kromě své klasické funkce prezentovat antigen T-lymfocytu slouží MHCII také jako receptor zprostředkovávající signalizaci vedoucí do APC, a ovlivňující tak její další osud. Stimulace MHCII na povrchu dendritických buněk je důležitá pro jejich zrání, produkci cytokinů a podporuje transport komplexů peptid-MHCII na povrch buňky.[6]U B-lymfocytů byla po stimulaci MHCII pozorována jejichproliferace,produkce protilátek a zvýšeníadhezivityk T-lymfocytu a exprese kostimulačních molekul CD80 a CD86. Signalizace zprostředkovaná MHCII může tedy vést k proliferaci adiferenciaciAPC. Po stimulaci MHCII může být ale také spuštěna apoptóza APC, a signalizace MHCII se tedy může podílet jak na zahájení, tak i na ukončení imunitní odpovědi.[6][7][8][9][10]
Mezi signalizační události po stimulaci MHCII patří: aktivace proteinových kináz z rodinySrcaSyk,protein kinázy C,MAP kinázErkap38,fosfatidylinositol-3 kinázy,fosfolipázy Cγ a mobilizace vápníku.[6][5] Signalizace MHCII také vede k aktivacitranskripčních faktorůNFATaAP-1.[11]
MHCII má jen velmi krátkou intracelulární část bez signalizačních motivů, a pro přenos signálu z MHCII do buňky je tedy nutná asociace s další signalizační molekulou. Mezi molekuly zprostředkovávající signalizaci MHCII patříCD19,CD20,MPYSaheterodimer Igα/Igβ(=CD79a/CD79b), jehož hlavní funkcí je zprostředkování signalizace BCR.[11][12][13][14] Signalizace MHCII je spouštěna především vazbou TCR při prezentaci antigenu. MHCII může být ale také stimulován vazbousuperantigenu,molekulyLAG-3(=CD223) nebo protilátky proti MHCII, čehož se využívá hlavně experimentálně.[6]
Onemocnění spojená s MHCII
[editovat|editovat zdroj]Porucha exprese MHCII způsobuje závažnouimunodeficienci,která se nazývá MHCII deficience nebo také syndrom holých lymfocytů. Nepřítomnost MHCII v imunitním systému vede k poruše vývoje CD4+ T-lymfocytů. Vthymutotiž nemůže docházet k jejichpozitivní selekcirozeznáním komplexu peptid-MHCII nathymocytechprezentujících antigen a i když se malé množství CD4+ T-lymfocytů přesto vyvine, nemůže být následně aktivováno antigen prezentujícími buňkami, protože ani ty MHCII neexprimují. Deficit CD4+ T-lymfocytů následně vede k poruše tvorby protilátek, protože B-lymfocyty nedostávají od CD4+ T-lymfocytů pomocný signál. Deficience MHCII není způsobena mutací v genu pro MHCII glykoprotein samotný, ale mutacemi v genech pro jeho transkripční faktory, a to CIIT (MHC class II transactivator), RFXANK, RFX5 nebo RFXAP.
MHCII glykoproteiny hrají také důležitou roli při vznikuautoimunitních onemocnění,některéalelyMHCII totiž zvyšují sklon k rozvoji těchto chorob.
| Onemocnění | Alela |
|---|---|
| Goodpastureův syndrom | HLA-DR2 |
| Roztroušená skleróza | HLA-DR2 |
| Gravesova choroba | HLA-DR3 |
| Myasthenia gravis | HLA-DR3 |
| Systémový lupus erythematodes | HLA-DR3 |
| Diabetes mellitus typu I | HLA-DR3/DR4 |
| Revmatoidní artritida | HLA-DR4 |
| Pemphigus vulgaris | HLA-DR4 |
| Hashitomova tyroiditida | HLA-DR5 |
Reference
[editovat|editovat zdroj]- ↑abHOŘEJŠÍ, Václav; BARTŮŇKOVÁ, Jiřina.Základy imunologie.Praha: Triton, 2009. 320 s.ISBN9788073872809.
- ↑TROMBETTA, E. Sergio; MELLMAN, Ira. CELL BIOLOGY OF ANTIGEN PROCESSING IN VITRO AND IN VIVO. S. 975–1028.Annual Review of Immunology[online]. 2005-04 [cit. 2020-12-10]. Roč. 23, čís. 1, s. 975–1028.DOI10.1146/annurev.immunol.22.012703.104538.PMID15771591.(anglicky)
- ↑BOISVERT, Judie; EDMONDSON, Samuel; KRUMMEL, Matthew F. Immunological Synapse Formation Licenses CD40-CD40L Accumulations at T-APC Contact Sites. S. 3647–3652.The Journal of Immunology[online]. 2004-09-15 [cit. 2020-12-10]. Roč. 173, čís. 6, s. 3647–3652.DOI10.4049/jimmunol.173.6.3647.(anglicky)
- ↑THAULAND, Timothy J.; PARKER, David C. Diversity in immunological synapse structure: Immunological synapse diversity. S. 466–472.Immunology[online]. 2010-12 [cit. 2020-12-10]. Roč. 131, čís. 4, s. 466–472.Dostupné online.DOI10.1111/j.1365-2567.2010.03366.x.(anglicky)
- ↑FRIEDL, Peter; DEN BOER, Annemieke Th.; GUNZER, Matthias. Tuning immune responses: diversity and adaptation of the immunological synapse. S. 532–545.Nature Reviews Immunology[online]. 2005-07 [cit. 2020-12-10]. Roč. 5, čís. 7, s. 532–545.Dostupné online.DOI10.1038/nri1647.PMID15999094.(anglicky)
- ↑abcdAL-DACCAK, Reem; MOONEY, Nuala; CHARRON, Dominique. MHC class II signaling in antigen-presenting cells. S. 108–113.Current Opinion in Immunology[online]. 2004-02 [cit. 2020-12-10]. Roč. 16, čís. 1, s. 108–113.DOI10.1016/j.coi.2003.11.006.PMID14734118.(anglicky)
- ↑TABATA, Hiroki; MATSUOKA, Takako; ENDO, Fumio; NISHIMURA, Yasuharu; MATSUSHITA, Sho. Ligation of HLA-DR Molecules on B Cells Induces Enhanced Expression of IgM Heavy Chain Genes in Association with Syk Activation. S. 34998–35005.Journal of Biological Chemistry[online]. 2000-11-10 [cit. 2020-12-10]. Roč. 275, čís. 45, s. 34998–35005.Dostupné online.DOI10.1074/jbc.M002089200.(anglicky)
- ↑MOURAD, Walid; GEHA, Raif S; CHATILA, Talal. Engagement of major histocompatibility complex class II molecules induces sustained, lymphocyte function-associated molecule 1-dependent cell adhesion.. S. 1513–1516.Journal of Experimental Medicine[online]. 1990-11-01 [cit. 2020-12-10]. Roč. 172, čís. 5, s. 1513–1516.Dostupné online.DOI10.1084/jem.172.5.1513.PMID2230655.(anglicky)
- ↑NABAVI, N.; FREEMAN, G. J.; GAULT, A.; GODFREY, D.; NADLER, L. M.; GLIMCHER, L. H. Signalling through the MHC class II cytoplasmic domain is required for antigen presentation and induces B7 expression. S. 266–268.Nature[online]. 1992-11 [cit. 2020-12-10]. Roč. 360, čís. 6401, s. 266–268.Dostupné online.DOI10.1038/360266a0.PMID1279442.(anglicky)
- ↑NASHAR, Toufic O.; DRAKE, James R. Dynamics of MHC Class II-Activating Signals in Murine Resting B Cells. S. 827–838.The Journal of Immunology[online]. 2006-01-15 [cit. 2020-12-10]. Roč. 176, čís. 2, s. 827–838.DOI10.4049/jimmunol.176.2.827.(anglicky)
- ↑abBOBBITT, Kevin R.; JUSTEMENT, Louis B. Regulation of MHC Class II Signal Transduction by the B Cell Coreceptors CD19 and CD22. S. 5588–5596.The Journal of Immunology[online]. 2000-11-15 [cit. 2020-12-11]. Roč. 165, čís. 10, s. 5588–5596.Dostupné online.DOI10.4049/jimmunol.165.10.5588.PMID11067914.(anglicky)
- ↑LÉVÉILLE, Claire; CASTAIGNE, Jean-Gabriel; CHARRON, Dominique; AL‐DACCAK, Reem. MHC class II isotype-specific signaling complex on human B cells. S. 2282–2291.European Journal of Immunology[online]. 2002 [cit. 2020-12-11]. Roč. 32, čís. 8, s. 2282–2291.Dostupné online.DOI10.1002/1521-4141(200208)32:8<2282::AID-IMMU2282>3.0.CO;2-M.PMID12209641.(anglicky)
- ↑JIN, Lei; WATERMAN, Paul M.; JONSCHER, Karen R.; SHORT, Cindy M.; REISDORPH, Nichole A.; CAMBIER, John C. MPYS, a Novel Membrane Tetraspanner, Is Associated with Major Histocompatibility Complex Class II and Mediates Transduction of Apoptotic Signals. S. 5014–5026.Molecular and Cellular Biology[online]. 2008-08-15 [cit. 2020-12-11]. Roč. 28, čís. 16, s. 5014–5026.Dostupné online.DOI10.1128/MCB.00640-08.PMID18559423.(anglicky)
- ↑JIN, Lei; STOLPA, John C.; YOUNG, Ryan M.; PUGH-BERNARD, Aimee E.; REFAELI, Yosef; CAMBIER, John C. MHC class II structural requirements for the association with Igα/β, and signaling of calcium mobilization and cell death. S. 184–194.Immunology Letters[online]. 2008-03 [cit. 2020-12-11]. Roč. 116, čís. 2, s. 184–194.Dostupné online.DOI10.1016/j.imlet.2007.11.023.PMID18194817.(anglicky)
- ↑Murphy, K.M., P. Travers, and M. Walport, Janeway's Immunobiology2011: Garland Science.
Externí odkazy
[editovat|editovat zdroj] Obrázky, zvuky či videa k tématuMHC glykoprotein II. třídynaWikimedia Commons
Obrázky, zvuky či videa k tématuMHC glykoprotein II. třídynaWikimedia Commons
