Monosacharidy

Monosacharidy(z řečtinymonos:jednoduchý,[zdroj?!]sacchar:cukr) jsou základnísacharidy,které již nelze dále dělit na jednodušší. Jsou základní stavební jednotkou všech složitějších sacharidů –oligosacharidůapolysacharidů.Monosacharidy jsou typicky krystalické látky dobře rozpustné ve vodě a v polárních rozpouštědlech. Monosacharidy jsou chirální sloučeniny, to znamená, že jsou opticky aktivní a stáčejí rovinurovinně polarizovaného světla.
Monosacharidy s aldehydovou skupinou se nazývajíaldosy,s ketoskupinouketosy.Podle počtu uhlíků se dělí natriosy,tetrosy,pentosyahexosy.Shoda konfigurace na posledním chirálním uhlíku s konfiguracíD- neboL-glyceraldehyduurčuje příslušnost monosacharidu do konfigurační řadyDneboL.Názvosloví monosacharidů se tvoří pomocí konfiguračních přepon, které označují relativní konfiguraci nachirálních centrechmolekuly.
V roztoku existují převážně v cyklických formách, přičemž formy s pětičlenným kruhem označujeme jako furanosy a šestičlenné kruhy nazýváme pyranosy. Při uzavření cyklické formy dochází k vzniku dvouanomerů,které rozlišujeme za pomoci anomerních konfiguračních symbolů α a β. Pyranosy se v roztoku nejčastěji vyskytují v židličkovýchkonformacích,furanosy jsou konformačně flexibilnější a preferují obálkové konformace.
Monosacharidy bývají obecně ne zcela přesně nazýványcukry,jako cukry však označujeme jensacharidysladké chuti, tedy i většinu monosacharidů. Monosacharidy hrají důležitou roli v primárním i sekundárnímmetabolismu,vznikají v zelených rostlinách v procesufotosyntézya v organickésyntézeslouží jako zásobárnachirálníchsloučenin.
O rozvoj chemie monosacharidů se výrazně zasloužil německý chemikHermann Emil Fischer(1852–1919), který uskutečnil první totální syntézuD-glukosyzformaldehydu[1]a zavedl základní nomenklaturu sacharidů[2].Z českých chemiků se v chemii sacharidů nejvíce realizovalEmil Votoček[3][4](1872–1945).
Struktura a názvosloví
[editovat|editovat zdroj]Monosacharidy lze chemicky definovat jakopolyhydroxyderivátykarbonylových sloučenin(aldehydůneboketonů).[5]To znamená, že v jejich molekule je přítomna karbonylová skupina a zároveň jedna nebo více skupin hydroxylových. Monosacharidy obsahující karbonyl ve formě aldehydové skupiny jsoualdosy,zatímco monosacharidy s ketoskupinou se nazývajíketosy.Podle počtu uhlíků v řetězci se monosacharidy dělí natriosy(3),tetrosy(4),pentosy(5),hexosy(6),heptosy(7) aoktosy(8). Monosacharidy s devíti a více uhlíky jsou vzácné a v přírodě se téměř nevyskytují.
Tyto dvě hlediska můžeme uplatnit při tvorbě obecného názvu skupiny monosacharidů, např. aldehydické monosacharidy se 6 atomy uhlíku se nazývají aldohexosy, ketonické monosacharidy se 4 atomy uhlíku jsou ketotetrosy.
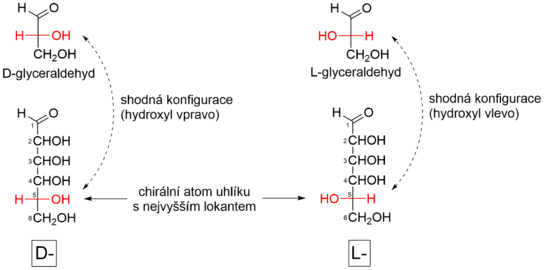
Zařazení doD- aL-řady
[editovat|editovat zdroj]Příslušnost monosacharidů doD- neboL-řady je určena shodoukonfiguracena konfiguračním atomu monosacharidu (chirální atom uhlíku s nejvyššímlokantem,tedy nejvzdálenější od karbonylové skupiny) s konfigurací chirálního atomu uhlíkuD- neboL-glyceraldehydu.[5][6]Zařazení do konfigurační řady závisí tedy pouze na konfiguraci na chirálním uhlíku s nejvyšším lokantem a konfigurace na ostatních chirálních centrech je lhostejná. Monosacharidy číslujeme tak, aby ualdosměl uhlík karbonylové skupiny vždy lokant 1, uketosmusí být lokant tohoto uhlíku co možná nejnižší.[7]
Například ualdohexosje zařazen monosacharid doD- neboL-řady tak, že porovnáme konfiguraci na atomu C-5 s konfigurací chirálního atomu uhlíkuD- neboL-glyceraldehydu. Je-li konfigurace na C-5 shodná s konfiguracíD-glyceraldehydu (hydroxyl na C-5 směřuje veFischerově projekcidoprava), jedná se o sacharid řadyD(dexter= napravo). Shoduje-li se naopak s konfiguracíL-glyceraldehydu (hydroxyl na C-5 směřuje ve Fischerově projekci doleva), patří sacharid do konfigurační řadyL(laevo= nalevo). Analogicky postupujeme u jakéhokoliv monosacharidu. Konfigurační symbolyDaLpíšeme malou kapitálkou.
Postup pro zařazení monosacharidu do konfigurační řady:
- Zakreslení monosacharidu ve Fischerově projekci a správné očíslování.
- Nalezení konfiguračního atomu (chirální atom uhlíku s nejvyšším lokantem).
- Směřuje-li hydroxylová skupina na konfiguračním atomu doprava, jedná se o řaduD.Směřuje-li doleva, jedná se o řaduL.
Konfigurační předpony
[editovat|editovat zdroj]Názvosloví monosacharidů je odvozeno od otevřených (acyklických) forem monosacharidů promítnutých veFischerově projekcia jeho základem jsou tzv. konfigurační předpony.[6]Tyto předpony popisují vzájemné postavení (relativní konfiguraci) dvou a více hydroxylových skupin v molekule. Spolu s konfiguračním symbolemDneboLlze pak definovat absolutní konfiguraci daného monosacharidu. Konfigurační předponyaldosjsou odvozeny odglyceraldehydupostupným přidáváním dalšího asymetrického uhlíku. Každým dalším přidaným „patrem “vzniká řada monosacharidů o jeden uhlík delší, přičemž z každého monosacharidu vznikají vždy dvě prodloužené aldosy lišící se konfigurací na nově přidaném chirálním centru.
Tímto způsobem lze dospět až k osmialdohexosámv jedné konfigurační řadě, název delších monosacharidů (7 atomů uhlíku a více) je tvořen složením dvou konfiguračních předpon. Na uvedeném schématu je znázorněno odvození aldos řadyDaž po šestičlenné monosacharidy. ŘadaLje odvozena analogicky, přičemžL-monosacharid lze získat z příslušnéhoD-monosacharidu obrácením konfigurace na všech chirálních centrech. Dva monosacharidy se stejným názvem lišící se pouze konfiguračním symbolemDaLjsou navzájemenantiomery.Konfigurační předpony se uvádí kurzívou a oddělují spojovníkem.
Systematický názevmonosacharidu je tvořen tedy například takto:D-gluko-hexosa, z praktických důvodů se často používají triviální názvy, např.D-glukosa, kde už kurzívu nepoužíváme.

Cyklické formy
[editovat|editovat zdroj]Ve skutečnosti se monosacharidy málokdy vyskytují v lineárních formách. V roztoku existují převážně v cyklických formách a v krystalickém stavu se v těchto formách nacházejí zcela výlučně.[8][9]Cyklická forma monosacharidu vzniká intramolekulární reakcí jedné z hydroxylových skupin skarbonylemza tvorbyhemiacetalového(v případěaldos) nebohemiketalového(v případěketos) uskupení. Tato reakce je zcela analogická klasické tvorběhemiacetalurovnovážnou reakcíalkoholuskarbonylovou sloučeninou,avšak v případě cyklizace monosacharidu reakce probíhá spontánně i bez kyselékatalýzy.[7]
Při tvorbě cyklických forem monosacharidů dochází nejčastěji ke vzniku pětičlenného (tetrahydrofuranového) nebo šestičlenného (tetrahydropyranového) kruhu. Tyto struktury proto nazýváme furanosy resp. pyranosy. Jednotlivé formy monosacharidu (lineární a cyklické formy) mezi sebou mohou v roztoku přecházet procesem zvanýmmutarotace.[10]

Uzavřením kruhu vzniká na uhlíku, který původně neslkarbonylovou skupinu,novéchirální centrum,které nazýváme anomerní centrum (uplatňuje se zdeanomerní efekt). Dvaisomery,které mohou na anomerním centru vzniknout, se označují jako anomery a liší se orientací hemiacetalové (anomerní) hydroxylové skupiny.
Pro vymezení konfigurace na anomerním centru používáme anomerních konfiguračních symbolů α a β. Tyto symboly udávají relativní konfiguraci vůči anomernímu referenčnímu atomu, který je pro monosacharidy o maximálně šesti atomech uhlíku totožný s konfiguračním atomem, tedy je to chirální atom uhlíku s nejvyšším lokantem. Pro monosacharidy delší než 6 atomů uhlíku (jejich název je tvořen více než jednou konfigurační předponou) je nomenklatura složitější. Anomer α nese na anomerním centru shodnou konfiguraci jako na konfiguračním atomu, anomer β opačnou.[5][6]
OdvozeníHaworthova vzorcecyklické formy monosacharidu zFischerovy projekcelineární formy se provádí pomyslným otočením Fischerovy projekce o 90 ° po směru hodinových ručiček v rovině nákresny a následným ohnutím koncových atomů řetězce za nákresnu.[11]Atom uhlíku nesoucíhydroxylovou skupinu,která atakujekarbonyl,je poté zapotřebí před uzavřením kruhu vhodně pootočit, přičemž acyklickická část se tím zorientuje pod nebo nad rovinu kruhu v závislosti na konfiguraci na tomto atomu uhlíku (nezáleží na tom, jestli se jedná o sacharid řadyDneboL).
Výsledkem je, že hydroxylové skupiny, které byly ve Fischerově projekci na pravé straně řetězce, jsou v cyklické formě orientovány pod rovinu kruhu a hydroxylové skupiny, které byly na levé straně, směřují nad rovinu kruhu. Orientace acyklické části monosacharidu v cyklické formě závisí na orientaci hydroxylu, přes který dochází k cyklizaci. Lze říci, že směřuje-li tento hydroxyl ve Fischerově projekci doprava, potom acyklická část bude směřovat v cyklické formě nad rovinu kruhu.
Obsahuje-li acyklická část monosacharidu chirální centrum, pak se tato část většinou znázorňuje ve Fischerově projekci.[12]Cyklická forma monosacharidu lze znázornit vTollensově vzorci,kde lze rozlišit způsob cyklizace a konfiguraci na anomerním centru.

Rozlišení α nebo β anomeru lze nejsnáze provést z Tollensova vzorce, kde je patrná konfigurace na anomerním centru (jedná se v podstatě o Fischerovu projekci cyklické formy). Je-lihydroxylna konfiguračním uhlíku na stejné straně řetězce jako atom kyslíku vázaný na anomerní centrum (cisuspořádání), jedná se o anomer α, jsou-li tyto skupiny uspořádánytrans,jedná se o anomer β.[5]
Obecný postup pro rozlišení α/β anomerů pro monosacharidy do šesti uhlíků[pozn. 1]:
- Zakreslení monosacharidu do Tollensova vzorce. Hydroxylové skupiny směřující pod kruh budou vpravo a hydroxyly směřující nad kruh budou vlevo.
- Nalezení konfiguračního atomu (chirální atom uhlíku s nejvyšším lokantem). Tento atom může, ale nemusí být součástí kruhu.
- Porovnání konfigurace na konfiguračním atomu s konfigurací na anomerním centru. Je-li uspořádánícis,jedná se o α-anomer. Je-li uspořádánítrans,jedná se o β-anomer.

Optická aktivita
[editovat|editovat zdroj]Kromědihydroxyacetonujsou monosacharidyopticky aktivnísloučeniny, obsahují alespoň jednochirální centrum.Stáčí tedy rovinupolarizovaného světlao určitý úhel doleva (levotočivé, (−)) nebo doprava (pravotočivé, (+)). Čím delší je uhlíkatý řetězec sacharidu, tím více obsahuje chirálních center. Molekula snchirálními centry se může vyskytovat v počtu 2noptických izomerů.[6]
| Řada | D-glyceraldehyd | L-glyceraldehyd |
|---|---|---|
| Fischerova projekce | 
|

|
| Prostorové uspořádání | 
|
|
| Optická aktivita | pravotočivý (+) | levotočivý (−) |
Po vzoru glyceraldehydu se všechny monosacharidy dělí do zmíněných dvou řad. Sacharidy s hydroxylem na posledním chirálním centru veFischerově projekcivpravo se označujíD-, vlevo jakoL-. Většina běžně se vyskytujících přírodních monosacharidů patří doD-řady. Ačkoliv příslušnost doDneboL-řady nesouvisí se skutečným směrem otáčení roviny polarizovaného světla, je většinaD-monosacharidů pravotočivá (+).[13]
Dvěma enantiomerům přiřazujeme stejný triviální název, lišící se jen stereodeskriptoremD- čiL-. Tak například existují čtyři (22)aldotetrosy,a toD-erythrosa,L-erythrosa,D-threosa,L-threosa.Aldopentosjiž existuje osm (23),aldohexosšestnáct (24).Ketosje obecně méně, protože mají méně chirálních center. Nejjednodušší ketosa jedihydroxyaceton,který neobsahuje dokonce vůbec žádné chirální centrum. Ketotetrosy jsou dvě, ketopentosy čtyři, ketohexos máme osm.
Dělení podle biochemické funkce
[editovat|editovat zdroj]Primární monosacharidy
[editovat|editovat zdroj]Mezi primární monosacharidy, tj. sacharidy, které jsou produkty primárníhometabolismuve valné většině organismů, patří kupodivu jen poměrně malý počet monosacharidů. Jsou to jednaktriosyD-glyceraldehydadihydroxyaceton,které jsou součástí životně nezbytnéglykolýzy.[14]Ztetrosse v organismech běžně vyskytuje pouzeD-erythrosa,která je ve formě fosfátu meziproduktem neméně důležitéhopentosového cyklua u rostlin navícCalvinova cyklu,který je součástí temnostní fázefotosyntézy.Pentosyjsou pro primární metabolismus důležité tři, a to jednakD-ribosa,složkakyseliny ribonukleové,a2-deoxy-D-ribosa,složkakyseliny deoxyribonukleové.Kromě těchto dvou je dále důležitáD-ribulosa,jejíž deriváty jsou důležité při přeměnách sacharidů a přifotosyntéze.
Konečně zhexosjsou důležitéD-glukosa(hroznový cukr, dextrosa), hojně se vyskytující v plodech, aD-fruktosa(ovocný cukr, levulosa), která se získává nejčastěji zpolysachariduinulinu.[15]Tyto nejznámější hexosy tvoří součástglykolýzya jsou často základní stavební jednotkou mnohýcholigosacharidů,polysacharidůaglykosidů.
Sekundární monosacharidy
[editovat|editovat zdroj]Sekundární monosacharidy jsou látky, které nejsou ve většiněorganismůsoučástí základníhometabolismua jejich přítomnost tedy není probuňkunezbytně nutná. Jsou součástí sekundárníhometabolismu.[16]Význam těchto monosacharidů je velice rozmanitý – mohou tvořit součást některýchpolysacharidů,glykosidůčiglykolipidů,aminosacharidy jsou součástíbuněčné stěnybakterií,sacharidy s větveným řetězcem mohou být součástíantibiotik.[17]
Sekundární monosacharidy tvoří velice širokou skupinu látek. Patří sem především:
- Monosacharidy s netypickou konfigurací
Do této skupiny patří několik základních monosacharidů, které nejsou součástí základních metabolických drah. Patří sem i monosacharidy neobvykléL-řady. Je to zejménaL-arabinosa,D-xylosa,D-mannosa,D-galaktosaaD-gulosa.
Tyto sacharidy jsou v organismu syntetizovány zvláštní reakcí zvanouepimerizace,která je katalyzována ji enzymy ze skupinyepimeras.[18]Při epimerizaci dochází ke změně konfigurace na jediném chirálním centru, vznikají epimery (isomerylišící se konfigurací na jednom chirálním centru). Příkladem mohou být epimerizace na uhlíku C-2 a C-4 glukosy, při kterých vznikáD-mannosa aD-galaktosa.
- Deoxymonosacharidy, monosacharidy s methoxyskupinou nebo acetylovou skupinou
Deoxymonosacharidy jsou deriváty monosacharidů, v kterých je hydroxylová skupina nahrazena atomem vodíku.[19]Poměrně často tyto deriváty obsahují zároveň i methoxy nebo acetylovou skupinu, tyto skupiny látek se tedy mohou prolínat.
Patří sem například deoxymonosacharidyL-rhamnosa,L-fukosa,D-digitoxosaa 2-deoxy-D-glukosa, nebo deoxysacharid s methoxyskupinouD-cymarosa.Dalším zástupcem je acetylovaný monosacharid3-acetyl-D-digitoxosa.
V bakteriích se vyskytují i dideoxy deriváty monosacharidů, které postrádají dvě hydroxylové skupiny, napříkladparatosa,abekvosa,askarylosa,tyvelosaneboamicetosa.[6]
- Aminosacharidy
Aminosacharidy jsou monosacharidy nesoucí místo některé z hydroxylových skupinaminoskupinu.Patří sem např.D-mannosamin,D-glukosamin,neboD-galaktosamin, který je obsažen v chondroitinsulfátu.[6]
Aminosacharidy jsou bazické látky a vyskytují se často ve forměN-acetylderivátů, které jsou v přírodě hojně zastoupeny vpolysacharidechnebo některýchantibioticích.NapříkladN-acetyl-D-glukosamin je stavební jednotkoupolysachariduchitinu,ze kterého jsou tvořeny krovkyhmyzu.Aminosacharidy jsou rovněž složkou mnohýchglykolipidůaglykoproteinů.[20]
- Větvené monosacharidy
Některé méně typické cukry nemají základní řetězec lineární, ale mají jej větvený. Např.D-apiosaz petržele,D-hamamelosaz kůry habru neboL-streptosa,D-kladinosaaL-mykarosa,které jsou součástí některých antibiotik. Tyto sacharidy vznikají v přírodě buďC-methylací, nebo přestavbou uhlíkatého řetězce.
Význam monosacharidů
[editovat|editovat zdroj]Monosacharidy často mívají sladkou chuť. Za chemickou podstatu vnímání sladké chuti je možno považovat seskupení -O-CH-CH2-OH[21],které se kromě případu mnohých monosacharidů vyskytuje například i uglycerolu,což je zřejmě příčinou jeho sladké chuti.
Monosacharidy jsou přímé produktyfotosyntézya je v nich nahromaděna energie slunečního záření.D-glukosaje tedy pro většinu organismů primárním zdrojem energie.[14]Je univerzálním platidlem mezi organizmy na Zemi. Například rostliny často využívají monosacharidů, často i sekundárních, k lákání zvířat – např. pro ziskopylovačůnebo roznossemen.Sekundární monosacharidy jsou prekurzorykarboxylových kyselin,cukernýchalkoholůaglykosidů.
Metabolismus
[editovat|editovat zdroj]Zmetabolickéhohlediska je nejdůležitějším monosacharidemD-glukosa,která slouží ve většině organismů jako zdroj energie.[14]
Hlavnímetabolickoudrahou rozkladu glukosy jeglykolýza,ve které je glukosa oxidačně štěpena na dvě molekulypyruvátu.Pyruvátje dále zužitkován vKrebsově cykluadýchacím řetězcipro tvorbuATP.Vedlejším produktem jednoho cykluglykolýzyjsou rovněž dvě molekulyATP,které jsou přímo využity jako zdroj energie. Za anaerobních podmínek je glukosa metabolizována nalaktát,v některýchmikroorganismech(např.kvasinkách) naEthanol.Tyto anaerobní procesy se nazývajífermentace.[22]
Opačným procesem jeglukoneogeneze,která slouží k biosyntéze glukosy z tříuhlíkatých sloučenin, jako napříkladpyruvátu,laktátu,a některýchaminokyselin.Ostatní monosacharidy jsou v buňce syntetizovány ve většině případů z glukosy nebo z některých meziproduktů glukoneogeneze.
Přebytečná glukosa se ukládá v organismech ve formě svýchpolymerů–polysacharidů.V rostlinách je hlavním zásobním polysacharidemškrob,živočichové ukládají glukosu nejčastěji ve forměglykogenu.Zelené rostliny využívajífotosyntézuk fixaci vzdušnéhooxidu uhličitéhodo molekuly glukosy pomocí enzymuRUBISCO.[23]
Další důležitou metabolickou drahou monosacharidů jepentosový cyklus,ve kterém je glukosa přeměňována na pětiuhlíkaté monosacharidy (pentosy). Nejdůležitějším produktem pentosového cyklu jeribosa,která je dále využita pro výstavbunukleových kyselin.Vedlejším produktem jeNADPH,který slouží například k syntézemastných kyselin.
Prostorové uspořádání
[editovat|editovat zdroj]
Přesné prostorové uspořádánímolekulymonosacharidu se označuje jakokonformace.Konformacemolekulyje výsledkem sterických a elektronických interakcí, u monosacharidu je určena zejména pnutím uvnitř cukerného kruhu a orientacíhydroxylových skupin.Jednotlivé konformace mohou mezi sebou přecházet pseudorotací kolem jednoduchých vazeb cukerného kruhu a vroztokujsou vždy zastoupeny poměrně v závislosti na své stabilitě.[24]
Jednotlivé konformace se obvykle značí velkým začátečním písmenem anglického názvu psaným kurzívou a čísly nebo symbolyatomů,které se nacházejí pod nebo nadrovinouvymezenou zbývajícímiatomy.Číslo atomu nacházející se nad touto rovinou píšeme horním indexem před symbol konformace, číslo atomu nacházející se pod touto rovinou píšeme dolním indexem za symbol konformace. Například4C1.
Konformace pyranos
[editovat|editovat zdroj]Nejstálejší a nejčastěji se vyskytující konformací pyranosových kruhů je židličková konformace (C-chair)[6][25],u které rozlišujeme dvě formy4C1a1C4.U konformace4C1je uhlík C-4 orientován nad rovinou určenou atomy C-2, C-3, C-5, O a uhlík C-1 se nachází pod touto rovinou. U konformace1C4,která je méně častá, je tomu právě naopak.
Preferována bude vždy ta forma židličky, ve které je co nejvíce objemných substituentů vázáno ekvatoriálně. Lze tedy říci, že například židličková konformace4C1je ze všech aldohexos nejvýhodnější proD-glukosu,která má v této konformaci všechnyhydroxylové skupinyvázány ekvatoriálně. Naopak jedním z mála monosacharidů, který za normálních podmínek preferuje konformaci1C4,jeD-idopyranosa.
Poněkud odlišná je situace naanomerním centru,kde ekvatoriální pozice nemusí být vždy energeticky nejvýhodnější, může se zde totiž uplatňovat repulze volných elektronových párůanomerníhohydroxylua cyklického atomu kyslíku, kterou označujeme jakoanomerní efekt.[26]

Pyranosové kruhy se mohou taktéž vyskytovat ve vaničkové konformaci (B-boat). Tatokonformacevšak není za normálních podmínek příliš stabilní a vyskytuje se zřídka. Vaničková konformace spíše slouží k přechodu mezi jinými konformacemi nebo se vytváří přechodně vtranzitních stavechněkterýchreakcí.Hlavní příčinou nestability vaničky bývá sterická repulze substituentů na protilehlých atomech uhlíku kruhu. Mezi důležité vaničkové konformace patří1,4B,O,3BaBO,3.

Konformace furanos
[editovat|editovat zdroj]Furanosové kruhy jsou konformačně flexibilnější nežli kruhy pyranosové, což je dáno malým rozdílem v energiích jednotlivých konformací. Jednotlivé konformery tedy mohou mezi sebou snadno přecházet a vroztokuse tak i děje. Nejčastějšíkonformacípětičlenných kruhů jsou obálkové konformace (E– envelope).[25][6]
Podle atomu, který vybočuje zrovinyurčené ostatnímiatomya směru, kterým vybočuje, rozlišujeme nejčastěji2E, E2,3E a E3obálkové konformace, které mezi sebou mohou v roztoku snadno přecházet. Zastoupení jednotlivých konformací se pro různé monosacharidy může lišit a je závislé zejména na substituci furanosového kruhu.

Reaktivita
[editovat|editovat zdroj]Reakce na karbonylové skupině
[editovat|editovat zdroj]Redukce
[editovat|editovat zdroj]Redukcímonosacharidů vznikají tzv.cukerné alkoholynebolialditoly.[27]Funkční karbonylová skupina (ketoskupina nebo skupina aldehydová) se redukuje na hydroxyl. Redukcí aldos vzniká 1 alditol, redukcí ketos vznikají 2 alditoly, protože přibývá jedno chirální centrum. Z některých aldos vznikají achirální cukerné alkoholy (mají rovinu symetrie). V jiných případech vzniká z více monosacharidůD- iL-řady redukcí identický alditol, a celkový počet možných alditolů je proto menší než celkový počet výchozích monosacharidů. Rozlišujeme 3 tetritoly, 4 pentitoly a pouze 10 hexitolů.

Oxidace
[editovat|editovat zdroj]Oxidací monosacharidů vznikají cukerné kyseliny.[7]Podle atomu uhlíku, který je oxidován, rozlišujeme 3 základní typy cukerných kyselin:
- Aldonové kyseliny
Vznikají oxidacíaldehydové skupinyvaldosachnakarboxylovou funkci.Tato oxidace se využívá mimo jiné pro určení redukujících sacharidů (sacharid se oxiduje pomocí Fehlingova činidla na aldonovou kyselinu a působí tedy jako redukční činidlo).Ketosyv tomto smyslu nereagují, neboť ketoskupina nemůže být dále oxidována. Aldonové kyseliny tvoří v roztoku snadno pětičlenné nebo šestičlenné laktony intramolekulární reakcíkarboxylus jednou zhydroxylových skupin.

- Aldarové kyseliny
Aldarové kyseliny jsoudikarboxylové kyselinyodvozené od monosacharidů (aldos) oxidacíaldehydové skupinyi koncové CH2OH skupiny.

- Uronové kyseliny
Uronové kyseliny vznikají dvoustupňovou oxidací koncové CH2OH skupiny nakarboxyl,přičemžkarbonylová skupinaje zachována.

Hydrazony, osazony, oximy
[editovat|editovat zdroj]Monosacharidy (aldosyiketosy) reagují s arylhydraziny za vznikuhydrazonů,při použití přebytku arylhydrazinu reakce pokračuje dále na osazon.[28][29]Nejčastěji používaným činidlem jefenylhydrazin.Při vzniku osazonu zaniká ualdoscentrum chirality na C-2, a proto napříkladD-glukosa,D-fruktosa aD-mannosa poskytují identický osazon.
Osazony v minulosti sloužily díky svým dobrým krystalizačním vlastnostem pro identifikaci monosacharidů. NapříkladEmil Fischervyužíval osazony k důkazu některých monosacharidů.[30]

Aldosyreagují rovněž shydroxylaminemza vznikuoximů.[9]
Kilianiho-Fischerova syntéza
[editovat|editovat zdroj]Adicí kyanidového aniontu na karbonylovou skupinualdosdochází k prodloužení řetězce o jeden uhlík.[31]Zkarbonylovéhouhlíku se stane C-2 a připojí se nový uhlíknitrilové skupiny,z kterého se stane C-1. Vzniká dvojice epimerníchkyanhydrinů,které mohou být následně převedeny na dvojici odpovídajícíchaldoslišíčích se konfigurací na C-2. Tímto způsobem lze zglyceraldehydusyntetizovat postupně všechny aldosy, kdy například zD-arabinosy vznikajíD-glukosa aD-mannosa.
Tato syntéza byla původně vypracována německými chemikyHeinrichem KilianimaHermannem Emilem Fischerem.K rozkladu vznikajícíchkyanhydrinůbyla původně využívána hydrolýza za zvýšené teploty a následná redukce vzniklých laktonů sodným amalgámem. Moderně se využívá spíše katalytická hydrogenace na Pd/BaSO4neboLindlarově katalyzátoru.

Reakce anomerní hydroxylové skupiny
[editovat|editovat zdroj]Glykosidy
[editovat|editovat zdroj]Reakcí anomerní hydroxylové skupiny salkoholemv kyselém prostředí vznikajíglykosidy.[9][32]Tato reakce je analogická tvorbě acetalu z poloacetalu,glykosidytedy můžeme označit za acetaly monosacharidů. Formálně je vglykosidechnahrazen vodík anomerní hydroxylové skupiny alkyl- nebo arylskupinou. Tuto necukernou část glykosidu nazýváme aglykon. Glykosidace je jedna z nejdůležitějších reakcí monosacharidů a glykosidy jsou v přírodě hojně rozšířeny zejména v rostlinách.
Název glykosidu je tvořen tak, že název aglykonu je zařazen před název daného monosacharidu a oddělen spojovníkem, koncovka -osa(popř. -óza) se nahradí koncovkou -osid.Mezi další používané metody syntézy glykosidů patří Koenigsova–Knorrova[33]syntéza (reakce glykosylhalogenidů s alkoholy) nebo alkylace v bazickém prostředí.

Odkazy
[editovat|editovat zdroj]Poznámky
[editovat|editovat zdroj]- ↑Tento postup není platný pro monosacharidy s počtem uhlíků 7 a více, kde anomerní referenční atom nemusí být totožný s konfiguračním atomem. Zde se za anomerní referenční atom označuje chirální atom uhlíku s nejvyšším lokantem, který je ještě součástí cukerného kruhu.
Reference
[editovat|editovat zdroj]- ↑Fischer, E., Syntheses in the sugar group.J. Am. Chem. Soc.1890,12(9), 461-71.
- ↑Fischer, E., Synthesen in der Zuckergruppe.Berichte der deutschen chemischen Gesellschaft1890,23(2), 2114-2141.
- ↑Votocek, E.; Kucerenko, V., Fucose (l-galactomethylose) and epifucose (l-talomethylose) series.Collect. Czech. Chem. Commun.1930,2,47-53.
- ↑Votocek, E.; Valentin, F., The glucosylalkylamines (and other aldose alkylamines).Collect. Czech. Chem. Commun.1934,6,77-96.
- ↑abcdMcNaught, A. D., Nomenclature of carbohydrates (Recommendations 1996). J. Carbohydr. Chem.1997,16 (8), 1191-1280.webArchivováno11. 8. 2011 naWayback Machine.,pdfArchivováno22. 2. 2016 naWayback Machine.
- ↑abcdefghČerný, M.; Trnka, T.; Buděšínský, M.Sacharidy.1. vyd. Praha: Česká společnost chemická,2010,178 s.ISBN978-80-86238-81-4.
- ↑abcMcMurry, J.Organická chemie,1. vydání; VŠCHT Praha: Praha,2007.ISBN978-80-7080-637-1.
- ↑Angyal, S. J., The Composition of Reducing Sugars in Solution: Current Aspects. InAdv. Carbohydr. Chem. Biochem.,Derek, H., Ed. Academic Press:1991;49, 19-35.
- ↑abcCapon, B., Mechanism in carbohydrate chemistry.Chem. Rev.1969,69 (4), 407-498.
- ↑Pigman, W.; Isbell, H. S., Mutarotation of sugars in solution. I. History, basic kinetics, and composition of sugar solutions.Advan. Carbohyd. Chem.1968,23, 11-57.
- ↑Moreno, L. F., Understanding Fischer Projection and Angular Line Representation Conversion.J. Chem. Educ.2012,89(1), 175-176.
- ↑IUPAC.Compendium of Chemical Terminology, 2nd ed. (the "Gold Book" ).Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). doi:10.1351/goldbook.H02749.Dostupné online.
- ↑The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 15th Edition, Royal Society of Chemistry, Cambridge, 2013ISBN978-1-84973-670-1.Dostupné online
- ↑abcVODRÁŽKA, Zdeněk.Biochemie.Praha: Academia,2007.ISBN978-80-200-0600-4.
- ↑Ricca, E.; Calabrò, V.; Curcio, S.; Iorio, G., The State of the Art in the Production of Fructose from Inulin Enzymatic Hydrolysis.Crit. Rev. Biotechnol.2007,27 (3), 129-145.
- ↑Biochemie sekundárních metabolitů – sylabus k předmětu, VŠCHT Praha.Dostupné online
- ↑Umezawa, S., Structures and syntheses of aminoglycoside antibioticsAdvances in Carbohydrate Chemistry and Biochemistry.1974,30, 111-82
- ↑Allard, S. T.; Giraud, M. F.; Naismith, J. H., Epimerases: structure, function and mechanism.Cellular and molecular life sciences2001,58 (11), 1650-65.
- ↑de Lederkremer, R. M.; Marino, C., Deoxy sugars: occurrence and synthesis.Adv. Carbohydr. Chem. Biochem.2007,61, 143-216.
- ↑Taylor, M.; Drickamer, K., Introduction to Glycobiology.Oxford University Press:2003;p 160 pp.
- ↑Kier, L. B., A molecular theory of sweet taste.J. Pharm. Sci.1972,61 (9), 1394-1397.
- ↑NELSON, David L.; COX, Michael M.Lehninger Principles of Biochemistry.5. vyd. [s.l.]: W. H. Freeman, 2008. 1100 s.Dostupné online.ISBN978-0716771081.
- ↑PDB Molekula měsíce - RUBISCO, doi:10.2210/rcsb_pdb/mom_2000_11,Dostupné onlineArchivováno3. 9. 2015 naWayback Machine.
- ↑Angyal, S. J., The Composition and Conformation of Sugars in Solution.Angewandte Chemie International Edition in English1969,8 (3), 157-166.
- ↑abDurette, P. L.; Horton, D., Conformational Analysis of Sugars and Their Derivatives. InAdv. Carbohydr. Chem. Biochem.1971,26, 49-125.
- ↑Tvaroŝka, I.; Bleha, T., Anomeric and Exo-Anomeric Effects in Carbohydrate Chemistry. InAdv. Carbohydr. Chem. Biochem,1989,47, 45-123.
- ↑Stoss, P.; Hemmer, R., 1,4:3,6-Dianhydrohexitols. Adv. Carbohydr. Chem. Biochem.1992,49, 93-173.
- ↑Mester, L.; El Khadem, H.; Horton, D., Structure of saccharide osazones.Journal of the Chemical Society C: Organic1970,(18), 2567-2569.
- ↑El Khadem, H. S.; Fatiadi, A. J., Hydrazine derivatives of carbohydrates and related compounds.Adv. Carbohydr. Chem. Biochem.2000,55,175-263.
- ↑Fischer, E., Ueber einige Osazone und Hydrazone der Zuckergruppe.Berichte der deutschen chemischen Gesellschaft1894,27(2), 2486-2492.
- ↑Wang, Z., Kiliani-Fischer Cyanohydrin Synthesis. In Comprehensive Organic Name Reactions and Reagents, John Wiley & Sons, Inc.:2010.
- ↑Brito-Arias, Marco.Synthesis and Characterization of Glycosides.Springer,2007.ISBN978-0-387-26251-2.
- ↑Wang, Z., Koenigs-Knorr Reaction. InComprehensive Organic Name Reactions and Reagents,John Wiley & Sons, Inc.:2010.
Literatura
[editovat|editovat zdroj]- McMurry, J.Organická chemie,1. vydání; VŠCHT Praha: Praha,2007.ISBN978-80-7080-637-1.
- Wade Jr., L. G.Organic Chemistry (8th Edition),8th ed.; Pearson,2012.ISBN978-0321768414.
- Černý, M.; Trnka, T.; Buděšínský, M.Sacharidy.1. vyd. Praha: Česká společnost chemická,2010.ISBN978-80-86238-81-4.
- VODRÁŽKA, Zdeněk.Biochemie.Praha: Academia,2007.ISBN978-80-200-0600-4.
Související články
[editovat|editovat zdroj]Externí odkazy
[editovat|editovat zdroj] Obrázky, zvuky či videa k tématumonosacharidynaWikimedia Commons
Obrázky, zvuky či videa k tématumonosacharidynaWikimedia Commons- IUPAC doporučení pro názvosloví monosacharidů
- IUPAC doporučení pro Haworthovu projekci
