Spektroskopie

Spektroskopiejefyzikálníobor, který se zabývá studiem interakce světla s látkou, tedyelektromagnetického zářeníse vzorkem. Jejím cílem je získat optické spektrum, tedy závislost intenzity látkou absorbovaného, odraženého, emitovaného nebo rozptýlenéhozářenína vlnové délce.
Historie[editovat|editovat zdroj]
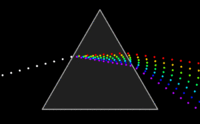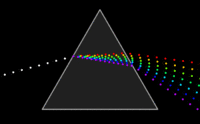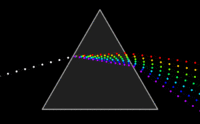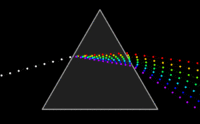
Zakladatelem spektroskopie jeJan Marek Marcia po něm sirIsaac Newton,který pomocíoptického hranoluobjevilmonochromatické světlo.Také si všiml, že čím čistější monochromatické světlo získává, tím slabší je jeho intenzita. Tuto skutečnost překonaly ažlaseryasynchrotrony.PrvníspektrometrvytvořiliKirchhoffaBunsenv roce1860.
Základní pojmy[editovat|editovat zdroj]
Absorpce a emise záření[editovat|editovat zdroj]

Interakcezáření shmotoumůže nastat několika způsoby.Atomnebo molekula mohou záření pohltit (absorpce), naopakenergiiuvolnit ve formě záření (emise) nebo mohou záření pohltit a po čase jej opět emitovat (fluorescenceafosforescence).
Vlnová délka záření[editovat|editovat zdroj]
Základní fyzikální vlastností látek je, že pohlcují záření určitýchvlnových délek.Absorbované nebo emitované spektrum pak není spojité, ale skládá se z mnoha linií (čar nebo pásů), které jsou pro každou látku specifické. Neexistují dvě chemicky odlišnélátky,které by měly stejné absorpční nebo emisní spektrum. Vplynné fázimají spektra atomů podobu separovaných linií, v případě molekul sdružených do pásů. Vkapalnéapevnéfázi pozorujeme spektra pásová.
Ve vzdálené infračervené oblasti odpovídá každá linie spektra změně rotace molekuly. Ve střední a blízké infračervené oblasti odpovídá každá linie spektra změně vibrace a rotace molekuly. Ve viditelné a ultrafialové oblasti spekter dochází k přeskokům elektronů mezi orbitaly různých energií ve vnějších slupkách atomových nebo molekulových orbitalů. V oblasti rentgenového záření dochází ke změnám ve vnitřních slupkách atomů. Ionizujícízáření gamavede k přeskokům jaderných částic mezi jednotlivými energetickými hladinami jádra.
Se zkracující se vlnovou délkou záření se zvyšuje jeho energie a také účinek záření na atomy amolekuly.Zatímco radiové vlny svým dopadem ovlivní jen orientaci jaderného spinu a účinek na molekulu je téměř nulový, tak gama záření je schopno zničit iatomová jádra.
| Typ záření | Vlnočet (cm−1) |
Frekvence | Energie (kJ/mol) |
Interakce s hmotou |
|---|---|---|---|---|
| Záření gama(γ) | 108– 1010 | 3×1018Hz – 3×1020Hz | 106– 108 | Rozpady atomových jader |
| Rentgenové záření(RTG) | 106– 108 | 3×1016Hz – 3×1018Hz | 104– 106 | Ionizace |
| Ultrafialové záření(UV) | 104– 106 | 3×1014Hz – 3×1016Hz | 100 – 104 | Přechody elektronů |
| Viditelné záření(VIS) | 100 – 104 | 3×1012Hz – 3×1014Hz | 1 – 100 | Přechody elektronů |
| Infračervené záření(IR) | 1 – 100 | 30 GHz – 3×1012 | 0,01 – 1 | Vibrace molekul |
| Mikrovlnné záření (MW) | 0,01 – 1 | 300 MHz – 30 GHz | 10−4– 0,01 | Rotace molekul |
| Rádiové záření(LW) | 10−4– 0,01 | 3 MHz – 300 MHz | 10−6– 10−4 | Přechody jaderného spinu |
Aplikace[editovat|editovat zdroj]
- Elektromagnetická spektroskopie– měření intenzityelektromagnetického zářenív závislosti nafrekvencinebovlnové délce.Do této oblasti spadá řadaspektrálních oblastía měřicích technik.
- Ramanova spektroskopie- měření spektra elektromagnetického záření rozptýleného díkyRamanově jevu(neelastický rozptyl). Rozptýlené záření má mírně odlišnou vlnovou délku než záření dopadající, neboť částenergiese spotřebuje na vibračních přechodechmolekuly.Tato spektroskopická technika poskytuje informace o struktuře a prostorovém uspořádání molekuly.
- Spektrometrie sFourierovou transformacíje založena na matematické transformaci interferogramu (závislosti intenzity signálu na dráhovém rozdílu paprsků) získaného detekcí signálu vystupujícího z interferometru. Interferující paprsky putují přes kyvetu se vzorkem. Spektrometry Fourierova typu jsou v současné době poměrně hodně rozšířeny.
- Infračervená spektroskopie(Zeslabený úplný odraz)
- UV/VIS spektroskopie
- Atomová absorpční spektroskopie
- Rentgenová fluorescence
- NMR spektroskopievyužívajícíjaderné magnetické rezonance– určuje rozloženíatomův okolíjaders nenulovým jaderným spinem (1H,13C,31P,…)
- Elektronová paramagnetická rezonance– měření částic obsahujících nepárovéelektrony.
- Analytická chemieaforenzní chemie- využívají RTG záření, případně UV/VIS nebo IR spektroskopii.
- Fluorescence- používá se například k zobrazování otisků a také kDNAznačení při hledání otcovství.
Literatura[editovat|editovat zdroj]
- Prosser, Václav,Experimentální metody biofyziky,1. vyd. Praha: Academia, 1989,ISBN80-200-0059-3.
- Amesz A., Hoff, A.J.Biophysical Techniques in Photosynthesis.Dordrecht: Kluwer Academic Publishers, 411 pp., (chapter 1-6, 9-11, 13, 18-20), 1996.ISBN0-7923-3642-9.
- Atkins, P., de Paula, J.Fyzikální chemie.VŠCHT Praha, 1. vydání, 2013.ISBN978-80-7080-830-6.
- Lakowicz R. J.,Principles of Fluorescence Spectroscopy.2006.ISBN0-387-31278-1.
- Gauglitz, G., Vo-Dinh, T.Handbook of spectroscopy.2014.ISBN978-3-527-32150-6.
- Valeur B., Bronchon J.-C.New trends in fluorescence spectroscopy. Application to chemical and life sicences.Berlin, 2001.ISBN3-540-67779-8.
- Seriál o detektivní chemii v brožuře KSICHTu
