Thiokyanatan
Thiokyanatan(téžsulfokyanatan,thiokyanidnebo dříverhodanid) jefunkční skupinaodvozená odkyseliny thiokyanatéa tvořícísloučeniny iontovézaložené na [SCN]−akonjugované zásady). Mezi typické sloučeniny patří bezbarvésolithiokyanatan draselnýasodný.Jako thiokyanatany se označují takéorganické sloučeninyobsahujícífunkční skupinuSCN.
Charakteristika[editovat|editovat zdroj]
Thiokyanatan je analogemkyanatanu,[OCN]−,kde jekyslíknahrazensírou.[SCN]−je jedním zpseudohalogenidů,vzhledem k podobnosti reakcí s těmi, které probíhají uhalogenidovýchiontů.Thiokyanatany se dříve označovaly jakorhodanidy(zřeckéhoslova prorůži), protožekomplexyseželezemměly červenou barvu. Thiokyanatany vznikají reakcíelementárnísírynebothiosíranůskyanidy:
- 8 CN−+ S8→ 8 SCN−
- CN−+ S2O2-
3→ SCN−+SO2-
3
Druhá z reakcí jekatalyzovánaenzymemsulfotransferázou,která je známa též jako rhodanáza a může mít význam při detoxikaci organismu odkyanidů.
Struktura, vazby a koordinační chemie[editovat|editovat zdroj]
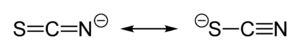
U thiokyanatanu sdílí svůj zápornýnábojpřibližně rovným dílem síra a dusík. V důsledku toho může thiokyanatan působit jakonukleofil,jak na síře, tak na dusíku – jeobouvazným ligandem.[SCN]−může být také můstkem pro dva (M−SCN−M) nebo i tři kovovéatomy(>SCN− or −SCN<).
Experimentální důkazy vedou k obecnému závěru, žetřída kovů A(tvrdé kyseliny) tvoříN-vazné thiokyanatanové komplexy, kdežto třída B (měkké kyseliny) tvoříS-vazné komplexy. Někdy se projevují i jiné faktory, například kinetika a rozpustnost, může se objevit také vazebnýizomerismus,například [Co(NH3)5(NCS)]Cl2a [Co(NH3)5(SCN)]Cl2.[1]
Organické thiokyanatany[editovat|editovat zdroj]
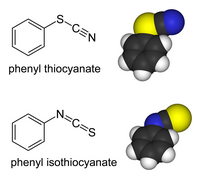
Organické deriváty thiokyanatanů a deriváty spřechodnými kovymohou existovat jakovazebné izomery.Organická skupina nebo kov se váže na síru: R−S−C≡N má jednoduchou vazbu S-C a trojnou vazbu C-N[2].V isothiokyanatanech se substituent váže na dusík: R−N=C=S má dvojnou vazbu a C-N taktéž dvojnou vazbu. Organické thiokyanatany sehydrolyzujínathiokarbamátyvRiemschneiderově thiokarbamátové syntéze.
Test na železo Fe3+[editovat|editovat zdroj]
Přidá-li se [SCN]−doroztokuobsahujícíhoželezitéionty (Fe3+), zbarví se roztok krvavě červeně, protože se vytvoří ionty [Fe(NCS)(H2O)5]2+.

Výskyt v těle[editovat|editovat zdroj]
Málo pravděpodobný se jeví výskyt rhodanidů v lidskýchslinách.Zde se totiž mohou rhodanidy tvořit, pokud je osobakuřákem.U nekuřáků se vyskytne pouze tehdy, pohybuje-li se v zakouřeném prostředí. Už jedna vykouřenácigaretaje podnětem pro jejich tvorbu. Jako důkaz může posloužit výše popsaná důkazová reakce. U pravidelných kuřáků vznikne rudý komplex, u občasných kuřáků a nekuřáků s pohybem v zakouřených prostředích vzniká oranžový až jemně červený komplex. Nutno dodat, že tvorba v lidskýchslináchmá jisté antibakteriální účinky, a tedy i protektivní účinky nazuby,neboť tak v důsledku sníženého výskytubakteriívdutině ústnísnižuje riziko tvorbyzubního kazu.
Reference[editovat|editovat zdroj]
V tomto článku byl použitpřekladtextu z článkuThiocyanatena anglické Wikipedii.
- ↑GREENWOOD, Norman Neill.Chemie prvků. Sv. 1..1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s.Dostupné online.ISBN80-85427-38-9,ISBN978-80-85427-38-7.OCLC320245801S. 1396.
- ↑Guy, R. G. "Syntheses and Preparative Applications of Thiocyanates" in "Chemistry of Cyanates and Their Derivatives," vol II. Patai, S., (Editor), John Wiley, 1977. New York
Externí odkazy[editovat|editovat zdroj]
 Obrázky, zvuky či videa k tématuthiokyanatannaWikimedia Commons
Obrázky, zvuky či videa k tématuthiokyanatannaWikimedia Commons
