Thioly
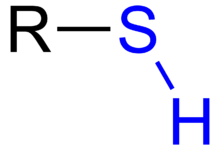
Thioly(téžthioalkoholynebosirné alkoholy,starší názevmerkaptany) jsou organické sloučeninysíryformálně odvoditelné odalkoholůnahrazením jednoho či více alkoholových atomůkyslíkusírou. V molekule tedy obsahují sulfanylovou skupinu –SH. V pevném skupenství se zpravidla jedná o bílé, ve vodě téměř nerozpustné,krystalickélátky. Nižšíalifatickéthioly se vyskytují za normálních podmínek v kapalném skupenství,methanthiolje plyn.[1]Thioly podléhají podobným reakcím jakoalkoholy,jsou to velmi silně zapáchající látky, napříkladmethanthiolje možné detekovat lidským čichem již při koncentraci 1 μg/dm3vzduchu.Solithiolů se nazývajíthioláty.Thioalkoholy mohou býtalifatickéhoiaromatickéhocharakteru (pak se také nazývajíthiofenoly).
Názvosloví
[editovat|editovat zdroj]Názvy thiolů se tvoří pomocí substitučního názvosloví, vychází z názvoslovíalkoholů.Názvem thiolů bývá jen jedno slovo, jehož kořenem je základní uhlovodík, prefixy jsou názvy lokantů a násobící předpony, sufixem je–thiol;podobně jako ualkoholů,u nichž se používá sufixu-ol.Ve starší literatuře se můžeme setkat se starší předponoumerkapto-,místo přípony-thio.Je-li dnes nutno použít předponu, je volena novější varianta sulfanyl-.
-
Benzenthiol
-
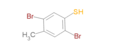
2,5-dibrom-4-methylbenzen-1-thiol
-
Butan-1,4-dithiol
-
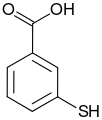
3-sulfanylbenzoová kyselina
Vazba S-H
[editovat|editovat zdroj]Vazba S-H tvoří v thiolech analog k alkoholové vazbě O-H. Většinu vlastností mají S-H a O-H podobné. Z nižšíelektronegativitysíry 2,44 (elektronegativita O2je 3,5), a z větších rozměrů atomůsíryvšak vyplývají určité odlišnosti. Předně vazba S-H je slabší než O-H. Ze stejných důvodů je ivodíková vazbav thiolech mnohem slabší než valkoholech.Proto mají thioly nižší bod varu než jejich alkoholové analogy.
| Thiol | Bod varu °C | Alkohol | Bod varu °C |
|---|---|---|---|
| [1]MethanthiolCH3SH | 6 | Methanol | 65 |
| [2]EthanthiolC2H5SH | 35 | Ethanol | 78 |
| [3]Benzenthiol | 168 | Fenol | 182 |
Slabá vazba mezisírouavodíkemrovněž způsobuje, že thioly jsou mnohem kyselejší než alkoholy. Díky vyššíkyselostije možné připravitsolithiolů-alkoholáty, na rozdíl od solí alkoholů reakcí thiolu s vodným roztokem bazickéhohydroxidu.
- CH3CH2-SH + NaOH → CH3CH2-S−Na++ H2O
Příprava
[editovat|editovat zdroj]Thioly se obvykle připravují SN2-reakcí (substituce nukleofilní binukleární) odpovídajícíchhalogenalkanůse sirnýminukleofily,například s hydrogensulfidovýmaniontemHS-. Vedlejším produktem reakce jesůlhalogenalkanu.
- R-Br + Na+ −SH → R-SH + NaBr
Hydrogensulfid musí být použit ve stechiometrickém přebytku, jinak dochází k následné nežádoucíreakci(jedná se rovněž oSN2-reakci) s halogenalkanem na symetrickýsulfid.
- R-SH + R-Br → R-S-R
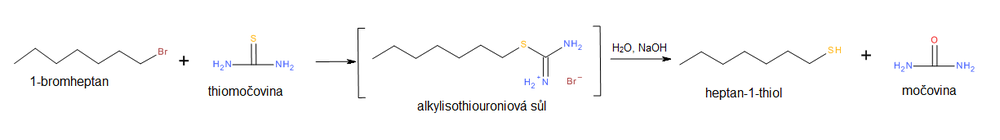
Další možností jak předejít nežádoucímu vznikusulfanuje použitíthiomočovinyjakonukleofilu.Přireakcidochází ksubstitucihalogenidovéhoiontuthiomočovinou přes intermediální sůl alkylisothiomočoviny, která je následněhydrolyzovánavodným roztokem alkalickéhohydroxidu,např.NaOH(aq).
Thioly lze rovněž připravovat redukcí disulfidůzinkemv kyselém prostředí. Kredukcilze také použítalkalické kovyv kapalnémamoniaku,nebotetrahydroboritan sodnýNaBH4.
- R-S-S-R + HX−→ 2R-SH
Thioly je rovněž možno připravit reakcíGrignardova činidlasírouna thiolát a následnou reakcí skyselinou chlorovodíkovou.
- R-Li + S → R-SLi
- R-SLi + HCl → R-SH + LiCl
Výroba
[editovat|editovat zdroj]V průmyslu se thioly nejčastěji vyrábějí reakcí odpovídajícího alkoholu sesulfanemH2S v kyselém prostředí. Dále se thioly vyrábějíadicísulfanu naalkenyza přítomnosti katalyzátoruoxidu hlinitého.
- CH3OH + H2S → CH3SH + H2O
Reakce
[editovat|editovat zdroj]Thioly se poměrně snadnooxidují,již při použití slabýchoxidovadeljako je třebabromnebojod.Produktem oxidace jsoudisulfidy.
- 2R-SH + I2→ R-S-S-R + 2HI
Thioly lze oxidovat rovněžperoxidem vodíku,který při reakci působí jako oxidovadlo a sám se redukuje. Produktem této reakce jesulfonová kyselinaavoda.
- R-SH + 3H2O2→ RSO3H + 3H2O
Reakcí thiolu sbází,například shydridem sodnýmvzniká thiolátový ion (RS-), který může následně reagovat s primárním nebo sekundárnímalkylahalogenidemza vznikuorganosulfidů.Reakce probíháSN2 mechanismem.Thiolátové anionty patří mezi nejsilnějšínukleofilya výtěžky jejich reakcí jsou velmi vysoké.
Thioly se též velice ochotně slučují s těžkými kovy, zejména sertutíza vzniku organometalických sloučeninmerkaptidů.Podobně thioly reagují solovemamědí.
- CH3CH2-SH +HgO→ (CH3CH2S)2Hg + H2O
Výskyt
[editovat|editovat zdroj]
Thioly způsobují charakteristický pachmléka,mléčných výrobků,česneku(prop-2-en-1-thiol čili „allylmerkaptan “; mimo jiných látek, např. allyl(methyl)sulfid neboli 3-(methylsulfanyl)prop-1-en) acibule(propan-1-thiol).3-methylbutan-1-thiolse vyskytuje v žlázovémsekretuprodukovanémšelmamiz čeledi skunkovitých, kteří je používají jako chemickou zbraň.Methanthiolvzniká vzažívacím traktusavcůrozklademproteinůpři trávení.
V neživé přírodě se thioly vyskytují vropě,uhlía kondenzátuzemního plynu.Zemní plyn těžený vKataruaÍránuobsahuje až 3 000ppmthiolů. Venergeticezpůsobují thioly problémy svou přítomností veskládkovém plynuabioplynu.Thioly způsobují u nesprávně skladovaných vín charakteristický zápach, který má za následek jejich znehodnocení.
Využití
[editovat|editovat zdroj]Zemní plyn,hojně používaný v domácnostech a průmyslu jakopalivo,je bez barvy a bez zápachu, na druhou stranu se však jedná o látku, která tvoří při smíšení se vzduchem výbušnou směs. Pro snadnější možnost detekce unikajícího plynu, zhaslé karmy, neuzavřeného hořáku atd. se do zemního plynu před distribucí k odběrateli přidávají thioly, tento proces se nazýváodorizace,k odorizaci se používá předevšímethanthiol.
Thioly se oxidací převádějí nadisulfidy,které tvoří sulfidové, disulfidové a polysulfidové můstky. Tyto můstky spojujípolymernířetězce syntetickéhokaučukupři jehovulkanizaci.Ochota thiolů reagovat stěžkými kovy,a vázat je na sebe se používá v lékařství, při léčení otravyrtutí,kadmiemaolovem.2,3-disulfanylpropanolse rovněž používá jako radioprotektivní látka, tj. látka snižující následkyradioaktivníhozáření naorganismus.
Odstraňování thiolů z paliv
[editovat|editovat zdroj]Thioly v ropě a ropných derivátech
[editovat|editovat zdroj]Thioly, jak už bylo řečeno, jsou velice zapáchající a korozivní látky. Jejichkorozivnostvede k destrukci potrubí při dopravěropya ropných derivátů. Ničí vnitřky motorů a vyžaduje vyšší nároky na povrchovou úpravu nádrží, v nichž jsou ropa a její deriváty uchovávány. Co se týče obsahu thiolů v ropě, obecně platí, že čím je ropa mladší, tím je v ní větší obsah thiolů. Jedná se o pozůstatek rozkladuživočichůpři vznikuropy.Aby se těmto nežádoucím vlivům předešlo, musí se thioly odstraňovat. Jednou z možností jehydrogenačnírafinace,při níž se za zvýšenéteplotyatlakumíchá svodíkem,následkem čehož vznikásulfan,který se následně vypírá vamoniakálnívypírce.Hydrogenačnímetoda je poměrně drahá a používá se u těžkých thiolů, zvláště při odstraňování thiolů zbenzinuapetroleje.Společně s thioly se odstraňují i další sirné sloučeniny.
Levnější metodou je slazení thiolů.[4]Slazení spočívá vextrakcithiolů v roztocíchlouhůa převádění na disulfidy, které nejsou zapáchající akorozivní,a mohou se vpalivechnadále ponechat. Slazení probíhá při mírně zvýšeném[5]tlaku0,3-0,8 MPa a mírně zvýšené[5]teplotě40-60 °C. Slazení se používá hlavně když nejsou přítomny ostatní, nežádoucí sirné sloučeniny jako např.sulfidy,disulfidyathiofeny.Slazení z důvodu vysokého obsahu thiolů způsobujících zápach akorozise postupně snižuje, z důvodu legislativních omezení využíváníropys vysokým obsahemsíry.Thioly se však z ropných produktů odstraňují i v koncentracích, kdy již nezpůsobujíkorozivnost,a to v případech, kdy se zvyšujeoktanové číslobenzínůizomerací,k níž se používáplatinovýchkatalyzátorů,na něž působí thioly jakojed.
- R-S + NaOH → R-SNa + H2O
Thioly v energetických plynech
[editovat|editovat zdroj]
Thioly se společně s dalšími sirnými sloučeninami vyskytují v skládkovém plynu abioplynu,v menší míře pak vzemním plynu.Thioly v těchto energetických plynech obsažené vznikly rozkladem tlejícího masa, živočichů, z fekálií a z dalších složek živočišného původu použitých při získáváníbioplynuvefermentorech,popř. naskládkách.Thioly působíkorozivněna zařízeníkogenerace,spalovací motoryapotrubív němž jsou dopravovány. Nejčastější metodou jejich odstranění jesorbcena vrstvěaktivního uhlí,a to jakabsorpce,takadsorbce.Jelikož je žádoucí, abysorbentbyl vanaerobním prostředí,jeimpregnovánjódem.Jinak by nedocházelo k žádoucíoxidaci(kvůli absencikyslíkuvanaerobním prostředí).Impregnacije možné provádět i sloučeninami šestimocnéhochromuamanganistanem draselným.
| Složka | Koncentrace mg/m3 |
|---|---|
| [6]Sulfan | 50-3000 |
| [6]Methanthiol | 0,1 – 30 |
| [6]Ethanthiol | 0 – 20 |
| [6]Sirouhlík | 0,5 – 20 |
| [6]Diethylsulfid | 0,02 – 40 |
Význam v biologii
[editovat|editovat zdroj]Thioly se snadnooxidujínadisulfidya naopak, tato vzájemná přeměna je velice důležitá pro vznikdisulfidových můstků,které stabilizují terciární strukturybílkovina dalšíchbiopolymerů.Vazba -SH je charakteristická proaminokyselinucystein.
Odkazy
[editovat|editovat zdroj]Reference
[editovat|editovat zdroj]- ↑abhttp:// chemspider /Chemical-Structure.855.html
- ↑http:// chemspider /Chemical-Structure.6103.html
- ↑http:// chemspider /Chemical-Structure.7681.html
- ↑Blažek V. Rábl J., Základy zpracování a využití ropy, VŠCHT Praha, 2. vydání, 2006, str. 120
- ↑abArchivovaná kopie.petroleum.cz[online]. [cit. 2011-03-31].Dostupné v archivupořízeném dne 2015-09-24.
- ↑abcdehttp://paliva.vscht.cz/data/clanky/14_odstranovani_sulfanu_z_bioplynu.pdf
Literatura
[editovat|editovat zdroj]- Klouda P.:Základy biochemie, Ostrava, 2005
- Kolář K., Kodíček M., Pospíšil J., Chemie II pro gymnázia (organická a biochemie), SPN, 2005
- McMurry J., Organická chemie, VŠCHT Praha, 1.vydání, 2007
- Svoboda J. a kol, VŠCHT Praha, 1. vydání, 2005
- Blažek V. Rábl J., Základy zpracování a využití ropy, VŠCHT Praha, 2. vydání, 2006
Související články
[editovat|editovat zdroj]Externí odkazy
[editovat|editovat zdroj] Obrázky, zvuky či videa k tématuthiolnaWikimedia Commons
Obrázky, zvuky či videa k tématuthiolnaWikimedia Commons- Shrnutí informací o thiolech[nedostupný zdroj]
- Metoda extrakce thiolů louhemArchivováno24. 9. 2015 naWayback Machine.
- Srovnání reaktivnosti s alkoholy, ethery a thioethery– vysokoškolský učební text