Vand
|
Vand | |
|---|---|
| Synonymer | Is(fast form),vanddamp(gasform) |
| Struktur | 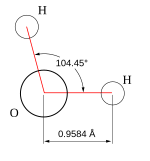
|
| Kuglekalot-model | 
|
| Sumformel | H2O |
| Farve | Svagt blå. |
|
Fysiske egenskaber | |
| Molvægt | 18,016g/mol |
| Smeltepunkt | 0,00°C |
| Kogepunkt | 100,0 °C |
| Massefylde | 0,9970 g/cm3(stuetemp.) |
| Varmefylde | 4,18 kJ/(kg*K) |
|
Syre/base-egenskaber | |
| pKa | 13,995 |
|
Diverse | |
| CAS-nummer | 7732-18-5 |
| E-nummer | Intet E-nummer |



Vander enkemisk forbindelse,der erflydendevedstuetemperaturog understandardtryk.Vand er fast ved temperaturen under 0. Det har denkemiske formelH2O, hvilket betyder, at étvandmolekyleer sammensat af tohydrogenatomerog étoxygenatom.Vand findes næsten overalt påJordenog er nødvendigt for alle kendtelivsformer.Ca. 71% af Jordens overflade er dækket af vand. Vand i fast form kaldesisog vand igasformkaldes (vand)damp.[1]
Kemikere omtaler ofte i spøg vand somdihydrogen monoxidellerDHMO,der er det systematiske navn for dette molekyle i det kemiskefagsprog.Det sker især i parodier på kemisk forskning, som kræver denne “dødelige kemiske forbindelse” forbudt.[2]Et accepteret og brugtIUPAC-navn eroxidane,men det bruges sjældent andre steder.[3][4]
Tripelpunkt[redigér|rediger kildetekst]
Temperaturenhederne(tidligere °Celsius,nuKelvin) er fastlagt ud fra vandstripelpunkt:273,16 K (= 0,01 °C) og 611,2 Pa er den temperatur og dettryk,hvor vand i alle tretilstandsformerfindes samtidig, også kaldetfaser(is, vand og damp), og er i ligevægt med hinanden.
Ved temperaturer højere end 647 K og et tryk større end 22.064 Mpa vil en samling vandmolekyler gå over i ensuperkritisk tilstand,hvor det er muligt at ændre temperatur og tryk, så man går fra væskeformigt til dampformigt vand uden en faseovergang. Det er altså ikke klart, hvor grænsen mellem væskeformigt og dampformigt vand går over det kritiske punkt.
Hydrosfære[redigér|rediger kildetekst]
Hydrosfærener en betegnelse for alt det vand, der er påJorden,uanset fase. Jordens hydrosfære er beregnet til at være ca. 1.360.000.000 km3.Oceanerne udgør 97 % af hydrosfæren, resten udgøres af floder og søer,grundvand,kryosfæren(is), vanddamp iatmosfæren,krystalvandi mineraler og bjergarter samt vandet i de levende organismer. Jordens ældste vand er fundet i Canada 2,4 km under overfladen.[5]Andre himmellegemer kan også have hydrosfærer, f.eks.kometer,Merkur,jupitermånenEuropa,saturnmånenEnceladusog uranusmånenOberon,menJordener indtil nu den enestevandverden,vi kender i detaljer.
Vandflade er en samlet betegnelse for
Jordens hydrosfære er formentlig "genbrug" frakometer,asteroiderog andre "snavsede snebolde", himmellegemer, der for 4,1 til 3,85 milliarder år siden under "Det Store Bombardement"bidrog med det meste af klodens vand. Det er stadig et helt åbent spørgsmål om det store bombardement har haft en direkte indflydelse på det aller-tidligsteliv- for eksempel som at plante livet på Jorden eller som den aller-førstemasseudslettelse.
Egenskaber[redigér|rediger kildetekst]
Vands dipolære karakter[redigér|rediger kildetekst]
Et vigtigt træk ved vand er dets polære karakter. Vandmolekylet danner en vinkel med brintatomerne for enden af 'benene' og iltatomet ved vinkelspidsen. Dailthar en højereelektronegativitetendbrint,får iltenden af molekylet en negativ ladning i forhold til brintenden. Et molekyle med sådan en forskel i ladning kaldes endipol.Den samme forskel gør, at vandmolekylerne tiltrækker hinanden (de forholdsvis positive brintender tiltrækkes af de forholdsvis negative iltender) og andre polære molekyler. Denne tiltrækning er kendt sombrintbinding eller hydrogenbinding.Vand kan betragtes som enpolymeraf vandmolekyler.
Den forholdsvis svage tiltrækning (set i forhold til dekovalentebindinger inden i vandmolekylet selv) medfører fysiske egenskaber f.eks. et meget højtkogepunkt,da der kræves en hel delvarmeenergifor at bryde brintbindingerne mellem molekylerne.Svovler grundstoffet lige neden under ilt i detperiodiske system,men dets tilsvarende forbindelse,svovlbrinte(brintsulfid, H2S), har ikke brintbindinger, og selv om stoffet har dobbelt så høj enmolekylvægtsom vand, optræder det somgasved stuetemperatur. Den ekstra binding mellem vandmolekylerne giver desuden vand en højvarmekapacitet.
Andre konsekvenser af vands hydrogenbindinger er vands højevarmefylde,smeltevarmeogfordampningsvarme,der medfører at flydende vand virker som envarmepuffer,der stabiliserer Jordens temperatur.
Derudover giver brintbindingerne vand en usædvanlig reaktion, når det fryser. Væsken bliver – som hos de fleste andre materialer – mere tung med faldende temperatur. Men i modsætning til de fleste andre stoffer medfører brintbindingerne, at molekylerne under den omflytning, der sker for at mindske deresenergived afkøling tæt på frysepunktet, i stedet danner en struktur, der fylder mere og har en lavere massefylde: derfor kan den faste form, is, flyde på vand. Mens de fleste andre stoffer krymper ved overgang til fast form, udvider vand sig, når det størkner. Flydende vand har sin største tæthed (vægt) ved en temperatur på 4 °C. Det har en interessant konsekvens for vandlevende væsner ved vintertide. Vand, som afkøles ved overfladen, bliver tungere og synker ned. Det fremkalderkonvektionsstrømme,der afkøler hele vandmassen, men når vandets temperatur kommer under 4 °C, bliver vandet på overfladen lettere og flyder ovenpå som et lag, der til sidst danner is. Da den nedadgående konvektionsstrømning af koldt vand blokeres, når skiftet i vægt finder sted, vil enhver større vandmasse, der fryser til om vinteren, have hovedparten af sit vand i flydende form ved 4 °C neden under isoverfladen.
Dette gør det muligt for fisk og andre dyr at overleve under isen. Det er i øvrigt også ét af de vigtigste eksempler på de fint afpassede fysiske egenskaber, som understøtter liv på Jorden. Det bruges som begrundelse for detantropo-kosmologiske princip. En yderligere konsekvens er, at is smelter, når den kommer under tilstrækkeligt tryk.
Vands dipolære karakter medfører desuden, at mangeioneri vandig opløsning krystalliserer til fast stof under systematisk indlejring af vandmolekyler i krystalstrukturen. Man kalder vandmolekyler, der sidder mellemionernei enkrystalsiongitter,forkrystalvand.Normalt kan man ikke se på en krystal eller et salt, om det indeholder krystalvand, men hvis et stof med krystalvand opvarmes, kan man både se og høre, at krystalvandet undviger fra iongitteret. I forbindelse hermed ændres gitterstrukturen.
Vand som opløsningsmiddel[redigér|rediger kildetekst]
Vand er også et godtopløsningsmiddelpå grund af dets polaritet og dets evne til at dannehydrogenbindinger.Når en forbindelse iionformeller polær form blandes med vand, bliver den omgivet af vandmolekyler. Deres relativt ringe størrelse tillader typisk mange vandmolekyler at samle sig om ét molekyle af det opløste stof. De delvis negative dipoler i vandet tiltrækkes af de positivt ladede dele af stoffet og omvendt for de positive dipoler.
I almindelighed kan ioniserede og polære stoffer som f.eks.syrer,alkoholerogsalteletopløsesi vand, modsat ikke-polære stoffer somfedtstofferogolier.De ikke-polære molekyler samles i vandet, da det er energimæssigt mere fordelagtigt for vandmolekylerne at bindes til hinanden ved brintbindinger snarere end at dannevan der Waals-forbindelsermed ikke-polære molekyler. Et eksempel på et ioniseret stof erbordsalt(natriumklorid, NaCl); stoffet deles i Na+-kationerog Cl--anioner,der begge omgives af vandmolekyler. Derefter kan ionerne let flyttes fra deres krystalgitter ud i opløsningen. Et eksempel på et ikke-ioniseret stof er sukker. Vand-dipolerne knyttes ved hjælp af brintbindinger til dipolære områder af sukkermolekylet og tillader, at det føres ud i opløsningen.
Vandets evne til at opløse stoffer er afgørende i biologiske sammenhænge, da mangestofskifteprocesserkun kan foregå i opløsning (f.eks. reaktionerne icytoplasmaetog iblodet).
Sammenhængsevne og overfladespænding[redigér|rediger kildetekst]

Hydrogenbindingernegiver vandet en stor sammenhængsevne og derfor også en høj overfladespænding. Dette ses klart, når små mængder vand anbringes på en overflade, der ikke kan opløses, og vandet samler sig idråber.Denne egenskab er vigtig for vandets transport op gennemvedkarrenei planternes stængler. De stærke bindinger mellem molekylerne holder vandsøjlen sammen og udligner trykforskelle gennem sugekraften, der er fremkaldt af fordampning fra plantens overflade. Andre væsker med en lavere overfladespænding ville have tilbøjelighed til at blive revet fra hinanden, hvad der kunne fremkaldevakuumeller luftlommer og gøre transport i vedkarrene umulig.
Et specielt udtryk for vands egenskaber er den såkaldte “vandbro”.[6]
Varmefylde[redigér|rediger kildetekst]
Bemærk at flydende vand (H2O) har en ganske højvarmefyldei forhold til andre stoffer der er almindelige på jordoverfladen. Dette er grunden til at klimaet i egne der er omgivet af meget hav, f.eks.Danmark,er mere temperatur-stabilt end det mere ekstremefastlandsklima.Man kunne sige at vand er en varmepuffer, der begrænser temperaturens udsving på Jorden.
Isens massefylde[redigér|rediger kildetekst]
En af de interessante egenskaber ved H2O er, at is har en mindre massefylde (densitet) end vand. Vands massefylde er på præcis 1,000 g/cm3ved 3,8 grader Celsius, mens massefylden af is er 0,917 g/cm3ved 0 grader Celsius. Årsagen er, at isen har en åben krystalstruktur. H2O er et af de få stoffer, der har denne egenskab.
Putter man f.eks. en isterning ned i et glas vand, vil man iagttage, at isterningen flyder i vandoverfladen, hvilket netop skyldes massefyldeforskellen mellem is og vand.
Denne usædvanlige opførsel har stor betydning for livet i søer og have. Om vinteren fryser åbne vande til fra oven. Det opbyggede islag virker herefter som isolator, der forhindrer bundfrysning på nær i meget lavvandede søer og have. Det betyder, at vandlevende dyr kan overleve måneders isdække.
En af ulemperne ved, at H2O udvider sig ved overgangen fra flydende til fast form, er faren for frostsprængning afvandrørogvandbeholdere.Om vinteren er det derfor nødvendigt at holde temperaturen lidt over 0 °C i alle huse eller at tømme rør og beholdere for vand.
Ledeevne[redigér|rediger kildetekst]
Rent vand er i virkeligheden isolerende, dvs., at det ikke lederelektrisk strømsærlig godt. Da vand er så effektivt et opløsningsmiddel, indeholder det oftest nogle stoffer i opløsning (f.eks. forskellige salte). Hvis vand har den slags urenheder i sig, er det derimod en god leder for elektrisk strøm. Fordi der er frie ioner i vandet, der bliver elektrisk ladede.
Elektrolyse[redigér|rediger kildetekst]
Vand skilles i sine to bestanddele, brint og ilt, når en elektrisk strøm passerer gennem det. Processen kaldeselektrolyse.Vandmolekyler dissocierer naturligt i H+- og OH--ioner, der trækkes hen mod henholdsviskatodenoganoden.Ved katoden optager to H+ioner hver en elektron og dannerH2gas (brint). Ved anoden samles fire OH--ioner og frigiverO2gas (ilt), molekylært vand og fireelektroner.Gasserne bobler op mod overfladen og kan samles op der.
Reaktion[redigér|rediger kildetekst]
Kemisk set er vandamfoterisk:det er i stand til at virke både somsyreogbase.Ved etpHpå 7 (neutral) er koncentrationen af hydroxyd-ioner (OH-) lig med mængden af hydronium- (H3O+) og brintioner (H+) tilsammen. Hvis denne ligevægt forskydes, bliver vandet surt (højere koncentration af hydronium- og brintioner) eller basisk (højere koncentration afhydroxidioner).
I teorien har rent vand et pH på 7, men i virkeligheden er det svært at skaffe helt rent vand. Når vand er i kontakt med luft selv i kort tid, opløser detCO2og danner en fortyndet kulsyre. Det medfører en pH-sænkning til ca. 5,7 ved normalt atmosfærisk partialtryk af CO2.Højere partialtryk af CO2medfører lavere pH, mens lavere partialtryk medfører højere pH (op til pH 7 ved partialtryk på 0), jf.havenes forsuringved den globale stigning af asmosfærens CO2-indhold.
Vandrensning[redigér|rediger kildetekst]

Renset vand bruges til mange industrielle formål, men også i husholdningen. Mennesker har brug for vand, der ikke indeholder alt for meget salt eller andre urenheder. De almindeligste urenheder omfatter kemikalier og skadeligebakterier.Nogle slags opløste stoffer er acceptable eller tilmed ønskværdige for at fremhæve smagen. Vand, der er egnet til drikkebrug, kaldesdrikkevand. Gængse metoder til rensning af vand er:
- Filtrering,hvor vandet passerer ensimed tilstrækkeligt fin maskestørrelse. Selv om filtrering ikke renser vand, kan det være et nødvendigt første skridt for at undgå, at partikler forhindrer den egentlige rensning.
- Kogning,hvor vandet bringes i kog længe nok til at uskadeliggjort eller dræbemikroorganismer.Kogning kan også fjerne” "hårdhed"”i vandet ved, atkalkudfældes somkedelsten.Metoden fjerner dog ikke andre mineralske stoffer fra vandet.
- Filtreringmed aktivt kul (setrækul). Det er den mest brugte metode til rensning af vand i husholdninger ogakvarier.
- Destillation,hvor vandet bringes i dampform vedkogning,hvorefter dampen fortættes under afkøling. På denne måde kan man levere næsten helt rent vand (99,9%), men enkelte stoffer vil dog følge med vanddampen og fortættes sammen med den. Sealkohol.
- Omvendt osmoseer en metode, hvor man udnytter en såkaldt halvgennemtrængelig hinde (semipermeabel membran). Ved normalosmosevil vandet af egen kraft bevæge sig gennem hinden i retning fra den svageste til den stærkestekoncentrationaf opløste stoffer. Ved omvendt osmose sætter man den forurenede vandmængde under et tryk, der er stærkt nok til at presse vandet i modsat retning. Hinden bruges altså som etfilter.
- Demineraliseringer en proces, hvor vandet passerer et filter medharpiksagtigestoffer, der bindermetalioner.På den måde kan man fremstille store mængder blødt, om end ikke helt rent, vand.
Mytologi[redigér|rediger kildetekst]
Netop fordi vand er nødvendigt for livet på Jorden, har det altid haft en central rolle i mytologi og folkesagn.
Førhen dansede mange nordamerikanske indianerstammer regndans i tørketider i håb om, at det ville bringe dem regnvand. Bibelen har historien om syndfloden, der truer med at udrydde livet på Jorden, hvilket Noas ark forhindrer. Et andet bibelsk eksempel er, da Moses får havet til at dele sig og danne en tør flugtvej, ad hvilken han og hans følge kan undslippe Faraos hær.
Nogle religioner havde havguder. Nordboernes havgud hedNjord,romernesNeptunog grækernesPoseidon.
Vand er blevet opfattet som et af de grundelementer, alt er opbygget af. Ifølgekelternevargrundelementerne:jord,vand ogild.De fire klassiskegræske elementer varjord,vand,luftog ild, og de fem kinesiske grundelementer varmetal,træ,vand,luftog ild.

Se også[redigér|rediger kildetekst]
Referencer[redigér|rediger kildetekst]
- ^den store danske vand - Molekylets fysiske egenskaber og kredsløb - lex.dk
- ^dhmo.org(engelsk)
- ^iupac.org: Red Book 2005Citat: "...[side 85] H2O oxidane b,c...",backup
- ^pubchem.ncbi.nlm.nih.gov: water SynonymsCitat: "...oxidane..."
- ^This strange, ancient water in Canada could host 'alien' life. ScienceAlert
- ^Forskerens favorit: Den flydende vandbro. Videnskab.dk 2019
Eksterne henvisninger[redigér|rediger kildetekst]
| Søsterprojekter med yderligere information: |
- K. Høeg-Smith & S. Brogaard: "The Energy of Raindrops" (Geografisk Tidsskrift,bind 75 (1976); s. 24-29)
- Water, Ice, and Vapour - vands forunderligere egenskaber (engelsk)
- Viden om vandArkiveret26. september 2007 hosWayback Machine– Permanent tema påPDFnet.
- Flydende vands massefylde som funktion af temperaturenArkiveret2. juni 2004 hosWayback Machine
- Universets største vandreservoirArkiveret5. marts 2012 hosWayback Machine
- http:// worldwaterforum.org/
- http:// unesco.org/water/wwap/
- http://unesdoc.unesco.org/images/0012/001295/129556e.pdf
- http:// physics.adelaide.edu.au/%7Edkoks/Faq/General/hot_water.htmlArkiveret21. januar 2013 hosWayback Machine~ Kan varmt vand fryse hurtigere end koldt?
- Water Structure and Behavior. Martin ChaplinCitat: "...Liquid water...is the most remarkable substance...A number of explanations of the complex behavior of liquid water have been published, many quite recently..."
- 2004-07-14, Sciencedaily: Some Of The Biggest Raindrops On Record Found In Both Clean And Dirty AirCitat: "...The largest ones were at least 8 millimeters in diameter..."
- En humorisitsk side om hvor farligt vand er
- Sådan renser vi regnvandet mest effektivt. Videnskab.dk 2013
- Oldest Water on Earth Found Deep Underground. Livescience
- Vand fryser til is ved minus 41 grader Celsius | Ingeniøren
| Infoboks uden skabelon Denne artikel har en infoboks dannet af en tabel eller tilsvarende. |
