Amine
AlsAminewerdenorganischeVerbindungen bezeichnet, die letztlich Derivate desAmmoniaks(NH3) sind und bei denen ein, zwei oder alle drei Wasserstoffatome des Ammoniaks durchAlkylgruppenoderArylgruppenersetzt sind oder sich zu mehr oder weniger unterschiedlichen heterocyclischen Ringsystemen zusammengeschlossen haben. Da Amine noch dazu auch mehr als ein N-Atom enthalten können, ist die Anzahl von möglichen Aminen so groß und ihre Strukturen sind so unterschiedlich, dass man Strukturen und Eigenschaften nicht in einem einzigen Artikel darstellen kann. Auf cyclische Amine wird hier nur am Rande eingegangen; deshalb sei verwiesen auf den ArtikelHeterocyclen.
Systematik nicht-cyclischer Amine
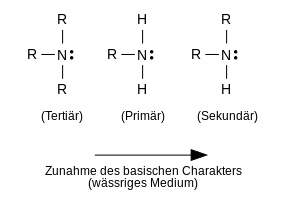
[Bearbeiten|Quelltext bearbeiten]Generell kann man drei große Typen von nicht-cyclischen Aminen unterscheiden. Entsprechend der Anzahl derWasserstoff-Atome, die im Ammoniak gegen organische Alkyl- oder Arylgruppen ausgetauscht wurden, spricht man von primären, sekundären und tertiären Aminen. Diese drei Typen können zusätzlich je nach Art der an das N-Atom gebundenen Gruppen noch genauer als aliphatische,aromatische,oder auch als gemischt aliphatisch-aromatische Amine bezeichnet werden. Wenn das an das N-Atom gebundene C-Atom Teil einer C-C-Doppelbindung ist, wie z. B. imEthenamin,werden die Verhältnisse kompliziert, denn solche Verbindungen bildentautomere Formen.
Amine können auch zwei an verschiedene C-Atome gebundene N-Atome (Aminogruppen) enthalten; dann spricht man vonDiaminen,die auch verschiedenen Typs sein können. Wenn – wie bei einem aliphatischen, sekundären Amin – zwei an ein N-Atom gebundene Alkylgruppen vorhanden sind, können beide Alkylgruppen auch zu einem Ring geschlossen sein. Dann spricht man von cyclischen sekundären Aminen, wie z. B. beimPiperidin.Auch bei den Diaminen kann der Ringschluss erfolgen, wie z. B. beimPiperazin.Solche cyclischen Amine ohne C-C-Doppelbindungen im Ringsystem gehören zwar zu der sehr großen und sehr variablen Gruppe der heterocyclischen Amine, verhalten sich aber wie normale, nicht cyclische Amine.
Alle Amine können durchAlkylierungin quartäre Ammoniumverbindungen umgesetzt werden. Quartäre Ammoniumverbindungen sind also keine Amine, sondern gehören zu einer weiteren, eigenen Verbindungsklasse, die sich von den jeweiligen Aminen ableiten. Die in der Tabelle am Ende gezeigte quartäre Ammoniumverbindung ist also kein Amin, sondern ein quartäres Ammoniumsalz des einfachsten Typs.
| Amine und Ammoniumsalze | |||||
|---|---|---|---|---|---|
| Typen | Funktionelle Gruppe | Beispiel | |||
| primäreAmine | R–NH2 | primäreAminogruppe | R–NH2 | Methylamin | 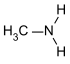
|
| sekundäreAmine | RNH–R | sekundäre Aminogruppe | R–NH-R | Dimethylamin | 
|
| tertiäreAmine | NR3 | tertiäre Aminogruppe | R–NR2 | Trimethylamin | 
|
| keine Amine, sondern quartäre Ammoniumverbindungen |
NR4+(X−) | quartäre Ammoniumgruppe | R–NR3+ | Tetramethyl- ammoniumchlorid |
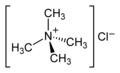
|
| Weitere Beispiele: sieheKategorie:AminundKategorie:Quartäre Ammoniumverbindung | |||||
Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Chemische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Aliphatische Amine
[Bearbeiten|Quelltext bearbeiten]
Wie Ammoniak sind alle aliphatischen Amine mehr oder weniger starkeBasen,weil ein Proton an dasfreie Elektronenpaardes N-Atoms angelagert werden kann. Ein Maß für die Basenstärke des Amins ist dieBasenkonstantedes Amins bzw. dieSäurekonstantedes zugehörigen Ammoniumkations, ausgedrückt durch den-Wert der Base, bzw. durch den-Wert des Ammoniumkations. Diese Werte geben Auskunft über die Lage des folgenden Gleichgewichts für dieProtonierungeines primären Amins durch Wasserund damit Auskunft über die Basenstärke des Amins bzw. über die Säurestärke des zugehörigen Ammoniumkations:
Da die durch die Protonierung entstehendenAmmoniumkationenmeist besser in Wasser löslich sind als die ursprünglichen Amine, ist die Extraktion mit wässriger Salzsäure die einfachste Methode zur Abtrennung der Amine von anderen nicht basischen organischen Substanzen. Die Art der Substitution und der Substitutionsgrad kann die Basizität von Aminen stark beeinflussen. Bei aliphatischen Aminen erhöhen Alkylgruppen als Substituenten wegen ihres „elektronenschiebenden “Effektes (Induktiver Effekt,+I-Effekt) die Elektronendichte am Stickstoffatom. Man kann also erwarten, dass das freie Elektronenpaar am N-Atom zunehmend leichter protoniert wird, wenn die Anzahl von Alkylgruppen am N-Atom (Substitutionsgrad) steigt. Das trifft jedoch nur dann zu, wenn keine weiteren störenden Effekte – wie z. B. dieHydratisierungder Amine und der gebildeten Ammoniumkationen durch Wassermoleküle – wirksam werden. Wenn keine Störungen vorliegen, dann spricht man von der sog.Gasphasen-Acidität.Unter solchen wasserfreien Bedingungen nimmt bei aliphatischen Aminen die Basizität wie erwartet mit zunehmender Substitution zu. Damit sind aliphatische Amine auch stärkere Basen als Ammoniak in der Reihenfolge:[1]
- Ammoniak < primär < sekundär < tertiär.
In Gegenwart von Wasser wird bei der Hydratisierung von Ammoniak und der Amine und Ammoniumkationen Hydratationswärme frei, bei primären Aminen am meisten und bei tertiären Aminen am wenigsten. Mit zunehmendem Substitutionsgrad wird offenbar die Hydratisierung sterisch behindert. Diese Effekte führen zu einer veränderten Reihenfolge der Basizität in wässrigen Lösungen:
In wässeriger Lösung zeigen aliphatische Amine folgende Reihenfolge der Basizität:
- tertiär < primär < sekundär.
Die geschilderten Abstufungen und die deutlich geringere Basizität tertiärer Amine in wässerigen Lösungen spiegelt sich auch in denund-Werten von Ammoniak und der drei einfachstenAlkylaminewieder.
- Ammoniak:9,25;= 4,75;
- Methylamin:10,6;= 3,4; (alle primären aliphatischen Amine haben ähnliche Werte).
- Dimethylamin:10,8;= 3,2;
- Trimethylamin:9,8;= 4,2;
Aromatische Amine
[Bearbeiten|Quelltext bearbeiten]Während die Basizität aliphatischer Amine wegen des+I-Effektsder Alkylgruppen größer ist als die von Ammoniak, ist die Basizitätaromatischer Aminedeutlich geringer als die Basizität von Ammoniak. Deshalb ist der-Wert des einfachsten aromatischen AminsAnilinmit 9,37 deutlich größer als der von Ammoniak mit 4,75. Durch die Delokalisierung des freien Elektronenpaars am Stickstoffatom in das aromatische System des Phenylrings wird die deprotonierte Form stabilisiert und aromatische Amine sind deutlich schwächer basisch als Ammoniak oder aliphatische Amine (formal ein −M-Effekt). Weitere elektronenabziehende Substituenten am aromatischen Ringsystem des Anilins – wie z. B. dieNitrogruppeinNitroanilinenkönnen die Basizität noch weiter drastisch verringern.
Heterocyclische Amine
[Bearbeiten|Quelltext bearbeiten]Die Eigenschaften cyclischer Amine sind je nach Art der Ringsysteme, die aus mehreren unterschiedlich verknüpften Ringsystemen verschiedenster Art bestehen können, sehr unterschiedlich und können nicht allgemein beschrieben werden. So verhalten sich z. B. cyclische Amine mitnichtaromatischenRingsystemen ohne Doppelbindungen, wie z. B.Piperidin,wie normale sekundäre, aliphatische Amine. Dagegen verhält sich das cyclische Amin mit einem Ringsystem und drei konjugierten Doppelbindungen, dasPyridin,nicht wie ein normales tertiäres aliphatisches Amin. Amine dieser Art sind auch Basen, haben aber sehr unterschiedliche Eigenschaften und bilden eine eigene, neue Verbindungsklasse: aromatische, heterocyclische Amine.
Physikalische und physiologische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Aliphatische Amine wieMonomethylamin,DimethylaminundTrimethylaminsowieEthylaminsind bei Raumtemperatur gasförmig. Viele weiterehomologe Verbindungensind flüssig und einige noch höhere homologe Amine, wie z. B.Decylaminsind bei Raumtemperatur fest.
Das einfachste aromatische AminAnilinist flüssig. Viele substituierte Aniline und andere aromatische Amine mit mehreren aromatischen Ringsystemen, wie z. B.Naphthylaminesind fest.
Infolge ihrer Polarität undBasizitätsind Amine besser in Wasser löslich als Kohlenwasserstoffe mit gleicher Anzahl von C-Atomen. Mit steigender Länge der Alkylketten nimmt die Wasserlöslichkeit aliphatischer Amine ab. Aromatische Amine sind nicht in Wasser löslich. Flüssige primäre und sekundäre aliphatische und aromatische Amine sind überWasserstoffbrückenbindungenassoziiert.Dies führt – ähnlich wie beiAlkoholen– zu höheren Siedepunkten im Vergleich zu analogen Kohlenwasserstoffen.
Gasförmige aliphatische Amine reizen die Schleimhäute der Augen und der Atemwege. Bei der Benetzung der Haut mit flüssigen Alkylaminen kommt es ebenfalls zu Verätzungen. Vergiftungen durch Einatmen höherer Konzentrationen können Blutdrucksteigerung und kurzdauernde Krämpfe bewirken. Aromatische Amine sind wegen ihrer geringeren Basizität und geringeren Flüchtigkeit zwar nicht reizend, sind aber im Vergleich zu aliphatischen Aminen deutlich giftiger, wie z. B.Anilin.
Gasförmige aliphatischen Amine besitzen einen dem Ammoniak ähnlichen, aber zusätzlich „fischigen, fauligen “Geruch. Höhere Homologe und aromatische oder heterocyclische Amine besitzen ebenfalls von Menschen als unangenehm empfundene Gerüche, etwa nach Fäkalien (Indol,Skatol), oder nach verwesendem Fleisch (Cadaverin,Putrescin), nach Urin oder altem Fisch (Methyl-,Ethyl- undTrimethylamin). Solche Verbindungen können als Zwischen- oder Endprodukte beimanaerobenAbbau von biologischem Material, insbesondere vonProteinen,oder durchDecarboxylierungvonAminosäurenentstehen. Für den charakteristischen Geruch vonSpermaistSpermin– ein lineares Polyamin – mit zwei primären und zwei sekundären Aminogruppen, verantwortlich.
Andererseits gehören aber auch viele Arzneimittel zur Gruppe der Amine, besonders häufig zur Untergruppe der heterocyclischen Amine, wie z. B.Atropin,Amphetamin,Chinin,CodeinundCoffein,aber auch Drogen, wie z. B.Methamphetamin,Kokain,Nicotin.
Herstellung, Entstehung
[Bearbeiten|Quelltext bearbeiten]Die Vorstellung, dass Amine durchAlkylierungvon Ammoniak z. B. mitAlkylhalogenideneinfach darstellbar sind, ist eine Fehleinschätzung, nicht nur weil Ammoniak gasförmig ist. Bei der Alkylierung von Ammoniak würden Gemische aller Alkylierungsstufen entstehen, da die zunächst gebildeten primären Amine sogar bevorzugt weiter alkyliert werden zu sekundären Aminen, diese zu tertiären Aminen und diese zuletzt zu quartären Ammoniumsalzen.
Primäre Amine
[Bearbeiten|Quelltext bearbeiten]Zur gezielten Darstellung von primären Aminen gibt es folgende wichtige Methoden:
- Häufig wird dieGabriel-Synthesebenutzt. Bei dieser Reaktion wird zunächstPhthalimidmit dem entsprechenden Alkylhalogenid umgesetzt und das entstandene Alkyl-Phthalimid anschließend mitNatronlaugedurchHydrolyseoder besser mitHydrazindurchHydrazinolyseaufgearbeitet, um das primäre Amin freizusetzen.
- Als Alternative können Alkylhalogenide mitNatriumazidzuAlkylazidenumgesetzt werden, die dann anschließend mitLithiumaluminiumhydridzu primären Aminen reduziert werden.
- Unter Kettenverlängerung erfolgt die Umsetzung eines Alkylhalogenids mitNatriumcyanidzumNitril,das anschließend zum primären Amin reduziert wird.
- BeimCarbonsäureamid-Abbau nachHofmannentstehen ebenfalls primäre Amine, wobei aber die Kohlenstoffkette um ein Kohlenstoffatom verkürzt wird.
- Eine weitere Möglichkeit der Synthese für primäre Amine unter Kettenverkürzung ist dieCurtius-Reaktion,bei der das Amin über den Abbau eines Acylhydrazids hergestellt wird.[2]
Sekundäre Amine
[Bearbeiten|Quelltext bearbeiten]- Sekundäre Amine lassen sich aus primären Aminen darstellen, indem das primäre Amin R'-NH2 mit einem Aldehyd R-CH=O zumImin(R-CH=N-R') umgesetzt wird, das anschließend durchHydrierungderDoppelbindungzum sekundären Amin reduziert wird.
Tertiäre Amine
[Bearbeiten|Quelltext bearbeiten]Zur Herstellung von tertiären Aminen eignet sich dieLeuckart-Wallach-Reaktion.
Aromatische Amine
[Bearbeiten|Quelltext bearbeiten]Aromatische Amine werden durchNitrierungund anschließende Reduktion hergestellt (z. B.Anilin,Toluidin).
Technische Verfahren
[Bearbeiten|Quelltext bearbeiten]- Technische Verfahren zur Herstellung von Aminen sind Umsetzungen von Ammoniak mit Alkoholen (→sieheAlkoholaminierung), bei denen z. B. Alkylamine wie Methyl- und Ethylamin entstehen, die dann getrennt werden müssen. Auch Aldehyde bzw. Ketone können mit Ammoniak umgesetzt werden, wobei z. B. Isopropylamine entstehen. Durch weitere Alkylierungen mit Chloralkanen entstehen insbesondere Feinchemikalien und quartäre Ammoniumsalze.
- Die Reduktion von Nitrilen liefert z. B. Fettamine
- Im großtechnischen Maßstab wird die Umsetzung vonEpoxidenmit Aminen bzw. Ammoniak durchgeführt. Dabei entstehenEthanolamine,Isopropanolamine etc.
- Die Nitrierung von Alkanen und anschließende Reduktion zum Alkylamin sowie die Hydroaminierung von Olefinen hat technisch nur eine geringe Bedeutung. Sie werden jedoch beide ebenfalls im technischen Maßstab betrieben.
Biologische Prozesse
[Bearbeiten|Quelltext bearbeiten]- Bei biologischen Vorgängen können Amine bei Abbau- und Verwesungsprozessen durchDecarboxylierungvonAminosäurenentstehen.
Die im Eiweiß (z. B. vonFischen) peptidisch gebundenen Aminosäuren werden nach dem Tod der Tiere biochemisch zu Aminen undKohlendioxidabgebaut. Amine sind für den charakteristischen Geruch von Fischen verantwortlich, der bisweilen als unangenehm empfunden wird. Fisch wird oft mit einem Stückchen Zitrone serviert. Wie alle Säuren protoniert auchCitronensäureAmine unter Bildung von Citraten (Salze der Citronensäure) und kann so den Amingeruch vermindern.
Vorkommen
[Bearbeiten|Quelltext bearbeiten]- Amine kommen in Pflanzen, Tieren und im Menschen natürlich vor und werden dann als biogene Amine bezeichnet, die aus Aminosäuren durch Decarboxylierung entstehen können. Biogene Amine haben eine große Bedeutung alsGewebshormone,wie z. B.HistaminundSerotonin,die aus den AminosäurenHistidinbzw.Tryptophanentstehen. Diese beiden Aminosäuren gehören zu den basischen Aminosäuren, die neben der obligatorischen α-ständigen Aminogruppe durch zusätzliche Aminogruppen gekennzeichnet sind. Im Histidin ist der Ring des heterocyclischen AminsImidazoldie zusätzliche basische Gruppe, im Tryptophan ist das heterocyclische AminIndoldie zusätzliche basische Gruppe.
- AlsNeurotransmitter-Substanzen kann man dieKatecholaminebezeichnen, zu denen die primären aliphatischen AmineDopaminundNoradrenalingehören. Beide Verbindungen enthalten jeweils auch noch ein zusätzliches aromatisches Ringsystem. Das Adrenalin ist dem Noradrenalin sehr ähnlich, ist aber zusätzlich am N-Atom methyliert und ist damit ein sekundäres aliphatisches Amin.
- Weiterhin findet man heterocyclische Amine wiePurinundPyrimidinals sogenannteNucleinbasenin den strukturellen Grundbausteinen derNucleosidein der DNA.
- Aminosäuren, die Bausteine vonPeptiden,sind keine Amine und auch keine Carbonsäuren. Sie enthalten zwar diefunktionellen Gruppender beiden Verbindungsklassen, zeigen aber nicht deren typischen Eigenschaften.
Chemische Reaktionen
[Bearbeiten|Quelltext bearbeiten]Amine reagieren mitSalpetriger Säureje nach Art des eingesetzten Amins zu unterschiedlichen Produkten.
- Primäre aliphatische und aromatische Aminereagieren zuDiazoniumsalzen,die als Ausgangsprodukte für weitere Synthesen vielfältig genutzt werden können.
- Sekundäre Aminereagieren mit sogenannten nitrosierenden Agentien (Salpetrige Säure,Stickstoffoxide,Nitrite) vor allem im sauren Milieu, wie es etwa im menschlichen Magen herrscht, zuNitrosaminen.Da sekundäre Amine in Nahrungsmitteln vorkommen und Nitrosamine cancerogene Wirkung haben, verdient diese Reaktion Beachtung.
Auchtertiäre aliphatische Aminekönnen unter Abspaltung einer Alkylgruppe langsam zu Nitrosaminen reagieren;[3]aromatische tertiäre Amine reagieren mit den elektrophilen nitrosierenden Agentien am aromatischen Ringsystem, und es entstehen aromatischeNitrosoverbindungen.
- Als elektronenreiche Verbindungen sind aromatische Amine reaktive Reaktionspartner fürelektrophile aromatische Substitutionen.
- Amine sindReaktantenbei zahlreichennukleophilen Substitutionsreaktionenbeispielsweise bei der Bildung vonCarbonsäureamiden,CarbonsäureimidenoderLactamenundIminen.Deswegen können Amine alsSchutzgruppenvonCarbonylverbindungeneingesetzt werden oder alschirale Auxiliare.
- BeiEliminierungenwerden voluminöse sekundäre oder tertiäre Amine als Protonenakzeptoren genutzt, die zwar basisch, aber nicht nucleophil sind.
- Weiterhin finden Amine, meistDiamineoder Triamine, Anwendung alsLigandenin derKomplexchemie.
Verwendung
[Bearbeiten|Quelltext bearbeiten]- Aromatische Amine werden zur Herstellung vonAzofarbstoffenverwendet.
- Amine sind Bausteine für Agro- und Pharmachemikalien sowie fürTenside,Beschichtungen und Schmierstoffe.
- Im Bereich der Gießereitechnik finden Amine als Katalysatoren Anwendung, um den Aushärtvorgang der Bindemittel im Formsand bei der Kernherstellung nach dem Cold-Box-Verfahren zu beschleunigen.
- Als Katalysatoren dienen Amine und Diamine auch zur Herstellung und zur Vernetzung vonPolyurethanen.Ihre puffernde Wirkung wird genutzt, wenn sie in wässrigen Systemen als Korrosionsinhibitoren eingesetzt werden.
- Ein weiteres wichtiges Anwendungsfeld für Amine ist die Gaswäsche in Raffinerien und Kraftwerken.
Nachweis von Aminen
[Bearbeiten|Quelltext bearbeiten]- Zum Nachweis von Stickstoff in einer organischen Verbindung kann einNatrium-Aufschlussder zu untersuchenden Substanz durchgeführt werden. In der neutralisierten Aufschluss-Lösung kann Stickstoff alsCyanidmit derLassaigne-ProbealsBerliner Blaunachgewiesen werden, oder, falls die Substanz gleichzeitig Schwefel enthielt, alsThiocyanatmitEisen(III)-chlorid.Diese Nachweise sind allerdings nicht spezifisch für Amine, sondern zeigen nur an, dass die Analysensubstanz Stickstoff enthielt.
- Amine sind oft schon durch ihren charakteristischen stechenden oder unangenehmen Geruch (ammoniakartig bis fischig) erkennbar. Das reicht aber für einen Nachweis nicht aus.
- Um denSubstitutionsgraddes Amins zu bestimmen, also ob ein primäres, sekundäres oder tertiäres Amin vorliegt, wird dieHinsberg-Trennungdurchgeführt. Hierbei wird das Amin zump-Toluolsulfonsäureamidumgesetzt:
Tertiäre Amine und quartäre Ammoniumsalze bilden keine Sulfonamide,
Sekundäre Amine bilden Sulfonamide, die nicht in Alkali löslich sind,
Primäre Amine bilden Sulfonamide, die in Alkali löslich sind.
- Die eindeutige Identifizierung eines unbekannten Amins erfolgt entwedermassenspektrometrischoder über ein geeignetesDerivat,dessen charakteristischer Schmelzpunkt bestimmt wird:
- Primäre und sekundäre Amine: Als Derivat eignet sich das aus der Hinsberg-Trennung bereits gewonnene Sulfonamid (siehe oben).
- Tertiäre Amine: Hier ist die Fällung desPikrateszu empfehlen.
Primäre, sekundäre und tertiäre Amine können mittelsHPLCchromatographisch ohne Derivatisierung getrennt werden. Die Detektion und Quantifizierung erfolgt mit einem massenselektiven Detektor (HPLC/MS). Zur eindeutigen Bestimmung von Aminen gleicher molarer Masse (z. B.DiethylaminundButylamin) empfiehlt sich der Einsatz von Standardsubstanzen zur Kalibrierung.
Siehe auch
[Bearbeiten|Quelltext bearbeiten]Literatur
[Bearbeiten|Quelltext bearbeiten]- Hans Beyer,Wolfgang Walter:Lehrbuch der Organischen Chemie.22. Auflage. 1991,ISBN 3-7776-0485-2.
- Autorengemeinschaft:Organikum.22. Auflage. Wiley-VCH, Weinheim, 2004,ISBN 3-527-31148-3.
- Karl Schwister:Taschenbuch der Chemie.Hanser Fachbuchverlag, 2004.
Weblinks
[Bearbeiten|Quelltext bearbeiten]- Pflanzliche Amine.
- Erklärungvom basischen Character von Aminen bei TutorVista.com (englisch).
- Tabellenmit pKb-Werten von verschiedenen Aminen.
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Jonathan Clayden, Stuart Warren, Nick Greeves, Peter Wothers:Organic Chemistry.Oxford University Press, New York 2001,ISBN 0-19-850346-6,S.199–200.
- ↑Louis Frederick Fieser,Mary Fieser:Lehrbuch der organischen Chemie.3. Auflage, Verlag Chemie, 1957, S. 254.
- ↑Eintrag zuNitrosamine.In:Römpp Online.Georg Thieme Verlag, abgerufen am 13. Juni 2014.




