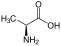
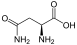
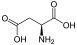
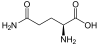
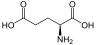
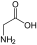
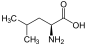
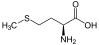
Aminosäuren

(RestRist im Fall vonGlycineinH-Atom)
Aminosäuren(AS), unüblich aber genauer auchAminocarbonsäuren,veraltetAmidosäurengenannt, sindchemische Verbindungenmit einerStickstoff(N) enthaltendenAminogruppeund einerKohlenstoff(C) undSauerstoff(O) enthaltendenCarbonsäuregruppe.[1]Aminosäuren kommen in allen bekanntenLebewesenvor. Sie sind die Bausteine vonProteinen(Eiweiß) und werden frei bei der Zerlegung von Proteinen (Proteolyse).Essentielle Aminosäurenkann ein Organismus nicht selbst herstellen, sie müssen daher mit der Nahrung aufgenommen werden.
Zur Klasse der Aminosäuren zählenorganischeVerbindungen, die zumindest eine Aminogruppe (–NH2bzw. substituiert –NR2) und eineCarboxygruppe(–COOH) alsfunktionelle Gruppenenthalten, also Strukturmerkmale derAmineund derCarbonsäurenaufweisen. Chemisch lassen sie sich nach der Stellung ihrer Aminogruppe zur Carboxygruppe unterscheiden – steht die Aminogruppe amCα-Atom unmittelbar benachbart zur endständigen Carboxygruppe, nennt man diesα-ständigund spricht vonα-Aminosäuren.
Ausgewählte α-Aminosäuren sind die natürlichen Bausteine von Proteinen. Sie werden miteinander zu Ketten verknüpft, indem die Carboxygruppe der einen Aminosäure mit der Aminogruppe der nächsten einePeptidbindungeingeht. Die auf diese Weise zu einemPolymerverketteten Aminosäuren unterscheiden sich in ihrenSeitenkettenund bestimmen zusammen die Form, mit der dasPolypeptidim wässrigen Milieu dann zumnativenProteinauffaltet.DieseBiosynthesevon Proteinen findet in allenZellenan denRibosomennach Vorgabe genetischer Information statt, die in Form vonmRNAvorliegt.
DieBasensequenzder mRNA codiert in Tripletts dieAminosäurensequenz,wobei jeweils einBasentripletteinCodondarstellt, das für eine bestimmteproteinogene Aminosäuresteht. Die hiermit als Bausteine für die Bildung von Proteinen in einer bestimmten Reihenfolge angegebenen Aminosäuren formen die Proteine.[2]Beim Menschen sind es 21 verschiedene proteinogene Aminosäuren, neben den standardmäßig 20 (kanonischen) Aminosäuren auchSelenocystein.Nach derTranslationkönnen die Seitenketten einiger im Protein eingebauter Aminosäuren nochmodifiziertwerden.
Das Spektrum der Aminosäuren geht allerdings über diese rund zwanzigproteinogenenweit hinaus. So sind bisher über 400nichtproteinogenenatürlich vorkommende Aminosäuren bekannt, die biologische Funktionen haben.[3]Die vergleichsweise seltenenD-Aminosäurenstellen hierbei eine spezielle Gruppe dar.[4]Die Vielfalt dersynthetischerzeugten und die der theoretisch möglichen Aminosäuren ist noch erheblich größer.
Einige Aminosäuren spielen alsNeurotransmittereine besondere Rolle, ebenso verschiedene Abbauprodukte von Aminosäuren;biogene Aminetreten nicht nur alsBotenstoffeim Nervensystem auf, sondern entfalten auch alsHormoneundGewebsmediatorenvielfältigephysiologischeWirkungen imOrganismus.
Die einfachste Aminosäure,Glycin,konnte nicht nur auf derErde,sondern auch aufKometen,Meteoritenund inGaswolkeniminterstellaren Raumnachgewiesen werden.[5]
Geschichte
[Bearbeiten|Quelltext bearbeiten]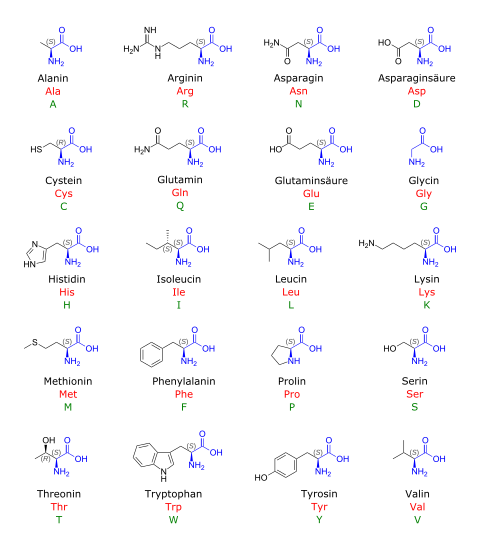
Die erste Aminosäure wurde 1805 im Pariser Labor vonLouis-Nicolas Vauquelinund dessen SchülerPierre Jean Robiquetaus dem Saft vonSpargel(Asparagus officinalis) isoliert und danachAsparagingenannt.[6]Als letzte der üblichen proteinaufbauenden Aminosäuren wurde dasThreonin1931 imFibrinentdeckt sowie 1935 seiner Struktur nach geklärt vonWilliam Rose.Rose hatte durch Experimente mit verschiedenen Futtermitteln herausgefunden, dass die bis dato entdeckten 19 Aminosäuren als Zusatz nicht ausreichten.[7]Er stellte auch dieEssentialitätanderer Aminosäuren fest und ermittelte je die für ein optimales Wachstum mindestenserforderliche Tagesdosis.[8]
In der Zeit zwischen 1805 und 1935 waren viele der damals bekannten Chemiker und Pharmazeuten daran beteiligt, Aminosäuren erstmals zu isolieren sowie deren Struktur aufzuklären. So gelangEmil Fischer,auf den auch dieFischer-Projektionzurückgeht, die finale Aufklärung der Struktur vonSerin(1901),Lysin(1902),Valin(1906) undCystein(1908). AuchAlbrecht Kossel(1896Histidinaus Störsperma),Richard Willstätter(1900Prolinvia Synthese) undFrederick Hopkins(1901TryptophanausCasein) wurden später Nobelpreisträger. Der deutsche ChemikerErnst Schulzeisolierte drei Aminosäuren erstmals – 1877Glutaminaus Rüben, 1881Phenylalaninund 1886ArgininausLupinen– und war an der Strukturaufklärung weiterer Aminosäuren beteiligt. Zuvor hatteHeinrich Ritthausen1866Glutaminsäureaus Getreideeiweiß, demGluten,kristallin gewonnen.Wilhelm Dittmarklärte 1872 die Struktur von Glutamin und Glutaminsäure, deren SalzeGlutamatesind, auf.
Bereits 1810 entdeckteWilliam Hyde WollastondasschwefelhaltigeCystinals „cystic oxide “inBlasensteinen,doch erst 1884Eugen Baumanndas monomereCystein.1819 trennteHenri BraconnotdasGlycinaus Leim ab undJoseph Louis ProustdasLeucinaus Getreide.Eugen von Gorup-Besánezisolierte 1856 dasValinausPankreassaft.Schon 1846 hatteJustus von Liebigaus Casein erstmals dasTyrosinabtrennen können, dessen Struktur 1869Ludwig von Barthklärte. ImHydrolysatdes Casein entdeckteEdmund Drechsel1889 auch dasLysinund späterJohn Howard Mueller1922 das schwefelhaltigeMethioninals 19. Aminosäure, derenStrukturformelGeorge Bargerund Philip Coine 1928 angaben. InMelassehatteFelix Ehrlichschon 1903 als 18. dasIsoleucingefunden, einStrukturisomerdes Leucin.
Friedrich Wöhler,dessenSynthesenin den 1820er Jahren das Gebiet derBiochemieeröffneten, entdeckte keine Aminosäure, doch waren drei seiner Schüler daran beteiligt, neben den erwähnten Gorup-Besánez und Schulze auchGeorg Städeler(1863Serinaus Rohseide). 18 der 20 entdeckten Aminosäuren wurden aus pflanzlichem oder tierischem Material isoliert, nur die beiden AminosäurenAlanin(1850Adolph Strecker) undProlin(Willstätter) durchorganischeSynthese erhalten. Während die Analyse der stofflichen Zusammensetzung bis hin zurSummenformelmit den damaligen Methoden gut zu bewerkstelligen war, konnte dieStrukturformelvieler Aminosäuren oftmals nur durch Teilschritte der Synthese endgültig aufgeklärt werden, was manchmal erst Jahre später gelang. Die Struktur des Asparagins und die vonAsparaginsäureklärteHermann Kolbeerst 1862 auf, 57 Jahre nach der ersten Beschreibung.
Den Gattungsnamen verdanken Aminosäuren zwei funktionellen Gruppen, ihre Einzelnamen mal einem hellen Aussehen (z. B.Arginin,Leucin), einem süßen Geschmack (z. B.Glycin) oder dem Material, in dem sie gefunden wurden (z. B.Asparagin,Cystein,Serin,Tyrosin), Merkmalen der chemischen Struktur (z. B.Prolin,Valin,Isoleucin) bzw. beidem (z. B.Glutamin,Glutaminsäure) und mal auch denEduktenihrer Synthese (z. B.Alanin).[9]
Dass Proteine als Ketten aus Aminosäuren, verbunden durch Peptidbindungen, aufgebaut sind, schlugen zuerst 1902 auf der Versammlung deutscher Naturforscher und Ärzte in Karlsbad gleichzeitig und unabhängig voneinander sowohlEmil Fischerals auchFranz Hofmeistervor (Hofmeister-Fischer-Theorie).[10]
Zu den Pionieren der Chromatographie der Aminosäuren gehören seit Ende der 1940er JahreWilliam Howard SteinundStanford Moore.[11]
Struktur
[Bearbeiten|Quelltext bearbeiten] |
Aminosäuren bestehen aus mindestens zwei Kohlenstoffatomen. Die instabileCarbamidsäurebesitzt lediglich ein Kohlenstoffatom und ist damit keine Aminosäure, sondern ein Kohlensäureamid. Aminosäuren lassen sich in Klassen einteilen je nach dem Kohlenstoffatom, an dem sich dieAminogrupperelativ zur Carboxygruppe befindet. Sind imMolekülmehrere Aminogruppen vertreten, so bestimmt das Kohlenstoffatom, dessen Aminogruppe dem Carboxy-Kohlenstoff am nächsten steht, um welche Klasse von Aminosäuren es sich handelt.
| Allgemeine Struktur von Aminosäuren (R: Seitenkette) |
 |
 |
 |
- α-Aminosäuren:Die Aminogruppe der α-Aminosäuren befindet sich am zweiten Kohlenstoffatom, einschließlich des Carboxy-Kohlenstoffatoms. Die Zählung beginnt immer mit dem Carboxy-Kohlenstoff. Die IUPAC-Bezeichnung lautet daher 2-Aminocarbonsäuren. Der einfachste Vertreter der α-Aminosäuren ist die proteinogene AminosäureGlycin.Alle proteinogenen Aminosäuren sind α-Aminosäuren.
- Mit dem Ausdruck Aminosäuren ist oft eine bestimmte Gruppe von α-Aminosäuren gemeint, die hauptsächlich ausL-α-Aminosäuren besteht: dieproteinogenen Aminosäuren.Diese sind die Bausteine sämtlicher Proteine allen Lebens auf der Erde und neben denNukleinsäurenGrundbausteine des Lebens.
- β-Aminosäuren:Die Aminogruppe der β-Aminosäuren befindet sich am dritten Kohlenstoffatom (das Carboxy-Kohlenstoffatom mitgezählt). Die IUPAC-Bezeichnung lautet 3-Aminocarbonsäuren. Der einfachste Vertreter istβ-Alanin.
- γ-Aminosäuren:Die Aminogruppe der γ-Aminosäuren befindet sich am vierten Kohlenstoffatom (das Carboxy-Kohlenstoffatom mitgezählt). Die IUPAC-Bezeichnung lautet 4-Aminocarbonsäuren. Der einfachste Vertreter istγ-Aminobuttersäure(GABA).
Die Bezeichnung weiterer Klassen der Aminosäuren ergibt sich nach dem gleichen Schema.
Die Aminosäuren einer Klasse unterscheiden sich durch ihreSeitenketteR.Ist die SeitenketteRverschieden von den anderenSubstituenten,die sich am Kohlenstoff mit der Amino-Gruppe befinden, so befindet sich hier einStereozentrumund es existieren von der entsprechenden Aminosäure zweiEnantiomere.Enthält die SeitenketteRselbst weitere Stereozentren, so ergeben sich auchDiastereomereund die Zahl möglicher Stereoisomerer nimmt entsprechend zur Anzahl der weiteren Stereozentren zu. Von Aminosäuren mitzweiverschieden substituierten Stereozentren gibt esvierStereoisomere. Unter bestimmten Bedingungen können alle drei ionogenen Gruppen geladen werden (z. B. Histidin), dann bilden sie Doppelsalze.[12]
Aminoacyl-Gruppe
[Bearbeiten|Quelltext bearbeiten]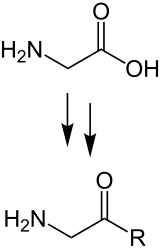 Aminoacyl-Gruppe, gebildet aus der AminosäureGlycin.R bedeutet hier einen Rest, an den die Aminoacyl-Gruppe gebunden ist; beispielsweise wird eine Transfer-RNA(tRNA) so beladen zurAminoacyl-tRNA. |
 Aminoacyl-Gruppe, gebildet aus der AminosäureL-Glutamin.R bedeutet hier einen Rest, an den die Aminoacyl-Gruppe gebunden ist; beispielsweise wird eine Transfer-RNA(tRNA) so beladen zurAminoacyl-tRNA. |
Aminoacyl-Gruppe bezeichnet die einwertige Gruppe, die aus einer Aminosäure durch Entfernen der Hydroxygruppe (–OH) aus der Carboxygruppe (–COOH) entsteht, also das univalente Radikal. Aus einer α-Aminosäure wird so eine α-Aminoacyl-Gruppe gebildet; aus der Aminosäure Tyrosin beispielsweise entsteht so dieTyrosylgruppeals eine spezielle α-Aminoacyl-Gruppe.
Proteinogene Aminosäuren
[Bearbeiten|Quelltext bearbeiten]Alsproteinogene Aminosäurenwerden Aminosäuren bezeichnet, die in Lebewesen als Bausteine derProteinewährend derTranslationnach Vorgabe genetischer Information verwendet werden.[2]Bei der Biosynthese von Proteinen, die an denRibosomeneiner Zelle stattfindet, werden im Zuge derProteinbiosyntheseausgewählte Aminosäuren durch Peptidbindungen in bestimmter Reihenfolge zur Polypeptidkette eines Proteins verknüpft. DieAminosäurensequenzdes ribosomal gebildeten Peptids wird dabei vorgegeben durch die in derBasensequenzeinerNukleinsäureenthaltene genetische Information, wobei nach demgenetischen Codeeine Aminosäure durch einBasentriplettcodiert wird.
 L-Prolin (proteinogene Aminosäure) |
 D-Prolin (nichtproteinogene Aminosäure) |
Die proteinogenen Aminosäuren sind stets α-Aminosäuren. Bis auf die kleinste,Glycin,sind siechiralund treten mit besonderer räumlicher Anordnung auf.[13]Eine Besonderheit weist die AminosäureProlinauf, deren Aminogruppe einsekundäres Aminbesitzt und die sich daher nicht so flexibel in eine Proteinfaltung einfügt wie andere proteinogene Aminosäuren – Prolin gilt beispielsweise als Helixbrecher beiα-helikalenStrukturen in Proteinen. Aufgrund der sekundären Aminogruppe wird Prolin auch alssekundäreAminosäure – öfters fälschlicherweise bzw. veraltet auch alsIminosäure– bezeichnet.
Von den spiegelbildlich verschiedenenEnantiomerensind jeweils nur dieL-Aminosäuren proteinogen (zurD/L-Nomenklatur sieheFischer-Projektion;in Fällen wieHydroxyprolingibt es weitereStereoisomere). Die molekularen Komponenten des zum Aufbau der Proteine notwendigen zellulären Apparats – neben Ribosomen nochtRNAsund diese mit Aminosäuren beladendeAminoacyl-tRNA-Synthetasen– sind selber auch chiral und erkennen allein dieL-Variante.[14]
Dennoch kommen in Lebewesen vereinzelt auchD-Aminosäuren vor. Diese werden jedoch unabhängig von proteinogenen Stoffwechselwegen synthetisiert und dienen nicht dem ribosomalen Aufbau von Proteinen. So wird zum BeispielD-AlanininPeptidoglycanederbakteriellen Zellwandeingebaut oderD-Valinin bakterielle Cyclo-DepsipeptidewieValinomycin.Verschiedene Arten vonArchaeen,Bakterien,PilzenundNacktkiemernverfügen übernichtribosomale PeptidsynthetasengenannteMultienzymkomplexe,mit denen solche (nichtproteinogenen) Aminosäuren in einnichtribosomales Peptideingebaut werden können.[15]
Kanonische Aminosäuren
[Bearbeiten|Quelltext bearbeiten]Für 20 derproteinogenenAminosäuren finden sichCodonsin der (am häufigsten gebrauchten) Standardversion des genetischen Codes. Diese werden daher alsStandardaminosäurenoder auchkanonische Aminosäurenbezeichnet.
InAminosäuresequenzenwerden die Aminosäuren meist mit einem Namenskürzel imDreibuchstabencodeangegeben oder imEinbuchstabencodedurch ein Symbol dargestellt.[16]
Der Einbuchstabencode wurde von IUPAC-IUB auf Grundlage der folgenden Regeln gewählt:[17]
- Wo keine Mehrdeutigkeit besteht, wurden die Anfangsbuchstaben verwendet: C Cystein, H Histidin, I Isoleucin, M Methionin, S Serin, V Valin,[17]
- Wenn eine willkürliche Zuordnung erforderlich ist, haben die strukturell einfacheren Aminosäuren Vorrang: A Alanin, G Glycin, L Leucin, P Prolin, T Threonin,[17]
- FPHenylalanin und R Arginin aRginine wurden phonetisch suggestiv zugeordnet,[17]
- W Tryptophan wurde zugeordnet da der Doppelring optisch an den sperrigen Buchstaben W erinnert,[17]
- K Lysin und Y Tyrosin wurden aufgrund der alphabetischen Nähe zu ihren Initialen L und T zugeordnet (dabei ist zu beachten, dass U wegen der Ähnlichkeit mit V vermieden wurde, während X für unbestimmte oder atypische Aminosäuren reserviert wurde); für Tyrosin wurde zudem die Merkhilfe tYrosine vorgeschlagen,[18]
- D Aspartat wurde willkürlich zugeordnet, wobei als Merkhilfe asparDic acid vorgeschlagen wurde;[19]E Glutamat wurde in alphabetischer Reihenfolge zugeordnet, da es lediglich um eineMethylen–CH2– Gruppe größer ist,[18]
- N Asparagin wurde willkürlich zugeordnet, wobei als Merkhilfe asparagiNe vorgeschlagen wurde;[19]Q Glutamin wurde in alphabatischer Reihenfolge zugeordnet von den noch verfügbaren Buchstaben (zu beachten ist, dass O aufgrund der Ähnlichkeit zu D vermieden wurde), mit der vorgeschlagenen MerkhilfeQlutamine.[19]
| Aminosäure | Acyl- gruppe[16] |
essen- tiell? |
Ø[20]in Proteinen | ||
|---|---|---|---|---|---|
| Name | Abk. | Symbol | |||
| Alanin | Ala | A | Alanyl- | nein | 9,0 % |
| Arginin | Arg | R | Arginyl- | semi | 4,7 % |
| Asparagin | Asn | N | Asparaginyl- | nein | 4,4 % |
| Asparaginsäure | Asp | D | α-Aspartyl- | nein | 5,5 % |
| Cystein | Cys | C | Cysteinyl- | nein* | 2,8 % |
| Glutamin | Gln | Q | Glutaminyl- | nein | 3,9 % |
| Glutaminsäure | Glu | E | α-Glutamyl- | nein | 6,2 % |
| Glycin | Gly | G | Glycyl- | nein | 7,5 % |
| Histidin | His | H | Histidyl- | semi | 2,1 % |
| Isoleucin | Ile | I | Isoleucyl- | ja | 4,6 % |
| Leucin | Leu | L | Leucyl- | ja | 7,5 % |
| Lysin | Lys | K | Lysyl- | ja | 7,0 % |
| Methionin | Met | M | Methionyl- | ja | 1,7 % |
| Phenylalanin | Phe | F | Phenylalanyl- | ja | 3,5 % |
| Prolin | Pro | P | Prolyl- | nein | 4,6 % |
| Serin | Ser | S | Seryl- | nein | 7,1 % |
| Threonin | Thr | T | Threonyl- | ja | 6,0 % |
| Tryptophan | Trp | W | Tryptophyl- | ja | 1,1 % |
| Tyrosin | Tyr | Y | Tyrosyl- | nein* | 3,5 % |
| Valin | Val | V | Valyl- | ja | 6,9 % |
| *Für Kinder und Schwangere essentiell. | |||||
Neben den oben angegebenen Codes werden zusätzliche Zeichen als Platzhalter benutzt, wenn aus derProteinsequenzierungoderRöntgenstrukturanalysenicht auf die genaue Aminosäure geschlossen werden kann.
| Mögliche Aminosäuren | Abk. | Symbol |
|---|---|---|
| Asparagin oder Asparaginsäure | Asx | B |
| Glutamin oder Glutaminsäure | Glx | Z |
| Leucin oder Isoleucin | Xle | J |
| unbekannte Aminosäure | Xaa (selten Unk) | X |
Nichtkanonische Aminosäuren
[Bearbeiten|Quelltext bearbeiten]Zu den natürlich vorkommenden Aminosäuren gehören außer den kanonischen die übrigen alsnichtkanonische Aminosäurenbezeichneten Aminosäuren, wozu proteinogene und nicht-proteinogene zählen. Hierbei lassen sich mehrere Gruppen unterscheiden:


- Zur ersten Gruppe gehören jeneproteinogenenAminosäuren, die durch eineRecodierungdes genetischen Materials in Proteine eingebaut werden. Die 21. und die 22. proteinogene Aminosäure gehören hierzu:Selenocystein(beiEukaryotenund manchenBakterienundArchaeen) undPyrrolysin(bei manchen Bakterien und Archaeen). Für beide Aminosäuren wurden spezifischetRNAs– tRNASecbzw. tRNAPyl– gefunden, die während der Translation einen Einbau am Ribosom möglich machen. DerenAnticodonpaart, abhängig von Strukturelementen im Kontext der mRNA (sieheSecis), mit demCodonUGAbzw.UAG;im Standardcode stellen diese einStopcodondar. Doch nicht alle Organismen verwenden die nichtkanonischen proteinogenen Aminosäuren dieser Gruppe.
Aminosäure Abk. Symbol Pyrrolysin Pyl O Selenocystein Sec U

- Das üblicheStartcodonAUGcodiert für die AminosäureMethionin.Bakterienverfügen neben der tRNAMetüber eine besondere tRNAfMet,die ebenfalls mit Methionin beladen wird und alsInitiator-tRNAdient. Die an tRNAifMetgebundene Aminosäure aber wird in Bakterien amN-TerminusformyliertzuN-Formylmethionin (fMet),noch bevor sie bei derInitiationam Ribosom zur ersten Aminosäure einer Peptidkette werden kann. Dieses Aminosäurederivat Formylmethionin wird daher gelegentlich auch als (23.) proteinogene Aminosäure gezählt. AuchMitochondrienundChloroplastennutzen fMet initial. Dagegen wird es imCytosoleukaryotischerZellen und inArchaeennicht bei der Translation verwendet.[21]
- Eine zweite Gruppe bilden die im engen Sinnnicht proteinogenenAminosäuren, die aus kanonischen Aminosäuren entstehen, wenn der AminosäurerestRnach dem Einbau in Proteine verändert wird, d. h. durch eine der vielfältigenposttranslationale Modifikationen.So kannProlinzuHydroxyprolin,SerinzuO-Phosphoserin,TyrosinzuO-PhosphotyrosinundGlutamatzuγ-Carboxyglutamatumgewandelt werden. Eine wichtige Änderung des Aminosäurerestes stellt auch dieGlykosylierungdar: Hier werdenKohlenhydratresteauf die Aminosäurereste übertragen, wodurchGlykoproteineentstehen.
- Als dritte Gruppe lassen sich die strenggenommennicht proteinogenenAminosäuren fassen, die der Organismus nicht von den kanonischen Aminosäuren unterscheiden kann und die er so anstelle dieser in Proteine unspezifisch einbaut. Dazu gehörtSelenomethionin,das anstelle desMethioninseingebaut werden kann, oder dasCanavanin,das der Organismus nicht vomArgininunterscheiden kann oder auch dieAzetidin-2-carbonsäure,die als giftigesProlin-Analogon wirkt. Viele der Aminosäuren dieser Gruppe sind toxisch, da sie oft zu einerFehlfaltungdes Proteins führen, wodurch die Form und somit die Funktionsfähigkeit des Proteins beeinträchtigt werden kann. So ist Azetidin-2-carbonsäure ein toxischer Bestandteil desMaiglöckchens,wobei sich das Maiglöckchen selber mit einer hochspezifischen Prolyl-tRNA-Synthetasevor dem unkontrollierten Einbau dieser Aminosäure in ihre Proteine schützt.
Der Mensch nutzt neben den 20 kanonischen auchSelenocysteinals proteinogene Aminosäure. Von den 20 kanonischen Aminosäuren werden 12 vom menschlichen Organismus beziehungsweise durch im menschlichen Verdauungstrakt lebende Mikroorganismen synthetisiert. Die restlichen 8 Aminosäuren sind für den Menschen essentiell, das heißt, er muss sie über die Nahrung aufnehmen.
Der Einbau künstlicher, nahezu beliebig gebauter Aminosäuren im Zuge einesProteindesignsist unter anderem über die Ersetzung des Liganden in der entsprechendenAminoacyl-tRNA-Synthetasemöglich.[22]DieseVerfahrensind teilweise so weit fortgeschritten, dass damit gezielt bestimmte Proteine eineMarkierungerhalten können, die beispielsweise das Protein nach Behandlung mit spezifischen Reagenzien zur Fluoreszenz anregen (Beispiel: Einbau von Norbornen-Aminosäure via Pyrrolysyl-tRNA-Synthetase/Codon CUA). Damit ist eine genaue Lokalisierung des Proteins auch ohne Produktion und Reaktion mitAntikörpernmöglich.[23]
Biochemische Bedeutung
[Bearbeiten|Quelltext bearbeiten]Aminosäuren als Bausteine von Proteinen
[Bearbeiten|Quelltext bearbeiten]
L-Aminosäuren sind in derBiochemievon großer Bedeutung, da sie die Bausteine vonPeptidenundProteinen(Eiweißen) sind. Bisher sind über zwanzig sogenannteproteinogeneAminosäuren bekannt. Dies sind zunächst jene 20L-α-Aminosäuren, die als Standard-Aminosäuren durchCodonsvon je dreiNukleinbasenin derDNAnach dem Standard-Codecodiertwerden. Zu diesenkanonischgenannten Aminosäuren sind inzwischen zwei weitere hinzugekommen,SelenocysteinundPyrrolysin.Beide nicht-kanonischen sind ebenfalls α-Aminosäuren, bezogen auf die endständigeCarboxygruppeist dieAminogruppeam unmittelbar benachbarten Kohlenstoffatom gebunden (Cα). Darüber hinaus gibt es noch weitere Aminosäuren, die als Bestandteil von Proteinen oder Peptiden auftreten, jedoch nicht codiert werden.
Aminosäureketten mit einer Kettenlänge unter zirka 100 Aminosäuren werden meist als Peptide bezeichnet, bei den größerenribosomalgebildeten spricht man von Makropeptiden oder Proteinen. Die einzelnen Aminosäuren sind dabei innerhalb der Kette je überPeptidbindungen(Säureamid) verknüpft. Ein automatisiertes Verfahren zur Synthese von Peptiden liefert dieMerrifield-Synthese.
In Form von Nahrung aufgenommene Proteine werden bei derVerdauunginL-Aminosäuren zerlegt. In derLeber[24]werden sie weiter verwertet. Entweder werden sie zur Proteinbiosynthese verwendet oder abgebaut (siehe auch:Aminosäureindex). Die wichtigsten Mechanismen des Aminosäurenabbaus sind:
Essentielle Aminosäuren
[Bearbeiten|Quelltext bearbeiten]Aminosäuren, die einOrganismusbenötigt, jedoch nicht selbst herstellen kann, heißenessentielleAminosäuren und müssen mit der Nahrung aufgenommen werden. Alle diese essentiellen Aminosäuren sindL-α-Aminosäuren. Für Menschen sindValin,Methionin,Leucin,Isoleucin,Phenylalanin,Tryptophan,ThreoninundLysinessentielle Aminosäuren. Seit 1985 wird von der WHO auch die Aminosäure Histidin als essenzielle Aminosäure eingestuft. Es gibt somit neun essenzielle Aminosäuren.[25] Bedingt essentielle odersemi-essentielleAminosäuren müssen nur in bestimmten Situationen mit der Nahrung aufgenommen werden, zum Beispiel während des Wachstums oder nach schweren Verletzungen. Die übrigen Aminosäuren werden entweder direkt synthetisiert oder aus anderen Aminosäuren durch Modifikation gewonnen. So kannCysteinaus der essentiellen Aminosäure Methionin synthetisiert werden. Solange das Vermögen, aus Phenylalanin die AminosäureTyrosinherzustellen, noch nicht ausgereift ist, zählt auch diese neben den anderen zu den essentiellen Aminosäuren im Kindesalter. Aus ähnlichem Grund muss auch bei einerPhenylketonurieTyrosin zugeführt werden. Daneben gibt es andere Erkrankungen, die denAminosäurestoffwechselbeeinträchtigen und die Aufnahme einer eigentlichnicht-essentiellenAminosäure unter Umständen erfordern.
Pflanzen und Mikroorganismen können alle für sie notwendigen Aminosäuren selbst synthetisieren. Daher gibt es für sie keineessentiellen Aminosäuren.[13]

Chemisch-physikalische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Die proteinogenen Aminosäuren lassen sich nach ihren Resten in Gruppen aufteilen (sieheTabellenübersicht der Eigenschaften). Dabei kann eine Aminosäure in verschiedenen Gruppen gleichzeitig auftauchen. In einemMengendiagrammlassen sich die Überlappungen der Gruppen grafisch darstellen.
Die Eigenschaften der Seitenkette von Cystein betreffend haben die Autoren unterschiedliche Ansichten: Löffler[27]hält sie für polar, während Alberts[28]sie für unpolar hält. Richtigerweise handelt es sich bei Schwefel um einHeteroatom,folglich gilt: Die Seitenkette von Cystein hat schwach polare Eigenschaften.
Säure- und Basen-Verhalten
[Bearbeiten|Quelltext bearbeiten]
Aufgrund der basischen Aminogruppe und der sauren Carbonsäuregruppe sind Aminosäuren zugleichBasenundSäuren.Als Feststoffe und in neutralen wässrigen Lösungen liegen Aminosäuren alsZwitterionenvor, das heißt, die Aminogruppe ist protoniert und die Carboxygruppe ist deprotoniert. Verallgemeinert lässt sich das Zwitterion so darstellen:
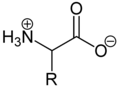
Als Zwitterion kann die protonierte Aminogruppe als Säure (Protonendonator) und die Carboxylatgruppe kann als Base (Protonenakzeptor) reagieren. In sauren Lösungen liegen Aminosäuren alsKationenund in basischen Lösungen alsAnionenvor:
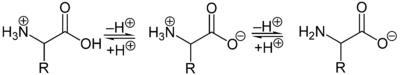
Die Ladung eines Aminosäuremoleküls hängt vompH-Wertder Lösung ab. Bei einem Zwitterion mit einer sauren und einer basischen Gruppe ist bei neutralem pH-Wert die Gesamtladung des Moleküls null. Daneben besitzen die Seitenketten der Aminosäuren teilweise saure oder basische geladene Gruppen. Der pH-Wert mit einer Nettoladung von Null ist derisoelektrische Punkt(pHI,pI) einer Aminosäure. Am isoelektrischen Punkt ist die Wasserlöslichkeit einer Aminosäure am geringsten.[29]
| Aminosäure | Eigenschaft | frei | im Protein |
|---|---|---|---|
| Asp | sauer | 3,68 | 3,7–4,0 |
| Glu | sauer | 4,25 | 4,2–4,5 |
| His | basisch | 6,00 | 6,7–7,1 |
| Cys | semi-sauer | 8,33 | 8,8–9,1 |
| Tyr | semi-sauer | 10,07 | 9,7–10,1 |
| Lys | basisch | 10,53 | 9,3–9,5 |
| Arg | basisch | 12,48 | – |
Für das Säure-Base-Verhalten proteinogener Aminosäuren ist vor allem das Verhalten ihrer Seitenkette (fortan mitRbezeichnet) interessant. In Proteinen sind die NH2- und COOH-Gruppen bei physiologischem pH-Wert (um pH 7) wegen derPeptidbindungnicht protonierbar und damit auch nichttitrierbar.Ausnahmen sind derAmino-und derCarboxy-Terminusdes Proteins. Daher ist für das Säure-Base-Verhalten von Proteinen und Peptiden der SeitenkettenrestRmaßgeblich.
Das Verhalten der SeitenketteRhängt von ihrer Konstitution ab, das heißt, ob die Seitenkette selbst wieder alsProtonenakzeptoroder alsProtonendonatorwirken kann. Die proteinogenen Aminosäuren werden nach den funktionellen Gruppen eingeteilt in solche mit unpolarer oder polarer Aminosäureseitenkette und weiter unterteilt in nachPolaritätsortierte Untergruppen:aliphatische,aromatische,amidierte,Schwefel-enthaltende,hydroxylierte,basischeundsaureAminosäuren.
Die Seitenketten von Tyrosin und Cystein sind zwar im Vergleich zu den anderen unpolaren Seitenketten relativ sauer, neigen aber erst bei unphysiologisch hohen pH-Werten zum Deprotonieren. Prolin ist eine sekundäre Aminosäure, da derN-Terminus mit der Seitenkette einen fünfatomigen Ring schließt. Innerhalb eines Proteins bindet der Carboxy-Terminus einer vorhergehenden Aminosäure an den Stickstoff des Prolins, welcher aufgrund der bereits erwähnten Peptidbindung nicht protonierbar ist. Histidin, Tyrosin und Methionin kommen jeweils in zwei Untergruppen vor.
| Aminosäure | pK2 COOH |
pK1 COOH |
Isoelektrischer Punkt |
pK1 NH2 |
pK2 NH2 |
|---|---|---|---|---|---|
| Alanin | – | 2,3 | 6,1 | 9,9 | – |
| Arginin | – | 2,81 | 10,76 | 9,09 | 12,5 |
| Asparagin | – | 2,02 | 5,41 | 8,80 | – |
| Asparaginsäure | 3,65 | 1,88 | 2,85 | 9,60 | – |
| Cystein | 8,33* | 1,71 | 5,05 | 10,78 | – |
| Glutamin | – | 2,17 | 5,65 | 9,13 | – |
| Glutaminsäure | 4,25 | 2,19 | 3,22 | 9,67 | – |
| Glycin | – | 2,21 | 5,97 | 9,15 | – |
| Histidin | – | 1,78 | 7,47 | 8,97 | 5,97 |
| Isoleucin | – | 2,32 | 5,94 | 9,76 | – |
| Leucin | – | 2,4 | 5,98 | 9,6 | – |
| Lysin | – | 2,20 | 9,59 | 8,90 | 10,28 |
| Methionin | – | 2,28 | 5,74 | 9,21 | – |
| Phenylalanin | – | 2,58 | 5,84 | 9,24 | – |
| Prolin | – | 1,99 | 6,3 | 10,60 | – |
| Serin | – | 2,21 | 5,68 | 9,15 | – |
| Threonin | – | 2,10 | 5,60 | 9,12 | – |
| Tryptophan | – | 2,15 | 5,64 | 9,12 | – |
| Tyrosin | 10,07** | 2,20 | 5,66 | 9,11 | – |
| Valin | – | 2,30 | 5,96 | 9,60 | – |
| *Thiolgruppe **phenolischeHydroxygruppe | |||||
- AliphatischeAminosäureseitenketten
- AromatischeAminosäureseitenketten
- AmidierteAminosäureseitenketten
- Schwefel-enthaltende Aminosäureseitenketten
- Hydroxylierte Aminosäureseitenketten
- Basische Aminosäureseitenketten
- Saure Aminosäureseitenketten
- Asparaginsäure(dissoziiert zu Aspartat)
- Glutaminsäure(dissoziiert zu Glutamat)
Der pK-Wert ist derpH-Wert,bei dem die titrierbaren Gruppen zu gleichen Teilen protoniert und deprotoniert vorliegen; die titrierbare Gruppe liegt dann zu gleichen Teilen in ihrer basischen wie in ihrer sauren Form vor (siehe auch:Henderson-Hasselbalch-Gleichung).
Es ist meist üblich, anstatt vom pKSvom pK zu sprechen, so vompK der Säure.In diesem Sinne müsste allerdings vom pK des Lysins als pKB,vompK der Basegesprochen werden. Aus Gründen der Vereinfachung wird diese Notation aber allgemein weggelassen, da sich auch aus dem Sinnzusammenhang ergibt, ob die Gruppe als Base oder Säure wirkt.
Der pK ist keine Konstante, sondern hängt von der Temperatur, derAktivität,derIonenstärkeund der unmittelbaren Umgebung der titrierbaren Gruppe ab und kann daher stark schwanken.
Ist der pH höher als der pK einer titrierbaren Gruppe, so liegt die titrierbare Gruppe in ihrer basischen (deprotonierten) Form vor. Ist der pH niedriger als der pK der titrierbaren Gruppe, so liegt die titrierbare Gruppe in ihrer sauren (protonierten) Form vor:
- Für Asp (pK =3,86) bei pH 7: Die Seitenkette ist nahezu vollständig deprotoniert.
- Für Lys (pK = 10,53) bei pH 7: Die Seitenkette ist nahezu vollständig protoniert.
Die Seitenkettenbasischer Aminosäurensind in ihrer protonierten (sauren) Form einfach positiv geladen und in ihrer deprotonierten (basischen) Form ungeladen. Die Seitenketten dersauren Aminosäuren(einschließlich Cystein und Tyrosin) sind in ihrer protonierten (sauren) Form ungeladen und in ihrer deprotonierten (basischen) Form einfach negativ geladen. Da das Verhalten der Seitenkette ein ganz anderes ist, wenn sie geladen bzw. ungeladen ist, spielt der pH-Wert für die Eigenschaften der Seitenkette eine so wichtige Rolle.
Die titrierbaren Seitenketten beeinflussen zum Beispiel dasLöslichkeitsverhaltender entsprechenden Aminosäure. In polaren Lösungsmitteln gilt: Geladene Seitenketten machen die Aminosäure löslicher, ungeladene Seitenketten machen die Aminosäure unlöslicher.
InProteinenkann das dazu führen, dass bestimmte Abschnittehydrophileroderhydrophoberwerden, wodurch die Faltung und damit auch die Aktivität vonEnzymenvom pH-Wert abhängt. Durch stark saure oder basische Lösungen können Proteine daherdenaturiertwerden.
Tabellenübersicht der Eigenschaften
[Bearbeiten|Quelltext bearbeiten]| Aminosäure | Seitenkette R | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Name | Abk. | Symbol | Strukturformel | Konstitutionsformel | relative Molekülmasse |
van-der- Waals- Volumen |
Pola- rität |
Hydro- phobi- zität[30] |
Acidität bzw. Basizität |
Säure- konstante (pKS) |
| Alanin | Ala | A | –CH3 | 15 | 67 | unpolar | +1,8 | neutral | – | |
| Arginin | Arg | R | –CH2CH2CH2NH-C(NH)NH2 | 100 | 148 | polar | −4,5 | basisch (stark) |
12,48 | |
| Asparagin | Asn | N | –CH2CONH2 | 58 | 96 | polar | −3,5 | neutral | – | |
| Asparagin- säure |
Asp | D | –CH2COOH | 59 | 91 | polar | −3,5 | sauer | 3,90 | |
| Cystein | Cys | C | –CH2SH | 47 | 86 | polar | +2,5 | neutral | 8,18 | |
| Glutamin | Gln | Q | –CH2CH2CONH2 | 72 | 114 | polar | −3,5 | neutral | – | |
| Glutamin- säure |
Glu | E | –CH2CH2COOH | 73 | 109 | polar | −3,5 | sauer | 4,07 | |
| Glycin | Gly | G | –H | 1 | 48 | unpolar | −0,4 | neutral | – | |
| Histidin | His | H | –CH2(C3H3N2) | 81 | 118 | polar | −3,2 | basisch (schwach) |
6,04 | |
| Isoleucin | Ile | I | –CH(CH3)-CH2CH3 | 57 | 124 | unpolar | +4,5 | neutral | – | |
| Leucin | Leu | L | –CH2CH(CH3)2 | 57 | 124 | unpolar | +3,8 | neutral | – | |
| Lysin | Lys | K | –CH2CH2CH2-CH2NH2 | 72 | 135 | polar | −3,9 | basisch | 10,54 | |
| Methionin | Met | M | –CH2CH2SCH3 | 75 | 124 | unpolar | +1,9 | neutral | – | |
| Phenylalanin | Phe | F | –CH2(C6H5) | 91 | 135 | unpolar | +2,8 | neutral | – | |
| Prolin | Pro | P | Es fehlt ein H am NH2[31] | 42 | 90 | unpolar | −1,6 | neutral | – | |
| Serin | Ser | S | –CH2OH | 31 | 73 | polar | −0,8 | neutral | – | |
| Threonin | Thr | T | –CH(OH)CH3 | 45 | 93 | polar | −0,7 | neutral | – | |
| Tryptophan | Trp | W | –CH2(C8H6N) | 130 | 163 | unpolar | −0,9 | neutral | – | |
| Tyrosin | Tyr | Y | –CH2(C6H4)OH | 107 | 141 | polar | −1,3 | neutral | 10,46 | |
| Valin | Val | V | –CH(CH3)2 | 43 | 105 | unpolar | +4,2 | neutral | – | |
Stereochemie
[Bearbeiten|Quelltext bearbeiten]18 der 20 proteinogenen Aminosäuren haben gemäß derCahn-Ingold-Prelog-Konventionam α-Kohlenstoff-Atom die (S)-Konfiguration, lediglichCysteinbesitzt die (R)-Konfiguration, da hier der Kohlenstoff mit derThiolgruppeeine höhere Priorität als die Carbonsäuregruppe hat.Glycinistachiral,daher kann keine absolute Konfiguration bestimmt werden.
Zusätzlich zum Stereozentrum am α-C-Atom besitzenIsoleucinundThreoninin ihrem RestRje ein weiteresstereogenes Zentrum.Proteinogenes Isoleucin [R= –C*H(CH3)CH2CH3] ist dort (S)-konfiguriert, Threonin [R= –C*H(OH)CH3] (R)-konfiguriert.
Nichtproteinogene Aminosäuren
[Bearbeiten|Quelltext bearbeiten]
Es sind bislang über 400nichtproteinogene(d. h. nicht während derTranslationin Proteine eingebaute) Aminosäuren, die in Organismen vorkommen, bekannt.[3]Dazu gehört etwa dasL-Thyroxin,ein Hormon derSchilddrüse,L-DOPA,L-Ornithinoder das in fast allen Arten vonCyanobakteriennachgewieseneNeurotoxinβ-Methylaminoalanin (BMAA).
Die meisten nichtproteinogenen Aminosäuren leiten sich von den proteinogenen ab, dieL-α-Aminosäuren sind. Dennoch können dabei auch β-Aminosäuren (β-Alanin) oder γ-Aminosäuren (GABA) entstehen.
Zu den nichtproteinogenen Aminosäuren zählen auch alleD-Enantiomereder proteinogenenL-Aminosäuren.D-Serin wird im Hirn durch dieSerin-RacemaseausL-Serin (seinem Enantiomer) erzeugt. Es dient sowohl alsNeurotransmitterals auch alsGliotransmitter durch die Aktivierung desNMDA-Rezeptors,was zusammen mit Glutamat die Öffnung des Kanals erlaubt. Zum Öffnen des Ionenkanals muss Glutamat und entweder Glycin oderD-Serin binden.D-Serin ist an der Glycin-Bindungsstelle desGlutamatrezeptorsvom NMDA-Typ ein stärkererAgonistals Glycin selbst, war aber zum Zeitpunkt der Erstbeschreibung der Glycin-Bindungsstelle noch unbekannt.D-Serin ist nachD-Aspartat die zweiteD-Aminosäure, die in Menschen gefunden wurde.[32]

Zu den synthetischen Aminosäuren gehört die2-Amino-5-phosphonovaleriansäure(APV), ein Antagonist desNMDA-Rezeptorsund das ökonomisch wichtigeD-Phenylglycin[Synonym: (R)-Phenylglycin], das in der Seitenkette vieler semisynthetischer β-Lactamantibiotica als Teilstruktur enthalten ist. (S)- und (R)-tert-Leucin [Synonym: (S)- und (R)-β-Methylvalin] sind synthetische Strukturisomere der proteinogenen Aminosäure (S)-Leucin und werden als Edukt in stereoselektiven Synthesen eingesetzt.
Es gibt auch Aminosulfonsäuren [Beispiel: 2-Aminoethansulfonsäure (Synonym:Taurin)], α-Aminophosphonsäuren und α-Aminophosphinsäuren.[33]Das sind auch α-Aminosäuren, jedochkeineα-Aminocarbonsäuren. Statt einer Carboxygruppe (–COOH) ist eine Sulfonsäure-, Phosphonsäure- bzw. Phosphinsäuregruppe in diesen α-Aminosäuren enthalten.
| Aminosäure | Biologische Bedeutung |
|---|---|
| Thyroxin | Schilddrüsen-Hormon |
| GABA | inhibitorischerNeurotransmitter |
| L-Homoserin | Stoffwechselzwischenprodukt derArgininsynthese |
| Ornithin | Stoffwechselzwischenprodukt imHarnstoffzyklus |
| Citrullin | Stoffwechselzwischenprodukt imHarnstoffzyklus |
| Argininosuccinat | Stoffwechselzwischenprodukt imHarnstoffzyklus |
| L-DOPA | Stoffwechselzwischenprodukt der Synthese vonKatecholaminen |
| 5-Hydroxytryptophan | Stoffwechselzwischenprodukt derSerotoninsynthese |
| β-Alanin | Baustein vonCoenzym A |
| β-Methylamino-Alanin | NeurotoxinderCyanobakterien |
| Ibotensäure | Pilzgift |
| D-Valin | Bestandteil des AntibiotikumsValinomycin |
| D-Alanin | Bestandteil bakteriellerZellwände |
| D-Glutamat | Bestandteil bakteriellerZellwände |
| 2,6-Diaminopimelinsäure | Bestandteil bakteriellerZellwände |
Nachweis
[Bearbeiten|Quelltext bearbeiten]Ein quantitativerphotometrischerNachweis von Aminosäuren kann unter anderem perKaiser-Test[34]mitNinhydrinoder mit demFolin-Reagenzerfolgen, wodurch primäre Amine nachgewiesen werden. Für sekundäre Amine werden derIsatin-Testoder derChloranil-Testverwendet.[35]Ebenso können Trennung und Nachweis von Aminosäuren perKapillarelektrophoreseoder perHPLCerfolgen,[36]teilweise alsFlüssigchromatographie mit Massenspektrometrie-Kopplung.Während die meisten Aminosäuren kein UV-Licht mit Wellenlängen über 220 nm absorbieren, sind die Aminosäuren Phenylalanin, Tyrosin, Histidin und Tryptophanaromatischund absorbieren UV-Licht mit einem Maximum zwischen 260 nm und 280 nm.[37]Die Aminosäurezusammensetzung eines Proteins kann durchHydrolysedes Proteins untersucht werden.[37]Die langsam eintretendeRacemisierungder Aminosäuren in den ursprünglich ausschließlich ausL-Aminosäuren aufgebauten Proteinen wird bei derAminosäuredatierunguntersucht.[38][39]
Gewinnung und Produktion
[Bearbeiten|Quelltext bearbeiten]Aminosäurenwerden entweder ausNaturstoffendurch Auftrennung eineshydrolysiertenProteinsoder auf synthetischem Wege gewonnen. Ursprünglich[40]diente die Entwicklung einer Synthese für die diversen Aminosäuren hauptsächlich der Strukturaufklärung. Inzwischen sind diese Strukturfragen gelöst und mit den verschiedenen Synthesen, soweit sie noch aktuell sind, werden gezielt die gewünschten Aminosäuren dargestellt. Bei den Synthesen entstehen zunächstracemischeGemische, die getrennt werden können. Eine Methode hierfür ist eine selektive enzymatische Hydrolyse, die zurRacematspaltungeingesetzt wird.

Nachfolgend ein Überblick über diverse Synthesen, die von Chemikern bereits ab Mitte des 19. Jahrhunderts entwickelt wurden. Einige dieser älteren Synthesen sind wegen geringer Ausbeuten oder sonstiger Probleme nur von historischem Interesse. Allerdings wurden diese alten Verfahren teilweise weiterentwickelt und einige sind auch noch heute zur Darstellung von Aminosäuren aktuell. Weitergehende Einzelheiten zu diesen Synthesen einschließlich der Gleichungen für die Synthesen sind unter denLinkszu denSynthesenund den angegebenenAminosäurenangeführt.
- Mit derCyanhydrinsynthesedes ChemikersAdolph Strecker1850[41]wurdeAlaninerstmals ausAcetaldehydsynthetisiert (sieheStrecker-Synthese).
- Eine Synthese für die Darstellung vonGlycinüber die α-Fettsäuren, die durch Reaktion von Brom- oderChlorfettsäurenmit Ammoniak hergestellt werden, wurde vonWilliam H. Perkin sen.und Baldwin F. Duppa bereits 1859[40]entwickelt.
- Josef Pöchl entdeckte 1883 dieAzlactonsynthesezur Darstellung von Aminosäuren. Deren genauer Ablauf wurde aber erst 1893 vonEmil Erlenmeyerjun. aufgeklärt. Diese Methode wird deshalb auchErlenmeyer-Synthesegenannt. Mit diesem Verfahren wurden 1911[42]HistidinsowiePhenylalaninundTyrosinhergestellt.
- Durch Reduktion von einerα-Oximinosäurewurde erstmals 1887[43]Asparaginsäuresynthetisiert. Nach der gleichen Methode wurde 1906 vonLouis BouveaultIsoleucinaus demOximdesMethyläthyl-brenztraubensäureestersdargestellt.
- Nach der vonSiegmund GabrielentwickeltenGabriel-Synthese,[40]wurde 1889 Glycinhydrochlorid über Phthalimidkalium als Ausgangschemikalie synthetisiert. Obwohl diese Synthese für die Darstellung vonGlycinüberholt ist, eignet sie sich wegen ihrer hohen Ausbeuten für die Gewinnung anderer Aminosäuren.
- Mit derCyanhydrinsynthesestellteEmil Fischer1902 erstmalsSerin[41]über Glykolaldehyd her. 1906 wurde mit der von ihm entwickeltenMalonestersynthese[44]Leucinsynthetisiert.Isoleucin,Norleucin,MethioninundPhenylalaninsind weitere Aminosäuren, die mit dieser Synthese leicht darstellbar sind.
- Theodor Curtiusbenutzte den von ihm entwickeltenCurtiusschen Abbaufür die Darstellung von α-Aminosäuren durch die Verwendung von Malonesterderivaten zur Synthese vonGlycin,Alanin,Valinund Phenylalanin.[45]
- 1911[45]wurdeTyrosin,PhenylalaninundTryptophanüber eine Kondensation aromatischer Aldehyde mitHydantoingewonnen.
- Mit einer kombiniertenPhthalimid-Malonester-Synthesewurde 1931[44]vonGeorge BargerMethioninsynthetisiert. Nach der gleichen Methode können auch Phenylalanin,Prolin,Tyrosin,AsparaginsäureundSerinhergestellt werden.Vincent du Vigneaudstellte 1939DL-Cystinmit dieser Methode her.
Industriell werden Aminosäuren heute nach folgenden Verfahren hergestellt:
- Extraktionsmethode:Hierzu werdenProteinezunächst mitSäurenhydrolysiert. NachFällungdes Aminosäuregemischs aus dem Hydrolysat erfolgt einechromatographischeTrennung perIonenaustauschchromatographie.Bei derElutionwerden die unterschiedlichenPolaritätender Aminosäuren ausgenutzt.[46]
- Chemische Synthese:Es gibt eine Vielzahl von Synthesemethoden. Beispiele sind dieStrecker-SynthesevonD,L-Valin, die Degussa-Synthese vonD,L-Cysteinund die Synthese vonD,L-MethioninausMethylmercaptan,AcroleinundBlausäure.Da die hergestellten Aminosäuren dabei alsRacematerhalten werden, müssen anschließend noch Verfahren zurEnantiomerentrennungerfolgen, wenn reineL- oderD-Aminosäuren benötigt werden.
- Enzymatische Verfahren:Dieses Verfahren hat den VorteilenantiomerenreineL- oderD-Aminosäuren mit geeignetenEnzymenalsBiokatalysatorenzu liefern. Beispiele sind die Herstellung vonL-AsparaginsäureausFumarsäuremitL-Aspartase und die Herstellung vonL-TryptophanausIndolundBrenztraubensäuremit Tryptopharase.
- Fermentationsverfahren:Bei derFermentationwerden die Aminosäuren mit Hilfe geeigneterMikroorganismenhergestellt. Der Syntheseprozess läuft dabei über sehr komplexe Zwischenschritte innerhalb der Zellen ab. Ein Beispiel ist die Herstellung vonL-GlutaminsäureausGlucose.Hierbei kann man aus 2 Gramm Glucose 1 Gramm Glutaminsäure gewinnen. Die meisten Aminosäuren werden heute durch Fermentation hergestellt.[47][48]Jährlich werden so weltweit 6 Millionen Tonnen an Glutaminsäure und Lysin produziert, teilweise aus hydrolysierterStärkeoderMelasseunter Verwendung der BakterienEscherichia colioderCorynebacterium glutamicum.[49]
Verwendung
[Bearbeiten|Quelltext bearbeiten]Aminosäuren haben für dieErnährungdes Menschen eine fundamentale Bedeutung, insbesondere solche, die als essentielle Aminosäuren nicht selbst erzeugt werden können. In der Regel wird im Zuge einer ausgewogenen Ernährung der Bedarf an essentiellen Aminosäuren durch tierische oder eine geeignete Kombination verschiedener pflanzlicherProteine(etwa aus Getreide und Hülsenfrüchten)[50]vollkommen gedeckt. Pflanzliche Proteine haben meist hinsichtlich ihrer Aminosäurenzusammensetzung eine geringerebiologische Wertigkeit.Futtermittelin der Nutztierhaltung werden daher oft angereichert durch Zusatz bestimmter Aminosäuren, beispielsweiseMethioninundLysinsowieverzweigtkettige Aminosäuren(Leucin,IsoleucinundValin),[51]wodurch der Nährwert erhöht wird. Verschiedene Aminosäuren werden alsNahrungsergänzungsmittelverkauft.
Aminosäuren bzw. ihreDerivatefinden Verwendung als Zusatz fürLebensmittel.Die menschliche Zunge besitzt einenGlutamatrezeptor,dessen Aktivierung allgemein mit einem gesteigerten Geschmack assoziiert ist. Daher wird alsGeschmacksverstärkerNatriumglutamatverwendet. Der SüßstoffAspartamenthält eine Aminosäure. Aminosäuren sind Vorstufen für bestimmteAromastoffe,die beim trockenenGarenvon Speisen über dieMaillard-Reaktionentstehen.
Aminosäuren werden in derZellbiologieundMikrobiologieals Bestandteile vonZellkulturmedienverwendet. In derBiochemiewerden Derivate von Aminosäuren wiePhoto-LeucinoderPhoto-Methioninzur Strukturaufklärung von Proteinen und andere zurMolekülmarkierungverwendet. Daneben werden Aminosäuren auch als Hilfsstoffe eingesetzt, z. B. alsSalzbildner,Puffer.In derPharmaziebzw.MedizinwerdenL-Aminosäuren als Infusionslösungen für dieparenterale Ernährungund als Stabilisatoren bei bestimmtenLebererkrankungenangewendet. Bei Krankheiten mit einem Mangel vonNeurotransmitternverwendet manL-Dopa.Für synthetischePeptidhormoneund für die Biosynthese vonAntibiotikasind Aminosäuren notwendige Ausgangsstoffe. Magnesium- und Kalium-Aspartatespielen bei der Behandlung von Herz- und Kreislauferkrankungen eine Rolle.
Cystein,beziehungsweise die DerivateAcetylcysteinundCarbocystein,finden zudem eine Anwendung bei infektiösen Bronchialerkrankungen mit erhöhtemBronchialsekret.Zudem wirdL-Cystein als Reduktionsmittel in derDauerwelleeingesetzt.[52]Aminosäuren werden in derKosmetikHautpflegemittelnundShampooszugesetzt.[48]
Metabolismus
[Bearbeiten|Quelltext bearbeiten]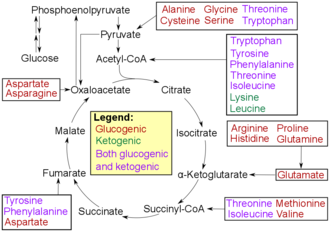
Aminosäuren können nach ihren Abbauwegen inketogene,glucogeneund gemischt keto- und glucogene Aminosäuren eingeteilt werden. Ketogene Aminosäuren werden beim Abbau demCitrat-Zykluszugeführt, glucogene Aminosäuren derGluconeogenese.Weiterhin werden im Stoffwechsel aus Aminosäuren verschiedene Abbauprodukte mit biologischer Aktivität (z. B.Neurotransmitter) gebildet. Tryptophan ist der Vorläufer vonSerotonin.[53]Tyrosin und sein Vorläufer Phenylalanin sind Vorläufer derCatecholamineDopamin,Epinephrin(synonym Adrenalin) undNorepinephrin(synonym Noradrenalin). Phenylalanin ist der Vorläufer vonPhenethylaminin Menschen. In Pflanzen ist Phenylalanin der Vorläufer derPhenylpropanoide.Glycin ist der Ausgangsstoff derPorphyrinsynthese(Häm).[54]Aus Arginin wird dersekundäre BotenstoffStickstoffmonoxidgebildet.[55]Ornithin undS-Adenosylmethioninsind Vorläufer derPolyamine.[56]Aspartat, Glycin und Glutamin sind Ausgangsstoffe der Biosynthese von Nukleotiden.[57]
Bei verschiedenen Infektionen des Menschen mitPathogenenwurde eine Konkurrenz mit demWirtum die Aminosäuren Asparagin, Arginin und Tryptophan beschrieben.[58]
Literatur
[Bearbeiten|Quelltext bearbeiten]Bücher
[Bearbeiten|Quelltext bearbeiten]- Harold Hart:Organische Chemie: Ein kurzes Lehrbuch.VCH, 1989,ISBN 3-527-26480-9.
- Jeremy M. Berg, Lubert Stryer, John L. Tymoczko, Gregory J. Gatto:Biochemistry.Macmillan Learning, 2015,ISBN 978-1-4641-2610-9.
- G. C. Barrett:Amino Acids and Peptides.Cambridge University Press, 1998,ISBN 0-521-46827-2.
- Uwe Meierhenrich:Amino Acids and the Asymmetry of Life.Springer-Verlag, Heidelberg/Berlin 2008,ISBN 978-3-540-76885-2.
- John M. Rattenbury:Amino acid analysis.John Wiley & Sons, New York / Chichester / Brisbane / Toronto 1981.
- Hubert Rehm, Thomas Letzel:Der Experimentator: Proteinbiochemie / Proteomics.6. Auflage. Spektrum Akademischer Verlag, Heidelberg 2009,ISBN 978-3-8274-2312-2.
Zeitschriftenartikel
[Bearbeiten|Quelltext bearbeiten]- Lei Wang,Peter G. Schultz:Die Erweiterung des genetischen Codes.In:Angewandte Chemie.Band 117, Nr. 1, 2005, S. 34–68.
- H. Uneyama, H. Kobayashi, N. Tonouchi:New Functions and Potential Applications of Amino Acids.In:Advances in Biochemical Engineering/Biotechnology.Band 159, 2017, S. 273–287,doi:10.1007/10_2016_35.PMID 27872968.
- Bernd Hoppe, Jürgen Martens:Aminosäuren – Bausteine des Lebens.In:Chemie in unserer Zeit.17. Jahrg., Nr. 2, 1983, S. 41–53.
- Bernd Hoppe, Jürgen Martens:Aminosäuren – Herstellung und Gewinnung.In:Chemie in unserer Zeit.18. Jahrg., Nr. 3, 1984, S. 73–86.
Weblinks
[Bearbeiten|Quelltext bearbeiten]- Lerne die 20 proteinogenen Aminosäuren
- Tabelle mit Eigenschaften und Häufigkeit von Aminosäuren(engl.)
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Georg Löffler:Biochemie und Pathobiochemie.Springer-Verlag, 2013,ISBN 978-3-662-06062-9,S. 25.
- ↑abKatharina Munk (Hrsg.):Biochemie – Zellbiologie.Georg Thieme Verlag, Stuttgart 2008,ISBN 978-3-13-144831-6,S. 122,Google Books.
- ↑abPeter Nuhn:Naturstoffchemie.S. Hirzel Wissenschaftliche Verlagsgesellschaft, Stuttgart 1990,ISBN 3-7776-0473-9,S. 70.
- ↑G. Genchi:An overview on D-amino acids.In:Amino Acids.Band 49, Nummer 9, September 2017, S. 1521–1533,doi:10.1007/s00726-017-2459-5.PMID 28681245.
- ↑NASA Researchers Make First Discovery of Life’s Building Block in Comet.nasa.gov, August 2009;Chiral amino acids in meteorites strengthen evidence for extraterrestrial life.spie.org, September 2010 (abgerufen am 4. Oktober 2010).
- ↑L. Vauquelin, P. Robiquet:The discovery of a new plant principle in Asparagus sativus.In:Annales de Chimie.Band 57, 1806, S. 88–93.
- ↑W. Rose u. a.:Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid.In:Journal of Biological Chemistry.Band 112, 1935, S. 283–302.
- ↑R. Simoni, R. Hill, M. Vaughan:The Discovery of the Amino Acid Threonine: the Work of William C. Rose.In:Journal of Biological Chemistry.Band 277, Nr. 37, 13. September 2002, S. 56–58.
- ↑Sabine Hansen:Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois.(vom 15. Juni 2016 imInternet Archive)Berlin 2015.
- ↑Theodor Wieland:History of Peptide Chemistry.In: Bernd Gutte (Hrsg.):Peptides.Academic Press, 1995, S. 2.
- ↑Vgl. etwaStanford Moore,William Howard Stein:Photometric ninhydrin method for use in the chromatography of amino acids.In:J Biol Chem.Band 176, 1948, S. 367 ff.; Stanford Moore, D. H. Spackman, William Howard Stein:Chromatography of amino acids on sulfonated polystyrene resins. An improved system.In:Anal Chem.Band 30, 1958, S. 1185 ff.
- ↑Anton P. Novikov, Alexey V. Safonov, Konstantin E. German, Mikhail S. Grigoriev:What kind of interactions we may get moving from zwitter to “dritter” ions: C–O⋯Re(O4) and Re–O⋯Re(O4) anion⋯anion interactions make structural difference between L-histidinium perrhenate and pertechnetate.In:CrystEngComm.1. Dezember 2023,doi:10.1039/D3CE01164J.
- ↑ab Wissenschaft-Online-Lexika:Eintrag zu Aminosäuren im Lexikon der Biologie.abgerufen am 25. April 2009.
- ↑G. Löffler, P. E. Petrides, P. C. Heinrich:Biochemie & Pathobiochemie.8. Auflage. Springer, Heidelberg 2007,ISBN 978-3-540-32680-9.
- ↑Hao Wang, David Fewer, Liisa Holm, Leo Rouhiainen, Kaarina Sivonena:Atlas of nonribosomal peptide and polyketide biosynthetic pathways reveals common occurrence of nonmodular enzymes.In:Proc Natl Acad Sci USA.Band111,Nr.25,Juni 2014,S.9259–9264,PMC 4078802(freier Volltext).
- ↑ab International Union of Pure and Applied Chemistry and International Union of Biochemistry:Nomenclature and Symbolism for Amino Acids and Peptides (Recommendations 1983).In:Pure & Appl. Chem.Band56,Nr.5,1984,S.595–624,doi:10.1351/pac198456050595.
- ↑abcdeIUPAC-IUB Commission on Biochemical Nomenclature A One-Letter Notation for Amino Acid Sequences.In:Journal of Biological Chemistry.243. Jahrgang,Nr.13,10. Juli 1968,S.3557–3559,doi:10.1016/S0021-9258(19)34176-6(englisch,jbc.org[PDF]).
- ↑abM. Saffran:Amino acid names and parlor games: from trivial names to a one-letter code, amino acid names have strained students' memories. Is a more rational nomenclature possible?In:Biochemical Education.26. Jahrgang,Nr.2,April 1998,S.116–118,doi:10.1016/S0307-4412(97)00167-2(englisch,elsevier.com).
- ↑abcGodwin I Adoga, Bh Nicholson:Letters to the editor.In:Biochemical Education.16. Jahrgang,Nr.1,Januar 1988,S.49,doi:10.1016/0307-4412(88)90026-X(englisch,wiley.com[PDF]).
- ↑Paula Yurkanis Bruice:Organic Chemistry.4. Auflage. Pearson Education, 2004,ISBN 0-13-121730-5,S. 960–962.
- ↑Katsura Asano:Why is start codon selection so precise in eukaryotes?In:Translation.Band 2, Nr. 1, März 2014,doi:10.4161/trla.28387,PMC 4705826(freier Volltext).
- ↑Y. Fan, C. R. Evans, J. Ling:Rewiring protein synthesis: From natural to synthetic amino acids.In:Biochimica et Biophysica Acta.Band 1861, Nummer 11 Pt B, 2017, S. 3024–3029,doi:10.1016/j.bbagen.2017.01.014.PMID 28095316,PMC 5511583(freier Volltext).
- ↑Kathrin Lang, Lloyd Davis u. a.:Genetically encoded norbornene directs site-specific cellular protein labelling via a rapid bioorthogonal reaction.In:Nature Chemistry.2012, S. 298–304,doi:10.1038/nchem.1250.
- ↑Vgl. auch L. L. Miller:The role of the liver and the non-hepatic tissues in the regulation of free amino acid levels in the blood.In: Joseph T. Holden (Hrsg.):Amino acid pools.Elsevier Publishing Company, Amsterdam / London / New York 1962, 708 ff.
- ↑Wissenschaftlicher Bericht zur Biologischen Wertigkeit - Welche Aminosäuren gibt es:Essenzielle Aminosäuren
- ↑abc W. R. Taylor:The classification of amino acid conservation.In:Journal of Theoretical Biology.Band 119, Jahrgang 1986, S. 205–218.doi:10.1016/S0022-5193(86)80075-3.
- ↑Georg Löffler:Basiswissen Biochemie.(=Springer-Lehrbuch). Heidelberg 2005,ISBN 3-540-23885-9,S. 24.
- ↑Bruce Alberts, Alexander D. Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter Alberts, Johnson, Lewis, Raff, Roberts, Walter:Molekularbiologie der Zelle.WILEY-VCH Verlag, Weinheim 2004,ISBN 3-527-30492-4,S. 152.
- ↑Siegfried Hauptmann:Organische Chemie.2., durchgesehene Auflage. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985,ISBN 3-342-00280-8,S. 506–507.
- ↑ J. Kyte, R. F. Doolittle:A simple method for displaying the hydropathic character of a protein.In:Journal of Molecular Biology.Band157,Nr.1,1982,S.105–132,PMID 7108955.
- ↑Darstellung nicht verfügbar, da bei Prolin am Peptid-Rückgrat ein Wasserstoff-Atom am Stickstoff weniger vorkommt (einsekundäres Amin), weil die Seitenkette mit dem Stickstoffatom einen Ring bildet (–NHCH2CH2CH2–).
- ↑Jean-Pierre Mothet, Angèle T. Parent, Herman Wolosker, Roscoe O. Brady, Jr., David J. Linden, Christopher D. Ferris, Michael A. Rogawski, Solomon H. Snyder:d-Serine is an endogenous ligand for the glycine site of theN-methyl-d-aspartate receptor.In:Proc. Natl. Acad. Sci. USA.Band97,Nr.9,2000,S.4926–4931,doi:10.1073/pnas.97.9.4926,PMID 10781100,PMC 18334(freier Volltext).
- ↑ Karlheinz Drauz, Hans Günter Koban,Jürgen Martens,Werner Schwarze:Phosphonic and Phosphinic Acid Analogs of Penicillamine.In:Liebigs Annalen der Chemie.Band1985,Nr.3,1985,S.448–452,doi:10.1002/jlac.198519850303.
- ↑D. A. Wellings, E. Atherton:Standard Fmoc protocols.In:Methods in enzymology.Band 289, 1997, S. 44–67.PMID 9353717
- ↑Bing Yan:Analytical Methods in Combinatorial Chemistry, Second Edition.CRC Press, 2011,ISBN 978-1-4398-5760-1.
- ↑Y. Song, C. Xu, H. Kuroki, Y. Liao, M. Tsunoda:Recent trends in analytical methods for the determination of amino acids in biological samples.In:Journal of pharmaceutical and biomedical analysis.Band 147, Januar 2018, S. 35–49,doi:10.1016/j.jpba.2017.08.050.PMID 28927726.
- ↑abZdzislaw E. Sikorski:Chemical and Functional Properties of Food Proteins.CRC Press, 2001,ISBN 1-56676-960-4,S. 71, 219.
- ↑Mebus A. Geyh, Helmut Schleicher:Absolute Age Determination – Physical and Chemical Dating Methods and Their Application.Springer-Verlag, Berlin/Heidelberg 1990,ISBN 3-540-51276-4,S. 345–371.
- ↑N. Fujii, T. Takata, N. Fujii, K. Aki, H. Sakaue:D-Amino acids in protein: The mirror of life as a molecular index of aging.In:Biochimica et Biophysica Acta.[elektronische Veröffentlichung vor dem Druck] März 2018,doi:10.1016/j.bbapap.2018.03.001.PMID 29530565.
- ↑abc L. F. Fieser, M. Fieser:Lehrbuch der organischen Chemie.3. Auflage. Verlag Chemie, 1957, S. 506.
- ↑ab L. F. Fieser, M. Fieser:Lehrbuch der organischen Chemie.3. Auflage. Verlag Chemie, 1957, S. 507.
- ↑ L. F. Fieser, M. Fieser:Lehrbuch der organischen Chemie.3. Auflage. Verlag Chemie, 1957, S. 511.
- ↑ L. F. Fieser, M. Fieser:Lehrbuch der organischen Chemie.3. Auflage. Verlag Chemie, 1957, S. 516.
- ↑ab L. F. Fieser, M. Fieser:Lehrbuch der organischen Chemie.3. Auflage. Verlag Chemie, 1957, S. 508.
- ↑ab L. F. Fieser, M. Fieser:Lehrbuch der organischen Chemie.3. Auflage. Verlag Chemie, 1957, S. 510.
- ↑Bernd Hoppe,Jürgen Martens:Aminosäuren – Herstellung und Gewinnung.In:Chemie in unserer Zeit.18. Jahrg., Nr. 3, 1984, S. 73–86.
- ↑N. Tonouchi, H. Ito:Present Global Situation of Amino Acids in Industry.In:Advances in Biochemical Engineering/Biotechnology.Band 159, 2017, S. 3–14,doi:10.1007/10_2016_23.PMID 27832295.
- ↑abM. D'Este, M. Alvarado-Morales, I. Angelidaki:Amino acids production focusing on fermentation technologies - A review.In:Biotechnology Advances.Band 36, Nummer 1, Jan-Feb 2018, S. 14–25,doi:10.1016/j.biotechadv.2017.09.001.PMID 28888551.
- ↑J. H. Lee, V. F. Wendisch:Production of amino acids - Genetic and metabolic engineering approaches.In:Bioresource Technology.Band 245, Pt B, Dezember 2017, S. 1575–1587,doi:10.1016/j.biortech.2017.05.065.PMID 28552565.
- ↑Eintrag zuProteinwertigkeit.In:Römpp Online.Georg Thieme Verlag, abgerufen am 18. Januar 2013.
- ↑K. Yamamoto, A. Tsuchisaka, H. Yukawa:Branched-Chain Amino Acids.In:Advances in Biochemical Engineering/Biotechnology.Band 159, 2017, S. 103–128,doi:10.1007/10_2016_28.PMID 27872960.
- ↑Wolfgang Legrum:Riechstoffe, Zwischen Gestank Und Duft: Vorkommen, Eigenschaften und Anwendung von Riechstoffen und deren Gemischen.Gabler Wissenschaftsverlage, 2011, S. 165 (eingeschränkte Vorschauin der Google-Buchsuche).
- ↑K. V. Savelieva, S. Zhao, V. M. Pogorelov, I. Rajan, Q. Yang, E. Cullinan, T. H. Lanthorn:Genetic disruption of both tryptophan hydroxylase genes dramatically reduces serotonin and affects behavior in models sensitive to antidepressants.In:PLOS ONE.Band3,Nr.10,2008,Artikel e3301,doi:10.1371/journal.pone.0003301,PMID 18923670,PMC 2565062(freier Volltext),bibcode:2008PLoSO...3.3301S.
- ↑David Shemin,D. Rittenberg:The biological utilization of glycine for the synthesis of the protoporphyrin of hemoglobin.In:The Journal of Biological Chemistry.Band166,Nr.2,Dezember 1946,S.621–5,PMID 20276176(jbc.org).
- ↑J. Tejero, A. Biswas, Z. Q. Wang, R. C. Page, M. M. Haque, C. Hemann, J. L. Zweier, S. Misra, D. J. Stuehr:Stabilization and characterization of a heme-oxy reaction intermediate in inducible nitric-oxide synthase.In:The Journal of Biological Chemistry.Band283,Nr.48,November 2008,S.33498–507,doi:10.1074/jbc.M806122200,PMID 18815130,PMC 2586280(freier Volltext).
- ↑C. Rodríguez-Caso, R. Montañez, M. Cascante, F. Sánchez-Jiménez, M. A. Medina:Mathematical modeling of polyamine metabolism in mammals.In:The Journal of Biological Chemistry.Band281,Nr.31,August 2006,S.21799–21812,doi:10.1074/jbc.M602756200,PMID 16709566.
- ↑Lubert Stryer, Jeremy M. Berg, John L. Tymoczko:Biochemistry.5. Auflage. W.H. Freeman, New York 2002,ISBN 978-0-7167-4684-3,S.693–698.
- ↑W. Ren, R. Rajendran, Y. Zhao, B. Tan, G. Wu, F. W. Bazer, G. Zhu, Y. Peng, X. Huang, J. Deng, Y. Yin:Amino Acids As Mediators of Metabolic Cross Talk between Host and Pathogen.In:Frontiers in immunology.Band 9, 2018, S. 319,doi:10.3389/fimmu.2018.00319.PMID 29535717,PMC 5835074(freier Volltext).