HBsAg
| HBsAg | ||
|---|---|---|
| ||
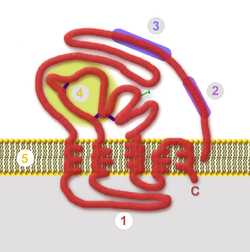
| schematischer Aufbau des HBsAg mit intrazellulärer Domäne (1), T-Zell-Epitop (2), Andockstelle (3), hypervariabler Domäne (4) und Lipiddoppelschicht (5) | ||
| Andere Namen |
| |
| Masse/LängePrimärstruktur | 226Aminosäuren,25,4kDa | |
| Bezeichner | ||
| Externe IDs | ||
HBsAg(englischHBV surface antigen‚HBV-Oberflächenantigen‘) ist einOberflächenproteinin derVirushülledesHepatitis-B-Virus(HBV). Das HBsAg ist zudem der wirksame Bestandteil in den zugelassenenHepatitis-B-Impfstoffen.
Eigenschaften
[Bearbeiten|Quelltext bearbeiten]
Das HBsAG ist einTransmembranproteinmit fünf Membrandurchgängen und dreiDisulfidbrückenauf der Membranaußenseite. Gleichzeitig ist es einAntigen,gegen das während einerInfektionoder nach einerImpfungneutralisierende Antikörpergebildet werden. Es dient dem HBV zum Andocken anGlykosaminoglykanealsRezeptorund dann zur Bindung anNTCP(Na+-taurocholate cotransporting polypeptide) auf einer Wirtszelle.[1][2]Anschließend dient HBsAg alsfusogenes Proteinzur Freisetzung des HBV insZytosol.HBsAg wurde ursprünglich vonBaruch BlumbergalsAustralia-Antigenbezeichnet, da es im Blut eines australischenAboriginesgefunden wurde.[3]HBsAg bildet spontanVirosomenvon 20 nm Durchmesser aus, die bei Infizierten eine Konzentration von bis zu 1012Partikel pro Milliliter Blut erreichen.[4]
Das Auftreten vonAnti-HBs-Antikörpern(Serokonversion) gegen HBsAg kennzeichnet den Übergang zur nicht-infektiösen Erkrankung. Weiterhin wird im Zuge dervirologischen Diagnostikeine erfolgte Infektion mit HBV durch Bestimmung des Serum-HBsAg oder per Antigen-ELISAnachgewiesen. In derHistotechnikkann HBsAg durch dieOrcein-Färbung nach Shikata angefärbt werden.[5]Etwa vierzehn Tage nach einer Impfung mit HBsAg können Antikörper dagegen nachgewiesen werden.[6]
Einer der erstenImpfstoffegegen HBV (Heptavax) wurde aus demBlutplasmavon HBV-Infiziertengereinigt,aufgrund desKontaminationsrisikosdurch anderePathogenewurde später aufrekombinantes HBsAgaus derBäckerhefeumgestellt.
DasHepatitis-D-Virusbenötigt HBsAg, um pathogen zu werden.[7]
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑J. M. Wettengel, B. J. Burwitz:Innovative HBV Animal Models Based on the Entry Receptor NTCP.In:Viruses.Band 12, Nummer 8, Juli 2020, S.,doi:10.3390/v12080828,PMID 32751581,PMC 7472226(freier Volltext).
- ↑H. Yan, G. Zhong, G. Xu, W. He, Z. Jing, Z. Gao, Y. Huang, Y. Qi, B. Peng, H. Wang, L. Fu, M. Song, P. Chen, W. Gao, B. Ren, Y. Sun, T. Cai, X. Feng, J. Sui, W. Li:Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus.In:eLife.Band 1, November 2012, S. e00049,doi:10.7554/eLife.00049,PMID 23150796,PMC 3485615(freier Volltext).
- ↑Baruch S. Blumberg:A "New" Antigen in Leukemia Sera.In:JAMA191, 1965, S. 541,doi:10.1001/jama.1965.03080070025007.
- ↑D. M. Knipe,Peter M. Howley(Hrsg.):Fields Virology.5. Auflage, Philadelphia 2007.ISBN 0-7817-6060-7.
- ↑P. Guarascio, F. Yentis, U. Cevikbas, B. Portmann, R. Williams:Value of copper-associated protein in diagnostic assessment of liver biopsy..In:Journal of Clinical Pathology.36, 1983, S. 18,doi:10.1136/jcp.36.1.18.
- ↑Carolyn D Rysgaard, Cory S Morris, Denny Drees, Tami Bebber, Scott R Davis, Jeff Kulhavy, Matthew D Krasowski:Positive hepatitis B surface antigen tests due to recent vaccination: a persistent problem.In:BMC Clinical Pathology.12, 2012, S. 15,doi:10.1186/1472-6890-12-15.
- ↑N. Chai, H. E. Chang, E. Nicolas, Z. Han, M. Jarnik, J. Taylor:Properties of subviral particles of hepatitis B virus.In:Journal of virology.Band 82, Nummer 16, August 2008,ISSN1098-5514,S. 7812–7817,doi:10.1128/JVI.00561-08.PMID 18524834,PMC 2519590(freier Volltext).