Kollagene
| Kollagen | ||
|---|---|---|

| ||
| Kollagen-Tripelhelix | ||
| Masse/LängePrimärstruktur | 3 × 200–1000 Aminosäuren | |
| Sekundär-bisQuartärstruktur | Tripelhelix | |
| Präkursor | Prokollagen-Polypeptidketten und Prokollagen | |
| Isoformen | 28 beim Menschen | |
| Arzneistoffangaben | ||
| ATC-Code | B02BC07,G04BX11,D11AX57 | |
| Wirkstoffklasse | Faserprotein | |
| Vorkommen | ||
| ÜbergeordnetesTaxon | Gewebetiere | |
Kollagene(VorstufeTropokollagene;internationalisierte SchreibweiseCollagene;Betonung auf der zweitletzten Silbe) sind eine Gruppe nur beivielzelligen Tieren(einschließlichMenschen) vorkommenderStrukturproteine(ein Faserbündel bildendes „Eiweiß“) hauptsächlich desBindegewebes(genauer: derextrazellulären Matrix). Kollagene finden sich unter anderem in den weißen, unelastischen Fasern von Sehnen, Bändern, Knochen und Knorpeln. Auch Schichten derHaut(Unterhaut) bestehen aus Kollagenen.
Hintergrund
[Bearbeiten|Quelltext bearbeiten]
Im menschlichen Körper ist Kollagen mit über 30 % Anteil an der Gesamtmasse allerProteinedas am häufigsten vorkommende Eiweiß. Es ist ein wesentlicher organischer Bestandteil desBindegewebes(Knochen,Zähne,Knorpel,Sehnen,Bänder) und derHaut.Seinen Namen erhielt das Kollagen (aus dem Griechischen:Leim erzeugend) ursprünglich aufgrund seiner früheren Nutzung alsKnochenleimim Holzhandwerk. Es ist der Hauptgrundstoff für die Herstellung vonGelatine.
Kollagen besteht aus einzelnen langen Kollagenmolekülen (Proteinkettenbzw. korrekterweise Aminosäureketten), die einelinksgängige Helix (ähnlich der Polyproline-II-Helix) ausbilden. Jeweils drei dieser Helices sind in einerrechtsgängigen Superhelix arrangiert, dem eigentlichen Kollagen. Diese Tripelhelix wird durchWasserstoffbrückenzwischen den einzelnen Strängen stabilisiert.
Auffallend an derPrimärstruktur(Aminosäuresequenz) des Kollagens ist, dass jede dritteAminosäureGlycinist. Ein in derProteinfamilieder Kollagene häufig wiederholtes Sequenzmotiv ist Glycin-Prolin-Hydroxyprolin.
Kollagenfasernbesitzen eine enormeZugfestigkeitund sind kaum dehnbar. Die dichte Wicklung ist hierbei ausschlaggebend für die hohe Zugfestigkeit von Kollagenfasern.
Kollagene spielen in derBiomineralisationderWirbeltiereeine entscheidende Rolle.[1]
Im allgemeinen Sprachgebrauch wird Kollagen Typ I gleichgesetzt mit „Kollagen “. Kollagen Typ I ist zwar mengenmäßig imSäugetierdas bedeutendste Kollagen und durch seine Verwendung als Gelatine auch das Bekannteste, es existieren jedoch weitere Kollagentypen, die sich strukturell wesentlich vom Kollagen Typ I unterscheiden und andere wichtige biologische Funktionen wahrnehmen.Gelatineist diedenaturierteForm von fibrillärem Kollagen Typ I, II und/oder III und wird meist ausSchlachtabfällengewonnen. Hierbei ist zu beachten, dass Kollagen Typ II vornehmlich imKnorpelvorkommt, Gemische von Kollagen Typ I und III stammen ausSehnen,Bändernund derHaut.
Vorkommen
[Bearbeiten|Quelltext bearbeiten]FunktionaleGenekollagener Strukturproteine finden sich bei allenStämmender vielzelligen Tiere, beiSchwämmen,[2]Nesseltieren[3][4]bis zu Säugetieren, hauptsächlich in deren extrazellulären Matrix und im Bindegewebe. Kollagene treten bei anderen Organismen wie Pilzen, Pflanzen oder Einzellern nicht auf.
Aufbau
[Bearbeiten|Quelltext bearbeiten]Kollagenmolekül
[Bearbeiten|Quelltext bearbeiten]DiePolypeptidkettendes Kollagens werden einzeln durch dieRibosomendes rauenEndoplasmatischen Retikulumssynthetisiert. Als Kollagenmolekül oderTropokollagenwerden nur tripelhelikale Moleküle der extrazellulären Matrix (EZM) bezeichnet. Sie haben gemeinsam, dass sie aus drei Polypeptidketten aufgebaut sind. Diese liegen jeweils in linksgängigen Kollagen-Helices (α-Ketten, nicht zu verwechseln mit den rechtsgängigenα-Helices) vor und sind gemeinsam in Form der charakteristischen rechtshändigen Tripelhelix umeinander gewunden. Jede einzelne Kollagen-Helix kann in Abhängigkeit vom Kollagentyp aus 600 bis 3000 Aminosäuren zusammengesetzt sein und ist mit großen Domänen ausgestattet, die aus sich wiederholenden (repetitiven) G-X-Y-Sequenzen aufgebaut sind.
Somit befindet sich an jeder dritten Position einGlycin(G)-Rest. Glycin als die kleinste Aminosäure passt ideal in die Tripelhelix mit ihren sehr engen Windungen. Die AminosäureProlinist sehr häufig an Position X zu finden. Prolin fungiert hier aufgrund seiner starren Ringstruktur als „Ecke “in der Polypeptidkette und unterstützt die Ausbildung von engen Windungen innerhalb der Tripelhelix. 4-Hydroxyprolinist überwiegend an Position Y lokalisiert und stabilisiert die Tripelhelix über Wasserstoffbrücken zwischen benachbarten Polypeptidketten. Durch die Verwendung von Glycin, Prolin und Hydroxyprolin wird die Rotation der Polypeptidkette begrenzt und den engen Raumbedingungen innerhalb der Tripelhelix Rechnung getragen.
| Strukturebene | molekularer Bereich |
|---|---|
| Primärstruktur(= Sequenz) | Polypeptidketten mit repetitiven G-X-Y-Sequenzen |
| Sekundärstruktur | linksgängige Kollagen-Helices (α-Ketten) |
| Tertiärstruktur | rechtsgängige Tripelhelix aus 3 Polypeptidketten (Tropokollagen Ø1,5 nm) |
| Quartärstruktur | Mikrofibrillen Ø20–40 nm, Fibrillen Ø300–500 nm, Fasern Ø4–12 μm |
Das Vorkommen vonHydroxylysinneben Hydroxyprolin ist ebenfalls charakteristisch für Kollagen. Hydroxylysin bildet die Voraussetzung für die AusbildungkovalenterQuervernetzungen, womit die einzelnen Tripelhelices innerhalb der Kollagenfibrillen räumlich fixiert werden können.
Kollagenfibrille
[Bearbeiten|Quelltext bearbeiten]
In denFibrillensind benachbarte Kollagenmoleküle nicht bündig angeordnet, sondern um 67 nm, d. h. um etwa ein Fünftel ihrer Länge, gegeneinander versetzt. Diese Anordnung hat zur Folge, dass auf elektronenmikroskopischen Aufnahmen von Metall-kontrastierten Kollagenfibrillen eine Querstreifung zu sehen ist. Es entsteht ein charakteristisches Bänderungsmuster, das sich alle 67 nm (234 Aminosäuren) wiederholt und als D-Periode bezeichnet wird. Dadurch werden die α-Ketten in vier homologe Bereiche D1–D4 unterteilt. Die in einer D-Einheit auftretenden Banden werden mit a–e bezeichnet. Die Kollagen-Fibrillen sind geordnetePolymere,die im ausgereiften Gewebe viele Mikrometer lang werden können. Sie sind oft zu größeren, kabelartigen Bündeln, den Kollagenfasern, zusammengefasst. Bei Sehnen betragen die Kollagen Typ I Fibrillendurchmesser 50–500 nm, in der Haut 40–100 nm und in der Kornea (Hornhaut des Auges) 25 nm. Die Fibrillogenese des Kollagens wird oftmals durch kleineleucinreicheProteoglykanereguliert, so dass in den entsprechenden Geweben Fibrillen mit definiertem Durchmesser und definierter Anordnung entstehen können.
Strukturaufklärung
[Bearbeiten|Quelltext bearbeiten]Das heutige Bild der Kollagen-Tripelhelix und die räumliche Einordnung der Aminosäurereste und ihrer Wasserstoffbrücken untereinander geht maßgeblich auf dieRöntgen-kristallographischenArbeiten der indischen WissenschaftlerG. N. RamachandranundGopinath Karthazurück (1954).
Wesentliche Aufklärung (die gesamtePrimärstrukturdes Typ I Kollagens sowie die Makrostrukturen der Typen IV und VI) leistete das ehemaligeMax-Planck-Institut für Eiweiß- und Lederforschungin München (1956 zur Aufklärung des Bindegewebes durch Sponsoring der Lederindustrie gegründet) ab 1966 unter der Leitung vonKlaus Kühn(nach Institutsverlegung amMax-Planck-Institut für Biochemiein Martinsried).[5]
Biosynthese
[Bearbeiten|Quelltext bearbeiten]Kollagen wird hauptsächlich inFibroblasten,Chondroblasten,OsteoblastenundOdontoblastenhergestellt, jedoch wird Kollagen auch in vielen anderen Zelltypensynthetisiert.Am besten untersucht ist die Biosynthese des Kollagens in Fibroblasten. Fibroblasten besitzen ein ausgedehntes raues endoplasmatisches Retikulum und einen gut entwickelten Golgi-Apparat, um an derSekretionder Kollagene in die extrazelluläre Matrix teilnehmen zu können. Fibroblasten stellen Kollagende novoher und sezernieren es in die extrazelluläre Matrix. Außerdem sind Fibroblasten in der Lage, Kollagen mithilfe von Enzymen, den sogenanntenKollagenasen,abzubauen.[6]
1.Transkription:Bislang sind 42 Gene bekannt, die sich an der Biosynthese von Kollagen beteiligen und für 28 verschiedene Kollagentypen codieren.[7]Jedes Gen codiert für eine bestimmte mRNA-Sequenz und der Genname enthält typischerweiseCOLals Präfix. Die Synthese wird durch die Aktivierung von bestimmten Genen gestartet, die für die Bildung von bestimmten α-Peptiden zuständig sind. Hauptsächlich sind dies die α-Peptide α1, α2 oder α3.
2.Translation:Sobald die mRNA vom Zellkern in das Cytoplasma gelangt, verbindet sich die mRNA zur Translation mit den ribosomalen Untereinheiten zur Bildung vonPräpro-α-Ketten(auch Präpropeptid genannt). Diese Präpro-α-Ketten enthalten amN-Terminus eine Signalsequenz. Diese Signalsequenz wird durch einSignalerkennungspartikelam rauen endoplasmatischen Retikulum (ER) erkannt, sodass die Kette in dasLumendes rauen ER gelangen kann.[8]
3.Präpro-α-Kette zum Prokollagen:Drei Modifikationen der Präpro-α-Kette sind zur Bildung einer α-Kette nötig. Danach folgt die Tripelhelixbildung dreier α-Ketten zum Prokollagen.
- Abspaltung der Signalsequenz:Die Signalsequenz amN-Terminus der Präpro-α-Kette wird durchSignalpeptidasenabgespalten und es entsteht eine Pro-α-Kette, die mitN-undC-terminalenPropeptiden versehen ist.[9]
- Hydroxylierung:Im Endoplasmatischen Retikulum werden an einzelne Prolin- undLysin-Reste entstehender oder bereits entstandener Polypeptidketten OH-Gruppen angehängt (Hydroxylierung).Ascorbinsäure(Vitamin C) ist ein wichtigerCofaktorbei der Hydroxylierung der Aminosäuren Prolin zu Hydroxyprolin durch dasEnzymProlyl-4-Hydroxylase[10](EC1.14.11.2) und Lysin zu Hydroxylysin durch das EnzymLysylhydroxylase[11](EC1.14.11.4). Hydroxyprolin kommt die Funktion zu, überWasserstoffbrückenzwischen benachbarten Kollagen-Polypeptidketten die Tripelhelix innerhalb eines Kollagenmoleküls zu festigen. Hydroxylysin dient der Verankerung von kovalenten Quervernetzungen zwischen Kollagenmolekülen. Bei fehlender Hydroxylierung werden nur schadhafte Kollagenmoleküle gebildet, die ihrer Funktion als Strukturprotein nicht nachkommen können. Hierbei ist anzumerken, dass nahezu alleSymptomeder Ascorbinsäure-MangelerkrankungSkorbutauf die fehlerhafte Biosynthese des Kollagens zurückzuführen sind.
- Glycosylierung:Schließlich erfolgt meist eineGlycosylierungmancher Lysinreste durch die Prokollagen-Galactosyltransferase (EC2.4.1.50) oder die Prokollagen-Glucosyltransferase (EC2.4.1.66) oder weitere Glycosylierungsenzyme. Eine Kollagen-α-Kette wurde synthetisiert.[12]
- Tripelhelixbildung:Durch Ausbildung vonDisulfidbindungenzwischen denC-terminalen Propeptiden mithilfe einerProteindisulfid-Isomerase(EC5.3.4.1) wird die Tripelhelixbildung eingeleitet. Drei α-Ketten formieren dabei über Wasserstoffbrücken ein dreisträngiges Helixmolekül, dasProkollagen.
4.Prokollagen-Sekretion und Transport zum Golgi-Apparat:Aufgrund der Größe von Prokollagen-Molekülen (ca. 300 nm) passen sie nicht in die normalenCOPII-Vesikel(50–90 nm) des endoplasmatischen Retikulums hinein. Um den Transport zu ermöglichen, wird eine Kopie des ProteinsUbiquitindurch das Enzym CUL3–KLHL12 an SEC31 des Proteinkomplexes SEC13–SEC31 gebunden, sodass die Größe der Transportvesikel modifiziert werden kann. Außerdem beteiligt sich das Transmembranprotein TANGO1 an der Koordination der Prokollagen-Sekretion. Nachdem das Prokollagen in den modifizierten Transportvesikeln verpackt worden ist, ist der Transport zumGolgi-Apparatmöglich.[13]
5.Modifikation im Golgi-Apparat:Die letzte posttranslationale Modifikation am Prokollagen erfolgt im Golgi-Apparat durch das Anhängen und die Modifikation von Oligosacchariden. Welche Enzyme für die Modifizierung vonN-terminusgebundenen Oligosacchariden verantwortlich sind, hängt vom Ort der posttranslationalen Modifikation im Golgi-Apparat ab. Im Folgenden sind die Enzyme für die jeweiligen Bereiche des Golgi-Apparats tabelliert:[14]
| Bereich des Golgi-Apparats | Enzym |
|---|---|
| cis | α-Mannosidase I |
| medial | N-Acetylglucosaminyl-Transferase I |
| medial | α-Mannosidase II |
| medial | N-Acetylglucosaminyl-Transferase II |
| medial | Fucosyltransferase |
| trans | Galactosyltransferase |
| trans | Sialyltransferase |
6.Transport vom Golgi-Apparat zur Plasmamembran und anschließende Exozytose in die extrazelluläre Matrix:Die sekretorischenVesikel,die sich an dertrans-Seite des trans-Golgi-Netzwerks abschnüren, bezeichnet man alsGolgi to plasma membrane carrier(GPC). In den GPC wird das Prokollagen zur Plasmamembran, genauer gesagt zu den Vorwölbungen der Plasmamembran, sogenannteFibripositoren,transportiert. Die tripelhelikalen Kollagenmoleküle werden aus der Zelle entlassen. Die Abgabe der Moleküle in den extrazellulären Raum erfolgt durchExozytosemit der Basis der Fibripositoren, woran die Glycosylbestandteile beteiligt zu sein scheinen.[15]
7.Bildung des Tropokollagens:Unmittelbar nach der Abgabe aus der Zelle werden die Propeptide mit Hilfe von Prokollagen-Peptidasenabgespalten.[16]Dabei ist das Enzym Prokollagen-N-Endopeptidase (EC3.4.24.14) bei der AbspaltungaminoterminalerSequenzen erforderlich, während das Enzym Prokollagen-C-Endopeptidase (EC3.4.24.19)carboxyterminaleProkollagen-Sequenzen abspaltet. Es kommt zur Bildung desTropokollagens.
8.Fibrillogenese:Nach Abspaltung der Prokollagenpeptide lagern sich einzelne Tropokollagen-Moleküle zuKollagenfibrillenzusammen (Fibrillogenese). Andere Moleküle können sich an die Fibrillen anlagern und somit den Fibrillendurchmesser anpassen. Dazu gehören die sogenanntensmallleucine-rich repeatproteoglycans(SLRPs), zu denen beispielsweiseDecorin,FibromodulinundLumicangehören.[17][18]
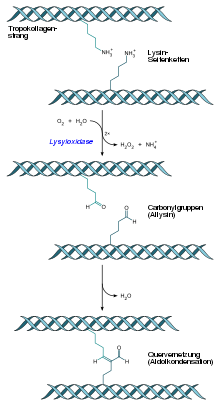
9.Quervernetzung:Nachdem sich einzelne tripelhelikale Tropokollagenmoleküle um ein Fünftel ihrer Länge versetzt aneinander gelagert haben, erfolgenkovalenteQuervernetzungenüber erst umzuwandelnde nahestehende Hydroxylysinreste, womit die räumliche Anordnung dauerhaft fixiert wird. Die (intrazellulär durch die Lysylhydroxylase entstandenen) Hydroxylysinreste werden durch die Lysyloxidase (EC1.4.3.13) zu Allysin oxidiert. Die beiden benachbarten Allysinreste gehen eineAldolkondensationein, womit diese Nachbarschaft durch eine dauerhafte Quervernetzung fixiert ist. Es kommt zur Bildung von quervernetzten Kollagenfibrillen.
10.Bildung von Kollagenfasern:Viele derartig kovalent stabilisierte Kollagenfibrillen bilden schließlich Kollagenfasern, welche die Grundstruktur derextrazellulären MatrixallerGewebetieredarstellen.
Kollagentypen
[Bearbeiten|Quelltext bearbeiten]Die Kollagene werden in mehrere Untergruppen unterteilt. 28 verschiedene Kollagentypen sind bekannt (Typ I bis XXVIII) sowie mindestens zehn weitere Proteine mit kollagenähnlichen Domänen. In der folgenden Zusammenstellung sind die bislang bekannten Mitglieder der Kollagenfamilie aufgeführt.
| Typ | Beschreibung | Gen(e) | Krankheiten |
| I | Bei Säugetieren ist Kollagen Typ I, ein fibrilläres Kollagen, der häufigste Kollagentyp und kommt in Haut, Sehnen, Faszien, Knochen, Gefäßen, inneren Organen und im Dentin vor. | COL1A1,COL1A2 | Osteogenesis imperfectaTyp I–IV,Ehlers-Danlos-Syndrom(klassisch, Arthrochalasie),Infantile kortikale Hyperostose |
| II | fibrillär;Strukturproteindeshyalinenundelastischen Knorpels;50 % aller Proteine des Knorpels bestehen aus Kollagen Typ II; Bestandteil desGlaskörpers | COL2A1 | Hypochondrogenesie,Achondrogenesie Typ II,Stickler-Syndrom,Kongenitale Spondyloepiphysäre Dysplasie,Spondyloepimetaphysäre Dysplasie Typ Strudwick,Kniest-Dysplasie |
| III | fibrillär; Bestandteil desGranulationsgewebesund derretikulären Fasern;ebenfalls Bestandteil der Gefäßwände, inneren Organe, Haut, Uterus und Hornhaut | COL3A1 | Akrogerie,Ehlers-Danlos-Syndrom(vaskulär) |
| IV | Bestandteil derBasallaminaund derAugenlinse;dient ebenfalls als Teil des Filtrationssystems inKapillarenund derGlomerulidesNephrons | COL4A1,COL4A2,COL4A3,COL4A4,COL4A5,COL4A6 | Alport-Syndrom,Goodpasture-Syndrom,Nephropathie vom Typ der dünnen Basalmembran |
| V | fibrillär; Bestandteil desInterstitiums,Plazentagewebeund der dermoepidermalen Junktionszone; meistens mit Zwischengewebe, die Kollagen Typ I beinhalten, assoziiert | COL5A1,COL5A2,COL5A3 | Ehlers-Danlos-Syndrom(klassisch, hypermobil) |
| VI | Organisation verschiedener Komponenten in derextrazellulären Matrix;Aufrechterhaltung der Integrität der verschiedenen Geweben; meistens mit Gewebe, die Kollagen Typ I beinhalten, assoziiert | COL6A1,COL6A2,COL6A3,COL6A5 | Kongenitale Muskeldystrophie Typ Ullrich,Bethlem-Myopathie,Atopisches Ekzem[19] |
| VII | bildet Ankerfibrillen in der dermoepidermalen Junktionszone | COL7A1 | Epidermolysis bullosa dystrophica,Bart-Syndrom |
| VIII | kurzkettig; integraler Bestandteil dersubendothelialen Schichtvon Bindegewebszellen in Blutgefäßen und derDescemet-Membrander Hornhaut;MigrationundProliferationvonglatten Muskelzellenin derTunica mediader Blutgefäße | COL8A1,COL8A2 | Hintere-polymorphe-Hornhautdystrophie,Fuchs-Endotheldystrophie1 |
| IX | FACIT1;Bestandteil des hyalinen Knorpels und des Glaskörpers; meistens mit Gewebe, die Kollagen Typ II und XI beinhalten, assoziiert | COL9A1,COL9A2,COL9A3 | Multiple epiphysäre Dysplasie(Typ 2,3 und 6) |
| X | kurzkettig; Bestandteil vonChondrozytenin derhypertrophen Zone | COL10A1 | Metaphysäre Chondrodysplasie Typ Schmid,Spondylometaphysäre DysplasieTyp Sutcliffe |
| XI | fibrillär; Bestandteil des Knorpels | COL11A1,COL11A2 | Stickler-SyndromTyp 2,Marshall-Syndrom,Weissenbacher-Zweymüller-Phänotyp,Oto-spondylo-megaepiphysäre Dysplasie |
| XII | FACIT, Interaktion mit Kollagenfibrillen Typ I,DecorinundGlykosaminoglykanen | COL12A1 | Bethlem-Myopathie2,Kongenitale Muskeldystrophie Typ Ullrich2 |
| XIII | MACIT2;interagiert mitIntegrinα1β1,Fibronectinund anderen Bestandteilen der Basalmembran wieNidogen-2undPerlecan;ist in der Zell-Matrix-Verbindung und in der Zelladhäsion involviert; Verknüpfung der Muskelfaser mit der Basalmembran | COL13A1 | Kongenitales myasthenes SyndromTyp 19 |
| XIV | FACIT; auch als Undulin bekannt; spielt eine Rolle bei der adhäsiven Integration vonKollagenfaszikeln;ist während der embryonalen Entwicklung in der Basalmembran präsent | COL14A1 | – |
| XV | Multiplexin; ist in der Lage, dieBasalmembranmit demlockeren Bindegewebezu verbinden; stabilisiertMikrogefäßeundMuskelzellenim Herz und imSkelettmuskel;kann dieAngiogeneseinhibieren | COL15A1 | – |
| XVI | FACIT; in derZelladhäsioninvolviert und induziertIntegrin-vermittelte zelluläre Reaktionen, wie dieProliferation;fördert die Lebensdauer vonintestinalensubepithelialenMyofibroblasten(engl.intestinal subepithelial myofibroblasts,ISEMF) in der Darmwand | COL16A1 | – |
| XVII | MACIT; spielt eine wichtige Rolle in der Integrität vonHemidesmosomenund in der Besfestigung vonKeratinozytenan die darunterliegende Basalmembran; fördert die Invasion von extravillösenTrophoblastenwährend der Entwicklung derPlazenta | COL17A1 | Bullöses Pemphigoid,Epidermolysis bullosa junctionalis |
| XVIII | Multiplexin; Aufrechterhaltung derNetzhautstrukturund Schließung desNeuralrohrs;ein Spaltprodukt des Kollagen XVIII ist dasEndostatinmit einer Molekülmasse von 20kDa | COL18A1 | Knobloch-SyndromTyp 1 |
| XIX | FACIT; befindet sich meistens in dervaskulären,neuronalen,mesenchymalenund in derepithelialenBasalmembran; Querbrücke zwischen Fibrillen und anderen extrazellulären Matrixmolekülen | COL19A1 | – |
| XX | FACIT; befindet sich meistens in derEpithelschichtder Hornhaut, der embryonalen Haut, demSchwertfortsatzund in derSehne | COL20A1 | – |
| XXI | FACIT; ist eine extrazelluläre Matrixkomponente der Blutgefäßwand, das von glatten Muskulaturzellen sekretiert wird | COL21A1 | – |
| XXII | FACIT; beteiligt sich an der Zelladhäsion von Liganden in mehrschichtigen Epithelien und in Fibroblasten | COL22A1 | – |
| XXIII | MACIT; befindet sich in derEpidermisund in anderen Epithelien wie in der Zunge, Darm, Lunge, Gehirn, Niere und Hornhaut; interagiert mit Integrin α2β1 | COL23A1 | – |
| XXIV | hauptsächlich imKnochengewebeexprimiert | COL24A1 | – |
| XXV | MACIT; fügt amyloide Fibrillen mitProtease-resistentenAggregatenzusammen und kannHeparinbinden | COL25A1 | – |
| XXVI | wird oftmals mit der Bildung vonNasenpolypenin derNasenhöhleassoziiert | COL26A1 | – |
| XXVII | befindet sich in derBasalmembranderKeratinozyteninHemidesmosomenTyp I, das im Wesentlichen alsAdhäsionsmolekülund Oberflächenrezeptor auch inmehrschichtigen Epithelienfungiert | COL27A1 | – |
| XXVIII | befindet sich hauptsächlich imIschiasnervund an derBasalmembraneinigerSchwann-Zellen;integraler Bestandteil desRanvier-Schnürringsund umgibt nicht-myelinisierteGliazellen | COL28A1 | – |
Aufbau des Kollagens Typ I
[Bearbeiten|Quelltext bearbeiten]Die drei Kollagen-Polypeptidkettensind im Falle von Kollagen Typ I die α-Ketten, [α1(I)2α2(I)], die sich zu einer Tripelhelix umeinander winden. Das Gen der α1-Kette von Kollagen Typ I besteht aus 50Exons,von denen über die Hälfte eine Länge von 54 Basenpaaren (bp) oder das zwei- bis dreifache dieser Länge besitzen. Sie codieren für die Sequenz (G-X-Y)6oder ein Vielfaches davon.
Nutzung
[Bearbeiten|Quelltext bearbeiten]Ernährung und Futterstoffe
[Bearbeiten|Quelltext bearbeiten]In Deutschland werden jährlich etwa 32.000 t Gelatine in Speisequalität hergestellt, die europäische Gesamtproduktion beträgt 120.000 t (70 % Schweineschwarten, 18 % Knochen, 10 % Rinderspalt, 2 % sonstige).[20]Verwendet werden in Deutschland etwa 90.000 t, wobei zwei Drittel auf den Ernährungsbereich und von dem Rest etwa die Hälfte auf den Futtermittelbereich entfallen.[21]
Daneben wird Kollagen für die Herstellung vonKunstdärmen,die alsWursthülledienen, benutzt.[22]
Pharma
[Bearbeiten|Quelltext bearbeiten]
Etwa 15.000 t werden in der chemischen und pharmazeutischen Industrie verarbeitet. Dabei stellen Umhüllungen von Tabletten und Vitaminpräparaten (Hart- und Weichkapseln) sowie Gelatinezäpfchen die Haupteinsatzbereiche in der Pharmaindustrie dar. Außerdem wird Gelatine für blutstillende Schwämmchen sowie als Blutplasma-Ersatz eingesetzt.
Kollagen wird außerdem in derregenerativen Medizinals Nährmedium in derGewebezüchtungbenutzt. Damit können beispielsweise Hautersatzmaterialien für schwere Verbrennungen hergestellt werden.[22]
Kosmetik
[Bearbeiten|Quelltext bearbeiten]Kollagen findet seit vielen Jahren auch in der Kosmetik Anwendung und soll dort hauptsächlich zur Minderung von Hautalterung, demAnti-Aging,dienen.
Eine investigative Reportage des Guardian konnte 2023 zeigen, dass Produzenten weltweit Kollagen von Kühen verkaufen, die auf Farmen gehalten werden, welche für die Abholzung des Regenwaldes verantwortlich sind.[23]
Kollagencremes gehören zu den Bestsellern auf dem Kosmetikmarkt. Allerdings kann das enthaltene Kollagen nicht in die Haut eindringen, da seine Fasern zu lang sind. Studien konnten bisher nicht zeigen, dass kürzere Fasern (Peptide) in die Haut eindringen können. Neben Cremes werden auch Supplemente zur oralen Einnahme verkauft. Bislang wurden die meisten, wenn nicht alle, Studien zu Kollagen von Industrien finanziert, die durch den Verkauf von Kollagenprodukten Vorteile hätten. Daher kann kein unabhängiges Urteil über die Effektivität von Kollagen getroffen werden.[24]
Zur Behandlung von Falten oder Runzeln wird Kollagen alsFaltenunterspritzunggelegentlich in die Haut injiziert.
Technik
[Bearbeiten|Quelltext bearbeiten]In der analogen Fotografie stellt Gelatine die Basis für die fotoempfindlichen Schichten auf dem Film und dem Fotopapier. Auch moderne Druckerpapiere zum Ausdrucken von Farbbildern sind mit Gelatine beschichtet.[21]
Leder
[Bearbeiten|Quelltext bearbeiten]Vernetzte Kollagenfasern bilden die Struktur von Leder und geben ihm seine Zugfestigkeit. Mit Hilfe von Gerbstoffen werden bestimmte Eigenschaften wie Flexibilität und Resistenz gegen Zersetzung durch Mikroorganismen erreicht.
Gewinnung
[Bearbeiten|Quelltext bearbeiten]Kollagen wird vor allem in Form derGelatinegenutzt, die ausRinderspalt,Schweineschwartensowie Knochen von Rindern und Schweinen gewonnen wird. Nach dieser Herstellungsmethode kann das Kollagen denaturiert vorliegen und verunreinigt sein. Diese Form kann somit ungeeignet für manche Anwendungen sein.[25]Rein synthetisches Kollagen kann beispielsweise über biotechnologische Prozesse mittels genetisch modifizierten Mikroorganismen hergestellt werden.[26]
Siehe auch
[Bearbeiten|Quelltext bearbeiten]
Literatur
[Bearbeiten|Quelltext bearbeiten]- Shirley Ayad, Ray P. Boot-Hanford, Martin J. Humphries, Karl E. Kadler, C. Adrian Shuttleworth:The Extracellular Matrix FactsBook.2nd edition. Academic Press (Harcourt Brace & Company), San Diego CA u. a. 1998,ISBN 0-12-068911-1,S. 43 ff.
- Jürgen Brinckmann, Holger Notbohm, Peter K. Müller (Hrsg.):Collagen. Primer in Structure, Processing and Assembly(=Topics in Current Chemistry.Bd. 247). Springer, Berlin u. a. 2005,ISBN 3-540-23272-9.
Weblinks
[Bearbeiten|Quelltext bearbeiten]- Die zwei Gesichter des Kollagen VII – Die Proteinvariante macht nicht nur die Haut straff, sondern auch Hautkrebs gefährlich.wissenschaft.de
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Hermann Ehrlich:Chitin and collagen as universal and alternative templates in biomineralization.In:International Geology Review.Band52,Nr.7-8,30. April 2010,S.661–699,doi:10.1080/00206811003679521(englisch).
- ↑Aaron L. Fidler u. a.:A unique covalent bond in basement membrane is a primordial innovation for tissue evolution.In:Proceedings of the National Academy of Sciences.Band 111, Nr. 1, 2014, S. 331–336.doi:10.1073/pnas.1318499111.
- ↑Jason W. Holland u. a.:A novel minicollagen gene links cnidarians and myxozoans.In:Proceedings of the Royal Society B: Biological Sciences.Band 278, Nr. 1705, 2011, S. 546–553.doi:10.1098/rspb.2010.1301.
- ↑Richard P. Tucker, Josephine C. Adams:Adhesion networks of cnidarians: A postgenomic view.In: Kwang W. Jeon (Hrsg.):International Review of Cell and Molecular Biology.Academic Press. Band 308, Kapitel 8, 7. Januar 2014, S. 323–377.doi:10.1016/B978-0-12-800097-7.00008-7.
- ↑Klaus Kühn:Struktur und Biochemie des Kollagens.In:Chemie in unserer Zeit.Band 8, 1974, S. 97–103.doi:10.1002/ciuz.19740080402.
- ↑Gregory D. Cramer, Susan A. Darby:Basic and Clinical Anatomy of the Spine, Spinal Cord.Elsevier Health Sciences, 2005,ISBN 0-323-07142-2,S.580(eingeschränkte Vorschauin der Google-Buchsuche).
- ↑Gerhard Meisenberg, William H. Simmons:Principles of Medical Biochemistry E-Book.Elsevier Health Sciences, 2011,ISBN 978-0-323-08107-8,S.212.
- ↑Hao Wang, Branko Stefanovic:Role of LARP6 and Nonmuscle Myosin in Partitioning of Collagen mRNAs to the ER Membrane.In:PLoS One.9(10) 2014,PMID 25271881,doi:10.1371/journal.pone.0108870.
- ↑U. Lindert, M. Gnoli, M. Maioli, M.F. Bedeschi, L. Sangiorgi, M. Rohrbach, C. Giunta:Insight into the Pathology of a COL1A1 Signal Peptide Heterozygous Mutation Leading to Severe Osteogenesis Imperfecta.In:Calcified Tissue International.102(3) März 2018, S. 373–379,doi:10.1007/s00223-017-0359-z.
- ↑J. Myllyharju:Prolyl 4-hydroxylases, the key enzymes of collagen biosynthesis.In:Matrix Biology.Band 22, Nummer 1, März 2003, S. 15–24,PMID 12714038(Review).
- ↑Sakari Kellokumpu, Raija Sormunen, Jari Heikkinen, Raili Myllylä:Lysyl Hydroxylase, a Collagen Processing Enzyme, Exemplifies a Novel Class of Luminallyloriented Peripheral Membrane Proteins in the Endoplasmic Reticulum.In:The Journal of Biological Chemistry.269(148) 2. Dezember 1994, S. 30524–30529, (PDF).
- ↑Richard Harwood, Michael E. Grant, David S. Jackson:Studies on the glycosylation of hydroxylysine residues during collagen biosynthesis and the subcellular localization of collagen galactosyltransferase and collagen glucosyltransferase in tendon and cartilage cells.In:Biochemical Journal.152, 1975, S. 291,doi:10.1042/bj1520291.
- ↑David J. Stephens:Collagen secretion explained.In:Nature.482, 2012, S. 474,doi:10.1038/482474a.
- ↑R. Kornfeld, S. Kornfeld:Assembly of Asparagine-Linked Oligosaccharides.In:Annual Review of Biochemistry.54, 1985, S. 631,doi:10.1146/annurev.bi.54.070185.003215.
- ↑E. G. Canty:Procollagen trafficking, processing and fibrillogenesis.In:Journal of Cell Science.118, 2005, S. 1341,doi:10.1242/jcs.01731.
- ↑Charles M. Lapière, Albert Lenaers, Leonard D. Kohn:Procollagen peptidase: An enzyme excising the coordination peptides of procollagen.In:Proc Natl Acad Sci U S A.Band68,Nr.12,Dezember 1971,S.3054–3058,PMC 389589(freier Volltext).
- ↑A. Oldberg, P. Antonsson, K. Lindblom, D. Heinegård:A collagen-binding 59-kd protein (fibromodulin) is structurally related to the small interstitial proteoglycans PG-S1 and PG-S2 (decorin).In:The EMBO Journal.Band 8, Nummer 9, September 1989, S. 2601–2604,PMID 2531085,PMC 401265(freier Volltext).
- ↑J. A. Rada, P. K. Cornuet, J. R. Hassell:Regulation of corneal collagen fibrillogenesis in vitro by corneal proteoglycan (lumican and decorin) core proteins.In:Experimental eye research.Band 56, Nummer 6, Juni 1993, S. 635–648,doi:10.1006/exer.1993.1081,PMID 8595806.
- ↑Cilla Söderhäll, Ingo Marenholz, Tamara Kerscher, Franz Rüschendorf, Jorge Esparza-Gordillo, Margitta Worm, Christoph Gruber, Gabriele Mayr, Mario Albrecht, Klaus Rohde, Herbert Schulz, Ulrich Wahn, Norbert Hubner, Young-Ae Lee:Variants in a Novel Epidermal Collagen Gene (COL29A1) Are Associated with Atopic Dermatitis.In:PLOS Biology.Band5,Nr.9,2007,S.e242,doi:10.1371/journal.pbio.0050242,PMID 17850181.
- ↑K. Rappold:Gelatine – Ein natürliches Nahrungsmittel.bmi aktuell 1/2004, Hrsg. Informationszentrale für Backmittel und Backgrundstoffe zur Herstellung von Brot und Feinen Backwaren e. V.
- ↑abGelatine.Gelatine Manufacturers of Europe,abgerufen am 23. Mai 2013.
- ↑abOliver Türk:Stoffliche Nutzung nachwachsender Rohstoffe.1. Auflage. Springer Vieweg, Wiesbaden 2014,ISBN 978-3-8348-1763-1,S.111–115.
- ↑Andrew Wasley, Elisângela Mendonça, Fábio Zuker:Global craze for collagen linked to Brazilian deforestation.In:The Guardian.6. März 2023 (theguardian.com[abgerufen am 6. März 2023]).
- ↑Harvard T.H. Chan School of Public Medicine:Collagen.26. Mai 2021,abgerufen am 6. März 2023(amerikanisches Englisch).
- ↑David Olsen, Chunlin Yang, Michael Bodo, Robert Chang, Scott Leigh, Julio Baez, David Carmichael, Maritta Perälä, Eija-Riitta Hämäläinen, Marko Jarvinen, James Polarek:Recombinant collagen and gelatin for drug delivery.In:Advanced Drug Delivery Reviews(=Collagen in drug delivery and tissue engineering).Band55,Nr.12,28. November 2003,ISSN0169-409X,S.1547–1567,doi:10.1016/j.addr.2003.08.008(sciencedirect.com[abgerufen am 1. April 2023]).
- ↑Julio Báez, David Olsen, James W. Polarek:Recombinant microbial systems for the production of human collagen and gelatin.In:Applied Microbiology and Biotechnology.Band69,Nr.3,1. Dezember 2005,ISSN1432-0614,S.245–252,doi:10.1007/s00253-005-0180-x.
- ↑PDB Community Focus: Julian Voss-Andreae, Protein Sculptor.In:Protein Data Bank Newsletter.Nr.32,2007 (wwpdb.org(vom 22. Mai 2023 imInternet Archive) [PDF;2,0MB]).
- ↑Barbara Ward:‘Unraveling Collagen’ structure to be installed in Orange Memorial Park Sculpture Garden.In:Expert Rev. Proteomics.Band3,Nr.2,April 2006,S.174,doi:10.1586/14789450.3.2.169.