Koordinationszahl

AlsKoordinationszahl(KZ) bezeichnet man die Anzahl der nächsten Nachbarn einer Struktureinheit (Atom,Ion,Molekül) in einemKristall(z. B.Ionenkristall,Metallgitter) bzw. die Anzahl der direkt an ein Zentralatom gebundenen Atome in einemKomplex.EineKristallstrukturwird durch die Angabe der Position ihrer Bausteine, d. h. durch deren Koordination in derElementarzelle,beschrieben.
Am häufigsten treten die Koordinationszahlen 4 und 6 auf, seltener auch 2, 3, 8 und 12, bei Komplexen manchmal auch andere Werte. Die Koordinationszahl hängt unter anderem vom Radienverhältnis der Ionen (im Ionenkristall) bzw. von den Bindungseigenschaften (in Komplexen) ab. In Kristallen nimmt die Koordinationszahl meist mit dem Druck zu, z. B. beim Übergang vonGraphit(KZ 3) zuDiamant(KZ 4).
Die Angabe der Koordinationszahl inKristallgitternerfolgt in eckigen Klammern. Als Beispiel seiKochsalzgenannt: Na[6] Cl[6], was einer rechtwinkligen Gitterstruktur entspricht. Jedes Natriumion besitzt 6 Nachbar-Chloridionen und ebenso jedes Chloridion 6 Nachbar-Natriumionen, alsKoordinationspolyederergibt sich in beiden Fällen einOktaeder.
In bestimmten Kristallstrukturen kann dieselbe Struktureinheit auch auf Positionen mit unterschiedlichen Koordinationszahlen vorkommen.
Koordinationszahlen in Komplexen
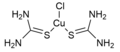
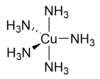
[Bearbeiten|Quelltext bearbeiten]Die Koordinationszahl ist eines der wichtigsten Strukturmerkmale von Komplexen und bestimmt die möglichenKoordinationspolyeder,d. h. die geometrische Anordnung der Donoratome um das Zentralatom bzw. -ion. Für Komplexe vonÜbergangsmetallensind Koordinationszahlen von 2 bis 9 beobachtbar, während inLanthanoid- undActinoidkomplexenauch Koordinationszahlen bis zu 12 auftreten. Am häufigsten sind die Koordinationszahlen 6 und 4 vertreten. Analog zu Festkörperstrukturen nimmt die Koordinationszahl in der Regel mit zunehmender Größe des Zentralatoms bzw. -ions und abnehmender Größe derLigandenzu.[1]
| Koordinationszahl | Koordinationsgeometrie | Beispielverbindungen |
|---|---|---|
| 2 | linear, gewinkelt | |
| 3 | trigonal-planar, pyramidal, T-förmig | |
| 4 | tetraedrisch, quadratisch-planar | |
| 5 | trigonal-bipyramidal, quadratisch-pyramidal | |
| 6 | oktaedrisch, trigonal-prismatisch | |
| 7 | pentagonal-bipyramidal, überkappt oktaedrisch, überkappt trigonal-prismatisch | [V(CN)7]4-,ZrCl(PhCOCHCOPh)3,[Mo(CNMe)7][BF4]2 |
| 8 | dodekaedrisch, quadratisch antiprismatisch, kubisch, hexagonal-bipyramidal | Cd2[Mo(CN)8], K4[Mo(CN)8]⋅3 H2O, Cs3[Mo(CN)8] |
| 9 | dreifach überkappt trigonal-prismatisch | [ReH9]2- |
| 12 | ikosaedrisch, kuboktaedrisch | [Ce(NO3)6]3-/2- |
Beispiele
[Bearbeiten|Quelltext bearbeiten]In der folgenden Tabelle[2]sind die Koordinationszahlen einiger Gittertypen dargestellt.
| Gitterstruktur | Koordinationszahl |
|---|---|
| einfach kubisch (sc) | 6 |
| kubisch flächenzentriert (fcc) | 12 |
| kubisch raumzentriert (bcc) | 8 |
| hexagonal dichte Kugelpackung (hcp) | 12 |
| Diamantstruktur | 4 |
Literatur
[Bearbeiten|Quelltext bearbeiten]- R. Hoppe:Die Koordinationszahl – ein „anorganisches Chamäleon “.In:Angewandte Chemie,82(1), 1970, S. 7–16,doi:10.1002/ange.19700820103
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Christoph Janiak,Hans-Jürgen Meyer, Dietrich Gudat, Carola Schulzke:Moderne Anorganische Chemie.6. Auflage. De Gruyter Verlag, Berlin 2023,ISBN 978-3-11-079007-8,S.444–453.
- ↑Harald Ibach,Hans Lüth:Festkörperphysik.7. Auflage. Springer Verlag, Berlin 2009,ISBN 978-3-540-85794-5,S.31–35.