Tautomerie
DieTautomerie(von gr.tautó„das Gleiche “undmeros„Anteil “) bezeichnet in derChemieeine besondere Form derIsomerie.Sie wurde 1876 vonAlexander Michailowitsch Butlerow(1828–1886) entdeckt und1885vonConrad Peter Laarals Begriff eingeführt.
| Übersicht | |||
|---|---|---|---|
| A–X–Y=Z mit A = H+ | X=Y–Z–A | Prototropie | |
| H–C–C=O | C=C–O–H | Keto-Enol | |
| H–C–N=O | C=N–O–H | Nitro-Acinitro | Nitroso-Oxim |
| H–C–N=N | C=N–N–H | Azo-Hydrazo | Hydrazo-Azo |
| H–N–C=O | N=C–O–H | Amid-Imidsäure | Lactam-Lactim |
| H–C–C=N | C=C–N–H | Imin-Enamin | |
| Ring-Ketten-Tautomerien | |||
| A–X–Y=Z mit A = OH− | Anionotropie | ||
| HO–C–C=C | C=C–C–OH | (siehe unten) | |
| A–X–Y | X–Y–H | dyadische Tautomerie | |
Wenn Moleküle zwar die gleicheSummenformelbesitzen, aber die einzelnen Atome unterschiedlich verknüpft sind, spricht man vonKonstitutionsisomeren.Als Tautomere bezeichnet man Isomere, die durch die Wanderung einzelner Atome oder Atomgruppen schnell ineinander übergehen, d. h. die beiden Isomere in einem dynamischenchemischen Gleichgewichtmiteinander stehen.[1][2]Aufgrund des schnellen Gleichgewichts lassen sich die einzelnen Tautomere oft nicht isolieren; das Mengenverhältnis der Tautomere untereinander ist konstant.
Tautomere unterscheiden sich oft in der Stellung einer Gruppe und in der Stellung einer Doppelbindung:
Als wandernde Gruppe kommeneinwertigeKationenwie dasProtonoder einwertigeAnionenwieChlorid-,Hydroxid- oderAcetat-Ionen in Frage. Wird eineDoppelbindungdurch eine Ringbildung ausEinfachbindungenersetzt, spricht man von derRing-Ketten-Tautomerie.[3]
Die Tautomerie darf dabei nicht mit derMesomerieverwechselt werden, bei der lediglich dasselbe Molekül durch verschiedene Grenzformeln beschrieben wird.
Prototropie
[Bearbeiten|Quelltext bearbeiten]Bei derPrototropiewechselt ein Proton seinen Platz im Molekül:[3]
Keto-Enol-Tautomerie
[Bearbeiten|Quelltext bearbeiten]Die häufigste Form der Tautomerie ist dieKeto-Enol-Tautomerie.Wegen der Polarisierung der C–O-Doppelbindungdurch die großeElektronegativitätdes Sauerstoffs und der Möglichkeit, die negative Ladung nach derDeprotonierungüber drei Atome zu delokalisieren, könnenProtonenamα-C-Atomder Carbonylgruppe leicht abgespalten werden. Eine Reprotonierung desEnolat-Ions am Sauerstoff führt zum Enol. Diese Tautomerisierung kann durchBasen,welche die Abspaltung des Protons unterstützen, oder durch Säuren, welche durch Protonierung des Carbonylsauerstoffs die Polarisierung der C–O-Bindung verstärken,katalysiertwerden.
| Keto-Enol-Tautomerie | |||||
|---|---|---|---|---|---|

|
 
|
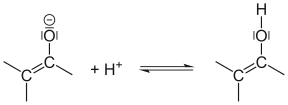
| |||
| Abspaltung eines Protons: Das α-C-Atom gibt in basischer Lösung ein Proton ab. | Dieses Carbanion istmesomeriestabilisiert:Mesomeriestabilisierung des Enolat-Anions. | Bindet sich das Proton an den negativierten Sauerstoff, entsteht das Enol: Anlagerung des Protons an das Enolat-Anion. | |||
| Carbonylverbindung | Enolform in % |
|---|---|
| Propanon (Aceton) | 0,00025 |
| Butan-2,3-dion (Diacetyl) | 0,0056 |
| Cyclohexanon | 0,02 |
| Ethyl-3-oxobutyrat (Acetessigester) | 8 |
| Pentan-2,4-dion (Acetylaceton) | 80 |
| einwertigePhenole | 100 |
Das Gleichgewicht liegt in der Regel auf der Seite der Ketoform. So beträgt der Anteil der Enol-Form imAcetonnur 0,00025 %. Beim Pentan-2,4-dion (TrivialnameAcetylaceton) dagegen überwiegt im Gleichgewicht die Enolform. Phenole liegen vorwiegend in der Enolform vor, da die Bildung der Ketoform (Beispiel:chinoideStruktur) das aromatische System aufhebt.
Beispiel:Ethanalund Ethenol befinden sich in Lösung in einem tautomeren Gleichgewicht, das Gleichgewicht liegt allerdings deutlich auf der Seite des Ethanals. Es liegt sowohl Bindungsisomerie (C=C / C=O) als auch funktionelle Isomerie (–CH=O / –C–OH) vor.
| Ethanal-Ethenol-Tautomerie |
|---|
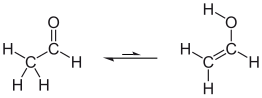
|
Aus der Lage des Gleichgewichts lässt sich nicht auf die Reaktivität schließen. Oft ist die Enol-Form erheblich reaktiver als die Keto-Form. Weil diese aber aufgrund des sich schnell einstellenden Gleichgewichtes ständig nachgebildet wird, beobachtet man makroskopisch ausschließlich die Reaktivität des Enols (siehePrinzip von Le Chatelier).
Sehr schön lässt sich dies bei der Reaktion von Aceton mit Brom zeigen. Nach Zugabe eines Tropfens Brom verschwindet dessen Farbe zunächst langsam, dann immer schneller, da durch das entstandeneHBrdie Einstellung des Keto-Enol-Gleichgewichts stark beschleunigt wird. Bei weiterer Bromzugabe erfolgt die Entfärbung unter Bildung vonBromacetonfast augenblicklich.
Ketol-Endiol-Tautomerie
[Bearbeiten|Quelltext bearbeiten]α-Hydroxy-Ketone(Acyloine) weisen eine besondere Form der Keto-Enol-Tautomerie auf.
1. Das 2-Hydroxy-propanal weist am α-C-Atom (dem 2. C-Atom) eine Hydroxygruppe auf. Diese polarisiert zusätzlich durch ihren negativen induktiven Effekt die C-H-Bindung am α-C-Atom und erleichtert damit die Abspaltung eines Protons. Es entsteht ein Endiol als ein Molekül mit einer Doppelbindung und zwei (-di-) benachbarten Hydroxygruppen. Durch Umlagerung eines Protons kann dieses wieder in ein Molekül mit einem Carbonylsauerstoff übergehen, in diesem Fall ein Keton.
| Hydroxypropanal-Propendiol-Hydroxypropanon-Tautomerie |
|---|
 |
Hier liegt zusätzlich Stellungsisomerie vor, da sich das 2-Hydroxy-propanal und das 1-Hydroxypropanon nur in den Positionen der Hydroxy- und der Carbonyl-Gruppe unterscheiden.
2. Wird im Beispiel des Propanals die Methylgruppe durch eine Kohlenwasserstoffkette mit vier C-Atomen und je vier Hydroxygruppen ersetzt, liegt eineAldohexosevor, die über die Endiol-Form mit derKetohexosein wässriger Lösung im Gleichgewicht vorliegt. So befinden sich in wässriger Lösung die epimereGlucoseundMannoseals Aldohexosen mit der KetohexoseFructoseim Gleichgewicht (Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung). Die bisher angenommene Erklärung, dass die positiveFehling-Probebei Fructose auch auf eine Keto-Enol-Tautomerie zurückzuführen ist, wurde mittlerweile widerlegt[4].Doch stellen Endiole (bzw. deren Anionen, wie sie in der alkalischen Fehling-Lösung entstehen) selbst starke Reduktionsmittel dar, die zu 1,2-Diketonen dehydriert werden. Beispielsweise wirken auchBenzoinundAcetoin(3-Hydroxybutanon-2) stark reduzierend. In derGlycolysewird die Umwandlung von Glucose-6-phosphat in Fructose-6-phosphat durch dasEnzymGlucose-Phosphat-Isomerase,in einem späteren Schritt der Glycolyse die Reaktion des Glycerinaldehyd-3-phosphats zu Dihydroxyacetonphosphat durch das EnzymTriosephosphat-Isomerasekatalysiert.
Weitere Beispiele:RiboseundArabinoseals Aldopentosen stehen mit der KetopentoseRibuloseim tautomeren Gleichgewicht.
3. Auch dieEpimerisierungist eine Tautomerisierung: In wässriger Lösung wandeln sich Epimere, das sind Aldosen, die sich nur durch die Stellung der Hydroxygruppe am 2. C-Atom unterschieden, ineinander um. Beispiele für Epimeren-Paare: Glucose / Mannose, Ribose / Arabinose,Erythrose/Threose,D-Glycerinaldehyd/L-Glycerinaldehyd
Siehe auch:Ketol-Endiol-Tautomerie beiPhloroglucin,Reduktone.
Nitro-aci-Nitro-Tautomerie
[Bearbeiten|Quelltext bearbeiten]Verbindungen mit einer Nitro-Gruppe stehen in saurer Lösung mit ihreraci-Form im Gleichgewicht. Dabei liegt das Gleichgewicht in der Regel auf der Seite der Nitroverbindung.
| Nitro-aci-Nitro-Tautomerie |
|---|

|
| Nitroethan:Tautomerie der Nitrogruppe |
Nitroso-Oxim-Tautomerie
[Bearbeiten|Quelltext bearbeiten]Verbindungen mit einer Nitroso-Gruppe stehen in saurer Lösung mit ihrerOxim-Form im Gleichgewicht. Dabei liegt das Gleichgewicht in der Regel zu 100 % auf der Seite des Oxims.
| Nitroso-Oxim-Tautomerie |
|---|

|
Amid-Imidsäure-Tautomerie
[Bearbeiten|Quelltext bearbeiten]Die Imidsäuren sind Tautomere derAmide.[5]
| Amid-Imid-Tautomerie | ||
|---|---|---|

|

|

|
| Tautomerie Amid / Imidsäure | Tautomerie desHarnstoffs | Tautomerie derHydroxamsäure |
Imin-Enamin-Tautomerie
[Bearbeiten|Quelltext bearbeiten]| Imin-Enamin-Tautomerie | |
|---|---|
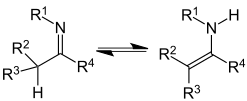
|

|
| Imin-Enamin-Tautomerie | Ein Beispiel für eine cyclische und doppelte Imin-Enamin-Tautomerie stellt dasHistidindar. |
Azo-Hydrazo-Tautomerie
[Bearbeiten|Quelltext bearbeiten]Azoverbindungen mit einem enolisierbaren Wasserstoffatom am α-Kohlenstoffatom neben der Azo-Gruppe stehen im Gleichgewicht mit der Hydrazo-Form. Dabei liegt das Gleichgewicht in der Regel vorwiegend auf der Seite der Hydrazo-Form.
| Azo-Hydrazo-Tautomerie |
|---|

|
Tautomerie bei Tetrazolen
[Bearbeiten|Quelltext bearbeiten]Tautomeres Gleichgewicht derheteroaromatischen1H-Tetrazole und 2H-Tetrazole im Vergleich mit 5H-Tetrazol (rechts):
| Tetrazol-Tautomerie |
|---|
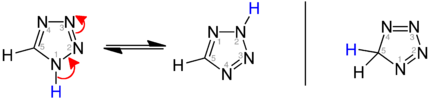
|
Lactam-Lactim-Tautomerie
[Bearbeiten|Quelltext bearbeiten]| Lactam-Lactim-Tautomerie | ||
|---|---|---|

|

|

|
| Tautomerie einesLactams | Tautomerie derCyanursäure | Tautomerie desHypoxanthins(einPurin) |

|
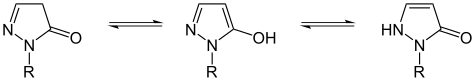
|
Guaninhat in Position 2 zusätzlich eine NH2-Gruppe,Harnsäurein Position 2 und 8 jeweils ein OH-Gruppe |
| Tautomerie derBarbitursäure(einPyrimidin) | Tautomerie vonDihydropyrazolonen | |
Thiolactam-Thiolactim-Tautomerie
[Bearbeiten|Quelltext bearbeiten]| Thiolactam-Thiolactim-Tautomerie |
|---|

|
| Tautomerie des 6-Purinthiols: 6-Thioguanin hat in Position 2 zusätzlich eine NH2-Gruppe |
Ring-Ketten-Tautomerien
[Bearbeiten|Quelltext bearbeiten]Oxy-Cyclo-Tautomerie
[Bearbeiten|Quelltext bearbeiten]Bei langkettigen Oxo-Verbindungen könnte sich cyclo-Etherbilden. Beispiel ist dieHalbacetal-Cyclo-Tautomerie.Halbacetaleentstehen in einerAdditionsreaktionvon Alkoholen an Carbonylverbindungen. Enthält ein Molekül eine Hydroxygruppe, die weit genug von der Carbonyl-Gruppe entfernt ist, kann es durch eine Reaktion innerhalb des Moleküls zum Ringschluss kommen. Dabei erhält der Carbonylsauerstoff das Proton der Hydroxygruppe und wird dadurch selbst zur Hydroxygruppe. Der Ringschluss erfolgt durch die Bildung einer Bindung zwischen dem negativ polarisierten Sauerstoff der entfernten Hydroxygruppe und dem positiv polarisierten Kohlenstoff der Carbonylgruppe. Zwischen der offenkettigen Aldhehyd- oder Ketoform und der Ringform liegt in wässriger Lösung ein Gleichgewicht vor. Dies ist bei allen Aldo- und Keto-Pentosen und -Hexosen in wässriger Lösung der Fall.
| Oxy-Cyclo-Tautomerie | |
|---|---|

|

|
| Cyclo-Acetal-Gleichgewicht | Tautomerie derRibose |
(vergleicheATPundRNA;siehe auchGlucoseundFructose)
Tropanol-Cycloheptanon-Tautomerie
[Bearbeiten|Quelltext bearbeiten]Das (1R)-1-Tropanolsteht mit (R)-(Methylamino)cycloheptanon in einem tautomeren Gleichgewicht:
| Tropanol-Heptanon-Tautomerie |
|---|
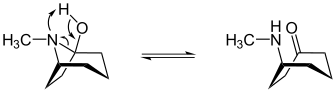
|
| Tautomerie des (1R)-1-Tropanols |
Anionotropie
[Bearbeiten|Quelltext bearbeiten]| Anionotropie |
|---|
 |
| Tautomerie derButenole |
BeispielButenole:3-Hydroxy-1-buten steht mit 1-Hydroxy-2-buten (Crotylalkohol) in einem tautomeren Gleichgewicht, wenn es mehrere Stunden mit verdünnterSchwefelsäureauf 100 °C erhitzt wird (Gleichgewichtsverhältnis 3: 7). Diese Tautomerie entspricht nur formal einer Anionotropie, bei welcher einHydroxid-Anion seine Position ändert. Der eigentliche Reaktionsmechanismus besteht darin, dass zunächst die Hydroxygruppe protoniert und anschließend als Wassermolekül abgespalten wird. Zurück bleibt ein mesomeriestabilisiertesCarbeniumion,welches am 1. und 3. C-Atom positiv polarisiert ist. An einem der beiden C-Atome kann sich ein Wassermolekül binden, welches durch Abspaltung eines Protons wieder zur Hydroxygruppe wird.
Dyadische Tautomerie
[Bearbeiten|Quelltext bearbeiten]Bei der dyadischen Tautomerie (von gr.dyas= Zweiheit) findet eine Protonenwanderung zwischen Nachbaratomen statt.
| Dyadische Tautomerie | |
|---|---|
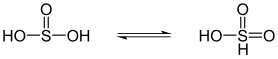
|
|
| Schweflige Säuresteht im Gleichgewicht mitSulfonsäure |
Cyanwasserstoff (Blausäure) steht im Gleichgewicht mitIsocyanwasserstoff,wobei das Gleichgewicht auf der Seite des Cyanwasserstoffs (links) liegt. |
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Eintrag zutautomerization.In:IUPAC(Hrsg.):Compendium of Chemical Terminology.The “Gold Book”.doi:10.1351/goldbook.T06253– Version: 2.3.3.
- ↑L Antonov:Tautomerism: Methods and Theories.1. Auflage. Wiley-VCH, Weinheim 2013,ISBN 978-3-527-33294-6.
- ↑abEintrag zutautomerism.In:IUPAC(Hrsg.):Compendium of Chemical Terminology.The “Gold Book”.doi:10.1351/goldbook.T06252– Version: 2.3.3.
- ↑Holger Fleischer:Fehlinterpretation der Fehling-Probe auf reduzierende Zucker – Von der Beobachtung im Chemieunterricht zur Evidenz gegen die Oxidation der Aldehydgruppe.In:CHEMKON.Band24,Nr.1,2017,S.27–30,doi:10.1002/ckon.201610283.
- ↑Eintrag zuImidsäuren.In:Römpp Online.Georg Thieme Verlag, abgerufen am 23. Februar 2019.

