Nikotinischer Acetylcholinrezeptor
| Nikotinischer Acetylcholinrezeptor | ||
|---|---|---|
| ||
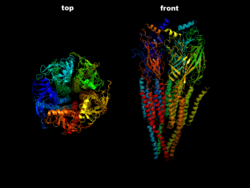
| Der ACh-n-Rezeptor aus dem Zitterrochen (Torpedo) in Seitenansicht (rechts) und Draufsicht (links) nachPDB2BG9 | ||
| Masse/LängePrimärstruktur | 2392 = 2*462 + 478 + 517 + 473 Aminosäuren (2α1β1γε) | |
| Sekundär-bisQuartärstruktur | Pentamer ααβδγ oder ααβδε | |
| Transporter-Klassifikation | ||
| TCDB | 1.A.9.1.1 | |
| Bezeichnung | Ligandengesteuerte Ionenkanäle | |
| Vorkommen | ||
| ÜbergeordnetesTaxon | Mehrzellige Tiere | |

Nikotinische Acetylcholinrezeptoren(nAChR), auch kurzNikotinrezeptoren,sindmembranständigeRezeptorenin verschiedenenNervenzellenund inMuskelfasern,die als Substrat denNeurotransmitterAcetylcholin(ACh) binden, doch auch durchNikotinund ähnlichenikotinergeSubstanzen aktiviert werden können. DieseionotropenRezeptoren bestehen aus fünf Untereinheiten, die neben den rezeptiven Bindungsstellen gemeinsam eine die Zellmembran durchspannende Pore bilden und somit einenligandengesteuerten Ionenkanaldarstellen. Hierbei handelt es sich um einen unspezifischen Kationenkanal, der vor allem für monovalente Na+und K+Ionen permeabel ist[1].Diemuskarinischen Acetylcholinrezeptorensind dagegenmetabotropemembranständige Rezeptoren.
Gut untersucht sind die nikotinergen Rezeptoren an derneuromuskulären Endplatte,wo Impulse von Nervenzellen auf Muskelfasernsynaptischübertragen werden. Für die Öffnung des Ionenkanals müssen an einen Rezeptor jeweils zwei ACh-Moleküle binden, was bei hohen Transmitterkonzentrationen eher vorkommt als bei niedrigen. Beim Krankheitsbild derMyasthenia graviswerden diese ACh-Rezeptoren durch Autoimmunprozesse zerstört und damit die Übertragung der neuronalen Signale auf den Muskel gestört.
Aufbau
[Bearbeiten|Quelltext bearbeiten]Dieser Rezeptor wird als Prototyp seiner Klasse angesehen. Er ist verwandt mit demionotropenSerotonin-(5-HT3)-Rezeptor,demGABAA-Rezeptorund dem Glycin-Rezeptor. Der nicotinerge ACh-Rezeptor ist ein zylindrischesTransmembranproteinbestehend aus 5 Untereinheiten (2x α1-, β1-, γ-, δ-Untereinheit), von denen jede jeweils viermal dieZellmembrandurchspannt (im ausgewachsenen Muskel ist γ durch ε ersetzt).DNA-Sequenzierungenhaben ergeben, dass die beiden α-Untereinheiten wiederum aus acht Untertypen bestehen: α1–α8.Durch das Auftreten verschiedener Untereinheiten, die jeweils einen Rezeptor-Komplex bilden können, entsteht eine Vielzahl von verschiedenen Rezeptor-Isoformen, die sich durch eine unterschiedliche Zusammensetzung der Untereinheiten auszeichnen, unterschiedlichepharmakokinetischeEigenschaften besitzen und spezifisch zwischen Organen und innerhalb desZNSverteilt sind.[2]So kann man grob zwischen einemMuskeltypNMund einemNeuronentypNNder N-Cholinozeptoren unterscheiden, je nachdem, ob sich der nikotinische Rezeptor in der Muskulatur oder dem Nervensystem befindet.
Kinetik
[Bearbeiten|Quelltext bearbeiten]Die α-Untereinheiten des Rezeptors besitzen jeweils eine Bindungsstelle für Acetylcholin (zwei Bindungsstellen pro Rezeptor). Wenn diese Bindungsstellen durch den Transmitter besetzt sind, ändert sich durch die Interaktion mit dem gebundenen Molekül die dreidimensionale Struktur und es eröffnet sich eine Kanalpore, durch dieIonendurch die Zellmembran gelangen können. Dieser Mechanismus wurde erst vor kürzerer Zeit aufgedeckt. Natrium und Calcium-Ionen strömen somit in die Zelle ein, Kalium strömt (in wesentlich geringerer Menge) aus der Zelle hinaus. Durch die Ladungsverschiebungen entsteht ein Strom über die Zellmembran, den man entsprechend seiner Richtung (von außen in die Zelle hinein) alsDepolarisationder Zelle bezeichnet, da er die vorbestehende polare Ladungsverteilung an der Zellmembran (innen negativ, außen positiv) vermindert und kurzzeitig sogar umkehren kann.
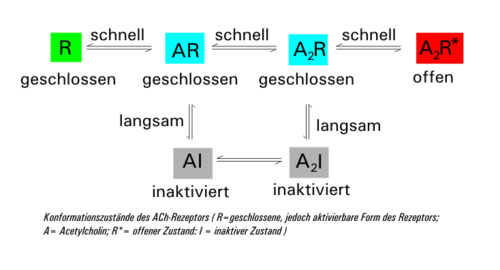
Der ligandenbesetzte Rezeptor kommt in zwei Formen vor: einmal als geschlossener (A2R) und einmal als offener (A2R*). Diese beiden Zustände können schnell ineinander übergehen. Parallel dazu geht die geschlossene Form (A2R) mit zeitlicher Verzögerung in die inaktive Form (A2I) über (Desensitisierung), die sich unter weiterer Abspaltung von ACh über AI wieder in die geschlossene Form AR umwandelt. Sinkt die Acetylcholin-Konzentration durch die Aktivität derAcetylcholinesterasewieder unter 10nM,so regeneriert der Rezeptor wieder zur ursprünglichen Form R. Die Zeitkonstante der Desensitisierung (mittlere Zeit zum Schließen des Kanals) beträgt bei einer ACh-Konzentration von 1 mM rund 20–50 ms.
Aufgrund derBrownschen Molekularbewegungdiffundieren die ACh-Moleküle nach kurzer Zeit wieder von der Bindungsstelle ab und werden durch dasEnzymAcetylcholinesterase zu Cholin und Acetat bzw. Essigsäure abgebaut. Dadurch schließt sich der Rezeptor wieder.
Pharmakologische Beeinflussung
[Bearbeiten|Quelltext bearbeiten]Zahlreiche pflanzlicheAlkaloide,tierische Sekrete, Medikamente oder potentielle Giftstoffe entfalten einen wesentlichen Teil ihrer Wirkung, indem sie an diesem nikotinischen ACh-Rezeptor ansetzen.
BeimMuskeltyp NMdes Rezeptors in der Membran vonMuskelfaserneinerneuromuskulären Synapsebeispielsweise blockiert dasTubocurarinder ZubereitungCurareaus Lianenpflanzen (etwaChondodendron tomentosum) als kompetitiver Antagonist reversibel die Anlagerung von ACh an den Rezeptor, das α-Bungarotoxinim Speichel von Giftnattern wieKraits(etwaBungarus multicinctus) irreversibel. Beidenfalls wird so quergestreifte Muskulatur der Aktivation durch neuronale Impulse entzogen. Das Pfeilgift Curare wurde dieser Wirkung wegen auch für medizinische Zwecke genutzt. Zeitgenössische muskelentspannende Pharmaka sind etwaCisatracurium,Pancuronium,Rocuroniumals blockierende, sogenanntenicht-depolarisierendeMuskelrelaxantien(Benzylisochinolinebzw. Steroid-Derivate).Suxamethonium(Succinylcholin) dagegen ist eineagonistischeSubstanz, es bindet am ACh-Rezeptor, aktiviert ihn und öffnet ligandensteuernd vorübergehend den Ionenkanal, als sogenanntesdepolarisiendesMuskelrelaxans. Dieser Arzneistoff bewirkt ebenfalls eine Muskellähmung, jedoch über einenDepolarisationsblockund daher mit vorangehender Muskelzuckung. Die anschließende Desensitisierung des Rezeptors kann ohne zwischenzeitlichen, ligandenfreien Zustand nicht aufgehoben, der belegte Rezeptor also nicht prompt wieder aktivierbar gemacht werden. Für die Wirkungsdauer von Succinylcholin ist vornehmlich dessen Abbau durch einePseudocholinesteraseentscheidend (nicht wie bei ACh durch die Acetylcholinesterase).
DerNeuronentyp NNdes Rezeptors in der Membran von Nervenzellen kann spezifisch mittelsHexamethoniumoder Pentamethonium blockiert werden. Früher wurden diese Arzneimittel alsGanglienblockerbenutzt, da sie unter anderem die Erregungsübertragung von prä- auf postganglionäre Neuronen in denGangliendes peripheren vegetativen Nervensystems unterbrechen; heute ist ein solcher Einsatz wegen der zahlreichen Nebenwirkungen jedoch obsolet. Die AlkaloideNikotin(etwa inTabakpflanzen),Coniin(etwa imSchierling) undCytisin(etwa imGoldregen) aktivieren diesen neuronalen ACh-Rezeptor und sind wegen ihrer in entsprechender Dosierung starken Wirkung auf das vegetative Nervensystem höchst toxisch (Herzstillstand, Atemlähmung).
Medizinische Bedeutung
[Bearbeiten|Quelltext bearbeiten]Beim Krankheitsbild derMyasthenia gravisproduziert der Körper Autoantikörper gegen den nicotinergen ACh-Rezeptor vom muskulären Typ und führt daher zu einer Muskelschwäche. Es folgt eine Aufstellung der möglichen Rezeptor-Untereinheiten, der Position ihresGensimGenomund möglicher Krankheitsbilder beiMutationdesselben.
| UE | Typ | UniProt | Genlocus | OMIM | Pathologie |
|---|---|---|---|---|---|
| α1 | Muskel | P02708 | 2q24-q32 | 100690 | Myasthenia gravis;Multiples Pterygium-Syndrom,letaler Typ;myasthenisches Syndrom(SCCMS, FCCMS) |
| α2 | Neuron | Q15822 | 8p21 | 118502 | NächtlicheFrontallappen-Epilepsie(ENFL4) |
| α3 | Neuron | P32297 | 15q24 | 118503 | Autoimmune Autonome Ganglionopathie;[3]Anfälligkeit fürLungenkrebs(LNCR2); Anfälligkeit für peripherearterielle Verschlusskrankheit(PAOD2) |
| α4 | Neuron | P43681 | 20 | 118504 | NächtlicheFrontallappen-Epilepsie(ENFL1) |
| α5 | Neuron | P30532 | 15q24 | 118505 | Anfälligkeit fürLungenkrebs(LNCR2) |
| α6 | Neuron | Q15825 | 8p22 | 606888 | |
| α7 | Neuron | P36544 | 15q13.3 | 118511 | |
| β1 | Muskel | P11230 | 17p12-p11 | 100710 | Myasthenisches Syndrom(SCCMS, ACHRDCMS) |
| β2 | Neuron | P17787 | 1q21.3 | 118507 | NächtlicheFrontallappen-Epilepsie(ENFL3) |
| β3 | Neuron | Q05901 | 8 | 118508 | |
| β4 | Neuron | P30926 | 15q24 | 118509 | |
| γ | P07510 | 2q33-34 | 100730 | Escobar-Syndrom;Multiples Pterygium-Syndrom,letaler Typ | |
| δ | Q07001 | 2q33-qter | 100720 | Multiples Pterygium-Syndrom,letaler Typ;myasthenisches Syndrom(SCCMS, FCCMS) | |
| ε | ausgew. Muskel | Q04844 | 17p13.2 | 100725 | Myasthenia gravis;myasthenisches Syndrom(SCCMS, FCCMS, ACHRDCMS) |
Siehe auch
[Bearbeiten|Quelltext bearbeiten]Weblinks
[Bearbeiten|Quelltext bearbeiten]- Orphanet:
- Eintrag zuKongenitales myasthenes Syndrom.In:Orphanet(Datenbank für seltene Krankheiten)
- Eintrag zuMultiples Pterygium-Syndrom, letales.In:Orphanet(Datenbank für seltene Krankheiten)
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑V. Itier, D. Bertrand:Neuronal nicotinic receptors: from protein structure to function.In:FEBS letters.Band504,Nr.3,31. August 2001,S.118–125,doi:10.1016/s0014-5793(01)02702-8,PMID 11532443.
- ↑Vgl. Shepard, 2004:The synaptic organization of the brain.
- ↑Elisabeth P. Golden, Steven Vernino:Autoimmune autonomic neuropathies and ganglionopathies: epidemiology, pathophysiology, and therapeutic advances.In:Clinical Autonomic Research.15. Mai 2019,doi:10.1007/s10286-019-00611-1.