Peptidbindung

EinePeptidbindungist eineCarbonsäureamid-Bindung,die zweiAminosäurenüber dieCarboxygruppeder einen Aminosäure und dieAminogruppeder anderen Aminosäure verknüpft.[1]
Meistenfalls ist mitPeptidbindungim engeren Sinn die Bindung zwischen den jeweiligenα-ständigenfunktionellen Gruppen zweier Aminosäuren gemeint, also zwischen C-1 der einen Aminosäure und N-2 der anderen Aminosäure. Diese Bindung wird selten auchEupeptidbindunggenannt und unterscheidet sich von derIsopeptidbindung.[1]
Mechanismus
[Bearbeiten|Quelltext bearbeiten]Die Bindung entsteht durch eineKondensationsreaktionunterWasserabspaltung.[2]Ein Beispiel ist die Reaktion von zwei Molekülen der AminosäureAlaninzu demDipeptidAlanyl-Alanin:
Die Aminogruppe fungiert in der Reaktion alsNukleophilund ersetzt die Hydroxygruppe unter Bildung der Peptidbindung. Da die Hydroxygruppe eine schlechte Abgangsgruppe ist und sich schwer verdrängen lässt, liegt das Gleichgewicht unterNormbedingungenauf der linken Seite.[2]Diechemische Reaktionistendergon.
Sowohl bei derPeptidsyntheseim Labor als auch bei derbiologischenSynthesevonPeptidenundProteinenmüssen die reaktivenGruppenzuerst aktiviert werden. Dies geschieht in biologischen Systemen zumeist durchEnzyme.Bei derProteinbiosynthesein einerZellewird diese Reaktion während derTranslationvon denRibosomenkatalysiert. Daneben kommen bei manchen Organismen zusätzlich auch nichtribosomale Peptidsynthetasen (NRPS) als Enzyme vor, die einenichtribosomale Peptidsyntheseermöglichen.

Durch mehrfache Kondensation können weitere Aminosäuren (AS) per Peptidbindung verknüpft werden. So entstehen aus Dipeptiden (2 AS) dannTripeptide(3),Tetrapeptide(4),Pentapeptide(5),Hexapeptide(6),Heptapeptide(7),Oktapeptide(8),Nonapeptide(9) etc., wobei solche Peptide aus wenigen Aminosäuren,Oligopeptidegenannt, von noch größeren Peptiden aus vielen Aminosäuren,Polypeptidegenannt, unterschieden werden. Die kettenförmig aus zahlreichen Aminosäuren aufgebauten Polypeptide gehören zu denMakromolekülen.
Polypeptidketten aus verschiedenen Aminosäuren bilden dasprimäre StrukturelementvonProteinenund werden durch ihreAminosäuresequenzcharakterisiert. Zu Primär-, Sekundär- und Tertiärstrukturen von Peptiden und Proteinen sieheProteinstruktur.
Eigenschaften
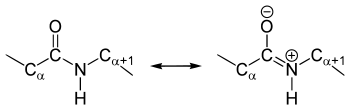
[Bearbeiten|Quelltext bearbeiten]DieKristallstrukturanalysenvon Aminosäuren und Dipeptiden zeigen, dass dieAmidgruppeplanarist, alle am Aufbau beteiligtenAtomeliegen also in einer Ebene. DerDiederwinkel(HNCO) liegt bei 180° und die Atome können wegenMesomeriestabilisierungnicht gegeneinander verdreht werden – die Peptidbindung ist dadurch nur begrenzt rotationsflexibel. Diese eingeschränkte Drehbarkeit ist in einemRamachandran-Plotoder einemJanin-Plotdarstellbar. Die Rotation um die Cα-N-Bindung wird dabei durch den Winkel Φ, die Rotation um die Cα-C-Bindung durch den Winkel ψ beschrieben.[3]

In dennativenProteinen liegen vorwiegendtrans-Peptidbindungen vor,cis-Peptidbindungen finden sich vor allem incyclischenDipeptiden (Diketopiperazine) und cyclischen Tripeptiden (Beispiel: Cyclotriprolyl).[4]Der Grund für das häufigere Auftreten vontrans-Peptidbindungen sind diesterischen Hinderungenzwischen den Gruppen am α-C-Atom beicis-Peptidbindungen, die bei dertrans-Konfigurationnicht auftreten.[5]

DieBindungslängensind zwischenStickstoffundCarbonyl-Kohlenstoff133pm,zwischen Stickstoff undα-C-Atom146 pm, zwischen Carbonyl-Kohlenstoff und α-C-Atom 151 pm und zwischen Carbonyl-Kohlenstoff undSauerstoff124 pm.[6]Die geringere Länge der C-N-Bindung in der Amidbindung im Vergleich zur normalen C-N-Bindung weist darauf hin, dass sieDoppelbindungscharakterbesitzt; diese Art der chemischen Bindung wird auch partielle Doppelbindung genannt. Diese Besonderheit findet ihre Erklärung in derAmid-Iminol-Tautomerieder Peptidbindung.
Peptide und Amide
[Bearbeiten|Quelltext bearbeiten]
Durch die Reaktion der Carboxygruppe einer Aminosäure und der Aminogruppe einer zweiten Aminosäure bildet sich unter Wasserabspaltung eine Peptidbindung. Jede Peptidbindung ist auch eineAmidbindung.
Voraussetzung für die Bildung einer Peptidbindung ist dieKondensationsreaktionder endständigen Carboxygruppe am C1-Atom mit der Aminogruppe am α-C-Atom einer zweiten Aminosäure. Jede andere Kondensation zwischen Carboxygruppe und Aminogruppe führt auch zu einer Amidbindung, die aber keine Peptidbindung ist.
Werden Peptide mittels Peptidbindungen verlängert, so reagieren die endständigen Carboxy- oder Aminogruppen am α-C-Atom mit weiteren Aminosäuren.
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑abIUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN). Nomenclature and symbolism for amino acids and peptides. Recommendations 1983.In:European Journal of Biochemistry.Band138,Nr.1,2. Januar 1984,ISSN0014-2956,S.9–37,doi:10.1111/j.1432-1033.1984.tb07877.x,PMID 6692818.
- ↑abMichael M. Cox, Albert L. Lehninger:Lehninger Biochemie mit 131 Tabellen.4., vollst. überarb. und erw. Auflage. Berlin 2009,ISBN 978-3-540-68637-8,S.109.
- ↑Donald Voet, Judith G. Voet, Charlotte W. Pratt:Lehrbuch der Biochemie.Hrsg.: Annette G. Beck-Sickinger, Ulrich Hahn. 2. Auflage. WILEY-VCH, 2016,ISBN 978-3-527-32667-9,S.146.
- ↑Hans-Dieter Jakubke, Hans Jeschkeit:Aminosäuren, Peptide, Proteine.Verlag Chemie, Weinheim 1982,ISBN 3-527-25892-2.
- ↑Jeremy M. Berg, Lubert Stryer, John L. Tymoczko:Stryer Biochemie.Springer-Verlag, Berlin, Heidelberg 2015,ISBN 978-3-8274-2989-6,S.37(eingeschränkte Vorschauin der Google-Buchsuche).
- ↑abHans-Dieter Jakubke, Hans Jeschkeit:Aminosäuren, Peptide, Proteine.Verlag Chemie, Weinheim 1982,ISBN 3-527-25892-2,S. 96–97.
