Xanthinoxidase
| Xanthinoxidase | ||
|---|---|---|

| ||
| Bändermodell desMonomerder Xanthinoxidase aus Rind, pdb1FIQ.Gebundene Cofaktoren, FAD (rot), FeS-cluster (orange), Molybdän-Cofactor mit Molybdän (gelb) und der gebundene Inhibitor Salicylat (blau), sind hervorgehoben. | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/LängePrimärstruktur | 146kDa/ 1332Aminosäuren | |
| Sekundär-bisQuartärstruktur | Homodimer | |
| Kofaktor | 2 (2Fe-2S),FAD,Molybdopterin | |
| Bezeichner | ||
| Gen-Namen | XDH;XO; XS; XDHA | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.17.3.2,Oxidoreduktase | |
| Reaktionsart | Hydroxylierung | |
| Substrat | Xanthin + 2 NAD++ 2 H2O | |
| Produkte | Harnsäure + 2 NADH + 2 H+ | |
| Vorkommen | ||
| Homologie-Familie | Xanthindehydrogenase | |
| ÜbergeordnetesTaxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 7498 | 22436 |
| Ensembl | ENSG00000158125 | ENSMUSG00000024066 |
| UniProt | P47989 | Q00519 |
| Refseq(mRNA) | NM_000379 | NM_011723 |
| Refseq(Protein) | NP_000370 | NP_035853 |
| Genlocus | Chr 2: 31.33 – 31.41 Mb | Chr 17: 73.88 – 73.95 Mb |
| PubMed-Suche | 7498 | 22436
|
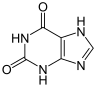
Xanthindehydrogenase(XDH) undXanthinoxidase(XO, manchmal auch XAO) sind zwei unterschiedliche Formen desselbenMetalloenzyms(eineHydroxylase), welches die zweistufigeOxidationvonHypoxanthinüberXanthinzurHarnsäurekatalysiert. Im Menschen findet es sich hauptsächlich in der Leber, im Dünndarm und in Brustdrüsenzellen[1].In seiner XDH-Form nutzt es in beiden Reaktionen bevorzugtNAD+alsElektronenakzeptor.[2][3]
Oxidation von Hypoxanthin zu Xanthin durch XDH[4]:
Oxidation von Xanthin zu Harnsäure durch XDH[5]:
Dasin vivoursprünglich als XDH vorliegende Enzym[6]kann leicht in XO umgewandelt werden (z. B. bei einerHypoxie).[7]In dieser Form bevorzugt es molekularen Sauerstoff als Elektronenakzeptor[8].
Oxidation von Hypoxanthin zu Xanthin durch XO[9]:
Oxidation von Xanthin zu Harnsäure durch XO[10]:
Das Enzym besteht aus zwei identischen Untereinheiten, deren aktive Zentren je einMolybdänatom,gebunden in Form des Molybdän-Cofaktors (MoCo), aufweisen.[11]Jede Untereinheit enthält zudem zwei unterscheidbareZwei-Eisen-zwei-Schwefel-Cluster(2Fe-2S) und einFAD-Molekül. In Prokaryoten werden die MoCo-, (2Fe-2S)- und FAD-Domäne von zwei bzw. dreiGenenkodiert, in Eukaryoten sind die Domänen in einem Gen fusioniert. Das Enzym kommt daher inEukaryotenalsHomodimervor, inProkaryotenals Heterotetramer bzw. Heterohexamer.
Erhöhter Harnsäurespiegel ist alsGichtbekannt. Gicht kann daher auch mit einemInhibitorder Xanthinoxidase behandelt werden; zum BeispielAllopurinoloderFebuxostat.Allopurinol bindet sich fest an die reduzierte Form der Xanthinoxidase und inaktiviert sie somit. Dadurch wird die Produktion der schwerlöslichen Harnsäure verringert und die Konzentration der besser löslichen VerbindungenXanthinundHypoxanthinerhöht.
Literatur
[Bearbeiten|Quelltext bearbeiten]- L. G. Nagler und L. S. Vartanyan:Subunit structure of bovine milk xanthine oxidase. Effect of limited cleavage by proteolytic enzymes on activity and structure.Biochim Biophys Acta.427/1/1976:78-90-PMID 1260010
- J. J. Truglio et al.:Crystal structures of the active and alloxanthine-inhibited forms of xanthine dehydrogenase from Rhodobacter capsulatus.Structure. 10/1/2002:115-25.PMID 11796116
- S. T. Smith et al.:Purification and properties of xanthine dehydroganase from Micrococcus lactilyticus.J Biol Chem.242/18/1976:4108-4117.PMID 6061702
Weblinks
[Bearbeiten|Quelltext bearbeiten]Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑The Human Protein Atlas: XHDEintrag zuXanthindehydrogenaseimHuman Protein Atlas.Abgerufen am 13. März 2024.
- ↑UniProt: XDH_HUMANEintrag zu humaner Xanthindehydrogenase/oxidase inUniProt.Abgerufen am 9. März 2024.
- ↑Usamah S. Kayyali, Cameron Donaldson, Hailu Huang, Raja Abdelnour und Paul M. Hassoun:Phosphorylation of Xanthine Dehydrogenase/Oxidase in Hypoxia.In:Journal of Biological Chemistry.Band276,Nr.17,27. April 2001,S.14359–14365,doi:10.1074/jbc.M010100200.
- ↑KEGG: Reaktion R01768Eintrag zu Hypoxanthin: NAD+ Oxidoreduktase inKEGG.Abgerufen am 9. März 2024.
- ↑KEGG: Reaktion R02103Eintrag zu Xanthin: NAD+ Oxidoreduktase inKEGG.Abgerufen am 9. März 2024.
- ↑Tomoko Nishino, Ken Okamoto, Bryan T. Eger, Emil F. Pai und Takeshi Nishino:Mammalian xanthine oxidoreductase – mechanism of transition from xanthine dehydrogenase to xanthine oxidase.In:FEBS Journal.Band275,Nr.13,Juli 2008,S.3278–3289,doi:10.1111/j.1742-4658.2008.06489.x.
- ↑Jeffrey S. Wiezorek, Douglas H. Brown, David E. Kupperman und Clifford A. Brass:Rapid Conversion to High Xanthine Oxidase Activity in Viable Kupifer Cells during Hypoxia.In:Journal of Clinical Investigation.Band94,Nr.6,1. Dezember 1994,S.2224–2230,doi:10.1172/JCI117584.
- ↑Usamah S. Kayyali, Cameron Donaldson, Hailu Huang, Raja Abdelnour und Paul M. Hassoun:Phosphorylation of Xanthine Dehydrogenase/Oxidase in Hypoxia.In:Journal of Biological Chemistry.Band276,Nr.17,27. April 2001,S.14359–14365,doi:10.1074/jbc.M010100200.
- ↑KEGG: Reaktion R01769Eintrag zu Hypoxanthin: Oxygen Oxidoreduktase inKEGG.Abgerufen am 9. März 2024.
- ↑KEGG: Reaktion R02107Eintrag zu Xanthin: Oxygen Oxidoreduktase inKEGG.Abgerufen am 9. März 2024.
- ↑Russ Hille, Takeshi Nishino:Xanthine oxidase and xanthine dehydrogenase.In:The FASEB Journal.Band9,Nr.11,August 1995,S.995–1003,doi:10.1096/fasebj.9.11.7649415.