Steroide

Steroide(griechischστερεοειδές,vonστερεόςstereós,deutsch‚fest‘[1]und dem Adjektivsuffix-id,Latinisierungvonaltgriechisch-ειδής-eidḗs„[dem Hauptwort] ähnlich “, vonεἶδοςeîdos„Erscheinung, Gestalt, Art “) sind eine Stoffklasse derLipide(Moleküle mitlipophilenGruppen, in der Regel wasserunlöslich). Formal sind die SteroideDerivatedesKohlenwasserstoffsSteran(Cyclopentanoperhydrophenanthren). Steroide gehören zu denIsoprenoiden,genauer zu denTriterpenoiden.[2]
Natürliche Steroide kommen in Tieren, Pflanzen undPilzenvor; viele werden imglatten Endoplasmatischen Retikulumsynthetisiert. IhrebiochemischenAufgaben reichen von der Herstellung vonVitaminenundSexualhormonen(Androgenebeim Mann beziehungsweiseEstrogenebei der Frau) überGallensäureundKrötengiftebis zu denherzaktivenGiftenvonDigitalisundOleander.
Der Name der Stoffklasse leitet sich ab vom ersten bekannten Steroid, demCholesterin.In Tieren und im menschlichen Organismus stellt Cholesterin das wichtigste Steroid dar; Pflanzen enthalten es dagegen nur in geringer Menge.[3]Aus Cholesterin werdenLipoproteineundSteroidhormoneaufgebaut, z. B. die Hormone derNebennierenrinde(Corticosteroide). Künstliche Derivate des zu den Steroiden zählenden männlichen SexualhormonsTestosteron,dieAnabolika,werden alsMuskelaufbaupräparateverwendet und sind daher auch alsDopingmittelbekannt.[4]
Die Totalsynthese von Steroiden gelang zuerst 1939 beiEquilenin[5]und 1948 beiEstron[6],beides aromatische Steroide. Bei den nicht-aromatischen Steroiden wie Cholesterin, Cortison gelang der Durchbruch unabhängig 1951 den Gruppen vonRobert B. Woodward[7]in den USA undRobert Robinsonin England.[8]
Struktur
[Bearbeiten|Quelltext bearbeiten]Das Grundgerüst der Steroide ist dasSteran.Eine strukturelle Gemeinsamkeit ist der Cyclopentanoperhydrophenanthren-Ring (Ausnahme:Vitamin D). Steroide haben eine starre Molekülgestalt, in der Regel einen relativ hohen Schmelzpunkt und lassen sich gut kristallisieren. Durch die asymmetrischen C-Atome an den Ringverknüpfungen sind zahlreiche Struktur-Isomeremöglich, die unterschiedlich gefaltet sind. Nicht alle möglichen Faltungen kommen in der Natur vor. Nach allgemeiner Konvention dient die Position der Methylgruppe am Kohlenstoffatom 10 als Bezugspunkt für die systematische Namensgebung der Isomere: zu der Methylgruppetrans-ständigeSubstitutienten werden mit dem Index α (Alpha) bezeichnet,cis-ständigemit β (Beta). BeiGallensäurenz. B. sind die Ringe A und Bcis-verknüpft (90° Abwinklung), sie zählen zu den 5β-Androstanen. Steroidhormone sind an dieser Stelle dagegentrans-verknüpft (5α-Androstane). Nebengruppen werden abgekürzt (z. B. „-ol “= Alkoholgruppe). Die Position von Doppelbindungen wird mit einem Δ (Delta) angegeben. Der systematische Name vonCholesterinist z. B. Cholest-Δ5-en-3β-ol.
Biosynthese der Steroidhormone
[Bearbeiten|Quelltext bearbeiten]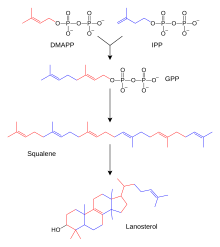

Die Biosynthese der Steroide gleicht zunächst in Grundzügen der Biosynthese derTerpene.Ein wichtiger Zwischenschritt führt zuSqualen,einem Triterpen.Lanosterolentsteht durch mehrere zyklische Verknüpfungen. Dieses Steroid mitSterangrundgerüstliefert unter Abspaltung dreier Methylgruppen, Hydrierung und IsomerisierungCholesterin.Über drei verschiedene Wege entstehen aus CholesterinAldosteron,TestosteronundCortisol.Dies geschieht in der Nebennierenrinde und in den männlichen und weiblichenGonaden(HodenundOvar). Im Ovar wird zunächst auch Testosteron (männliches Geschlechtshormon) produziert, das dann mit einerAromatase(Enzym, das den Ring A des Steroidgerüstes zu einem Benzolringdehydriert) zuEstradiolumgebaut wird. Die Enzyme, welche die einzelnen Schritte vom Cholesterin zu den Steroidhormonen katalysieren, können durch Gendefekte gestört sein. Relativ häufig ist der21-Hydroxylase-Mangel. Dieser führt zu einer Überproduktion von Geschlechtshormonen, da der Weg zum Cortisol und Aldosteron gestört ist. Die Krankheit nennt sichAdrenogenitales Syndrom.
Abbau
[Bearbeiten|Quelltext bearbeiten]Im Menschen werden die Steroide in derLeberdurchHydroxylierungundKonjugationmitGlycinoderTaurinwasserlöslich gemacht und alsGallensäurenüber die Galle insDuodenum(vorderer Teil des Dünndarms) ausgeschieden.
Einteilung
[Bearbeiten|Quelltext bearbeiten]- Sterine(Sterole)
- Zoosterine(beispielsweiseCholesterin(Cholesterol))
- Phytosterine(beispielsweiseStigmasterin(Stigmasterol))
- Mycosterine(beispielsweiseErgosterin(Ergosterol))
- Gallensäuren(beispielsweiseCholsäure)
- Steroidhormone
- Glucocorticoide(beispielsweiseCortison,Cortisol)
- Mineralocorticoide(beispielsweiseAldosteron)
- Estrogene(beispielsweiseEstron,Estradiol,Estriol)
- Gestagene(beispielsweiseProgesteron,Pregnenolon)
- Androgene(beispielsweiseTestosteron,Androsteron)
- Ecdysteroide(beispielsweiseEcdyson,Ecdysteron)
- herzwirksame Steroide (AglykonederHerzglykoside)
- Cardenolide(beispielsweiseDigoxigenin,Digitoxigenin,Gitoxigenin,Strophanthidin)
- Bufadienolide(beispielsweiseCillarenin,Hellebrigenin,Uzarigenin)
- Sapogenine(beispielsweiseDigitogenin,Diosgenin)
- Steroidalkaloide(beispielsweiseSolanidin,Tomatidin)
Literatur
[Bearbeiten|Quelltext bearbeiten]- Christoph Rüchardt:Die Entdeckung und die Struktur von Steroiden. Arbeiten von Heinrich Kilian (1855–1945), Adolf Windaus (1876–1959) und Heinrich Wieland (1877–1957).In:550 Jahre Albert-Ludwigs-Universität Freiburg.Band 4. Alber, Freiburg im Breisgau 2007,ISBN 978-3-495-48254-4,S. 207–210,uni-freiburg.de
Weblinks
[Bearbeiten|Quelltext bearbeiten]- IUPAC-Nomenklatur der Steroide(englisch)
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Eintrag zuSteroide.In:Römpp Online.Georg Thieme Verlag, abgerufen am 2. April 2014.
- ↑Zdzislaw Z. E. Sikorski:Chemical and Functional Properties of Food Lipids.CRC Press, 2010,ISBN 978-1-420-03199-7,S. 41.
- ↑Cholesterin.In:Lexikon der Biologie.Spektrum Akademischer Verlag, Heidelberg, 1999.
- ↑Prohibited List.(PDF) In:Welt-Anti-Doping-Agentur.September 2022,S. 5,abgerufen am 2. August 2023(englisch).
- ↑W. E. Bachmann,W. Cole, A. L. Wilds,J. Am. Chem. Soc.,Band 61, 1939, S. 974, Band 62, 1940, S. 824.
- ↑G. Anner,Karl Miescher,Experientia, Band 4, 1948, S. 25, Helv. Chim. Acta, Band 31, 1948, S. 2173, Band 32, 1949, S. 1957.
- ↑R. B. Woodward,F. Sondheimer,D. Taub, K. Heusler, W. M. McLamore,J. Am. Chem. Soc.,Band 74, 1952, S. 4223.
- ↑H. M. E. Caldwell, J. W. Cornforth, S. R. Duff, H. Holtermann, R. Robinson, Chem. Ind., London, 1951, S. 389, J. Chem. Soc., London, 1953, S. 361.