Alkene
| Alkene |
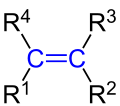 (blaumarkiert). Dabei gilt: R1bis R4sind Wasserstoffatome oder Alkyl-Reste. In Dienen ist einer der Reste R1bis R4eineAlkenylgruppe. |
 |
 |
 |
 |
 |
 |
Alkene(früher auchOlefine) sindchemische Verbindungenaus der Gruppe deraliphatischen Kohlenwasserstoffe,die an beliebiger Position eineKohlenstoff-Kohlenstoff-Doppelbindungim Molekül besitzen. Alkene sindungesättigte Verbindungenim Gegensatz zu denAlkanen,bei denen alleValenzendes Kohlenstoffatoms abgedeckt (gesättigt) sind. Alkene kommen im geringen Maßstab imErdölvor, in der Natur werden sie alsPheromoneundPhytohormoneverwendet. Sie sind die wichtigsten Basisprodukte der industriellen organischen Chemie.
Die Alkene bilden einehomologe Reihemit derallgemeinen SummenformelCnH2nbeginnend mit demEthen.Der veraltete Name Olefine ergibt sich aus dem alten Namen Olefin von Ethen, da es mit Halogenen ölige, wasserunlösliche Flüssigkeiten bildet, die ausHalogenalkanenbestehen.
Alicyclische Verbindungenmit einer Doppelbindung werden alsCycloalkenebezeichnet, mitCyclohexenals wichtigstem Vertreter.
Eigenschaften
Die Alkene sind von Ethen (C2H4) bis Buten (C4H8) gasförmig und damit leichtflüchtig. Von Penten mit 5 bis zu Pentadecen mit 15 Kohlenstoff-Atomen sind die Alkene flüssig. Alkene mit mehr als 15 Kohlenstoffatomen sind fest (jeweils unterNormbedingungen). In Wasser sind Alkene schwer löslich, sie verbrennen mit rußender Flamme. Die Alkene sind reaktionsfreudig. Die schwacheDoppelbindungbietet einen Angriffspunkt für Reagenzien, genauer ist es die π-Bindung, welche elektrophil angegriffen wird. Alkene reagieren mit Halogenen zu Dihalogenalkanen. Dies geschieht durch eine elektrophile Addition.
Hier die wichtigsten Alkene von Ethen (C2H4) bis Decen (C10H20) mit Namen und Summenformeln:
- Ethen:C2H4
- Propen:C3H6
- Buten:C4H8
- Penten:C5H10
- Hexen:C6H12
- Hepten:C7H14
- Octen:C8H16
- Nonen:C9H18
- Decen:C10H20
Von Buten und den höheren Alkenen gibt es jeweils mehrere Strukturisomere. Die allgemeine Summenformel der unsubstituierten Alkene lautet: CnH2n.
Nomenklatur und Isomere
Nomenklatur allgemein
Allgemein werden Alkene nachIUPACanalog zu Alkanen benannt, wobei das Suffix-andurch-enersetzt wird.
Die Position der Doppelbindung in der Kohlenstoffkette wird im Namen durch eine Zahl angegeben, die das Kohlenstoffatom bezeichnet, an dem die Doppelbindung beginnt. Sie gilt dabei alsfunktionelle Gruppeund muss für die Reihenfolge der Nummerierung berücksichtigt werden, also eine möglichst kleine Ziffer erhalten. Bei Molekülen mit mehreren funktionellen Gruppen wird die Zahl direkt vor das-en,sonst auch vor den Namen gestellt. Mehrfache Doppelbindungen erhalten vor das Suffix das entsprechende griechische Zahlwort gestellt.
| (EZ)-Nomenklatur bei Alkenen. DieCIP-Priorität der vier Substituenten ist a>bundc>d. |
 |
 |
Neben derStrukturisomerie,bei der die Kohlenstoffatome unterschiedlich angeordnet sind, kann bei Alkenen an der C=C-Doppelbindung auch noch diecis-trans-Isomerieauftreten.
Da die Doppelbindung im Gegensatz zurEinfachbindungnicht frei drehbar ist, kann es bei anhängenden Atomen oder Atomgruppen an der Doppelbindung zu zwei möglichen Anordnungen kommen. Cis-trans-Isomere unterscheiden sich in ihren physikalischen und chemischen Eigenschaften. Sie lassen sich über dasDipolmomentund überIR-Spektroskopieunterscheiden. Während dascisim Verbindungsnamen erwähnt wird, kann man dastransauch weglassen.
Am Beispiel der isomeren But-2-ene lässt sich diecis-trans-Isomerie nachvollziehen. Beimcis-But-2-en liegen beideMethylgruppenals Kettenreste diesseits (lat.cis), das heißt auf der gleichen Seite. Beimtrans-But-2-en liegen die Methylgruppen auf der jeweils anderen (lat.trans) Seite der Doppelbindung.
Von derIUPACwurde diecis/trans-Bezeichnung ersetzt (da sie bei mehr als zwei Substituenten leicht in die Irre führt; man betrachte nur (E)-2-Brom-1-chlor-1-fluor-ethen!) durchE/Z,wobei (E) (entgegengesetzt) meist – aber nicht immer – fürtranssteht und (Z) (zusammen) fürcis.Dabei wird die gegenseitige Lage der Substituenten höchster CIP-Prioritätangegeben. Genauere Ausführungen siehe(E,Z)-Isomerie.
Traditionell haben einige einfache Substanzen mit (E,Z)-Isomerie unterschiedliche Namen:Fumarsäure[(E)-Butendisäure] undMaleinsäure[(Z)-Butendisäure] sowie deren Derivate sind dafür Beispiele.
Diene und Polyene
Verbindungen mit zwei Doppelbindungen nennt manDiene,mit drei DoppelbindungenTriene.Allgemein werden diesePolyenegenannt. Die Benennung der Moleküle folgt hier denselben Regeln wie bei den einfach ungesättigten Alkenen, siehe1,3-ButadienundIsopren.Die Anzahl der möglichencis-trans-Isomere steigt dabei drastisch an, da es für jede der Doppelbindungencis-trans-Isomere gibt.
Verwendung
Aufgrund der recht reaktiven Doppelbindung sind Alkene wichtige Ausgangsstoffe für viele andere Grundstoffe der chemischen Industrie.
Alkene werden alsTreibstoffeund zur Herstellung vonHalogenkohlenwasserstoffen,Alkoholen,Ketonen,Glycolen,Olefinoxiden,KunststoffenundWaschmittelkomponentengebraucht. Propen wird für die Synthese von z. B.Glycerin,Phenol,Isopropylalkohol,Epoxidharzenverwendet und für diePolymerisationvonPolypropylenbenötigt.
Herstellungsverfahren
Herstellungsverfahren allgemein
Alkene können durch verschiedene Verfahren hergestellt werden. Eine Möglichkeit bildet die pyrolytische Dehydrierung und Spaltung von Alkanen (Cracking). Dabei werden bei 450–500 °C die kurzkettigen Alkane in Gegenwart von Mischoxid-Katalysatoren in Alkene und Wasserstoff gespalten. Bei höheren Alkanen ist dieses Verfahren allerdings wenig sinnvoll, da dabei viele verschiedeneIsomereentstehen können, deren Trennung sehr aufwendig, wenn nicht unmöglich ist.

Eine weitere Möglichkeit, Alkene herzustellen, ist die partielle Hydrierung vonAlkinen.Dabei werden Alkine in der Gegenwart desLindlar-Katalysatorshydriert. Durch diesen leicht vergifteten Katalysator wird die Weiterhydrierung von Alkenen zuAlkanenverhindert. Dadurch, dass sich das Wasserstoffmolekül von einer Seite an die Dreifachbindung nähert, entstehen ausschließlich (Z)-Alkene.
β-Eliminierungen
Allgemein können Verbindungen mit dem Strukturfragment CH–CX durch Abspaltung von HX zu einem Alken mit dem Strukturfragment C=C umgesetzt werden. Im Edukt mit dem Strukturfragment CH-CX sind dabei das H und die Gruppe X an direkt benachbarte C-Atome gebunden.
Dehydratisierung
Die Dehydratisierung von Alkoholen findet in saurem Milieu statt. Aus tertiären Alkoholen lässt sich wesentlich leichter Wasser eliminieren als aus sekundären oder gar primären Alkoholen.
Alkohole lassen sich auch bei erhöhten Temperaturen (z. B. ca. 200…250 °C) über porösen Katalysatoren mit hoher innerer Oberfläche (wie z. B. Aluminiumoxid Al2O3) zu Alkenen dehydratisieren. Sekundäre Alkohole vom Typ CH3–CHOH–CH2–R (R =Alkylrest) ergeben dabei ein Gemisch aus 1-Olefinen, cis-2- und trans-2-Olefinen:[1][2]
Dehydrohalogenierung
Analog dazu lassen sich Halogenalkane zu Alkenen verwandeln. Diese als Dehydrohalogenierung bekannte Reaktion erfolgt, im Gegensatz zur Dehydratisierung von Alkoholen, unter basischen Bedingungen. Auch hier lassen sich tertiäre Halogenwasserstoffe leichter dehydrohalogenieren als sekundäre, und diese wiederum leichter als primäre Halogenwasserstoffe.
Saytzeff-Regel
Bei diesen β-Eliminierungen ist eine Regioselektivität zu beobachten. Unter Umständen können mehrere Produkte entstehen. Es gilt dieRegel nach Saytzeff:
Neben der OH-Gruppe respektive dem Halogenatom wird der Wasserstoff von demjenigen Nachbar-C-Atom eliminiert, welches am wenigsten Wasserstoffatome hat. Oder anders ausgedrückt, es entsteht das am höchsten substituierte Alken.

Dehalogenierung
Als dritte mögliche β-Eliminierung gibt es die Dehalogenierung von 1,2-Dihalogenalkanen. Dabei wird in Alkoholen während der Anwesenheit von Zink zwei gleichartige Halogenatome von benachbarten Kohlenstoffatomen eliminiert. Dabei entsteht das Alken und das Halogen in molekularer Form:
Dehydrierung
Alkene können durch partielle Dehydrierung ausAlkanengewonnen werden. Man eliminiert hierzu Wasserstoff aus dem entsprechenden Alkan. Die Anzahl der Kohlenstoffatome bleibt gleich.
Pyrolyse von quartären Ammoniumhydroxiden
Alkene entstehen bei der Pyrolyse vonquartären Ammoniumhydroxiden,wenn mindestens eine Alkangruppe am Stickstoff 2 oder mehr C-Atome besitzt. Die Umsetzung ist wie folgt:[3]
Typische Reaktionen
Der für Alkene typische Reaktionsmechanismus ist dieElektrophile Addition.Auf dieser Reaktion beruht auch die typische Nachweismethode für Alkene, dieBromwasserprobe:dabei gibt man Alkene oder andere ungesättigte Kohlenwasserstoffe mit braun gefärbtem Bromwasser zusammen, wobeiBroman das Alken addiert wird und eine rasche Entfärbung des Gemisches eintritt.
Addition von Halogenwasserstoffen
Die Addition von Halogenwasserstoffen verläuft ähnlich wie die Addition von Halogenen wie Brom. Obwohl bei der Addition an unsymmetrische Alkene theoretisch verschiedene Reaktionsprodukte denkbar sind, je nachdem, an welches an der Doppelbindung beteiligte C-Atom das Halogenatom angelagert wird, läuft die Additionsreaktion bevorzugt regioselektiv entsprechend derMarkownikow-Regelab.
Mit einer regioselektiven Reaktion bezeichnet man eine chemische Veränderung, die vorzugsweise an einer von mehreren möglichen Stellen eintritt. Es bildet sich durch Reaktion mit dem Proton H+der Halogenwasserstoffsäure als Zwischenprodukt stets das stabilste Carbeniumion. Mesomerieeffekte sind für diese Betrachtung stets wichtiger als induktive Effekte. Das Halogenid addiert sich dann an das C+des Carbeniumions. Wenn keine Mesomeriestabilisierung des Carbeniumions möglich ist, kann die Markownikow-Regel angewandt werden: Bei unsymmetrischen Alkenen erfolgt die elektrophile Addition von Halogenwasserstoffen so, dass das Halogen bevorzugt an das Kohlenstoffatom bindet, das die wenigsten Wasserstoffatome besitzt; das Wasserstoff-Atom dagegen an das wasserstoffreichste Kohlenstoff-Atom. Grund dafür ist, dass Alkylgruppen als Elektronendonatoren wirken (+I-EffektundHyperkonjugation) und dadurch die Verteilung (Delokalisation) der positiven Ladung begünstigen. Die Stabilität der positiven Carbeniumionen ist umso größer, je mehr Alkylgruppen an dem geladenen Kohlenstoffatom gebunden sind. Deshalb ist ein tertiäres Carbeniumion stabiler als ein Sekundäres und Primäres. Dasselbe gilt ebenfalls für Radikale (siehe Abweichung #2), da diese auch unter Elektronenmangel leiden.
Abweichungen von der Markownikow-Regel treten unter anderem beiradikalischen Additionund derHydroborierungauf. Bei diesen Reaktionen entsteht das Anti-Markownikow-Produkt:
- Bei der Hydroborierung wird das Boratom (Elektrophil) an das negativer teilgeladene Kohlenstoffatom (niedriger substituiert) der Doppelbindung addiert, wohingegen das Wasserstoffatom (Nucleophil) an dem positiv teilgeladenen Kohlenstoffatom (höher substituiert) addiert wird. Da das Wasserstoffatom meistens das Elektrophil ist, bewirkt dieser Rollentausch einen Bruch der Regel.
- Bei der radikalischen Addition von z. B. Bromwasserstoff greift nicht die Doppelbindung das Elektrophil (Wasserstoff) an, sondern ein Bromradikal die Doppelbindung. Dabei bindet das Bromatom an dem niedriger substituierten Kohlenstoffatom, damit das Radikal am höhersubstituierten entsteht. Durch Hyperkonjugation mit den Substituenten und durch +I-Effekt kann so der Elektronenmangel am Radikal stabilisiert werden. Erst danach greift dieses Radikal ein weiteres H-Br Molekül an und erlangt so sein Wasserstoffatom, das sich dann am höhersubstituierten Kohlenstoffatom befindet und somit gegen die Regel verstößt.
Reaktion mit konzentrierter Schwefelsäure
Die Anlagerung erfolgt nach derMarkownikow-Regel,es sei denn Mesomerieeffekte dominieren. Technisch dient dieses Verfahren zur Darstellung von Alkoholen aus Alkenen. Alkylschwefelsäure ist durchHydrolyseleicht in Alkohole zu überführen.
Reaktion mit Hypochloriger Säure
Diese Reaktion ist regioselektiv. Das Chloratom lagert sich an das C-Atom an, welches die meisten Wasserstoff-Atome trägt, wenn keine mesomeren Effekte auftreten. Ebenso läuft die Reaktion mit Nitrosylchlorid und Nitrosylbromid an Alkene unter Addition.
Reaktion mit einem Oxidationsmittel
Die Oxidation erfolgt entweder mit Osmiumtetroxid oder mit alkalischerKaliumpermanganatlösung.Zuerst entsteht unter einercis-Addition ein cyclischer Ester, dieHydrolyseführt zu einemcis-1,2-Diol.
Ozonierung von C=C-Doppelbindungen
WennOzonin wasserfreie Alkene geleitet wird, bilden sichOzonide,die im trockenen Zustand explosiv sind. DieOzonolysespaltet dabei die Doppelbindung komplett und ist somit für die Ermittlung des Aufbaus einer Kohlenstoffkette eine wichtige Reaktion, da die Spaltprodukte Aufschluss über die Lage der Doppelbindung geben. Das Ozon kann durch Entladung aus Luftsauerstoff in einem Ozonisator erzeugt werden.
Katalytische Hydrierung
DieHydrierungist die Addition vonWasserstoffan die Doppelbindung, die dadurch zur Einfachbindung wird, mit Hilfe einesKatalysators.Die Reaktion erfolgt bei Raumtemperatur in Gegenwart vonPlatinoderPalladium,das mit Wasserstoff gesättigt ist.
Beispiel:
Umwandlung voncis- intrans-Alkene und umgekehrt
(E)-Alkene [Beispiel: (E)-Stilben,Schmelzpunkt 124°C] lassen sichphotochemischin (Z)-Alkene [Beispiel: (Z)-Stilben, Schmelzpunkt 1°C] umwandeln.[4]Die Reaktion ist umkehrbar. – In seltenen Ausnahmefällen (Beispiel:Ranitidin) ist die Energiebarriere für die Umwandlung speziell substituierter Alkene bei Raumtemperatur so niedrig, dass sich die (E)-Form spontan in die (Z)-Form umwandelt und umgekehrt. Mit anderen Worten: (E)-Isomer und (Z)-Isomer können in seltenen Ausnahmefällen im Gleichgewicht miteinander stehen.
Nachweis
Zum unspezifischenNachweisder Doppelbindung, besonders zur Unterscheidung von denAlkanen,wird ein Alken (z. B. Ethen) in braunesBromwassereingeleitet. Dabei kann die Reaktion auch ohne das Hinzufügen von Energie, wie z. B. Licht, ablaufen. Das Alken-Molekül addiert an jedem C-Atom der C=C-Doppelbindungnach demReaktionsmechanismusderelektrophilen AdditioneinBrom-Atom; als Reaktionsprodukt bildet sich das entsprechendeHalogenalkan.Zum Beispiel:
Das Bromwasser entfärbt sich aufgrund dieser Reaktion, ein eingeleitetes Alkan würde das braune Bromwasser nicht entfärben.Phenoleund viele reduzierende Verbindungen entfärben jedoch ebenfalls eine Bromlösung.
Die sogenannteBaeyer-Probedient zum allgemeinen Nachweis von C=C-Doppelbindungen bzw. Alkenen. Das Alken wird in eine Kaliumpermanganat-Lösung im schwach alkalischen oder sauren Milieu eingeleitet, worauf sich die Lösung braun färbt bzw. farblos wird. Es entstehen ein Alkohol undBraunsteinbzw. Mangan(II)-Ionen.
Literatur
- Allinger,Cava,de Jongh,Johnson,Lebel,Stevens:Organische Chemie,1. Auflage, Walter de Gruyter, Berlin 1980,ISBN 3-11-004594-X,S. 222–240.
- Beyer/Walter:Lehrbuch der Organischen Chemie,19. Auflage, S. Hirzel Verlag, Stuttgart 1981,ISBN 3-7776-0356-2,S. 62–76.
- Morrison/Boyd:Lehrbuch der Organischen Chemie,3. Auflage, Verlag Chemie, Weinheim 1986,ISBN 3-527-26067-6,S. 305–370.
- Streitwieser/Heathcock:Organische Chemie,1. Auflage, Verlag Chemie, Weinheim 1980,ISBN 3-527-25810-8,S. 305–361.
- K. Peter C. Vollhardt,Neil E. Schore:Organische Chemie,4. Auflage, Wiley-VCH, Weinheim 2005,ISBN 978-3-527-31380-8,S. 509–560.
Weblinks
- Eintrag zualkenes.In:IUPAC(Hrsg.):Compendium of Chemical Terminology.The “Gold Book”.doi:10.1351/goldbook.A00224– Version: 2.3.3.
Einzelnachweise
- ↑Dirk Dautzenberg, Helmut Knözinger:Influence of Steric and Inductive Effects on Product Distribution in the Dehydration of Secondary Alcohols on Alumina,Journal of Catalysis33, 142–144 (1974)doi:10.1016/0021-9517(74)90254-1.
- ↑Dirk Dautzenberg, Helmut Knözinger:Inductive Effects and Product Distributions in the Dehydration of Secondary Alcohols on Alumina.Reply to the Comments by B. H. Davis,Journal of Catalysis58, 496–497 (1979)doi:10.1016/0021-9517(79)90288-4.
- ↑L. F. Fieser und M. Fieser:Lehrbuch der Organischen Chemie,3. Auflage, Verlag Chemie, Weinheim/Bergstr. 1957, S. 260.
- ↑Siegfried Hauptmann:Organische Chemie,2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985,ISBN 3-342-00280-8,S. 283.








