Alkine

Alkine(Acetylene) sindorganische Verbindungen,die mindestens eineKohlenstoff-Kohlenstoff-Dreifachbindung(R–C≡C–R) im Molekül besitzen. Nach denIUPAC-Regelnwerden solche Verbindungen allgemein als Acetylene bezeichnet, wogegen der Begriff Alkine nur für Verbindungen der Summenformel CnH2n-2verwendet wird, also für acyclische (offenkettige)Kohlenwasserstoffemit exakt einer Dreifachbindung. Entgegen der strengen IUPAC-Definition wird der Begriff Alkine jedoch auch für Verbindungen mit C≡C-Dreifachbindungen im Allgemeinen verwendet. In diesem weiteren Sinne fallen darunter z. B. auch Verbindungen mit zwei (Diine) oder mehr C≡C-Dreifachbindungen (Polyine), sowie Verbindungen mit einer C≡C-Dreifachbindung in einem Ring (Cycloalkine).
Alkine sindunpolareVerbindungen und ähneln mit ihren Dreifachbindungen sowohl in den physikalischen Eigenschaften als auch in der Reaktivität denAlkenenmitDoppelbindungen.Durch ihre Dreifachbindungen weisen Alkine aber eine besonders hohe Energiedichte auf und neigen unter bestimmten Bedingungen zurPolymerisationoder Explosion. Diese Tendenz nimmt umso mehr zu, je mehr Dreifachbindungen vorliegen. Man unterscheidet zwischen terminalen Alkinen, bei denen an mindestens einem Kohlenstoff-Atom der Dreifachbindung ein Wasserstoffatom anschließt, und internen Alkinen, bei denen auf beiden Seiten Kohlenstoffatome anschließen. Die Struktureinheit einer terminalen Dreifachbindung mit einer zusätzlichen Methylengruppe wird alsPropargylgruppebezeichnet. Eine wichtige Eigenschaft, die terminale Alkine vonAlkanenund Alkenen unterscheidet, ist ihre vergleichsweise hohe Acidität.
Diverse Alkine kommen natürlich vor, in Pflanzen, Tieren und anderen Lebewesen und auch imWeltraum.Viele Alkine werden wegen der charakteristischen Reaktivität in der organischen Synthese eingesetzt. Dasindustriellwichtigste Alkin und gleichzeitig auch das einfachste ist das Ethin (Trivialname Acetylen), das im20. Jahrhundertzeitweise eine der wichtigsten industriellen Grundchemikalien war. Obwohl seine Bedeutung seitdem abgenommen hat, wird es nach wie vor in industriellen Prozessen eingesetzt.
Geschichte
[Bearbeiten|Quelltext bearbeiten]
Die erste entdeckte natürlich vorkommende Alkinverbindung,Dehydromatricariaester,wurde 1826 aus einerArtemisia-Artisoliert, jedoch wurde die Struktur zu diesem Zeitpunkt nicht aufgeklärt.[1]1836 versuchteEdmund Davy,der Cousin vonHumphry Davy,durch Umsetzung vonKaliumhydrogentartratmitKohlenstoffgrößere MengenKaliumzu gewinnen und stellte dabei zufällig Acetylen her. Erst etwa 20 Jahre später entwickelteMarcelin Berthelotweitere Herstellungsmethoden (insbesondere durch thermische Zersetzung vonEthylen,Ethanolund anderen organischen Verbindungen, sowie die Herstellung aus den Elementen imLichtbogen) und gab der Verbindung den Namen Acetylen.[2][3]Im Jahr 1862 gelang dem deutschen Chemiker und ArztFriedrich Wöhlerdie Darstellung von Acetylen durch die Reaktion von Wasser mitCalciumcarbid.[1]Der erste Naturstoff mit C≡C-Dreifachbindung, dessen Struktur aufgeklärt wurde, war die im Jahr 1892 isolierteTaririnsäure.[4]1895 entdeckteHenry Le Chatelier,dass Acetylen mitSauerstoffmit einer sehr heißen Flamme verbrennt. Damit war die Grundlage desAcetylen-Schweißensund-Schneidensgelegt.[5]In der zweiten Hälfte des 19. Jahrhunderts waren schon verschiedene Reaktionen der Alkine bekannt, darunter die Isomerisierung interner Alkine zu terminalen Isomeren, also Vorläufer derAlkin-Zipper-Reaktion,[6]und die 1869 entdeckteGlaser-Kupplungterminaler Alkine.[7]

Schon vor seiner chemisch-industriellen Nutzung wurde Acetylen für Brenner und Beleuchtungen (z. B.Autoscheinwerfer) genutzt. In den 1920er- und 30er-Jahren wurden Prozesse entwickelt, um aus der Verbindung verschiedene Produkte herzustellen, darunterAcetaldehyd,TrichlorethylenundNeopren.Ein besonders wichtiger Akteur warWalther Reppe,Laborchef beiI.G. Farben.Er entwickelte sicherere Prozesse zur Verarbeitung von Acetylen durch Verdünnung mitInertgasund Herstellungsprozesse unter anderem fürPropargylalkoholundButindiol(durchEthinylierungvonFormaldehydmitKupferacetylid), die Folgeprodukte des Butindiols (wieButadienundAdiponitril), sowieCyclooctatetraen.ImZweiten Weltkriegwurde die Verbindung in Deutschland als Ersatz für petrochemische Materialien in der chemischen Industrie verwendet.[8]Dies ebnete dem Acetylen den Weg zu seiner großen industriellen Bedeutung Mitte des 20. Jahrhunderts. Zeitweise war es eine der wichtigstenGrundchemikalienund wurde zur Herstellung einer großen Zahl weiterer Verbindungen verwendet, darunterAcrylsäure(sowie abgeleiteteEsterundPolymere),Vinylchlorid(undPVC),Vinylacetat(sowiePolyvinylacetatund andere Vinylester), Propargylalkohol und Butindiol (sowie Folgeprodukte, darunterButan-1,4-diol,ButendiolundTetrahydrofuran). Zum Höhepunkt der Verwendung in den 1960er- und 1970er-Jahren wurden inDeutschlandetwa 350.000 Tonnen und in denUSA480.000 Tonnenper annumproduziert. Seitdem haben die Bedeutung und die Verwendungsmenge deutlich abgenommen, da es für viele Produkte billigere Produktionsmethoden gibt, insbesondere ausgehend von Ethylen aus derErdölverarbeitung.[9]
Etwa seit Mitte des 20. Jahrhunderts wird die C≡C-Dreifachbindung als Baustein für pharmazeutische Wirkstoffe verwendet[10]und ist ein Teil diverser Pharmazeutika, die heute verwendet werden. Zwei Nobelpreise für Chemie wurden für Forschungsthemen vergeben, bei denen Reaktionen von Alkinen einen maßgeblichen Anteil ausmachen: Durch direkte katalytische Polymerisation von Acetylen-Gas mitTitan(IV)-butanolatundTriethylaluminiumalsKatalysatorkönnenPolyacetylen-Folien hergestellt werden, was Ende der 1960er-Jahre vonHideki Shirakawaentdeckt wurde.[11][12]Polyacetylen weist Doppel- und keine Dreifachbindungen auf und ist demnach selbst kein Alkin. DurchDotierung(mitChlor,Brom,Iod,Bortrifluorid,Arsen(V)-fluorid,Lithiumnaphthalid,Natriumoder Kalium) wird daraus ein Material mit hervorragenderelektrischer Leitfähigkeit.[13][14][15]Die Möglichkeit der Dotierung wurde 1976 entdeckt, wobei Brom verwendet wurde.[12]Für die Entdeckung und Erforschungleitfähiger Polymerewurde 2000 derChemie-Nobelpreisverliehen, unter anderem an Shirakawa.[16]Der Chemie-Nobelpreis 2022 wurde unter anderem für die Erfindung bzw. Erforschung derClick-Chemieverliehen, deren prototypische Reaktion dieCycloadditionzwischen einemAzidund einem terminalen Alkin ist.[17]
Vertreter und Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Die Dreifachbindung der Alkine besteht aus einer σ-Bindung und zwei orthogonalen π-Bindungen. Durch die diffuse Gestalt der an den π-Bindungen beteiligten Orbitale liegt aber eine zylindrische Verteilung der Elektronen vor. Die elektronische Struktur der C≡C-Dreifachbindung hängt direkt mit der Geometrie der Dreifachbindung zusammen, in der die C-Atome der Dreifachbindung und die beiden direkt mit diesen C-Atomen verknüpften Atome in einer Linie (linear) ausgerichtet sind. Der Kohlenstoff-Kohlenstoff-Abstand einer Dreifachbindung liegt bei 120,3 pm und ist damit kürzer als der Abstand einer C=C-Doppelbindung (133 pm). Mit etwa 958 kJ/mol (gegenüber 724 kJ/mol oder 377 kJ/mol in Doppel- und Einfachbindungen) ist die Dreifachbindung auch besonders stabil, allerdings sind Alkine hochenergetische Verbindungen, die unter bestimmten Bedingungen zu Polymerisation oder Explosion neigen. Interne Alkine sind durchHyperkonjugationenergetisch etwas stabiler als terminale.[18]
Durch den höheren Anteil ans-Orbitalenin den sp-Hybridorbitalen (50 %) ist die Aufenthaltswahrscheinlichkeit derElektronender C–H-Bindung in der Nähe des Kohlenstoff-Kerns größer als bei Alkenen (sp2) und Alkanen (sp3), worauf dieCH-Aciditätendständiger (terminaler) Alkine beruht, da die negative Ladung so stabilisiert wird. Mitstarken Basenkönnen terminale Alkine deprotoniert werden und das Wasserstoffatom durch ein Metallatom ersetzt werden.[18][19][20]Beispielsweise ist derpKS-Wertder Protonen im Acetylen mit etwa 25 gegenüber 44 im Ethylen und 50 imEthandeutlich niedriger.[18]
Lineare Alkine
[Bearbeiten|Quelltext bearbeiten]Lineare Alkine mit einer Dreifachbindung bilden eine homologe Reihe. Durch verschiedene mögliche Positionen der Dreifachbindung existieren ab vier Kohlenstoffatomen mehrerePositionsisomere.Einige Eigenschaften der Alkine bis acht Kohlenstoffatome sind in der folgenden Tabelle zusammengefasst. Ethin, Propin und 1-Butin sind bei Raumtemperatur gasförmig und 2-Butin siedet nur knapp über Raumtemperatur. Die Alkine mit fünf (Pentine) bis zehn (Decine) Kohlenstoffatomen sind alle bei Raumtemperatur flüssig. Bei gleicher Kettenlänge haben die meisten terminalen Alkine geringere Schmelz- und Siedepunkte als die internen.
| Gruppe | Summenformel | Molmasse | Isomer | Strukturformel | CAS-Nummer | Schmelzpunkt | Siedepunkt |
|---|---|---|---|---|---|---|---|
| C2H2 | 26,04 g/mol | Ethin | 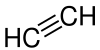 |
74-86-2 | −84 °C (Sublimation)[18] | ||
| C3H4 | 40,06 g/mol | Propin | 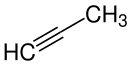
|
74-99-7 | −102,7 °C[21] | −23,2 °C[21] | |
| Butine | C4H6 | 54,09 g/mol | 1-Butin | 107-00-6 | −125,73 °C[22] | 8,07 °C[22] | |
| 2-Butin | 
|
503-17-3 | −32 °C[23] | 27 °C[23] | |||
| Pentine | C5H8 | 68,12 g/mol | 1-Pentin | 627-19-0 | −106 °C[24] | 39–41 °C[24] | |
| 2-Pentin | 
|
627-21-4 | −109 °C[25] | 55–57 °C[25] | |||
| Hexine | C6H10 | 82,14 g/mol | 1-Hexin | 693-02-7 | −132 °C[26] | 71 °C[26] | |
| 2-Hexin | 
|
764-35-2 | −89,6 °C[26] | 84,5 °C[26] | |||
| 3-Hexin | 928-49-4 | −103 °C[26] | 81 °C[26] | ||||
| Heptine | C7H12 | 96,17 g/mol | 1-Heptin | 628-71-7 | −81 °C[27] | 100 °C[27] | |
| 2-Heptin | 1119-65-9 | ? | 113,6 °C[28] | ||||
| 3-Heptin | 2586-89-2 | −130,5 °C[28] | 109,2 °C[28] | ||||
| Octine | C8H14 | 110,2 g/mol | 1-Octin | 629-05-0 | −79,3 °C[29] | 126,3 °C[29] | |
| 2-Octin | 2809-67-8 | −61,6 °C[29] | 137,6 °C[29] | ||||
| 3-Octin | 15232-76-5 | −103,9 °C[29] | 133,1 °C[29] | ||||
| 4-Octin | 1942-45-6 | −103 °C[29] | 131,6 °C[29] | ||||
Diine und Polyine
[Bearbeiten|Quelltext bearbeiten]
Viele Polyine mit unterschiedlichen Kettenlängen und Substituenten wurden untersucht. SchonButadiin(Diacetylen) mit zwei Dreifachbindungen ist sehr reaktiv undHexatriin(Triacetylen) ist extrem instabil,[30]kommt allerdings natürlich als Metabolit des PilzesFomes annosusvor.[31]Einein-silico-Studie von 1,3-Butadiin und1,3-Pentadiinzeigt, dass im Gegensatz zu den analogen Verbindungen mit konjugierten Doppelbindungen keine nennenswerte Resonanzstabilisierung vorliegt.[32]Je länger Polyine sind, also je mehr Dreifachbindungen sie aufweisen, desto instabiler und reaktiver sind sie, da sie leichtexothermpolymerisieren und sich insbesondere als Feststoffe explosiv zersetzen können, auch in Abwesenheit vonLuft.Terminal substituierte Polyine sind stabiler, wobei die Stabilität mit der Größe der Substituenten zunimmt, da größere Gruppen eine Annäherung der Ketten effektiv verhindern können.[30]Während Hexatriin schon unter Raumtemperatur explodiert, kannDiphenylhexatriinerhitzt und geschmolzen werden.tert-Butylgruppenhaben ebenfalls einen deutlich stabilisierenden Effekt, wodurch schon in den 1950er-JahrenDi-tert-butyltetradecaheptainhergestellt werden konnte.[30][33][34][35]Erst 2010 wurde ein Polyin mit 22 Dreifachbindungen und Tris(3,5-di-tert-butylphenyl)methyl-Gruppen als endständige Substituenten hergestellt. Im Jahr 2020 wurde ein noch längeres Polyin mit 24 Dreifachbindungen präsentiert. Ein sehr langkettiges Polyin ist dasCarbin.[33][36]
Cycloalkine
[Bearbeiten|Quelltext bearbeiten]
Cycloalkine mit kleineren Ringgrößen weisen eine erheblicheRingspannungauf.Cyclooctinwurde in den 1950er-Jahren zum ersten Mal synthetisiert und ist das kleinste Cycloalkin, das unter normalen Bedingungen isoliert werden kann (Siedepunkt 157,5–158 °C), obwohl es auch sehr reaktiv ist.[37][38][39][40]Bei dieser Verbindung beträgt der Winkel der Alkinsubstituenten etwa 160° und die Ringspannung beträgt nach unterschiedlichen Angaben 9–19 kcal/mol.[38][41][42]Cyclopentin,CyclohexinundCycloheptinsind alsLigandenvonÜbergangsmetallkomplexenbekannt.[37]DieHalbwertszeitvon freiem Cycloheptin beträgt etwa eine Stunde bei −78 °C, freies Cyclohexin konnte bisher nur durchMatrixisolationbei −100 °C untersucht werden und freies Cyclopentin ist lediglich als reaktives Intermediat bekannt.[43][44]Cyclobutinwurde nur theoretisch untersucht und existiert möglicherweise nur als Übergangszustand.[45][46]Das kleinste Cycloalkin ohne Ringspannung istCyclodecin.[47]
Spektroskopische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Im1H-NMRsind Alkinyl-Wasserstoffatome nicht so stark entschirmt wie Alkenylwasserstoffatome, da in der rotations-symmetrischen Dreifachbindung durch das äußere Magnetfeld ein Ringstrom induziert wird, dessen Magnetfeld dem äußeren entgegengesetzt ist.[18]Daher erscheinen Wasserstoffatome terminaler Alkine bei 1,7–3,3 ppm (2–2,5 ppm).[18][19]Bei Protonen terminaler Alkine liegt oft eine Fernkopplung (4J-Kopplung) von etwa 2–4Hzüber die Dreifachbindung hinweg vor.[18][19]Im13C-NMR erscheinen die Kohlenstoffatome, die an der Dreifachbindung eines Alkins beteiligt sind, bei etwa 65–95 ppm, also bei höherer Verschiebung als Alkane aber niedrigerer als Alkene.[18]Die Verschiebung hängt deutlich vom Winkel der Alkinsubstituenten ab: Bei Cyclooctin mit einem Winkel von etwa 160° ist die Verschiebung um 95 ppm. Bei stärker gebogenen Verbindungen mit einem Winkel von 140–150° kann die Verschiebung auch 100–110 ppm betragen.[48]
Auch durchInfrarotspektroskopiekönnen Alkine nachgewiesen werden. Die C–H-Bindung weist eine Valenzschwingung bei 3260–3330 cm−1und eine Deformationsschwingung bei etwa 640 cm−1auf. Die C≡C-Bindung weist eine Valenzschwingung bei 2100–2260 cm−1auf, die aber bei internen Alkinen weniger deutlich ist, wodurch Infrarotspektroskopie insbesondere zum Nachweis terminaler Alkine geeignet ist.[18]
Natürliche Vorkommen
[Bearbeiten|Quelltext bearbeiten]Alkine sind alsNaturstoffenicht sehr verbreitet, Stand 2013 waren lediglich etwa 1000 Verbindungen bekannt[49],2019 jedoch schon über 2000.[50]Allerdings sind diese Verbindungen auf sehr unterschiedliche Lebewesen verteilt und kommen sowohl in Pflanzen, Tieren und Pilzen, als auch in Mikroorganismen vor.
Vorkommen in Pflanzen
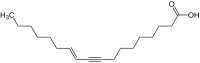
[Bearbeiten|Quelltext bearbeiten]Neben der Taririnsäure sind diverse weitereFettsäurenmit Dreifachbindungen bekannt, darunter dieCrepeninsäure,die inKorbblütlernvorkommt (z. B.Crepis foetida),[51][52]und dieXimeninsäure,die inSandelholzartigen(z. B.Santalum album) vorkommt.[53][54]In der Familie der Korbblütler kommen neben der Crepeninsäure viele weitere Alkine vor, darunter auch eine große Zahl an Verbindungen mit mehreren Dreifachbindungen.[49][55]Das Haupttoxin derWasserschierlinge(Cicutoxin) ist ebenfalls ein Alkin.[56]DerPolyolAvocadinaus derAvocadoträgt eine terminale Dreifachbindung.[57]
-
Crepis foetida
-
Crepeninsäure
-
Santalum album
-
Ximeninsäure
-
Wasserschierling
-
Cicutoxin
-
Avocado
-
Avocadin
Vorkommen in Tieren
[Bearbeiten|Quelltext bearbeiten]1971 wurden die ersten Vertreter derHistrionicotoxineaus demHarlekin-Baumsteiger,einemPfeilgiftfrosch,isoliert. Die meisten Vertreter dieser Gruppe weisen eine Dreifachbindung auf, manche, wie das Histrionicotoxin selbst, sogar zwei.[58]
Eine große Anzahl an Alkinen wurde ausSchwämmenisoliert. Beispielsweise wurden mehr als zehn langkettige, lineare, stark ungesättigte Verbindungen mit jeweils vier Dreifachbindungen aus einer Art der GattungPetrosiaisoliert[59]und auch weitere Polyine wurden in dieser Gattung gefunden.[60][61]Callyspongia[62][63]undStelletta[63]sind weitere Gattungen von Schwämmen, aus der Alkine isoliert wurden. Auch inSteinkorallender GattungMontiporakommen Alkine vor.[59][62]
Vorkommen in Pilzen
[Bearbeiten|Quelltext bearbeiten]In Pilzen kommen viele Alkin-Metaboliten vor[49],darunter Carbonsäuren wie dasMycomycin[64],EpoxidewieBiformin(ausTrichaptum biforme)[49][S 1],Alkinylphenole wie dasSiccain[49][S 2]und einfache Kohlenwasserstoffe wie das Hexatriin.[31]
-
Der PilzFomes annosusbildet flüchtiges Hexatriin
-
Trichaptum biforme
-
Mycomycin
-
Biformin
-
Siccain
Vorkommen in Mikroorganismen
[Bearbeiten|Quelltext bearbeiten]In vielen marinenCyanobakterienkommenPeptidevor, die Komponenten mit terminaler Dreifachbindung enthalten, beispielsweiseOnchidin[S 3]und dieDragonamide.[65]
Eine große Gruppe von biologisch aktiven Alkinen bilden dieEndiin-Antibiotika,die seit den späten 1980er-Jahren erforscht werden. Naturstoffe, die als Strukturmotiv die Endiin-Einheit besitzen, wirken häufigcytotoxischgegenüber menschlichenTumorzelllinienund stellen somit potentielleChemotherapeutikadar. Der Wirkmechanismus beruht auf einerBergman-Cyclisierung(siehe unten).[66][67]Etwa 40 natürliche Endiin-Verbindungen sind bekannt.[66]Beispiele hierfür sind das vonStreptomyces carcinostaticussezernierteNeocarzinostatin[68],dieCalicheamicineausMicromonospora echinospora[69],dieEsperamicineausActinomadura verrucospora[70]und dasDynemicinausMicromonospora chersina.[71]
Vorkommen im Weltall
[Bearbeiten|Quelltext bearbeiten]
In den protoplanetaren NebelnCRL 618undCRL 2688wurden Acetylen, Butadiin (Diacetylen) und Hexatriin (Triacetylen) nachgewiesen.[72]In derAtmosphäredesSaturnmondsTitanwurden ebenfalls Acetylen und Diacetylen, sowie Propin nachgewiesen.[73][74]Auch iminterstellaren Raumwurden diverse Alkine nachgewiesen, darunter Ethin, Propin, Diacetylen, 1,3-Pentadiin, Hexatriin, sowieCyanoacetylenund diverseCyanopolyinemit zwei bis fünf konjugierten Dreifachbindungen.[75]
-
Diacetylen
-
Pentadiin
-
Cyanotriacetylen, ein Cyanopolyin
Nomenklatur
[Bearbeiten|Quelltext bearbeiten]Gemäß den Regeln der IUPAC werden Verbindungen mit Dreifachbindungen im Allgemeinen alsAcetylenebezeichnet[76],während der BegriffAlkinenur für eine eng umgrenzte Gruppe von Verbindungen gilt, die acyclisch (offenkettig) sind, exakt eine C≡C-Dreifachbindung aufweisen und demnach die Summenformel CnH2n–2besitzen.[77][78]Acyclische verzweigte oder unverzweigte Kohlenwasserstoffe mit mehr als einer Dreifachbindung werden als Alkadiine, Alkatriine usw. bezeichnet.[77]Entgegen den IUPAC-Regeln wird jedoch auch der BegriffAlkineim weiteren beziehungsweise allgemeinen Sinn gebraucht.[79][80]
Die Benennung der Alkine nach denIUPAC-Regeln orientiert sich an den Namen für die Alkane. Als Stammnamen für das Alkin wählt man den Wortstamm des Alkans mit gleicher Anzahl an Kohlenstoffatomen und ersetzt die Endsilbe-andurch-in.Bei verzweigten Alkinen gibt die längste mögliche Kohlenstoffkette mit der Dreifachbindung den Stammnamen. Die Lage der Dreifachbindung wird mit einer vorgestellten Zahl beschrieben, sodass diese möglichst klein ist z. B. 1-Butin (statt 3-Butin) für H–C≡C–CH2–CH3und 2-Pentin (statt 3-Pentin) für H3C–C≡C–CH2–CH3.Enthält die Kohlenstoffkette mehrere Dreifachbindungen, so fügt man im Namen vor der Silbeindie Silbedi,tri,tetrausw. ein. So erhält ein Alkin mit fünf (griechischpenta) C-Atomen und zwei Dreifachbindungen nach dem 1. und 4. C-Atom denIUPAC-Namen1,4-Pentadiin(H–C≡C–CH2–C≡C–H). Das strukturisomere 1,3-Pentadiin hat demnach folgende Struktur: H–C≡C–C≡C–CH3.Gibt es für eine Verbindung mit einer Doppel- und einer Dreifachbindung zwei unterschiedliche Benennungsmöglichkeiten mit dem gleichen Lokantensatz (Zahlenkombination), z. B. bei H–C≡C–CH2–CH=CH2dann erhält die Doppelbindung die kleinere Ziffer, sodass der korrekte NamePent-1-en-4-in[S 4](statt Pent-4-en-1-in) ist.[18]
Herstellung
[Bearbeiten|Quelltext bearbeiten]Alkine können analog zu Alkenen durchEliminierungsreaktionengewonnen werden.[18]Aus terminalen Alkinen können außerdem komplexere Alkine aufgebaut werden, beispielsweise durchAdditions-oderSubstitutionsreaktionenoder durch eineSonogashira-Kupplung,siehe Abschnitt Reaktionen terminaler Alkine.
Eliminierung
[Bearbeiten|Quelltext bearbeiten]Alkine erhält man durchDehydrohalogenierungvon Dihalogenalkanen oder Alkenylhalogeniden mit verschiedenenBasen.[81][20]Beispielsweise können diese durch Eliminierung vonBromwasserstoffaus einem Alkenylbromid mit geeignetem Substitutionsmuster gewonnen werden. Die beiden Atome müssen antiperiplanar zueinander stehen, das heißt jeweils eines an jedem Atom der Doppelbindung, in (E)-Stellung. Die zweifache Eliminierung aus einem Dihalogenalkan (z. B. 1,2-Dibromalkan) mit einemAlkenylhalogenidals Zwischenstufe ist ebenfalls möglich. So kann durch Umsetzung von1,2-DibrompropanmitLithiumdiisopropylamidPropin gewonnen werden.[18][19]Andere geeignete Basen sindNatriumamidundKalium-tert-Butanolat.[18]Während der erste Eliminierungsschritt auch mit weniger starken Basen funktioniert, sind für den zweiten Schritt drastischere Reaktionsbedingungen nötig.[20]DurchHalogenierungund anschließende zweifache Dehydrohalogenierung kann ein Alken in ein Alkin überführt werden.[18]Beispielsweise kannÖlsäureinDichlorstearinsäureoderDibromstearinsäureüberführt werden, deren zweifache DehydrohalogenierungStearolsäureergibt.[82][83][84]

oder durch Bromierung Dibromstearinsäure (unten) erhalten werden.
Aus beiden Halogensäuren kann durch zweifache Dehydrohalogenierung
Stearolinsäure erhalten werden
Alkinsynthese nach Bourguel
[Bearbeiten|Quelltext bearbeiten]Bei derAlkinsynthese nach Bourguelwird zunächst2,3-Dibrom-1-propenmit einerGrignard-Verbindungumgesetzt. Anschließende Eliminierung mit Natriumamid führt zum Alkin.[85]
Herstellung aus Carbonylen
[Bearbeiten|Quelltext bearbeiten]
Es sind verschiedene Methoden bekannt, umCarbonyle,alsoAldehydeundKetonein Alkine umzuwandeln, wobei jeweils ein zusätzliches Kohlenstoffatom eingeführt wird. Bei derCorey-Fuchs-Reaktionwird zunächst ein Aldehyd mittelsTriphenylphosphinundTetrabrommethanzu einemgem-Dibromolefin umgesetzt. Eliminierung mittelsButyllithiumerzeugt ein Lithiumacetylid. Dieses kann durchHydrolysein ein terminales Alkin überführt werden oder mittelsKohlenstoffdioxidin eineCarbonsäure.[86][87]Eine Umsetzung mit anderenElektrophilenwieAlkylhalogeniden,Aldehyden und Epoxiden ist aber auch möglich.[86][88]Durch Verwendung einer geeigneten Base (Natriumhexamethyldisilazid) kann das Dibromolefin auch in ein Bromalkin überführt werden.[88]EineEintopfreaktionist unter Verwendung vonDibrommethyltriphenylphosphoniumbromidmöglich.[89]Der Vorteil dieser Reaktion ist die einfache Anpassbarkeit durch Verwendung eines bestimmten Elektrophils. Nachteil ist die Notwendigkeit zum Einsatz starker Basen sowie die schwierige Aufarbeitung durch Nebenprodukte wieTriphenylphosphinoxid.[86][88]Eine ähnliche Reaktion verwendetHexamethylphosphorsäuretrisamidundBromtrichlormethan,aus denen eingem-Dichloralken erzeugt wird.[88]
Bei derColvin-UmlagerungwirdTrimethylsilyldiazomethanoderDimethyldiazomethylphosphonat(DAMP) als Kohlenstoffquelle und Lithiumdiisopropylamid oder Butyllithium als Base eingesetzt.[86][90][91]Vorteil dieser Reaktion ist die Verwendung von Trimethylsilyldiazomethan, welches ein sehr einfaches und käuflich erhältliches Reagenz ist. Nachteil sind einerseits die Notwendigkeit zum Einsatz starker Basen und tiefer Temperaturen, andererseits dieNukleophiliedes Reagenzes durch die es inkompatibel mit diversen funktionellen Gruppen ist.[86]
Bei derSeyferth-Gilbert-Homologisierungwerden DAMP und Kalium-tert-Butanolat verwendet, bei der Weiterentwicklung nach Ohira und Bestmann das sogenannteOhira-Bestmann-Reagenz,aus dem DAMP durch Umsetzung mitKaliumcarbonatinMethanolin situgewonnen werden kann. Die Reaktion gelingt an Luft bei Raumtemperatur und ohne starke Basen. Vorteile sind die milden Bedingungen und einfache Aufarbeitung. Nachteil ist dabei, dass die Reaktion weder mit Ketonen noch mitα,β-ungesättigten Aldehyden funktioniert.[86]Das Ohira-Bestmann-Reagenz ist vergleichsweise teuer. Ein alternatives Reagenz, das statt einer Methylgruppe eine Phenylgruppe trägt, kann leicht durch Umsetzung von2-BromacetophenonmitTrimethylphosphitundMesylazid[S 5]hergestellt werden.[92]
Viele weitere Phosphorreagenzien zur Erzeugung von Alkinen aus Carbonylen sind ebenfalls bekannt.[88]
Herstellung von Polyinen
[Bearbeiten|Quelltext bearbeiten]Polyine werden oft durch Kombinationen von Eliminierungs- undKupplungsreaktionen(beispielsweise Glaser-Eglinton-Hay-Reaktionen) hergestellt.[30][33]
Polyine können außerdem durchLaserablationausGrafithergestellt werden, wobei in der Regel Gemische anfallen. Beispielsweise entstehen unter einerArgon-Propan-Atmosphäre Hexatriin,Octatetrainund weitere Polyine bis C14.[93]In wässriger Phase entstehen beispielsweise Hexatriin, Octatetrain undDecapentain.[94]Durch Laserablation aus suspendierten Grafit-Partikeln werden je nach Lösungsmittel andere Gemische enthalten. InHexanwerden vorwiegend Polyine mit C8bis C14erhalten. InBenzoloderToluolvor allem solche mit C10bis C16.[95]Durch einen Lichtbogen zwischen Grafit-Elektroden in Methanol oder Ethanol werden ebenfalls Polyine, insbesondere Octatetrain, erhalten.[96]
Herstellung von Cycloalkinen
[Bearbeiten|Quelltext bearbeiten]Cycloalkine mit größeren Ringgrößen können durch diverse Ringschlussreaktionen erzeugt werden, kleinere hingegen fast nur durch Eliminierungsreaktionen.[48]Beispiele für Ringschlussreaktionen, mit denen Cycloalkine erzeugt werden können, sind dieAlkinmetathese[97]und die Glaser-Kupplung.[98]Cyclische Diine können erzeugt werden aus einer Alkylkomponente, die zwei terminale Halogenatome trägt und einer Komponente, die zwei terminale Dreifachbindungen trägt. Durch Umsetzung mit Butyllithium wird ein Acetylid erzeugt, das mit dem Halogenid eine Substitutionsreaktion eingeht.[99]Ein Beispiel für eine Synthese durch Eliminierung ist die Herstellung von Cyclooctin durchBromierungund zweifache Dehydrobromierung vonCycloocten.[40]

Reaktionen der Alkine
[Bearbeiten|Quelltext bearbeiten]Alkine gehen viele charakteristische Reaktionen ein sowie diverse Reaktionen, die denen von Alkenen analog sind. Da Alkine in vielfältigen Reaktionen umgesetzt werden können und Ausgangsprodukte vieler Namensreaktionen sind, spielen sie eine wichtige Rolle in der organischen Synthese und wurden zum Beispiel für die Synthesen verschiedener Naturstoffe eingesetzt.
Hydrierung
[Bearbeiten|Quelltext bearbeiten]Alkine können analog zu Alkenen durchWasserstoffhydriertwerden. Mit den für Alken-Hydrierungen üblichen Katalysatoren (PalladiumoderPlatinaufKohle) werden dabei Alkane erhalten.[18][20]
Durch geeignete Reaktionsbedingungen können Alkine selektiv sowohl zu (Z)-Alkenen als auch zu (E)-Alkenen hydriert werden. Mit einemvergiftetenKatalysator, demLindlar-Katalysator,reagiert das Alkin nur zum Alken. Dabei entstehen ausschließlich (Z)-Alkene (cis), da sich die Wasserstoffatome von der gleichen Seite an das Alkin nähern und reagieren. Geeignete Katalysatorsysteme sind beispielsweise Palladium aufCalciumcarbonatmitBlei(II)-acetatals Katalysatorgift oder Palladium aufBariumsulfatmitChinolinals Katalysatorgift. Dabei dient jeweils das Katalysatorgift der Herabsetzung der katalytischen Aktivität. Die dabei verwendeten Unterlagematerialien sind ebenfalls wichtig. Da sie Produkte schneller freisetzen als die normalerweise verwendete Kohle, tritt weniger Überreaktion auf.[19]
Die Hydrierung zu einem (E)-Alken ist über eine radikalische Reaktion mit elementarem Natrium in flüssigemAmmoniakmöglich[19],mitLithiuminMethyl-,Ethyl-oderPropylamin[100]oder mit Natrium undtert-Butanolin Hexamethylphosphorsäuretrisamid.[101]Eine Alternative ist die Reduktion mitLithiumaluminiumhydridoderRed-Al,die jedoch nur funktioniert, wenn sich in der Nähe der Dreifachbindung ein Sauerstoffatom (z. B. eineHydroxylgruppe) befindet, das dasAluminiumkoordinieren kann.[19]
Elektrophile Addition
[Bearbeiten|Quelltext bearbeiten]Analog zu den Doppelbindungen in Alkenen können diverse Elektrophile an die Dreifachbindungen in Alkinen addiert werden. Beispielsweise können Alkine bromiert werden, wobei in der Regel ebenfalls einBromonium-Ionals Zwischenstufe entsteht.[19]
Hydrohalogenierung
[Bearbeiten|Quelltext bearbeiten]Alkine können mit Bromwasserstoff oderIodwasserstoffhydrohalogeniert werden. Allerdings ist die Reaktion mit Bromwasserstoff nicht selektiv, da eine radikalische Nebenreaktion auftritt, die nur durch Ausschluss von Licht und Sauerstoff sowie Zusatz einesRadikalfängersverhindert werden kann.Chlorwasserstoffist gegenüber den meisten Alkinen unreaktiv. Zusatz vonAluminiumoxidoderSilicazur Reaktion ermöglicht aber die selektive Hydrohalogenierung mit Chlorwasserstoff und Bromwasserstoff.[102]Solche Hydrohalogenierungen sind im Allgemeinen aber nicht stereoselektiv, da (E)- und (Z)-Isomer im Gleichgewicht vorliegen, wobei zuerst das kinetisch vorteilhafte (Z)-Isomer entsteht, das aber überwiegend zum thermodynamisch stabileren (E)-Isomer isomerisiert.[102][103]Chlorwasserstoff oder Bromwasserstoff kann für die Reaktionin situgewonnen werden aus Vorläufermolekülen wieThionylchlorid,Oxalylchlorid,Oxalylbromid,PhosphortribromidoderAcetylbromid.[103]
Hydratisierung
[Bearbeiten|Quelltext bearbeiten]DieOxymercurierungvon Alkinen ergibtEnole,die sich zügig zu Ketonen umlagern. Aus terminalen Alkinen können soMethylketonegewonnen werden.[19][20][103]Aus internen Alkinen entstehen im Regelfall zwei regioisomere Ketone.[103]Addition vonEssigsäurean Alkine ergibt Enolacetate, die schnell hydrolysieren und sich dann ebenfalls zu Ketonen umlagern.[104]DieHydroborierungvon Alkinen erfordert geeigneteBoran-Reagenzien, um Polymerisationen als Nebenreaktionen zu vermeiden. Geeignet ist zum BeispielCatecholboran.Das entstehende Alkenylboran kann je nach Reaktionsbedingungen in weitere nützliche Verbindungen überführt werden: Mit Wasser in eineAlkenylboronsäure,mit Brom und einer Base in ein Alkenylbromid, mitWasserstoffperoxidüber ein Enol in ein Keton und mit Essigsäure in ein (Z)-Alken.[103]
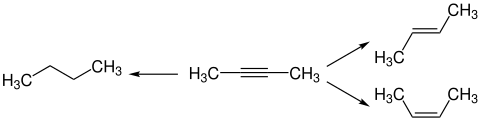
Alkin-Zipper-Reaktion
[Bearbeiten|Quelltext bearbeiten]Die Alkin-Zipper-Reaktion ist eine Isomerisierung, durch die mittelsKalium(3-aminopropylamid)(hergestellt aus1,3-DiaminopropanundKaliumhydrid) interne Alkine zu terminalen Alkinen umgesetzt werden können, die wichtige synthetische Intermediate sind.[6][105]Eine ähnliche Isomerisierung mit verschiedenen starken Basen wurde erstmals Ende des 19. Jahrhunderts beschrieben, allerdings ermöglichte diese nur die Wanderung einer Dreifachbindung über ein bis zwei Bindungen bei sehr hohen Temperaturen und langen Reaktionszeiten, während die moderne Reaktion auch eine Wanderung über zehn Bindungen bei 0 °C in sehr kurzen Reaktionszeiten (z. T. innerhalb von Sekunden) ermöglicht.[6][106]Die Isomerisierung zu einem terminalen Alkin ist thermodynamisch ungünstig, allerdings fällt durch Deprotonierung des terminalen Alkins ein Acetylid-Salz aus, was die Triebkraft der Reaktion darstellt.[105][106]Mit dem analogen Natriumreagenz ist die Reaktion ebenfalls möglich, wodurch die Verwendung von gefährlichem Kaliumhydrid vermieden werden kann, allerdings funktioniert diese Reaktion erst bei höheren Temperaturen von 50-60 °C und erfordert längere Reaktionszeiten.[6][105]Die Methode wurde in diversenNaturstoffsynthesenverwendet, beispielsweise vonMuscon[107]und von(9Z, 25S, 26R, 43Z)-25,26-Epoxy-9,43-henpentacontadien,einemPheromonder KakerlakeNauphoeta cinerea.[108]Eine Synthese von Avocadin ging von einer Propargylverbindung und1-Iodundecanaus; durch anschließende Isomerisierung wurde die terminale Dreifachbindung aufgebaut.[109]Bei einer Synthese verschiedenerMycolsäurenwurde das kommerziell erhältliche3-Heptin-1-olals Edukt in das terminale Isomer6-Heptin-1-olüberführt.[110]

Cyclisierungen
[Bearbeiten|Quelltext bearbeiten]Anhand derBaldwin-Regeln[111]und darauf aufbauender weiterentwickelter Regeln lässt sich vorhersagen, ob eine Cyclisierungsreaktion geometrisch vorteilhaft ist. Dies hängt maßgeblich davon ab, welchen Hybrisierungszustand das beim Ringschluss angegriffene Atom hat (bei Dreifachbindungen sp, was alsdig,für digonale Geometrie bezeichnet wird), welche Größe der gebildete Ring hat und ob eine dabei gebrochene Bindung Teil des Rings wird (bei Dreifachbindungen ist dies eine Doppelbindung, die durch Bruch der zweiten π-Bindung entsteht).[112][113][114]Ein Beispiel für eine Cyclisierungsreaktion mit derart vorhersehbarer vorteilhafter Geometrie ist der durchGold(I) katalysierte Aufbau desPyridinringsmitexocyclischer Doppelbindungbei der Totalsynthese vonConolidin.[115]
Durch eine stufenweiseCyclotrimerisierungkann aus drei Alkinmolekülen ein aromatischer Ring aufgebaut werden.[116]Dabei handelt es sich um eine konvergente,atomeffizienteMethode, um insbesondere hochsubstituierte Aromaten herzustellen, allerdings ist dieRegioselektivitätoft schwierig zu kontrollieren, insbesondere, wenn zwei oder sogar drei unterschiedliche Alkinkomponenten verwendet werden.[117]Als Katalysator für Cyclotrimerisierungen wird insbesondereRutheniumverwendet.[116][117]
Durch Umsetzung von Alkinen mitNitriloxidenkönnenIsoxazolegewonnen werden.[19]Auch andere 1,3-dipolare Cycloadditionen von Alkinen spielen eine Rolle, zum Beispiel die Addition von Aziden und dieOzonolyse,siehe unten.
Diels-Alder-Reaktionen
[Bearbeiten|Quelltext bearbeiten]Werden beiDiels-Alder-Reaktioneneine oder mehrere Doppelbindungen der Edukte durch Dreifachbindungen ersetzt, ergibt die Reaktion gespannte cyclischeAllene,die sich im Allgemeinen weiter umlagern, z. B. durch Wanderungen von Wasserstoffatomen, wodurch die Ringspannung reduziert wird. Während die normale Diels-Alder-Reaktion fast immer ein konzertierter thermischer Prozess ist, sind Diels-Alder-Reaktionen mit Alkinen oft mehrstufig und es sind sowohl thermische als auchphotochemischeReaktionen bekannt, wobei letztere typischerweise bei Raumtemperatur ablaufen. Im Allgemeinen entstehen als Endprodukte aromatische Ringe, bei der Umsetzung eines Diens mit einem Alkin über die Zwischenstufe eines1,4-Cyclohexadiens.[118][119]Bei Umsetzung eines Diins mit einem Alkin entsteht ein hochreaktives Arin.[119][120]Diels-Alder-Reaktionen von Alkinen können beispielsweise zum Aufbau vonpolycyclischen aromatischen Verbindungengenutzt werden.[121]
Pauson-Khand-Reaktion und Dötz-Reaktion
[Bearbeiten|Quelltext bearbeiten]DiePauson-Khand-Reaktionermöglicht die Synthese einesCyclopentenonsaus einem Alken, einem Alkin undKohlenmonoxidmittelsDicobaltoctacarbonyl.Die Reaktion benötigt oft hohe Temperaturen, vermutlich wegen der nötigen Abspaltung eines Kohlenmonoxid-Liganden, durch den eine Bindung des Alkens oder Alkins an dasCobaltmöglich wird. Durch Zugabe eines tertiärenAminoxids(z. B.N-Methylmorpholin-N-oxidoderTrimethylaminoxid), kann ein Kohlenmonoxidligand als Kohlendioxid abgespalten werden und die Reaktion ist unter deutlich milderen Bedingungen möglich.[122]
Bei der 1975 entdecktenDötz-Reaktionhandelt es sich formal um eine [3+2+1]-Cycloaddition. Edukte sind einα,β-ungesättigtesFischer-Carben(mit Aryl- oder Vinylgruppe) und ein Alkin. Durch Einbau eines Kohlenmonoxid-Moleküls entsteht einChinon.Die Reaktion hat große Bedeutung bei der Synthese von Naturstoffen mit einer1,4-Naphthochinon-Struktureinheit.[123]
Bergman-Cyclisierung und verwandte Reaktionen
[Bearbeiten|Quelltext bearbeiten]Eine spezielle Reaktion von Endiinen ist die Bergman-Cyclisierung, bei der sich diese Struktur zu einemBenzol-1,4-Diradikalumlagert.[124]DieAktivierungsenergiehängt dabei stark von der konkreten Struktur ab.[125]Während die 1972 von Bergman beschriebene Reaktion vonHexa-1,5-diin-3-enhohe Temperaturen benötigt[126],können verschiedene Naturstoffe, die später entdeckt wurden und ebenfalls eine Endiin-Struktur aufweisen, eine solche Reaktion schon bei Raumtemperatur eingehen.[125]Verschiedene Faktoren spielen eine Rolle für die Aktivierungsenergie, darunter der Abstand zwischen den beiden Dreifachbindungen, Substituenten an den Dreifachbindungen und ein Abbau von Ringspannung.[67][124]Letzteres ist zum Beispiel bei der Bergman-Cyclisierung von Calicheamicin γ1wichtig.[67]
Bei der verwandtenMoore-Cyclisierung,die ebenfalls über ein Diradikal verläuft, reagiert einEnin-Ketenzu einem Chinon.[127]Eine analoge Reaktion ohne Beteiligung von Sauerstoffatomen ist dieMyers-Cyclisierung,bei der ein Enin-Allen zu einem Benzol-Ring reagiert.[128]
Oxidationen
[Bearbeiten|Quelltext bearbeiten]Durch bestimmteOxidationsmittelwieKaliumpermanganatoderRuthenium(IV)-oxidmitNatriumperiodatkönnen Alkine zuDionenoxidiert werden.[103]Eine oxidative Spaltung ist ebenfalls möglich, beispielsweise mitChromsäure[20],durch Ozonolyse, sowie mitRuthenium(VIII)-oxidoderOsmium(VIII)-oxid.[129]Eine weitere Methode der oxidativen Spaltung verwendetEisen(III)-chloridundtert-Butylhydroperoxid.[130]Im Allgemeinen entstehen bei solchen oxidativen Spaltungen Carbonsäuren, aber unter bestimmten Bedingungen können auch Carbonsäureester oderCarbonsäureamideerhalten werden.[129]
Metathesen
[Bearbeiten|Quelltext bearbeiten]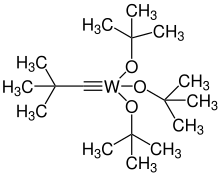
Bei der Alkinmetathese werden analog zurOlefinmetathesezwischen zwei Alkinen die Enden der Dreifachbindungen getauscht.[97]Die erste solche Reaktion, die beschrieben wurde, nutzte einen heterogenen Katalysator ausWolfram-Oxidenauf Silica und funktionierte nur bei hohen Temperaturen über 200 °C.[97][131]Die erste Reaktion mithomogenem Katalysatorwurde von Mortreux beschrieben, derp-TolylphenylacetylenmitMolybdänhexacarbonylundResorcinumsetzte, wodurchDiphenylacetylenundDi-p-tolylacetylenerhalten wurden.[97][132]Die meisten Katalysatoren der Alkinmetathese sind gegenüber Alkenen unreaktiv. Der Mechanismus besteht in einer [2+2]-Cycloaddition undCycloreversionmit einem Metallacyclobutan als Intermediat. Ein typischer Katalysator istTri-tert-butoxy(tert-butylmethylidin)wolfram(VI),das kommerziell erhältlich ist. Die Alkinmetathese kann auch in Form einer Ringschlussmetathese durchgeführt werden. Bei Alkenmetathesen ist eine Stereoselektivität oft schwierig zu erzielen. Mit einer Alkinmetathese und Lindlar-Hydrierung ist hingegen problemlos ein (Z)-Alken zu erhalten. Sie wurde daher für diverse Totalsynthesen eingesetzt.[97]Beispiele für Naturstoffe, die so synthetisiert wurden, sindZibeton[133],sowieAmbrettolidundYuzu-Lacton.[134]
Bei derEnin-Metathesewerden ein Alken und ein Alkin zu einem1,3-Dienumgesetzt. Die Reaktion ist mit der Olefin-Metathese verwandt und in vielen Fällen kommen dieselben Katalysatoren wie bei Olefinmetathesen zum Einsatz, z. B.Grubbs-Katalysatoren.Eines der wichtigsten Einsatzgebiete dieser Reaktion ist die Synthese von cyclischen Molekülen. Die Methode wurde für verschiedene Naturstoffsynthesen eingesetzt, zuerst vonStemoamid[135],außerdem zum Beispiel vonAnatoxin A.[136][137]
Polymerisationen
[Bearbeiten|Quelltext bearbeiten]Acetylengas kann mit Titan(IV)-butanolat und Triethylaluminium als Katalysator zu Polyacetylen polymerisiert werden.[12]Diverse Reaktionen von Alkinen können mit geeignetenMonomerenzur Herstellung von Polymeren verwendet werden, beispielsweise die Sonogashira-Kupplung und die Glaser-Hay-Kupplung.[138]Polykupplungenvon Alkinen können beispielsweise mitKupfer(I)-chloridoderIndium(III)-chloridkatalysiert werden.[139]DiePolyadditionvon Nukleophilen an Alkine ist eine einfache Methode zur Herstellung von Vinylen-Polymeren.[138]Durch Polycyclotrimerisierung (z. B. mittelsTantal(V)-chloridundTetraphenylstannanoder mittelsTantal(V)-bromid) können hyperverzweigte Netze aus aromatischen Ringen aufgebaut werden.[140]Auch eine Polymerisation durch Click-Chemie ist mit geeigneten Monomeren möglich.[141][142]
Nicholas-Reaktion
[Bearbeiten|Quelltext bearbeiten]Bei derNicholas-Reaktionwird ein Dicobalthexacarbonylkomplex eines Propargylalkohols mit Säure umgesetzt, wodurch ein Propargylkation erhalten wird. Dieses kann anschließend mit diversen Nucleophilen umgesetzt werden, darunterAlkohole,Amine,Thiole,Aluminiumalkyle,Hydridüberträger(wieTributylzinnhydridoderNatriumborhydrid), Silylenolether oderAllyltributylzinn.[143]
Reaktionen von Cycloalkinen
[Bearbeiten|Quelltext bearbeiten]Inpericyclischen Reaktionenmit Aziden werden typischerweise terminale Alkine unter Kupferkatalyse verwendet (s. u.), es sind jedoch auch kupferfreie Varianten mit Cyclooctinen bekannt, wobei die Triebkraft der Abbau von Ringspannung ist.[42]Durch die Geometrie in Cycloalkinen ist die Dreifachbindung nicht mehr symmetrisch; stattdessen ergeben sich Angriffsvektoren orthogonal zur Ringebene, von außerhalb des Rings, sowie von innerhalb des Rings, wodurch auchtransannulare Reaktionenmöglich sind.[48]Beispielsweise kann in5-Cyclodecinondas Sauerstoffatom der Carbonylgruppe unter Säurekatalyse die Dreifachbindung nucleophil angreifen, wodurch nach einer Umlagerung Bicyclo[4.4.0]-1(6)-decen-2-on entsteht.[144]
Reaktionen terminaler Alkine
[Bearbeiten|Quelltext bearbeiten]Terminale Alkine, also solche, die an einem Kohlenstoffatom der Dreifachbindung ein Wasserstoffatom tragen, gehen einige Reaktionen ein, die mit anderen Alkinen nicht möglich sind.
Sonogashira-Kupplung
[Bearbeiten|Quelltext bearbeiten]Die im Jahr 1975 entdeckte Sonogashira-Kupplung ist eine palladium-katalysierte Kupplungsreaktion, die die Kupplung eines terminalen Alkins mit einemArylhalogenidoderVinylhalogenidermöglicht, und hat in der organischen Synthese eine große Bedeutung zur Knüpfung von C–C-Bindungen.[145][146]Als Edukte eignen sich Iodide, Bromide und Chloride, aber auchTriflate.[145]Als Produkte werdenArylalkineoder Enine erhalten.[146]Als Katalysator dienen Palladium(0)-spezies, diein situerzeugt werden, zum Beispiel ausTetrakis(triphenylphosphin)palladium(0)oderBis(triphenylphosphin)palladium(II)-chlorid.[145]Zusätzlich wird eine Base benötigt, die jedoch in vielen Fällen auch direkt als Lösungsmittel verwendet werden kann.[145][146]In dieser Variante benötigt die Reaktion oft höhere Temperaturen bis zu 100 °C.[146]Durch Zusatz einesKupfer-Katalysators (z. B.Kupfer(I)-iodid) ist die Reaktion jedoch auch bei Raumtemperatur möglich, dann muss allerdings unter Luftausschluss gearbeitet werden, um eine Glaser-Kupplung alsNebenreaktionzu vermeiden.[145][146]Die gewonnenen Arylalkine können synthetisch verschiedentlich weiterverwendet werden, zum Beispiel durch Hydrierung zu Alkanen und Alkenen oder zur Bildung vonHeterocyclen(wieBenzofuranen,IndolenundIsochinolinen).[147]Die Sonogashira-Kupplung wurde auch zur Synthese vieler Naturstoffe verwendet[147]wieDesmosin[148],Pyrrhoxanthin[149][S 6]und Calicheamicin γ1.[147]
Glaser-Kupplung und verwandte Reaktionen
[Bearbeiten|Quelltext bearbeiten]Carl Glaserentdeckte 1869 inBonn,dassPhenylacetylenunter Einwirkung von Kupfer(I)-chlorid und Luftsauerstoff zuDiphenyldiacetylendimerisiert.[7]Die Glaser-Kupplung, bei der unter Kupfer-Katalyse und Einwirkung von Luftsauerstoff zwei terminale Alkine zu einem 1,3-Diin gekoppelt werden, war eine der ersten metall-katalysierten Kupplungsreaktionen.[150][151]Verwendet wurde die Glaser-Kupplung beispielsweise in einer frühen Synthese desIndigo.[7]Diese Reaktion wurde später weiterentwickelt:1956beschriebEglintoneine effizientere Reaktion mitKupfer(II)-acetatundPyridinin Methanol. 1962 beschrieb Hay eine Reaktion unter Verwendung von Kupfer(I)-chlorid undTMEDAan Luft. TMEDA verbessert die Löslichkeit der beteiligten Kupferverbindungen und damit das Reaktionsergebnis.[7][152][153]Eine solche modifizierte Reaktion wird daher auch als Glaser-Eglinton-Hay-Reaktion bezeichnet.[153]Inzwischen wurden diverse ähnliche Reaktionen mit anderen Katalysatormetallen beschrieben, darunter Palladium,Nickel,Silberund Gold.[154]Glaser-Kupplungen eignen sich zum Beispiel für die Synthese molekularer Knoten[155]und anderermakrocyclischer Verbindungen.[98]
Bei derCadiot-Chodkiewicz-Reaktionwird ein terminales Alkin mit einem Bromalkin zu einem Diin umgesetzt. Dabei kommt Kupfer(I) (i. d. R. als Halogenid) zum Einsatz, sowie eine Base (z. B. Ethylamin), um entstehenden Bromwasserstoff abzufangen. Zusätzlich kannHydroxylaminhydrochloridals Reduktionsmittel zugesetzt werden, das eine oxidative Homokupplung verhindert.[156]Bei derStephens-Castro-Kupplungwird ein Kupferacetylid mit einem Arylhalogenid oder Vinylhalogenid gekuppelt. Wird ein Arylhalogenid mit einem Stickstoff- oder Sauerstoffatom in ortho-Position verwendet (z. B.2-Iodanilin), erfolgt eine Cyclisierung zu einem Indol oder Benzofuran.[157]
Click-Reaktionen
[Bearbeiten|Quelltext bearbeiten]Die kupfer(I)-katalysierte Umsetzung eines terminalen Alkins mit einem Azid zu einemTriazol,eine Variante derHuisgen-Reaktion,die auch alsSharpless-Click-Reaktionbezeichnet wird, ist die prototypische Reaktion der Click-Chemie.[158][159][160]Kupfer(I) kannin situausKupfer(II)-sulfatund einemReduktionsmittelerzeugt werden.[19]Die Edukte, Azide und Alkine sind leicht darstellbar, kinetisch stabil und vertragen sich mit vielen funktionellen Gruppen und Reaktionsbedingungen.[158]Die Reaktion verläuft in der Regel hochselektiv, praktisch quantitativ (typischerweise über 95 % Umsatz) und erfordert keine aufwendige Aufarbeitung.[158][159]Die Reaktion läuft außerdem bei niedrigen Temperaturen ab, oft bei Raumtemperatur, und kann in Wasser als Lösungsmittel durchgeführt werden.[159][160]
Durch ihre vorteilhaften Eigenschaften spielt diese Reaktion eine wichtige Rolle inbioorthognaler Chemie,bei der Reaktionen an Biomolekülen mit minimaler Interferenz durchgeführt werden können. Sie ermöglichen die Verkettung vonBiomolekülen(Peptide,Proteine,Kohlenhydrate) oder deren Modifikation mitFlurophoren,ChlelatorenoderIsotopenmarkierungen.Dadurch ist auch dasLabelingvon Biomolekülenin vivomöglich.[158]Auch im Bereich derMaterialwissenschaftenfindet die Technik Verwendung: Beispielsweise konnte eine mit11-Azidoundecanthiol[S 7]funktionalisierte Goldoberfläche mitEthinylferrocen[S 8]weiterfunktionalisiert werden. Sie ist außerdem in dersupramolekularen Chemieund zur Funktionalisierung von Polymeren von Bedeutung.[159]Click-Reaktionen eignen sich auch für diekombinatorische SynthesevonMolekülbibliothekenfür die pharmazeutische Forschung.[160]
Halogenierung terminaler Alkine
[Bearbeiten|Quelltext bearbeiten]Acetylide können mit verschiedenen Reagenzien wie Chlor, Brom, Iod,Bromcyan,Iodcyan,N-ChlorsuccinimidoderN-Bromsuccinimidhalogeniert werden. MitNatriumhypochloritoderNatriumhypobromitist eine direkte Halogenierung terminaler Alkine möglich.[156]
Terminale Alkine als Nucleophile
[Bearbeiten|Quelltext bearbeiten]
Terminale Alkine sind Nucleophile, die an verschiedene Carbonyl- und Carboxylverbindungen addiert werden können. Eine Addition an ein Aldehyd ist zum Beispiel durch einen Silberkatalysator (Tricyclohexylphosphinsilber(I)-chlorid) möglich oder durch einen Mischkatalysator ausRuthenium(III)-chloridundIndium(III)-acetat.[161]Eine weitere Alternative ist die Katalyse mitZinktriflat.[19]Die Addition anSäurechloridekann zum Beispiel mit einem Palladium-Kupfer-Katalysatorsystem durchgeführt werden. Auch Additionen anImineundIminium-Ionen,sowie1,4-Additionen(z. B. anVinylketone) sind möglich.[161]
Durch starke Basen können terminale Alkine quantitativ deprotoniert werden.[156]Möglich ist dies beispielsweise mitLithiumalkylen(wie Butyllithium), mit Natriumamid, mit Lithiumdiisopropylamid oder mit Grignard-Verbindungen (wieEthylmagnesiumbromid).[18][19]Mit den meisten Basen läuft die Deprotonierung schnell ab, mit Grignardverbindungen dauert sie hingegen länger.[156]Auch eine Deprotonierung mit elementarenAlkalimetallenist möglich, wobei Wasserstoff-Gas als Nebenprodukt anfällt.[20]In deprotonierter Form können terminale Alkine leichtalkyliertwerden, beispielsweise mit Epoxiden (wieEthylenoxid), Aldehyden und Ketonen, sowie Alkylhalogeniden (wieAlkylbromiden).[18][19][20]Die Alkylierung funktioniert allerdings im Falle der Alkylhalogenide meistens nur mit Methylhalogeniden und primären Alkylhalogeniden, da das Alkinyl-Anion gegenüber sterisch anspruchsvolleren sekundären und tertiären Alkylhalogeniden als Base wirkt.[18]Liegt das Alkin jedoch in Form eines Trialkinylaluminiumreagenzes vor, ist hingegen auch eine Alkylierung mit sekundären und tertiären Alkylresten möglich.[156]
Kupfer- und Silber-Alkinylide können durch Umsetzung terminaler Alkine mit den Ammoniak-Komplexen von Kupfer(I)-chlorid oderSilbernitratgewonnen werden. Sie fallen dabei als roter bzw. weißer Niederschläge aus, was sich als Nachweisreaktion eignet. Für synthetische Anwendungen sind sie aufgrund ihrer Brisanz weniger geeignet.[20]
Die Umsetzung von Acetylen mit einem ÜberschussKaliumhydroxidund einem Keton zu einem Propargylalkohol wird alsFavorski-Reaktionbezeichnet.[162]
Weitere Reaktionen terminaler Alkine
[Bearbeiten|Quelltext bearbeiten]Terminale Alkine sind auch Elektrophile.[18][19]Durch Aktivierung mit einer Gold(I)- oder Gold(III)-verbindung (z. B.Gold(I)-chlorid) können Nukleophile wie Wasser an terminale Alkine addiert werden.[19]AuchNormant-Cupratekönnen (selbst ohne Aktivierung) an terminale Alkine addiert werden, wobei Alkenylkupfer-Spezies entstehen. Diese können durch saure Aufarbeitung protoniert oder mit anderen Elektrophilen umgesetzt werden, beispielsweise mit Iod,Chlorcyanoder Ethylenoxid.[103]
Durch Umsetzung mitSilbercarbonatundTrimethylsilylazidkönnen terminale Alkine inNitrileüberführt werden.[163]Durch Umsetzung mit katalytisch Kalium-tert-butanolat können terminale Alkine (1-Alkine) in interne Alkine (2-Alkine) isomerisiert werden. Auch Isomerisierungen zu Allenen sind bekannt, diese haben jedoch meist keine synthetische Bedeutung, weil sie schlecht zu trennende Gemische von Produkten ergeben.[156]
Schutzgruppen für terminale Alkine
[Bearbeiten|Quelltext bearbeiten]Terminale Alkine können mit einerTrimethylsilylgruppegeschütztwerden.[19][156]Hierfür wird die Verbindung zunächst mit einer starken Base deprotoniert und dann mitTrimethylsilylchloridumgesetzt.[19]Trimethylsilyl- undTrimethylgermanylgruppeneignen sich als orthogonale Schutzgruppen, da erstere selektiv mitKaliumfluoridund[18]Krone-6und letztere selektiv mitKupfer(I)-bromidentschützt werden kann.[164]Eine alternative Schutzgruppe ist ein Diphenylphosphinoxid, das durch Umsetzung mitChlordiphenylphosphinund Oxidation mit Wasserstoffperoxid eingeführt und mit Kalium-tert-butanolat entfernt werden kann.[165]
Alkine als Komplexliganden
[Bearbeiten|Quelltext bearbeiten]Alkine bilden Komplexverbindungen mit verschiedenen Übergangsmetallen in diversen Bindungsmodi, was oft auch einen erheblichen Einfluss auf die Bindungssituation im Liganden hat, beispielsweise eine Abweichung des Bindungswinkels von der Linearität.[48]Acetylid-Ionen bilden Komplexe unter anderem mitMangan,Eisen,Cobalt, Nickel und Kupfer. Diese weisen überwiegend dieselben Stöchiometrien, Farben undmagnetischen Eigenschaftenauf wie die analogen Cyanid-Komplexe, sind aber explosiv und sehr pyrolyseempfindlich.[166]Von Platin ist eine große Anzahl an Komplexen mit Alkinliganden bekannt, darunter sowohl η1- als auch η2-Komplexe.[167]AuchRhodium-Alkin-Komplexe sind bekannt.[168]Durch Komplexierung können stark gespannte Cycloalkine stabilisiert werden. Cyclopentin, Cyclohexin und Cycloheptin sind als freie Verbindungen nicht isolierbar, sind aber als Liganden von Übergangsmetallen wieZirconium,Nickel, Platin oderOsmiumbekannt.[37]Beispielsweise können ausgehend von1-Bromcyclohexenund1-Bromcycloheptendurch Eliminierung mit Lithiumdiisopropylamid in Gegenwart vonTris(triphenylphosphin)platin(0)die entsprechenden Cycloalkin-Platinkomplexe gewonnen werden.[169]Auch durch Reduktion von1,2-Dibromcyclopentenund1,2-DibromcyclohexenmitNatriumamalgamin Gegenwart dieses Platinkomplexes, können entsprechende Komplexe der Cycloalkine erzeugt werden.[170]
Bedeutung und Verwendung
[Bearbeiten|Quelltext bearbeiten]Von großer technischer Bedeutung sind unter den Alkinen lediglich Acetylen und Propin. Etwa drei Viertel dieser beiden Verbindungen werden zur Synthese, vor allem für Polymerisationsreaktionen, eingesetzt.[171]Insbesondere die Monomere Vinylchlorid, Vinylacetat und Acrylsäure werden z. T. noch aus Acetylen hergestellt, obwohl ein Großteil der Weltproduktion dieser Verbindungen heutzutage aus billigerem Ethylen (bzw.Propylenim Fall der Acrylsäure) hergestellt wird. Der größte Produzent von Acetylen (sowie mit 80 % der weltweiten Produktion der größte Verbraucher) istChina,wo nach 2010 noch neue Anlagen zur Herstellung von Acetylen über Calciumcarbid in Betrieb genommen wurden.[9]Bei der Produktion von anderen Alkinen ist Acetylen nach wie vor die wichtigste Ausgangsverbindung, z. B. bei Butindiol, das selbst wiederum ein wichtiger Vorläufer für die Herstellung von Tetrahydrofuran (THF) ist.[9][172]
Acetylen-Sauerstoff-Flammen werden mit bis zu 3100 °C extrem heiß, weshalb Acetylen für Schweiß- und Schneidbrenner verwendet wird.[9][171]Je nach Verhältnis von Sauerstoff zu Acetylen ergibt sich eine oxidierende Flamme (z. B. zum Schweißen vonMessing,sowie zum Schneiden von Werkstoffen und Härten von Oberflächen) oder eine reduzierende Flamme (z. B. zum Schweißen vonStahl,Kupfer und Aluminium).[9]
Aufgrund der Giftigkeit vonHydrazinwerden verstärkt weniger bedenklicheRaketentreibstoffeerforscht. Auch einhypergolesGemisch aus Propin und Wasserstoffperoxid ist ein Kandidat hierfür.[173]Acetylen wirkt auf Pflanzen ähnlich wie das Reifungshormon Ethylen, daher wird aus Calciumcarbid erzeugtes Acetylen teilweise als Reifungsbeschleuniger verwendet, z. B. im Vertrieb vonBananen.[174][175]
-
Die Monomere diverser technischer Polymere werden aus Acetylen hergestellt, zum Beispiel Vinylchlorid als Monomer für Polyvinylchlorid, aus dem z. B. Rohre produziert werden
-
THF wird ausgehend von Acetylen produziert
-
Durch Verbrennung von Acetylen kann eine sehr heiße und helle Flamme erzeugt werden, die z. B. zum Schweißen verwendet wird
-
Acetylen wird als Reifungsbeschleuniger verwendet, z. B. für Bananen
Alkine in der Medizin
[Bearbeiten|Quelltext bearbeiten]Ethinylgruppen dienen imWirkstoffdesignverschiedenen Zwecken. Eine solche Dreifachbindung verhält sichisosterzu diversen anderen Gruppen. Hinsichtlich derπ-Elektronenweist sie Ähnlichkeit mit sechsgliedrigen oder auch kleineren aromatischen Ringen auf. Elektrostatisch verhält sich die Ethinylgruppe ähnlich zu Chlor-, Brom- oder Iodsubstituenten und ist bei letzterem auch in der Länge ähnlich. Diese Alkingruppen ermöglichen die Steuerung von Moleküleigenschaften und dadurch indirekt die von pharmakologischen Parametern wieBioverfügbarkeit,Target-Selektivitätund metabolische Stabilität von Wirkstoffen. Die Ethinylgruppe ist außerdem geometrisch ähnlich zurNitrilgruppe.Allerdings ist gegenüber dieser einerseits die elektronenziehende Eigenschaft der Ethinylgruppe schwächer ausgeprägt[10]sowie andererseits die Elektronendichte am Wasserstoffatom geringer.
Terminale, aber auch internale Dreifachbindungen eignen sich als „Gefechtskopf“(Reaktionszentrum) fürkovalente Inhibitoren.Eine terminale Dreifachbindung ist in der Regel mäßig reaktiv, was unerwünschte Nebenreaktionen gegenüber reaktivieren Gruppen reduziert. Trotzdem treten diese zum Teil auf und betreffen dann dieKonjugationmitGlutathionund die irreversible Hemmung vonCytochrom-P450-Enzymen.Da diese Enzyme eine wichtige Rolle bei der Metabolisierung vonArzneistoffenspielen, kann ihre Ausschaltung zu problematischenWechselwirkungen mit anderen Arzneistoffenführen, soweit kein angemessener zeitlicher Abstand bei ihrer Einnahme eingehalten wird.[10]
Verschiedene Alkine werden als Arzneistoffe verwendet. Viele darunter sind synthetischeSteroidhormonderivate,die für dieKontrazeptionundHormonersatztherapieverwendet werden. Zu ihnen gehören Estrogene wie dasEthinylestradiol– eines der meistgenutzten Kontrazeptiva – und seinProdrugMestranol.[176]Sie tragen wie auch manchesynthetische Gestagene(etwaNorethindron,[177]Gestoden,Desogestrel[178]Levonorgestrel,[179]Etonogestrel,[180]Etynodioldiacetat[181]Norgestimat[182][S 9]und sein MetabolitNorelgestromin[183][S 10]) sowie der zum medikamentösen Schwangerschaftsabbruch verwendete Progesteronrezeptor-AntagonistMifepriston[184]am C-17 des Steroidgerüsts eine Ethinylgruppe, die die rasche Inaktivierung des jeweiligen Stoffes in derLeberverhindert.[185]Die 17-OH-Gruppe derartiger Verbindungen kann normalerweise leicht zum Keton oxidiert werden, was im Allgemeinen einen deutlichen Wirkungsverlust bedeutet. Die Ethinylgruppe verhindert diese Oxidation jedoch.[10]Dies ist auch der Fall beiDanazol,das beiEndometrioseeingesetzt wird.[10][186]
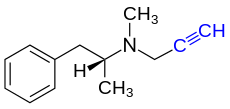
SelegilinundRasagilinwerden als Inhibitoren derMonoaminoxidase BbeiParkinson-Patienten eingesetzt.[187][188]Die Wirkung beruht auf der Ausbildung einer kovalenten Bindung über die Ethinylgruppe der Wirkstoffe mit einer Struktur imFlavin-Adenin-Dinukleotid(FAD)-Cofaktordes Enzyms, was zu einer irreversiblen Hemmung führt.[10][189]Tremorin[S 11]wirkt krampfauslösend und wird beiTierversuchenin der Parkinsonforschung verwendet.[190]
Mehrere Pharmazeutika mit Dreifachbindungen werden beiKrebserkrankungeneingesetzt. Dazu gehört der beiLungenkrebsverwendeteTyrosinkinasehemmerErlotinib,das als Inhibitor des Rezeptors für den epidermalen Wachstumsfaktor (EGF-Rezeptor,EGFR) wirkt,[191][192]indem er an dieATP-Bindungsstellein der mutierten Kinasedomäne des EGFR bindet.[193]Der Wirkstoff geht jedoch unerwünschte Nebenreaktionen mit mehreren Cytochrom-P450-Enzymen ein, insbesondereCYP3A4.Einerseits kann die Verbindung einige der Enzyme irreversibel hemmen, andererseits kann die Dreifachbindung durch Oxidation in ein hochreaktivesOxirenoder Keten umgewandelt werden.[194]Futibatinib,das im September 2022 in den USA zugelassen wurde, ist ein Krebsmedikament für verschiedene Arten von Krebs, u. a. fürBrustkrebs,Magenkrebs,Speiseröhrenkrebsund Lungenkrebs.[195]Die systemische Toxizität mancher cytotoxischer Wirkstoffe kann durch das Konzept desDrug-Targetingreduziert werden. Durch Kopplung an einenAntikörperentsteht einImmunkonjugat(Antibody Drug Conjugate,ADC), das die zielgerichtete Behandlung von bestimmten Krebserkrankungen ermöglicht. Zwei Beispiele sind das gegenakute lymphatische Leukämie(ALL) zugelasseneGemtuzumab-Ozogamicin(USA, 2000, 2017)[196]und das gegenakute myeloische Leukämie(AML) zugelasseneInotuzumab-Ozogamicin(EU,2017).[196][197]Bei den beiden ADC ist der eigentliche Wirkstoff („Payload “) das halbsynthetische Derivat eines hochtoxischen Bakteriengifts aus der Gruppe der Calicheamicine, das eine Endiin-Substruktur enthält.[196]Dieses kann durch Bergman-Cyclisierung und Bildung eines Diradikals einen Doppelstrangbruch in der DNA und dadurch eineApoptose(Zelltod) der betroffenen Zelle verursachen.[196]Die Einschleusung des Wirkstoffs in die Zellen funktioniert durch die Bindung des Antikörpers an bestimmte Rezeptoren. Der monoklonales Antikörper Gemtuzumab bindet beispielsweise an den RezeptorCD33,während der monoklonale Antikörper Inotuzumab an den RezeptorCD22bindet.[198]
-
Die Einführung einer Ethinylgruppe am C-17 von Steroidhormonen (z. B. Ethinylestradiol) verlangsamt deren metabolischen Abbau
-
Die endständige Alkingruppe des Parkinsonmittels Selegilin bindet kovalent an Strukturen eines Enzym-Cofaktors
-
Das Prodrug Tazaroten hat durch die interne Alkinylstruktur eine starre Konformation, auf der die hohe Selektivität des wirksamen Metaboliten für bestimmte Retinoidrezeptoren beruht
-
Dreifachbindungen im reaktiven Endiin-Strukturelement des Bakterientoxins Calicheamicin γ1
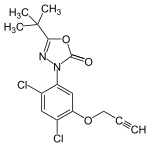
Pralatrexatwird beientzündlichen Erkrankungenverwendet.[199]Tazarotenist ebenfalls einentzündungshemmenderWirkstoff, der an dieRetinoid-RezeptorenRARβund RARγbindet, und wird insbesondere beiAkneundSchuppenflechteeingesetzt.[10][200]In diesem Fall führte der Einbau einer Dreifachbindung durch die starrere Konformation zu einer besseren Selektivität gegenüber diesen spezifischen Rezeptoren.[10]
Efavirenzist einHIV-1-Medikament.[201]Lenacapavir,das ebenfalls gegen HIV verwendet wird, wurde vonGilead Sciencesentwickelt und wurde 2022 als erster Kapsidinhibitor in den USA, Kanada und in der EU zugelassen.[202]Haloproginist eintopischesFungizid[203]undTerbinafinwird beiMykoseneingesetzt.[204]DasAnticholinergikumOxybutyninwird bei übermäßigemHarndrangangewendet,[205]dasProstacyclinanalogonIloprostbeipulmonaler Hypertonie.[206]DasSchlafmittelEthinamatist nicht mehr im Handel.[207]Linagliptin,das erst im September 2022 in den USA zugelassen wurde, findet Verwendung bei der Behandlung vonDiabetes mellitus Typ 2.[208]
Alkine in der Schädlingsbekämpfung
[Bearbeiten|Quelltext bearbeiten]AlsHerbizidewerden diverse Verbindungen verwendet, die als Inhibitoren derProtoporphyrinogen-IX-Oxidasewirken. Ihre Wirkung besteht in der Akkumulation vonProtoporphyrin IXdurch dieEnzymhemmung.Dieses ist ein starkerPhotosensibilisator,der unter Einfluss vonSonnenlichtgrößere MengenSingulett-Sauerstofferzeugt, der zur Schädigung und zum Absterben von Blättern führt.[209][210][211]Viele Wirkstoffe dieses Typs tragen eine Propargylgruppe. Diese ist vermutlich wichtig für die Bindungseigenschaften, da sie den Vinylgruppen des Protoporphyrin IX ähnelt, das das natürliche Substrat des Enzyms ist.[209]Zu diesen Verbindungen gehört beispielsweise dasThidiazimin,das gegen verschiedene Unkräuter wirkt, jedoch unschädlich für verschiedene Getreidearten wieTriticaleoderWinterweizenist.[212]Weitere Vertreter sindOxadiargyl,Pyraclonil,Flumioxazin,FlumipropynundAzafenidin.Kommerzielle Herbizide, die ebenfalls Alkine sind, jedoch eine andere Wirkungsweise haben, sind beispielsweiseClodinafop,PropyzamidundPrynachlor.[209]
Zu den Alkinen, die als Fungizide verwendet werden, gehört dasMepanipyrim[209],das dieMethionin-Biosynthese inhibiert, sowie dasCapillin.[213]Mandipropamidwirkt gegen verschiedeneEipilzeund wird ausgehend von4-Hydroxy-3-methoxyphenethylaminsynthetisiert. Die Propargylgruppe wird mitPropargylbromideingeführt.[214]
VieleinsektizideEster derChrysanthemumsäurewie dieAllethrinetragen eine Allylgruppe. Solche, die stattdessen eine Propargylgruppe tragen, sind jedoch ähnlich oder mehr wirksam.[215]Kommerziell genutzte Vertreter dieser Gruppe, die eine Ethinyl- oder Propargylgruppe tragen, sindPrallethrin,Imiprothrin,Furamethrin,KikuthrinundEmpenthrin.[209]
Literatur
[Bearbeiten|Quelltext bearbeiten]- Peter J. Stang, François Diederich:Modern acetylene chemistry.VCH, Weinheim 1995,ISBN 3-527-29084-2.
- Lambert Brandsma:Synthesis of acetylenes, allenes and cumulenes (= Best synthetic methods).Elsevier, Amsterdam 2004,ISBN 0-12-125751-7.
- K. Peter C. Vollhardt, Neil E. Schore, Übersetzung herausgegeben von Holger Butenschön:Organische Chemie.Weinheim 2020,ISBN 978-3-527-34582-3,S. 663–677.
Alkine als Naturstoffe:
- Dmitry V. Kuklev, Abraham J. Domb, Valery M. Dembitsky:Bioactive acetylenic metabolites.In:Phytomedicine.Band 20, Nr. 13, Oktober 2013, S. 1145–1159,doi:10.1016/j.phymed.2013.06.009.
- Robert E. Minto, Brenda J. Blacklock:Biosynthesis and function of polyacetylenes and allied natural products.In:Progress in Lipid Research.Band 47, Nr. 4, Juli 2008, S. 233–306,doi:10.1016/j.plipres.2008.02.002.
Weblinks
[Bearbeiten|Quelltext bearbeiten]Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑abBarry M. Trost and Chao-Jun Li:Modern Alkyne Chemistry.Wiley,ISBN 978-3-527-33505-3,S.1(eingeschränkte Vorschauin der Google-Buchsuche).
- ↑Jaime Wisniak:Edmond Davy.In:Educación Química.Band31,Nr.4,6. Oktober 2020,S.144,doi:10.22201/fq.18708404e.2020.4.72934.
- ↑Justin Russell:Edmund Davy.In:Journal of Chemical Education.Band30,Nr.6,Juni 1953,S.302,doi:10.1021/ed030p302.
- ↑Robert E. Minto, Brenda J. Blacklock:Biosynthesis and function of polyacetylenes and allied natural products.In:Progress in Lipid Research.Band47,Nr.4,Juli 2008,S.233–306,doi:10.1016/j.plipres.2008.02.002,PMID 18387369,PMC 2515280(freier Volltext).
- ↑Jesse A. Grantham, Richard W. McLay:Engineering Standards in Weld Failure.In:Engineering Standards for Forensic Application.Elsevier, 2019,ISBN 978-0-12-813240-1,S.189–198,doi:10.1016/b978-0-12-813240-1.00014-5.
- ↑abcdÅshild Moi Sørskår, Helge Ø. K. Stenstrøm, Yngve Stenstrøm, Simen Gjelseth Antonsen:The Alkyne Zipper Reaction: A Useful Tool in Synthetic Chemistry.In:Reactions.Band4,Nr.1,30. Dezember 2022,S.26–65,doi:10.3390/reactions4010002.
- ↑abcdPeter Siemsen, Robert C. Livingston, François Diederich:Acetylenic Coupling: A Powerful Tool in Molecular Construction.In:Angewandte Chemie International Edition.Band39,Nr.15,4. August 2000,S.2632–2657,doi:10.1002/1521-3773(20000804)39:15<2632::AID-ANIE2632>3.0.CO;2-F.
- ↑Yahraes, Herbert. “THE ARRIVAL OF ACETYLENE.”Scientific American,vol. 180, no. 1, 1949, pp. 16–21
- ↑abcdeUllmann's Encyclopedia of Industrial Chemistry.1. Auflage. Wiley, 2003,ISBN 3-527-30385-5,doi:10.1002/14356007.a01_097.pub4.
- ↑abcdefghTanaji T. Talele:Acetylene Group, Friend or Foe in Medicinal Chemistry.In:Journal of Medicinal Chemistry.Band63,Nr.11,11. Juni 2020,S.5625–5663,doi:10.1021/acs.jmedchem.9b01617.
- ↑Floyd L. Klavetter, Robert H. Grubbs:Polycyclooctatetraene (polyacetylene): synthesis and properties.In:Journal of the American Chemical Society.Band110,Nr.23,November 1988,S.7807–7813,doi:10.1021/ja00231a036.
- ↑abcHideki Shirakawa:The Discovery of Polyacetylene Film: The Dawning of an Era of Conducting Polymers (Nobel Lecture).In:Angewandte Chemie International Edition.Band40,Nr.14,16. Juli 2001,S.2574–2580,doi:10.1002/1521-3773(20010716)40:14<2574::AID-ANIE2574>3.0.CO;2-N.
- ↑C. K. Chiang, C. R. Fincher, Y. W. Park, A. J. Heeger, H. Shirakawa, E. J. Louis, S. C. Gau, Alan G. MacDiarmid:Electrical Conductivity in Doped Polyacetylene.In:Physical Review Letters.Band39,Nr.17,24. Oktober 1977,S.1098–1101,doi:10.1103/PhysRevLett.39.1098.
- ↑Hans-Georg Elias:Makromoleküle. 4: Anwendungen von Polymeren.6. vollst. überarb. Auflage. Wiley-VCH, Weinheim 2003,ISBN 3-527-29962-9.
- ↑Bernd Tieke:Makromolekulare Chemie: eine Einführung.Dritte Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2014,ISBN 978-3-527-33216-8.
- ↑The Nobel Prize in Chemistry 2000.Abgerufen am 12. September 2023(amerikanisches Englisch).
- ↑The Nobel Prize in Chemistry 2022.Abgerufen am 9. September 2023(amerikanisches Englisch).
- ↑abcdefghijklmnopqrsK. Peter C. Vollhardt, Neil E. Schore, Übersetzung herausgegeben von Holger Butenschön:Organische Chemie.Weinheim 2020,ISBN 978-3-527-34582-3,S. 663–677
- ↑abcdefghijklmnopqrJonathan Clayden, Nick Greeves, Stuart G. Warren:Organische Chemie(=Lehrbuch). 2. Auflage [2., korrigierter Nachdruck]. Springer Spektrum, Berlin 2017,ISBN 978-3-642-34715-3.
- ↑abcdefghiPaul Arnaud, Brigitte Jamart, Jacques Bodiguel, Nicolas Brosse:Chimie organique: les cours de Paul Arnaud avec 350 questions et exercices corrigés(=Sciences Sup). 18e éd. entièrement refondue. Dunod, Paris 2009,ISBN 978-2-10-052647-5.
- ↑abEintrag zuPropinin derGESTIS-StoffdatenbankdesIFA,abgerufen am 8. Januar 2021.(JavaScript erforderlich)
- ↑abEintrag zu1-Butinin derGESTIS-StoffdatenbankdesIFA,abgerufen am 8. Januar 2021.(JavaScript erforderlich)
- ↑abEintrag zu2-Butinin derGESTIS-StoffdatenbankdesIFA,abgerufen am 8. Januar 2021.(JavaScript erforderlich)
- ↑abDatenblatt1-PentinbeiMerck,abgerufen am 13. März 2023.
- ↑abDatenblatt2-PentinbeiMerck,abgerufen am 21. Februar 2010.
- ↑abcdefDavid R. Lide (Hrsg.):CRC Handbook of Chemistry and Physics.90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL,Physical Constants of Organic Compounds,S. 3-284.
- ↑abDavid R. Lide (Hrsg.):CRC Handbook of Chemistry and Physics.90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL,Physical Constants of Organic Compounds,S. 3-276.
- ↑abcDavid R. Lide (Hrsg.):CRC Handbook of Chemistry and Physics.96. Auflage. CRC Press / Taylor and Francis, Boca Raton FL,Physical Constants of Organic Compounds,S. 3-292.
- ↑abcdefghDavid R. Lide (Hrsg.):CRC Handbook of Chemistry and Physics.90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL,Physical Constants of Organic Compounds,S. 3-406.
- ↑abcdA M Sladkov, Yu P Kudryavtsev:POLYYNES.In:Russian Chemical Reviews.Band32,Nr.5,31. Mai 1963,S.229–243,doi:10.1070/RC1963v032n05ABEH001338.
- ↑abS A Hutchinson:Biological Activities of Volatile Fungal Metabolites.In:Annual Review of Phytopathology.Band11,Nr.1,September 1973,S.223–246,doi:10.1146/annurev.py.11.090173.001255.
- ↑Donald W. Rogers, Nikita Matsunaga, Andreas A. Zavitsas, Frank J. McLafferty, Joel F. Liebman:The Conjugation Stabilization of 1,3-Butadiyne Is Zero.In:Organic Letters.Band5,Nr.14,1. Juli 2003,S.2373–2375,doi:10.1021/ol030019h.
- ↑abcYueze Gao, Rik R. Tykwinski:Advances in Polyynes to Model Carbyne.In:Accounts of Chemical Research.Band55,Nr.24,20. Dezember 2022,S.3616–3630,doi:10.1021/acs.accounts.2c00662.
- ↑Ray H. Baughman:Dangerously Seeking Linear Carbon.In:Science.Band312,Nr.5776,19. Mai 2006,S.1009–1110,doi:10.1126/science.1125999.
- ↑Ferdinand Bohlmann:Polyacetylene, IV. Mitteil.: Darstellung von Di‐ tert.‐butyl‐polyacetylenen.In:Chemische Berichte.Band86,Nr.5,Mai 1953,S.657–667,doi:10.1002/cber.19530860519.
- ↑Wesley A. Chalifoux, Rik R. Tykwinski:Synthesis of polyynes to model the sp-carbon allotrope carbyne.In:Nature Chemistry.Band2,Nr.11,November 2010,S.967–971,doi:10.1038/nchem.828.
- ↑abcMartin A. Bennett, Heinz P. Schwemlein:Metal Complexes of Small Cycloalkynes and Arynes.In:Angewandte Chemie International Edition in English.Band28,Nr.10,Oktober 1989,S.1296–1320,doi:10.1002/anie.198912961.
- ↑abDieter Heber, Peter Rösner, Werner Tochtermann:Cyclooctyne and 4‐Cyclooctyn‐1‐ol – Versatile Building Blocks in Organic Synthesis.In:European Journal of Organic Chemistry.Band2005,Nr.20,Oktober 2005,S.4231–4247,doi:10.1002/ejoc.200500288.
- ↑A. T. Blomquist, Liang Huang Liu:Many-membered Carbon Rings. VII. Cycloöctyne.In:Journal of the American Chemical Society.Band75,Nr.9,Mai 1953,S.2153–2154,doi:10.1021/ja01105a039.
- ↑abL. Brandsma, H. D. Verkruijsse:An Improved Synthesis of Cyclooctyne.In:Synthesis.Band1978,Nr.04,1978,S.290–290,doi:10.1055/s-1978-24725.
- ↑S. A. Krouse, R. R. Schrock, R. E. Cohen:Ring-opening polymerization of cyclooctyne.In:Macromolecules.Band20,Nr.4,April 1987,S.903–904,doi:10.1021/ma00170a033.
- ↑abKimberly Chenoweth, David Chenoweth, William A. Goddard III:Cyclooctyne-based reagents for uncatalyzed click chemistry: A computational survey.In:Organic & Biomolecular Chemistry.Band7,Nr.24,2009,S.5255,doi:10.1039/b911482c.
- ↑John C. Gilbert, Everett G. McKinley, Duen-Ren Hou:The Nature of Cyclopentyne from Different Precursors.In:Tetrahedron.Band53,Nr.29,Juli 1997,S.9891–9902,doi:10.1016/S0040-4020(97)00334-7.
- ↑Christian M. Gampe, Erick M. Carreira:Arynes and Cyclohexyne in Natural Product Synthesis.In:Angewandte Chemie International Edition.Band51,Nr.16,16. April 2012,S.3766–3778,doi:10.1002/anie.201107485.
- ↑Heather A. Carlson, Geoffrey E. Quelch, Henry F. Schaefer:How stable is cyclobutyne? The activation energy for the unimolecular rearrangement to butatriene.In:Journal of the American Chemical Society.Band114,Nr.13,Juni 1992,S.5344–5348,doi:10.1021/ja00039a053.
- ↑Zhi Sun, Henry F. Schaefer:Cyclobutyne: Minimum or Transition State?In:The Journal of Organic Chemistry.Band84,Nr.9,3. Mai 2019,S.5548–5553,doi:10.1021/acs.joc.9b00502.
- ↑Herbert Meier, Norbert Hanold, Thomas Molz, Hans Joachim Bissinger, Heinz Kolshorn, Johannes Zountsas:Strained cycloalkenynes.In:Tetrahedron.Band42,Nr.6,Januar 1986,S.1711–1719,doi:10.1016/S0040-4020(01)87588-8.
- ↑abcdPeter J. Stang, François Diederich:Modern acetylene chemistry.VCH, Weinheim 1995,ISBN 3-527-29084-2.
- ↑abcdeDmitry V. Kuklev, Abraham J. Domb, Valery M. Dembitsky:Bioactive acetylenic metabolites.In:Phytomedicine.Band20,Nr.13,Oktober 2013,S.1145–1159,doi:10.1016/j.phymed.2013.06.009.
- ↑Samuele Sala, Jane Fromont, Oliver Gomez, Daniel Vuong, Ernest Lacey, Gavin R. Flematti:Albanitriles A–G: Antiprotozoal Polyacetylene Nitriles from a Mycale Marine Sponge.In:Journal of Natural Products.Band82,Nr.12,27. Dezember 2019,S.3450–3455,doi:10.1021/acs.jnatprod.9b00840.
- ↑Edgar B. Cahoon, Judy A. Schnurr, Errol A. Huffman, Robert E. Minto:Fungal responsive fatty acid acetylenases occur widely in evolutionarily distant plant families: Fungal responsive fatty acid acetylenases.In:The Plant Journal.Band34,Nr.5,Juni 2003,S.671–683,doi:10.1046/j.1365-313X.2003.01757.x.
- ↑K. L. Mikolajczak, C. R. Smith, M. O. Bagby, I. A. Wolff:A New Type of Naturally Occurring Polyunsaturated Fatty Acid.In:The Journal of Organic Chemistry.Band29,Nr.2,Februar 1964,S.318–322,doi:10.1021/jo01025a016.
- ↑Kurt Aitzetmüller:Santalbic acid in the plant kingdom.In:Plant Systematics and Evolution.Band298,Nr.9,November 2012,S.1609–1617,doi:10.1007/s00606-012-0678-5.
- ↑Marcel S. F. Lie Ken Jie, Mohammed Khysar Pasha, Fasih Ahmad:Ultrasound-assisted synthesis of santalbic acid and a study of triacylglycerol species inSantalum album (Linn.) seed oil.In:Lipids.Band31,Nr.10,Oktober 1996,S.1083–1089,doi:10.1007/BF02522466.
- ↑D. A. Konovalov:Polyacetylene Compounds of Plants of the Asteraceae Family (Review).In:Pharmaceutical Chemistry Journal.Band48,Nr.9,Dezember 2014,S.613–631,doi:10.1007/s11094-014-1159-7.
- ↑Leo J. Schep, Robin J. Slaughter, Gordon Becket, D. Michael G. Beasley:Poisoning due to water hemlock.In:Clinical Toxicology.Band47,Nr.4,April 2009,S.270–278,doi:10.1080/15563650902904332.
- ↑Matthew Tcheng, Mark D. Minden, Paul A. Spagnuolo:Avocado‐derived avocadyne is a potent inhibitor of fatty acid oxidation.In:Journal of Food Biochemistry.Band46,Nr.3,März 2022,doi:10.1111/jfbc.13895.
- ↑Alex Sinclair, Robert A. Stockman:Thirty-five years of synthetic studies directed towards the histrionicotoxin family of alkaloids.In:Natural Product Reports.Band24,Nr.2,2007,S.298,doi:10.1039/b604203c.
- ↑abJohn W. Blunt, Brent R. Copp, Murray H. G. Munro, Peter T. Northcote, Michèle R. Prinsep:Marine natural products.In:Natural Product Reports.Band20,Nr.1,21. Januar 2003,S.1–48,doi:10.1039/b207130b.
- ↑John W. Blunt, Brent R. Copp, Wan-Ping Hu, Murray H. G. Munro, Peter T. Northcote, Mich?le R. Prinsep:Marine natural products.In:Natural Product Reports.Band24,Nr.1,2007,S.31,doi:10.1039/b603047p.
- ↑John W. Blunt, Brent R. Copp, Wan-Ping Hu, Murray H. G. Munro, Peter T. Northcote, Michèle R. Prinsep:Marine natural products.In:Natural Product Reports.Band26,Nr.2,2009,S.170,doi:10.1039/b805113p.
- ↑abJohn W. Blunt, Brent R. Copp, Murray H. G. Munro, Peter T. Northcote, Michèle R. Prinsep:Marine natural products.In:Natural Product Reports.Band21,Nr.1,2004,S.1,doi:10.1039/b305250h.
- ↑abJohn W. Blunt, Brent R. Copp, Murray H. G. Munro, Peter T. Northcote, Michèle R. Prinsep:Marine natural products.In:Natural Product Reports.Band22,Nr.1,2005,S.15,doi:10.1039/b415080p.
- ↑Walter D. Celmer, I. A. Solomons:Mycomycin. I. Isolation, Crystallization and Chemical Characterization.In:Journal of the American Chemical Society.Band74,Nr.9,Mai 1952,S.2245–2248,doi:10.1021/ja01129a024.
- ↑Qiu-Ye Chai, Zhen Yang, Hou-Wen Lin, Bing-Nan Han:Alkynyl-Containing Peptides of Marine Origin: A Review.In:Marine Drugs.Band14,Nr.11,23. November 2016,S.216,doi:10.3390/md14110216,PMID 27886049,PMC 5128759(freier Volltext).
- ↑abMukesh C. Joshi, Diwan S. Rawat:Recent Developments in Enediyne Chemistry.In:Chemistry & Biodiversity.Band9,Nr.3,März 2012,S.459–498,doi:10.1002/cbdv.201100047.
- ↑abcMatija Gredičak, Ivanka Jerić:Enediyne compounds - new promises in anticancer therapy.In:Acta Pharmaceutica.Band57,Nr.2,1. Juni 2007,S.133–150,doi:10.2478/v10007-007-0011-y.
- ↑Nakao Ishida, Keizō Miyazaki, Katsuo Kumagai, Mitsuo Rikimaru:Neocarzinostatin, an Antitumor Antibiotic of High Molecular Weight Isolation, Physicochemical Properties and Biological Activities.In:The Journal of Antibiotics, Series A.Band18,Nr.2,1965,S.68–76,doi:10.11554/antibioticsa.18.2_68.
- ↑Nada Zein, Achyut M. Sinha, William J. McGahren, George A. Ellestad:Calicheamicin γ 1 I: an Antitumor Antibiotic That Cleaves Double-Stranded DNA Site Specifically.In:Science.Band240,Nr.4856,27. Mai 1988,S.1198–1201,doi:10.1126/science.3240341.
- ↑Masataka Konishi, Hiroaki Ohkuma, Kyo-Ichiro Saitoh, Hiroshi Kawaguchi, Jerzy Golik, George Dubay, Gary Groenewold, Bala Krishnan, Terrence W. Doyle:Esperamicins, a novel class of potent antitumor antibiotics. I. Physico-chemical data and partial structure.In:The Journal of Antibiotics.Band38,Nr.11,1985,S.1605–1609,doi:10.7164/antibiotics.38.1605.
- ↑Masataka Konishi, Hiroaki Ohkuma, Kiyoshi Matsumoto, Takashi Tsuno, Hideo Kamei, Takeo Miyaki, Toshikazu Oki, Hiroshi Kawaguchi, Gregory D. Vanduyne, Jon Clardy:Dynemicin A, a novel antibiotic with the anthraquinone and 1,5-diyn-3-ene subunit.In:The Journal of Antibiotics.Band42,Nr.9,1989,S.1449–1452,doi:10.7164/antibiotics.42.1449.
- ↑José Cernicharo, Ana M. Heras, A. G. G. M. Tielens, Juan R. Pardo, Fabrice Herpin, Michel Guélin, L. B. F. M. Waters:[ITAL]Infrared Space Observatory's[/ITAL] Discovery of C[TINF]4[/TINF]H[TINF]2[/TINF], C[TINF]6[/TINF]H[TINF]2[/TINF], and Benzene in CRL 618.In:The Astrophysical Journal.Band546,Nr.2,10. Januar 2001,S.L123–L126,doi:10.1086/318871.
- ↑F. Shindo, Y. Benilan, J.-C. Guillemin, P. Chaquin, A. Jolly, F. Raulin:Ultraviolet and infrared spectrum of C6H2revisited and vapor pressure curve in Titan's atmosphere.In:Planetary and Space Science.Band51,Nr.1,Januar 2003,S.9–17,doi:10.1016/S0032-0633(02)00151-4.
- ↑W. C. Maguire, R. A. Hanel, D. E. Jennings, V. G. Kunde, R. E. Samuelson:C3H8and C3H4in Titan's atmosphere.In:Nature.Band292,Nr.5825,August 1981,S.683–686,doi:10.1038/292683a0.
- ↑Jean-Claude Guillemin, Miloud Bouyahyi, El Hassan Riague:Prebiotic, planetary and interstellar chemistry starting from compounds detected in the interstellar medium.In:Advances in Space Research.Band33,Nr.1,Januar 2004,S.81–87,doi:10.1016/j.asr.2003.07.015.
- ↑The International Union of Pure and Applied Chemistry (IUPAC):acetylenes.In:iupac.org.goldbook.iupac.org,abgerufen am 21. Dezember 2023.
- ↑abThe International Union of Pure and Applied Chemistry (IUPAC):alkynes.In:iupac.org.goldbook.iupac.org,abgerufen am 21. Dezember 2023.
- ↑G. P. Moss, P. A. S. Smith, D. Tavernier:Glossary of class names of organic compounds and reactivity intermediates based on structure (IUPAC Recommendations 1995).In:Pure and Applied Chemistry.Band67,Nr.8-9,1. Januar 1995,S.1307–1375,doi:10.1351/pac199567081307.
- ↑Angelika Fallert-Müller, Birgit Jarosch, Angela Simeon:Organische Chemie I.In:Pocket Guide Chemie.Springer Berlin Heidelberg, Berlin, Heidelberg 2019,ISBN 978-3-662-58746-1,S.127–166,doi:10.1007/978-3-662-58747-8_4.
- ↑Alois Haas, Hans‐Udo Krächter:Darstellung und Reaktionen Trifluormethylchalkogenyl‐substituierter Alkine.In:Chemische Berichte.Band121,Nr.10,Oktober 1988,S.1833–1840,doi:10.1002/cber.19881211023.
- ↑Arthur J. Hill, Floyd Tyson:STUDIES ON THE PREPARATION OF THE HIGHER ACETYLENES. I. (PRELIMINARY PAPER.) DEHALOGENATION OF 1,1-DICHLOROHEPTANE IN THE VAPOR PHASE.In:Journal of the American Chemical Society.Band50,Nr.1,Januar 1928,S.172–177,doi:10.1021/ja01388a024.
- ↑Tsutomu Maruyama, Bunsuke Suzuki:Unsaturated Fatty Acids and Their Derivatives: Part IV. The Mechanism of Forming Stearolic Acid from Dichlorstearic Acid.In:Proceedings of the Imperial Academy.Band7,Nr.7,1931,S.265–268,doi:10.2183/pjab1912.7.265.
- ↑N. A. Khan, F. E. Deatherage, J. B. Brown:The preparation of stearolic acid and methyl dideutero-oleate, and certain of their derivatives.In:Journal of the American Oil Chemists Society.Band28,Nr.1,Januar 1951,S.27–31,doi:10.1007/BF02639746.
- ↑N. A. Khan:Acetylenic compounds. I. The dehydrohalogenation reactions by sodamide in liquid ammonia and preparation of some mono-acetylenic substances and their derivatives.In:Journal of the American Oil Chemists Society.Band30,Nr.9,September 1953,S.355–358,doi:10.1007/BF02633768.
- ↑John R. Johnson, W. L. McEwen:THE IDENTIFICATION OF MONOSUBSTITUTED ACETYLENES. DERIVATIVES OF DIETHINYL MERCURY.In:Journal of the American Chemical Society.Band48,Nr.2,Februar 1926,S.469–476,doi:10.1021/ja01413a025.
- ↑abcdefDamien Habrant, Vesa Rauhala, Ari M. P. Koskinen:Conversion of carbonyl compounds to alkynes: general overview and recent developments.In:Chemical Society Reviews.Band39,Nr.6,2010,S.2007,doi:10.1039/b915418c.
- ↑E.J. Corey, P.L. Fuchs:A synthetic method for formyl→ethynyl conversion (RCHO→RC≡CH or RC≡CR′).In:Tetrahedron Letters.Band13,Nr.36,1972,S.3769–3772,doi:10.1016/S0040-4039(01)94157-7.
- ↑abcdeFrédéric Eymery, Bogdan Iorga, Philippe Savignac:The Usefulness of Phosphorus Compounds in Alkyne Synthesis.In:Synthesis.Band2000,Nr.02,2000,S.185–213,doi:10.1055/s-2000-6241.
- ↑Patrick Michel, Dominique Gennet, André Rassat:A one-pot procedure for the synthesis of alkynes and bromoalkynes from aldehydes.In:Tetrahedron Letters.Band40,Nr.49,Dezember 1999,S.8575–8578,doi:10.1016/S0040-4039(99)01830-4.
- ↑Ernest W. Colvin, Brendan J. Hamill:One-step conversion of carbonyl compounds into acetylenes.In:Journal of the Chemical Society, Chemical Communications.Nr.5,1973,S.151,doi:10.1039/c39730000151.
- ↑Kazuhiro Miwa, Toyohiko Aoyama, Takayuki Shioiri:Extension of the Colvin Rearrangement Using Trimethylsilyldiazomethane. A New Synthesis of Alkynes.In:Synlett.Band1994,Nr.02,1994,S.107–108,doi:10.1055/s-1994-22755.
- ↑Douglass F. Taber, Sha Bai, Peng-fei Guo:A convenient reagent for aldehyde to alkyne homologation.In:Tetrahedron Letters.Band49,Nr.48,November 2008,S.6904–6906,doi:10.1016/j.tetlet.2008.09.114,PMID 19946355,PMC 2634292(freier Volltext).
- ↑Y. Taguchi, H. Endo, Y. Abe, J. Matsumoto, T. Wakabayashi, T. Kodama, Y. Achiba, H. Shiromaru:Polyyne formation by graphite laser ablation in argon and propane mixed gases.In:Carbon.Band94,November 2015,S.124–128,doi:10.1016/j.carbon.2015.06.058.
- ↑Seung Keun Shin, Jae Kyu Song, Seung Min Park:Preparation of polyynes by laser ablation of graphite in aqueous media.In:Applied Surface Science.Band257,Nr.12,April 2011,S.5156–5158,doi:10.1016/j.apsusc.2010.10.074.
- ↑Masaharu Tsuji, Takeshi Tsuji, Shingo Kuboyama, Seong-Ho Yoon, Yozo Korai, Teppei Tsujimoto, Kanji Kubo, Akira Mori, Isao Mochida:Formation of hydrogen-capped polyynes by laser ablation of graphite particles suspended in solution.In:Chemical Physics Letters.Band355,Nr.1-2,März 2002,S.101–108,doi:10.1016/S0009-2614(02)00192-6.
- ↑Franco Cataldo:Polyynes and cyanopolyynes synthesis from the submerged electric arc: about the role played by the electrodes and solvents in polyynes formation.In:Tetrahedron.Band60,Nr.19,Mai 2004,S.4265–4274,doi:10.1016/j.tet.2004.03.033.
- ↑abcdeAlois Fürstner, Paul W. Davies:Alkyne metathesis.In:Chemical Communications.Nr.18,2005,S.2307,doi:10.1039/b419143a.
- ↑abTadashi Eguchi, Kenji Arakawa, Katsumi Kakinuma:Synthesis of over 30-Membered Giant Ring Compounds. Synthetic Study of Archaeal 36- and 72-Membered Macrocyclic Membrane Lipids.In:Journal of Synthetic Organic Chemistry, Japan.Band57,Nr.9,1999,S.784–797,doi:10.5059/yukigoseikyokaishi.57.784.
- ↑Rolf Gleiter:Cycloalkadiynes—From Bent Triple Bonds to Strained Cage Compounds.In:Angewandte Chemie International Edition in English.Band31,Nr.1,Januar 1992,S.27–44,doi:10.1002/anie.199200271.
- ↑Robert A. Benkeser, Gene Schroll, Dale M. Sauve:Reduction of Organic Compounds by Lithium in Low Molecular Weight Amines. II. Stereochemistry. Chemical Reduction of an Isolated Non-terminal Double Bond.In:Journal of the American Chemical Society.Band77,Nr.12,Juni 1955,S.3378–3379,doi:10.1021/ja01617a066.
- ↑Herbert O. House, Edith F. Kinloch:Reactions involving electron transfer. V. Reduction on nonconjugated acetylenes.In:The Journal of Organic Chemistry.Band39,Nr.6,März 1974,S.747–755,doi:10.1021/jo00920a002.
- ↑abPaul J. Kropp, Scott D. Crawford:Surface-Mediated Reactions. 4. Hydrohalogenation of Alkynes.In:The Journal of Organic Chemistry.Band59,Nr.11,Juni 1994,S.3102–3112,doi:10.1021/jo00090a031.
- ↑abcdefgFrancis A. Carey, Richard J. Sundberg:Advanced organic chemistry.5th ed Auflage. Springer, New York 2007,ISBN 978-0-387-44897-8.
- ↑Robert C. Fahey, Do-Jae Lee:Polar additions to olefins and acetylenes. V. Bimolecular and termolecular mechanisms in the hydrochlorination of acetylenes.In:Journal of the American Chemical Society.Band90,Nr.8,April 1968,S.2124–2131,doi:10.1021/ja01010a034.
- ↑abcSuzanne R. Macaulay:The rearrangement of isomeric linear decyn-1-ols by reaction with the sodium salt of 1,3-diaminopropane.In:Canadian Journal of Chemistry.Band58,Nr.23,1. Dezember 1980,S.2567–2572,doi:10.1139/v80-409.
- ↑abCharles Allan Brown, Ayako Yamashita:Saline hydrides and superbases in organic reactions. IX. Acetylene zipper. Exceptionally facile contrathermodynamic multipositional isomerization of alkynes with potassium 3-aminopropylamide.In:Journal of the American Chemical Society.Band97,Nr.4,Februar 1975,S.891–892,doi:10.1021/ja00837a034.
- ↑Kiitiro Utimoto, Michio Tanaka, Mitsumasa Kitai, Hitosi Nozaki:Cyclization of ω-trimethylsilylethynylalkanoyl chlorides. Application of the preparation of large ring ynones and dl- and (R)-muscone.In:Tetrahedron Letters.Band19,Nr.26,1. Januar 1978,S.2301–2304,doi:10.1016/S0040-4039(01)91520-5.
- ↑Kenji Mori, Narshinha P. Argade:Pheromone Synthesis, CLXIII. Synthesis of (9Z,25S,26R,43Z)-25,26-Epoxy-9,43-henpentacontadiene and Its Antipode, Components of the Nymph Recognition Pheromone Produced by Nymphs of the CockroachNauphoeta cinerea.In:Liebigs Annalen der Chemie.Band1994,Nr.7,12. Juli 1994,S.695–700,doi:10.1002/jlac.199419940711.
- ↑Vitor L. S. Cunha, Xiaofan Liu, Todd L. Lowary, George A. O’Doherty:De NovoAsymmetric Synthesis of Avocadyne, Avocadene, and Avocadane Stereoisomers.In:The Journal of Organic Chemistry.Band84,Nr.23,24. Oktober 2019,S.15718–15725,doi:10.1021/acs.joc.9b02391.
- ↑Nabil Tahiri, Peter Fodran, Dhineshkumar Jayaraman, Jeffrey Buter, Martin D. Witte, Tonatiuh A. Ocampo, D. Branch Moody, Ildiko Van Rhijn, Adriaan J. Minnaard:Total Synthesis of a Mycolic Acid fromMycobacterium tuberculosis.In:Angewandte Chemie International Edition.Band59,Nr.19,10. März 2020,S.7555–7560,doi:10.1002/anie.202000523,PMID 32067294,PMC 7216993(freier Volltext).
- ↑Jack E. Baldwin:Rules for ring closure.In:Journal of the Chemical Society, Chemical Communications.Nr.18,1976,S.734,doi:10.1039/c39760000734.
- ↑Kerry Gilmore, Rana K. Mohamed, Igor V. Alabugin:The Baldwin rules: revised and extended: Baldwin: Revised, Extended.In:Wiley Interdisciplinary Reviews: Computational Molecular Science.Band6,Nr.5,September 2016,S.487–514,doi:10.1002/wcms.1261.
- ↑Igor V. Alabugin, Kerry Gilmore:Finding the right path: Baldwin “Rules for Ring Closure” and stereoelectronic control of cyclizations.In:Chemical Communications.Band49,Nr.96,2013,S.11246,doi:10.1039/c3cc43872d.
- ↑Kerry Gilmore, Igor V. Alabugin:Cyclizations of Alkynes: Revisiting Baldwin’s Rules for Ring Closure.In:Chemical Reviews.Band111,Nr.11,9. November 2011,S.6513–6556,doi:10.1021/cr200164y.
- ↑Noriyuki Takanashi, Kenta Suzuki, Mariko Kitajima, Hiromitsu Takayama:Total synthesis of conolidine and apparicine.In:Tetrahedron Letters.Band57,Nr.3,Januar 2016,S.375–378,doi:10.1016/j.tetlet.2015.12.029.
- ↑abKarl Kirchner, Maria José Calhorda, Roland Schmid, Luís F. Veiros:Mechanism for the Cyclotrimerization of Alkynes and Related Reactions Catalyzed by CpRuCl.In:Journal of the American Chemical Society.Band125,Nr.38,1. September 2003,S.11721–11729,doi:10.1021/ja035137e.
- ↑abYoshihiko Yamamoto:Recent Advances in Intramolecular Alkyne Cyclotrimerization and Its Applications.In:Current Organic Chemistry.Band9,Nr.6,S.503–519,doi:10.2174/1385272053544399.
- ↑Pablo Wessig, Gunnar Müller:The Dehydro-Diels−Alder Reaction.In:Chemical Reviews.Band108,Nr.6,1. Juni 2008,S.2051–2063,doi:10.1021/cr0783986.
- ↑abWenbo Li, Liejin Zhou, Junliang Zhang:Recent Progress in Dehydro(genative) Diels–Alder Reaction.In:Chemistry – A European Journal.Band22,Nr.5,26. Januar 2016,S.1558–1571,doi:10.1002/chem.201503571.
- ↑Alexander Z. Bradley, Richard P. Johnson:Thermolysis of 1,3,8-Nonatriyne: Evidence for Intramolecular [2 + 4] Cycloaromatization to a Benzyne Intermediate.In:Journal of the American Chemical Society.Band119,Nr.41,1. Oktober 1997,S.9917–9918,doi:10.1021/ja972141f.
- ↑Ok Ton Dyan, Gennady I. Borodkin, Pavel A. Zaikin:The Diels–Alder Reaction for the Synthesis of Polycyclic Aromatic Compounds.In:European Journal of Organic Chemistry.Band2019,Nr.44,30. November 2019,S.7271–7306,doi:10.1002/ejoc.201901254.
- ↑Young Keun Chung:Transition metal alkyne complexes: the Pauson–Khand reaction.In:Coordination Chemistry Reviews.Band188,Nr.1,Juli 1999,S.297–341,doi:10.1016/S0010-8545(99)00032-6.
- ↑Rodney A. Fernandes, Anupama Kumari, Ramdas S. Pathare:A Decade with Dötz Benzannulation in the Synthesis of Natural Products.In:Synlett.Band31,Nr.05,März 2020,S.403–420,doi:10.1055/s-0039-1690791.
- ↑abJanet Wisniewski Grissom, Gamini U. Gunawardena, Detlef Klingberg, Dahai Huang:The chemistry of enediynes, enyne allenes and related compounds.In:Tetrahedron.Band52,Nr.19,Mai 1996,S.6453–6518,doi:10.1016/0040-4020(96)00016-6.
- ↑abMatija Gredičak, Ivanka Jerić:Enediyne compounds - new promises in anticancer therapy.In:Acta Pharmaceutica.Band57,Nr.2,1. Juni 2007,S.133–150,doi:10.2478/v10007-007-0011-y.
- ↑Richard R. Jones, Robert G. Bergman:p-Benzyne. Generation as an intermediate in a thermal isomerization reaction and trapping evidence for the 1,4-benzenediyl structure.In:Journal of the American Chemical Society.Band94,Nr.2,Januar 1972,S.660–661,doi:10.1021/ja00757a071.
- ↑Patrick W. Musch, Christian Remenyi, Holger Helten, Bernd Engels:On the Regioselectivity of the Cyclization of Enyne−Ketenes: A Computational Investigation and Comparison with the Myers-Saito and Schmittel Reaction.In:Journal of the American Chemical Society.Band124,Nr.8,1. Februar 2002,S.1823–1828,doi:10.1021/ja017532f.
- ↑Michael Schmittel, Marc Strittmatter, Susanne Kiau:Switching from the Myers reaction to a new thermal cyclization mode in enyne-allenes.In:Tetrahedron Letters.Band36,Nr.28,Juli 1995,S.4975–4978,doi:10.1016/0040-4039(95)00937-8.
- ↑abShivalinga Kolle, Sanjay Batra:Transformations of alkynes to carboxylic acids and their derivatives via CC bond cleavage.In:Organic & Biomolecular Chemistry.Band14,Nr.47,2016,S.11048–11060,doi:10.1039/C6OB01912A.
- ↑Tanveer Mahamadali Shaikh, Fung-E Hong:Iron-Catalyzed Oxidative Cleavage of Olefins and Alkynes to Carboxylic Acids with Aqueous tert-Butyl Hydroperoxide.In:Advanced Synthesis & Catalysis.Band353,Nr.9,Juni 2011,S.1491–1496,doi:10.1002/adsc.201000899.
- ↑F. Pennella, R. L. Banks, G. C. Bailey:Disproportionation of alkynes.In:Chemical Communications (London).Nr.23,1968,S.1548,doi:10.1039/c19680001548.
- ↑André Mortreux, Michel Blanchard:Metathesis of alkynes by a molybdenum hexacarbonyl–resorcinol catalyst.In:J. Chem. Soc., Chem. Commun.Nr.19,1974,S.786–787,doi:10.1039/C39740000786.
- ↑Alois Fürstner, Günter Seidel:Ring closing alkyne metathesis: stereoselective synthesis of civetone.In:Journal of Organometallic Chemistry.Band606,Nr.1,Juli 2000,S.75–78,doi:10.1016/S0022-328X(00)00096-6.
- ↑Alois Fürstner, Oliver Guth, Antonio Rumbo, Günter Seidel:Ring Closing Alkyne Metathesis. Comparative Investigation of Two Different Catalyst Systems and Application to the Stereoselective Synthesis of Olfactory Lactones, Azamacrolides, and the Macrocyclic Perimeter of the Marine Alkaloid Nakadomarin A.In:Journal of the American Chemical Society.Band121,Nr.48,1. Dezember 1999,S.11108–11113,doi:10.1021/ja992074k.
- ↑Miwako Mori:Synthesis of Natural Products and Related Compounds using Enyne Metathesis.In:Advanced Synthesis & Catalysis.Band349,Nr.1-2,8. Januar 2007,S.121–135,doi:10.1002/adsc.200600484.
- ↑Miwako Mori, Tomohiro Tomita, Yoichi Kita, Tsuyoshi Kitamura:Synthesis of (+)-anatoxin-a using enyne metathesis.In:Tetrahedron Letters.Band45,Nr.22,Mai 2004,S.4397–4399,doi:10.1016/j.tetlet.2004.03.171.
- ↑Jehrod B. Brenneman, Rainer Machauer, Stephen F. Martin:Enantioselective synthesis of (+)-anatoxin-a via enyne metathesis.In:Tetrahedron.Band60,Nr.34,August 2004,S.7301–7314,doi:10.1016/j.tet.2004.06.021.
- ↑abYajing Liu, Jacky W. Y. Lam, Ben Zhong Tang:Conjugated polymers developed from alkynes.In:National Science Review.Band2,Nr.4,1. Dezember 2015,S.493–509,doi:10.1093/nsr/nwv047.
- ↑Rongrong Hu, Weizhang Li, Ben Zhong Tang:Recent Advances in Alkyne-Based Multicomponent Polymerizations.In:Macromolecular Chemistry and Physics.Band217,Nr.2,Januar 2016,S.213–224,doi:10.1002/macp.201500291.
- ↑Rongrong Hu, Jacky W. Y. Lam, Min Li, Haiqin Deng, Jie Li, Ben Zhong Tang:Homopolycyclotrimerization of A 4 -type tetrayne: A new approach for the creation of a soluble hyperbranched poly(tetraphenylethene) with multifunctionalities.In:Journal of Polymer Science Part A: Polymer Chemistry.Band51,Nr.22,15. November 2013,S.4752–4764,doi:10.1002/pola.26897.
- ↑Anjun Qin, Jacky W. Y. Lam, Ben Zhong Tang:Click polymerization.In:Chemical Society Reviews.Band39,Nr.7,2010,S.2522,doi:10.1039/b909064a.
- ↑Hong-kun Li, Jing-zhi Sun, An-jun Qin, Ben Zhong Tang:Azide-alkyne click polymerization: An update.In:Chinese Journal of Polymer Science.Band30,Nr.1,Januar 2012,S.1–15,doi:10.1007/s10118-012-1098-2.
- ↑James R. Green:Chemistry of Propargyldicobalt Cations Recent Developments in the Nicholas and Related Reactions.In:Current Organic Chemistry.Band5,Nr.7,S.809–826,doi:10.2174/1385272013375247.
- ↑John R. Grunwell, Michael F. Wempe, Judith Mitchell, Jocelyn R. Grunwell:The transannular rearrangement of 5-cyclodecynone.In:Tetrahedron Letters.Band34,Nr.45,November 1993,S.7163–7166,doi:10.1016/S0040-4039(00)79277-X.
- ↑abcdeRafael Chinchilla, Carmen Nájera:Recent advances in Sonogashira reactions.In:Chemical Society Reviews.Band40,Nr.10,2011,S.5084,doi:10.1039/c1cs15071e.
- ↑abcdeRafael Chinchilla, Carmen Nájera:The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry.In:Chemical Reviews.Band107,Nr.3,1. März 2007,S.874–922,doi:10.1021/cr050992x.
- ↑abcDan Wang, Shuanhu Gao:Sonogashira coupling in natural product synthesis.In:Org. Chem. Front.Band1,Nr.5,2014,S.556–566,doi:10.1039/C3QO00086A.
- ↑Toyonobu Usuki, Haruka Yamada, Takahiro Hayashi, Hiroto Yanuma, Yohei Koseki, Noriyuki Suzuki, Yoshiro Masuyama, Yong Y. Lin:Total synthesis of COPD biomarker desmosine that crosslinks elastin.In:Chemical Communications.Band48,Nr.26,2012,S.3233,doi:10.1039/c2cc17958j.
- ↑Belén Vaz, Leticia Otero, Rosana Álvarez, Ángel R. de Lera:Total Synthesis of Enantiopure Pyrrhoxanthin: Alternative Methods for the Stereoselective Preparation of 4-Alkylidenebutenolides.In:Chemistry - A European Journal.Band19,Nr.39,23. September 2013,S.13065–13074,doi:10.1002/chem.201301873.
- ↑Glaser coupling.In:Name Reactions.Springer Berlin Heidelberg, Berlin, Heidelberg 2006,ISBN 3-540-30030-9,S.263–264,doi:10.1007/3-540-30031-7_117.
- ↑Siqi Zhang, Liang Zhao:A merged copper(I/II) cluster isolated from Glaser coupling.In:Nature Communications.Band10,Nr.1,24. Oktober 2019,doi:10.1038/s41467-019-12889-w,PMID 31649254,PMC 6813345(freier Volltext).
- ↑Allan S. Hay:Oxidative Coupling of Acetylenes. II 1.In:The Journal of Organic Chemistry.Band27,Nr.9,September 1962,S.3320–3321,doi:10.1021/jo01056a511.
- ↑abWei Shi, Aiwen Lei:1,3-Diyne chemistry: synthesis and derivations.In:Tetrahedron Letters.Band55,Nr.17,April 2014,S.2763–2772,doi:10.1016/j.tetlet.2014.03.022.
- ↑Guoli Mo, Zaimin Tian, Jiping Li, Guohua Wen, Xiaomin Yang:Silver-catalyzed Glaser coupling of alkynes: Silver-catalyzed Glaser coupling of alkynes.In:Applied Organometallic Chemistry.Band29,Nr.4,April 2015,S.231–233,doi:10.1002/aoc.3275.
- ↑Riccardo F. Carina, Christiane Dietrich-Buchecker, Jean-Pierre Sauvage:Molecular Composite Knots.In:Journal of the American Chemical Society.Band118,Nr.38,1. Januar 1996,S.9110–9116,doi:10.1021/ja961459p.
- ↑abcdefgLambert Brandsma:Synthesis of acetylenes, allenes and cumulenes(=Best synthetic methods). Elsevier, Amsterdam 2004,ISBN 0-12-125751-7.
- ↑Carin C. C. Johansson Seechurn, Matthew O. Kitching, Thomas J. Colacot, Victor Snieckus:Palladium-Catalyzed Cross-Coupling: A Historical Contextual Perspective to the 2010 Nobel Prize.In:Angewandte Chemie International Edition.Band51,Nr.21,21. Mai 2012,S.5062–5085,doi:10.1002/anie.201107017.
- ↑abcdJohn E. Moses, Adam D. Moorhouse:The growing applications of click chemistry.In:Chem. Soc. Rev.Band36,Nr.8,2007,S.1249–1262,doi:10.1039/B613014N.
- ↑abcdWolfgang H. Binder, Christian Kluger:Azide/Alkyne- “Click” Reactions: Applications in Material Science and Organic Synthesis.In:Current Organic Chemistry.Band10,Nr.14,S.1791–1815,doi:10.2174/138527206778249838.
- ↑abcJean-François Lutz, Zoya Zarafshani:Efficient construction of therapeutics, bioconjugates, biomaterials and bioactive surfaces using azide–alkyne “click” chemistry.In:Advanced Drug Delivery Reviews.Band60,Nr.9,Juni 2008,S.958–970,doi:10.1016/j.addr.2008.02.004.
- ↑abChao-Jun Li:The Development of Catalytic Nucleophilic Additions of Terminal Alkynes in Water.In:Accounts of Chemical Research.Band43,Nr.4,20. April 2010,S.581–590,doi:10.1021/ar9002587.
- ↑E. Yu. Shmidt, I. A. Bidusenko, N. I. Protsuk, A. I. Mikhaleva, B. A. Trofimov:Improved synthesis of tertiary propargyl alcohols by the Favorskii reaction of alkyl aryl (hetaryl) ketones with acetylene.In:Russian Journal of Organic Chemistry.Band49,Nr.1,Januar 2013,S.8–11,doi:10.1134/S1070428013010028.
- ↑Tao Shen, Teng Wang, Chong Qin, Ning Jiao:Silver-Catalyzed Nitrogenation of Alkynes: A Direct Approach to Nitriles through C≡C Bond Cleavage.In:Angewandte Chemie International Edition.Band52,Nr.26,24. Juni 2013,S.6677–6680,doi:10.1002/anie.201300193.
- ↑Alexander Ernst, Luca Gobbi, Andrea Vasella:Orthogonally protected dialkynes.In:Tetrahedron Letters.Band37,Nr.44,Oktober 1996,S.7959–7962,doi:10.1016/0040-4039(96)01838-2.
- ↑Xin Yang, Daisuke Matsuo, Yoshinori Suzuma, Jing-Kun Fang, Feng Xu, Akihiro Orita, Junzo Otera, Shingo Kajiyama, Nagatoshi Koumura, Kohjiro Hara:Ph2P(O) Group for Protection of Terminal Acetylenes.In:Synlett.Band2011,Nr.16,Oktober 2011,S.2402–2406,doi:10.1055/s-0030-1261223.
- ↑Reinhard Nast:Coordination chemistry of metal alkynyl compounds.In:Coordination Chemistry Reviews.Band47,Nr.1-2,November 1982,S.89–124,doi:10.1016/0010-8545(82)85011-X.
- ↑Umberto Belluco, Roberta Bertani, Rino A. Michelin, Mirto Mozzon:Platinum—alkynyl and —alkyne complexes: old systems with new chemical and physical perspectives.In:Journal of Organometallic Chemistry.Band600,Nr.1-2,April 2000,S.37–55,doi:10.1016/S0022-328X(00)00089-9.
- ↑Helmut Werner:Organometallic chemistry of alkenes and alkynes.In:Journal of Organometallic Chemistry.Band475,Nr.1-2,Juli 1994,S.45–55,doi:10.1016/0022-328X(94)84006-7.
- ↑Zheng Lu, Khalil A. Abboud, W. M. Jones:Platinum(0) complexes of cyclic alkynes and allenes from base-induced dehydrohalogenation of bromocycloalkenes.In:Organometallics.Band12,Nr.4,April 1993,S.1471–1474,doi:10.1021/om00028a079.
- ↑Martin A. Bennett, Heinz P. Schwemlein:Metall-Komplexe mit kleinen Cycloalkinen und Arinen.In:Angewandte Chemie.Band101,Nr.10,Oktober 1989,S.1349–1373,doi:10.1002/ange.19891011006.
- ↑abStefanie Federle,´Stefanie Hergesell, Sebastian Schubert:Die Stoffklassen der organischen Chemie.Springer Berlin Heidelberg, 2017,S.40(eingeschränkte Vorschauin der Google-Buchsuche).
- ↑Ioan-Teodor Trotuş, Tobias Zimmermann, Ferdi Schüth:Catalytic Reactions of Acetylene: A Feedstock for the Chemical Industry Revisited.In:Chemical Reviews.Band114,Nr.3,12. Februar 2014,S.1761–1782,doi:10.1021/cr400357r.
- ↑Ahmed E. S. Nosseir, Angelo Cervone, Angelo Pasini:Review of State-of-the-Art Green Monopropellants: For Propulsion Systems Analysts and Designers.In:Aerospace.Band8,Nr.1,15. Januar 2021,S.20,doi:10.3390/aerospace8010020.
- ↑S.D.T. Maduwanthi, R.A.U.J. Marapana:Comparison of pigments and some physicochemical properties of banana as affected by ethephon and acetylene induced ripening.In:Biocatalysis and Agricultural Biotechnology.Band33,Mai 2021,S.101997,doi:10.1016/j.bcab.2021.101997.
- ↑S. D. T. Maduwanthi, R. A. U. J. Marapana:Induced Ripening Agents and Their Effect on Fruit Quality of Banana.In:International Journal of Food Science.Band2019,2. Mai 2019,S.1–8,doi:10.1155/2019/2520179,PMID 31187037,PMC 6521425(freier Volltext).
- ↑Frank Z. Stanczyk, David F. Archer, Bhagu R. Bhavnani:Ethinyl estradiol and 17β-estradiol in combined oral contraceptives: pharmacokinetics, pharmacodynamics and risk assessment.In:Contraception.Band87,Nr.6,Juni 2013,S.706–727,doi:10.1016/j.contraception.2012.12.011.
- ↑Dennis R. Doose, Shean-Sheng Wang, Mukund Padmanabhan, Stefan Schwabe, David Jacobs, Meir Bialer:Effect of Topiramate or Carbamazepine on the Pharmacokinetics of an Oral Contraceptive Containing Norethindrone and Ethinyl Estradiol in Healthy Obese and Nonobese Female Subjects.In:Epilepsia.Band44,Nr.4,10. April 2003,S.540–549,doi:10.1046/j.1528-1157.2003.55602.x.
- ↑Frank Z. Stanczyk, David F. Archer:Gestodene: A review of its pharmacology, potency and tolerability in combined contraceptive preparations.In:Contraception.Band89,Nr.4,April 2014,S.242–252,doi:10.1016/j.contraception.2013.12.003.
- ↑Antony Stewart, Carole Cummins, Lisa Gold, Rachel Jordan, Wendy Phillips:The effectiveness of the levonorgestrel-releasing intrauterine system in menorrhagia: a systematic review.In:British Journal of Obstetrics and Gynaecology.Band108,Nr.1,Januar 2001,S.74–86,doi:10.1016/S0306-5456(00)00020-6.
- ↑Kusum V. Moray, Himanshu Chaurasia, Oshima Sachin, Beena Joshi:A systematic review on clinical effectiveness, side-effect profile and meta-analysis on continuation rate of etonogestrel contraceptive implant.In:Reproductive Health.Band18,Nr.1,Dezember 2021,doi:10.1186/s12978-020-01054-y,PMID 33407632,PMC 7788930(freier Volltext).
- ↑M Babják, G Balogh, M Gazdag, S Görög:Estimation of impurity profiles of drugs and related materials.In:Journal of Pharmaceutical and Biomedical Analysis.Band29,Nr.6,August 2002,S.1153–1157,doi:10.1016/S0731-7085(02)00165-6.
- ↑Susan S. Jick, James A. Kaye, Stefan Russmann, Hershel Jick:Risk of nonfatal venous thromboembolism in women using a contraceptive transdermal patch and oral contraceptives containing norgestimate and 35 μg of ethinyl estradiol.In:Contraception.Band73,Nr.3,März 2006,S.223–228,doi:10.1016/j.contraception.2006.01.001.
- ↑Karen L Goa, Gregory T Warner, Stephanie E Easthope:Transdermal Ethinylestradiol/Norelgestromin: A Review of its Use in Hormonal Contraception.In:Treatments in Endocrinology.Band2,Nr.3,2003,S.191–206,doi:10.2165/00024677-200302030-00005.
- ↑Eric A. Schaff:Mifepristone: ten years later.In:Contraception.Band81,Nr.1,Januar 2010,S.1–7,doi:10.1016/j.contraception.2009.08.004.
- ↑Herbert Kuhl:Pharmacology of estrogens and progestogens: influence of different routes of administration.In:Climacteric.2005, Band 8, Nummer sup1, S. 3–63.doi:10.1080/13697130500148875.
- ↑Richard Godin, Violaine Marcoux:Vaginally Administered Danazol: An Overlooked Option in the Treatment of Rectovaginal Endometriosis?In:Journal of Obstetrics and Gynaecology Canada.Band37,Nr.12,Dezember 2015,S.1098–1103,doi:10.1016/S1701-2163(16)30075-5.
- ↑Tamás Tábi, László Vécsei, Moussa B. Youdim, Peter Riederer, Éva Szökő:Selegiline: a molecule with innovative potential.In:Journal of Neural Transmission.Band127,Nr.5,Mai 2020,S.831–842,doi:10.1007/s00702-019-02082-0,PMID 31562557,PMC 7242272(freier Volltext).
- ↑Vicki Oldfield, Gillian M Keating, Caroline M Perry:Rasagiline: A Review of its Use in the Management of Parkinson??s Disease.In:Drugs.Band67,Nr.12,2007,S.1725–1747,doi:10.2165/00003495-200767120-00006.
- ↑Rok Borštnar, Matej Repič, Mojca Kržan, Janez Mavri, Robert Vianello:Irreversible Inhibition of Monoamine Oxidase B by the Antiparkinsonian Medicines Rasagiline and Selegiline: A Computational Study.In:European Journal of Organic Chemistry.2011, Band 2011, Nummer 32, S. 6419–6433doi:10.1002/ejoc.201100873.
- ↑G. M. Everett, L. E. Blockus, I. M. Shepperd:Tremor Induced by Tremorine and Its Antagonism by Anti-Parkinson Drugs.In:Science.Band124,Nr.3211,1956,S.79–79,doi:10.1126/science.124.3211.79.a.
- ↑Jin H. Park, Yingting Liu, Mark A. Lemmon, Ravi Radhakrishnan:Erlotinib binds both inactive and active conformations of the EGFR tyrosine kinase domain.In:Biochemical Journal.Band448,Nr.3,15. Dezember 2012,S.417–423,doi:10.1042/BJ20121513,PMID 23101586,PMC 3507260(freier Volltext).
- ↑Jonathan Dowell, John D. Minna, Peter Kirkpatrick:Erlotinib hydrochloride.In:Nature Reviews Drug Discovery.Band4,Nr.1,Januar 2005,S.13–14,doi:10.1038/nrd1612.
- ↑N. Spellmon, C. Li, Z. Yang:Allosterically targeting EGFR drug-resistance gatekeeper mutations.In:Journal of thoracic disease.Band 9, Nummer 7, Juli 2017, S. 1756–1758,doi:10.21037/jtd.2017.06.43,PMID 28839955,PMC 5542946(freier Volltext).
- ↑Xiaohai Li, Theodore M. Kamenecka, Michael D. Cameron:Cytochrome P450-Mediated Bioactivation of the Epidermal Growth Factor Receptor Inhibitor Erlotinib to a Reactive Electrophile.In:Drug Metabolism and Disposition.Band38,Nr.7,Juli 2010,S.1238–1245,doi:10.1124/dmd.109.030361,PMID 20382753,PMC 3202369(freier Volltext).
- ↑Yahiya Y. Syed:Futibatinib: First Approval.In:Drugs.Band82,Nr.18,Dezember 2022,S.1737–1743,doi:10.1007/s40265-022-01806-z.
- ↑abcdJuliana T. W. Tong, Paul W. R. Harris, Margaret A. Brimble, Iman Kavianinia:An Insight into FDA Approved Antibody-Drug Conjugates for Cancer Therapy.In:Molecules.Band26,Nr.19,27. September 2021,S.5847,doi:10.3390/molecules26195847,PMID 34641391,PMC 8510272(freier Volltext).
- ↑Yvette N. Lamb:Inotuzumab Ozogamicin: First Global Approval.In:Drugs.Band77,Nr.14,September 2017,S.1603–1610,doi:10.1007/s40265-017-0802-5.
- ↑Alejandro D. Ricart:Antibody-Drug Conjugates of Calicheamicin Derivative: Gemtuzumab Ozogamicin and Inotuzumab Ozogamicin.In:Clinical Cancer Research.Band17,Nr.20,15. Oktober 2011,S.6417–6427,doi:10.1158/1078-0432.CCR-11-0486.
- ↑Gary S. Wood, Jianqiang Wu:Methotrexate and Pralatrexate.In:Dermatologic Clinics.Band33,Nr.4,Oktober 2015,S.747–755,doi:10.1016/j.det.2015.05.009,PMID 26433846,PMC 5549926(freier Volltext).
- ↑Lyn C. Guenther:Optimizing Treatment with Topical Tazarotene:.In:American Journal of Clinical Dermatology.Band4,Nr.3,2003,S.197–202,doi:10.2165/00128071-200304030-00006.
- ↑Saskia ME Vrouenraets, Ferdinand WNM Wit, Jacqueline van Tongeren, Joep MA Lange:Efavirenz: a review.In:Expert Opinion on Pharmacotherapy.Band8,Nr.6,April 2007,S.851–871,doi:10.1517/14656566.8.6.851.
- ↑Julia Paik:Lenacapavir: First Approval.In:Drugs.Band82,Nr.14,September 2022,S.1499–1504,doi:10.1007/s40265-022-01786-0,PMID 36272024,PMC 10267266(freier Volltext).
- ↑Michele Baldrighi, Davide Bartesaghi, Gabriella Cavallo, Michele R. Chierotti, Roberto Gobetto, Pierangelo Metrangolo, Tullio Pilati, Giuseppe Resnati, Giancarlo Terraneo:Polymorphs and co-crystals of haloprogin: an antifungal agent.In:CrystEngComm.Band16,Nr.26,2014,S.5897–5904,doi:10.1039/C4CE00367E.
- ↑S Krishnan-Natesan:Terbinafine: a pharmacological and clinical review.In:Expert Opinion on Pharmacotherapy.Band10,Nr.16,November 2009,S.2723–2733,doi:10.1517/14656560903307462.
- ↑Kelly Jirschele, Peter K. Sand:Oxybutynin: past, present, and future.In:International Urogynecology Journal.Band24,Nr.4,April 2013,S.595–604,doi:10.1007/s00192-012-1915-8.
- ↑H. Olschewski:Inhaled iloprost for the treatment of pulmonary hypertension.In:European Respiratory Review.Band18,Nr.111,1. März 2009,S.29–34,doi:10.1183/09059180.00011111.
- ↑Marzieh Hashemi, Avat (Arman) Taherpour:Theoretical kinetic and thermodynamic studies of the strain energies and ring size effects of the 1,3-dipolar cycloaddition reactions on ethinamate medicine analogs.In:Journal of Molecular Structure.Band1204,März 2020,S.127544,doi:10.1016/j.molstruc.2019.127544.
- ↑Ulrike Graefe-Mody, Silke Retlich, Christian Friedrich:Clinical Pharmacokinetics and Pharmacodynamics of Linagliptin:.In:Clinical Pharmacokinetics.Band51,Nr.7,Juli 2012,S.411–427,doi:10.2165/11630900-000000000-00000.
- ↑abcdeClemens Lamberth:Alkyne chemistry in crop protection.In:Bioorganic & Medicinal Chemistry.Band17,Nr.12,Juni 2009,S.4047–4063,doi:10.1016/j.bmc.2008.11.037.
- ↑René Scalla, Michel Matringe, Jean-Michel Camadro, Pierre Labbe:Recent Advances in the Mode of Action of Diphenyl Ethers and Related Herbicides.In:Zeitschrift für Naturforschung C.Band45,Nr.5,1. Mai 1990,S.503–511,doi:10.1515/znc-1990-0535.
- ↑Stephen O. Duke, José M. Becerril, T. D. Sherman, John Lydon, Hiroshi Matsumoto:The role of protoporphyrin IX in the mechanism of action of diphenyl ether herbicides.In:Pesticide Science.Band30,Nr.4,1990,S.367–378,doi:10.1002/ps.2780300402.
- ↑Brighton Crop Protection Conference 1993 — Weeds: Introduction.In:Crop Protection.Band12,Nr.7,November 1993,S.555–559,doi:10.1016/0261-2194(93)90101-n.
- ↑L. C. Whelan, M. F. Ryan:Effects of the polyacetylene capillin on human tumour cell lines.In:Anticancer Research.Band24,Nr.4,2004,S.2281–2286,PMID 15330173.
- ↑Clemens Lamberth, Andre Jeanguenat, Fredrik Cederbaum, Alain De Mesmaeker, Martin Zeller, Hans-Joachim Kempf, Ronald Zeun:Multicomponent reactions in fungicide research: The discovery of mandipropamid.In:Bioorganic & Medicinal Chemistry.Band16,Nr.3,1. Februar 2008,S.1531–1545,doi:10.1016/j.bmc.2007.10.019.
- ↑Yoshio Katsuda, Tadayoshi Chikamoto, Hiroshi Ogami, Hajime Hirobe, Tsutomu Kunishige:Novel Insecticidal Chrysanthemic Esters.In:Agricultural and Biological Chemistry.Band33,Nr.9,1969,S.1361–1362,doi:10.1271/bbb1961.33.1361.
Verweise
[Bearbeiten|Quelltext bearbeiten]- ↑Externe Identifikatoren von bzw. Datenbank-Links zuBiformin:CAS-Nummer:1403-08-3,PubChem:121452,Wikidata:Q76010284.
- ↑Externe Identifikatoren von bzw. Datenbank-Links zuSiccayne:CAS-Nummer:22944-03-2,PubChem:189063,Wikidata:Q82923031.
- ↑Externe Identifikatoren von bzw. Datenbank-Links zuOnchidin:CAS-Nummer:161779-98-2,PubChem:101752790,Wikidata:Q104937330.
- ↑Externe Identifikatoren von bzw. Datenbank-Links zuPent-1-en-4-in:CAS-Nummer:871-28-3,PubChem:522708,ChemSpider:455959,Wikidata:Q122577007.
- ↑Externe Identifikatoren von bzw. Datenbank-Links zuMethansulfonylazid:CAS-Nummer:1516-70-7,PubChem:556271,ChemSpider:483609,Wikidata:Q82108447.
- ↑Externe Identifikatoren von bzw. Datenbank-Links zuPyrrhoxanthin:CAS-Nummer:nicht vergeben,PubChem:16061186,Wikidata:Q76507231.
- ↑Externe Identifikatoren von bzw. Datenbank-Links zu11-Azidoundecanthiol:CAS-Nummer:668420-70-0,PubChem:71311045,Wikidata:Q82694993.
- ↑Externe Identifikatoren von bzw. Datenbank-Links zuEthinylferrocen:CAS-Nummer:1271-47-2,PubChem:139251409,Wikidata:Q72477782.
- ↑Externe Identifikatoren von bzw. Datenbank-Links zuNorgestimat:CAS-Nummer:35189-28-7,EG-Nummer:639-446-1,ECHA-InfoCard:100.167.085,PubChem:6540478,ChemSpider:5022837,DrugBank:DBDB00957,Wikidata:Q7051181.
- ↑Externe Identifikatoren von bzw. Datenbank-Links zuNorelgestromin:CAS-Nummer:53016-31-2,EG-Nummer:642-893-5,ECHA-InfoCard:100.170.714,PubChem:62930,ChemSpider:7843336,DrugBank:DBDB06713,Wikidata:Q15295638.
- ↑Externe Identifikatoren von bzw. Datenbank-Links zuTremorin:CAS-Nummer:1448169-71-8,PubChem:71621331,DrugBank:DBDB15149,Wikidata:Q76791462.