Allylgruppe

Allyl-Kation (Mitte) und Allyl-Radikal (unten). Der Allyl-Rest istblaumarkiert.
AlsAllylgruppewird in derorganischen ChemieeinungesättigterKohlenwasserstoffrestbezeichnet, der die Formel H2C=CH–CH2– hat, also eine 2-Propenyl-Gruppe darstellt. Es handelt sich dabei formal um eineVinylgruppeH2C=CH–, an die eineMethylengruppe–CH2– angehängt ist. Allyl-Kationen und -Radikale sindmesomeriestabilisiertund deshalb deutlich stabiler als das entsprechendetert-Butyl-Kation bzw. -Radikal. Zum Beispiel hatAllylalkoholdie Formel H2C=CH–CH2–OH.
Die BezeichnungAllylwurde 1844 vonTheodor Wertheimgeprägt und leitet sich ab vonAllium,lateinischfürKnoblauch,in dem sich eine Reihe von Allylverbindungen wie z. B.Allicinfinden.[1]
Eigenschaften und Verwendung
[Bearbeiten|Quelltext bearbeiten]Die Allylgruppe ist durch die leichte Abstrahierbarkeit eines derallylständigen,d. h. am sp3-hybridisierten, der Doppelbindung benachbarten Kohlenstoffatom gebundenen, Wasserstoffatome oder Protonen eine reaktionsfreudigefunktionelle Gruppein organischenMolekülen.Sind dort außerdem zwei unterschiedliche weitere Substituenten gebunden, so kann die aufgrund der 1,3-Allylspannungauftretende eindeutige Orientierung der Gruppen zueinander in derstereoselektivenSyntheseausgenutzt werden.
Allylverbindungen
[Bearbeiten|Quelltext bearbeiten]Es existieren zahlreiche natürliche und synthetischeorganische Verbindungen,die eine oder mehrere Allylgruppen enthalten. Technisch wichtige Allylverbindungen sind derAllylalkohol,dasAllylchloridsowie dasAllylamin(mitDiallyl-undTriallylamin). Daneben existieren Allylverbindungen, die meist intermediär bei chemischen Reaktionen auftreten. Dazu zählen Allylkationen,-anionensowie -radikale.Diese sind aufgrund der auftretendenMesomeriesehr gut stabilisiert.
Allyl-Kation
[Bearbeiten|Quelltext bearbeiten]Das Allyl-Kation stellt eine positiv geladene Allylgruppe dar. Es lassen sich folgende zwei gleichwertigemesomere Grenzstrukturen(Resonanzformeln) formulieren:

Die positive Ladung ist dabei über das gesamte Molekül verteilt, alsodelokalisiert.
Allyl-Anion
[Bearbeiten|Quelltext bearbeiten]Im Gegensatz zum Allylkation, stellt das Allyl-Anion eine negativ geladene Allylgruppe dar. Wiederum lassen sich hierbei zwei mesomere Grenzstrukturen zeichnen:
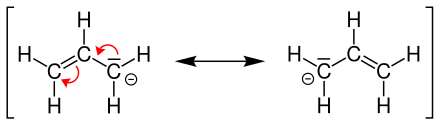
Dasfreie Elektronenpaarist dabei nicht an den endständigenKohlenstoffatomenlokalisiert, sondern mesomer über das gesamte Molekül delokalisiert.
Literatur
[Bearbeiten|Quelltext bearbeiten]- K. Peter C. Vollhardt, Neil E. Schore, Katrin-M. Roy:Organische Chemie.Hrsg.: Holger Butenschön. 5. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2011,ISBN 978-3-527-32754-6.
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Eintrag zuAllyl....In:Römpp Online.Georg Thieme Verlag, abgerufen am 14. April 2020.