Archaeen
| Archaeen | ||||
|---|---|---|---|---|
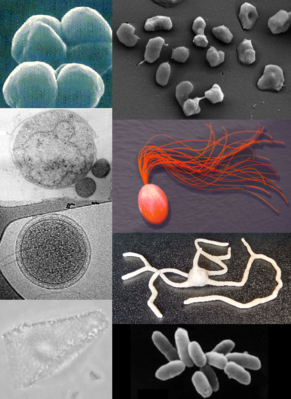
Die vielfältigeMorphologievon Archaeen veranschaulichende Bildkomposition | ||||
| Systematik | ||||
| ||||
| Wissenschaftlicher Name | ||||
| Archaea | ||||
| Otto Kandler&Mark L. Wheelis | ||||
| Überstämme | ||||
DieArchaeen(Archaea,Singular:Archaeon;vonaltgriechischἀρχαῖοςarchaĩos,deutsch‚uralt‘,‚ursprünglich‘),[1]früher auchArchaebakterien,ArchebakterienoderUrbakteriengenannt, bilden eine der dreiDomänen,in die allezellulärenLebeweseneingeteilt werden. Die anderen beiden Domänen sind dieBakterien(Bacteria), die mit den Archaeen zu denProkaryotenzusammengefasst werden, und dieEukaryoten(Eukaryota), die im Unterschied zu den Prokaryoten einenZellkernmitKernmembranbesitzen. Archaeen hingegen haben (wie auch die Bakterien) in sich geschlosseneDNA-Moleküle (zirkuläre Chromosomen[2]) im Zellplasma alsKernäquivalentohne Hülle vorliegen. Die Archaea sind einzellige Organismen.
Bislang sind keine Krankheitserreger aus der Gruppe der Archaeen bekannt.
Eigenschaften
[Bearbeiten|Quelltext bearbeiten]In vielen molekularbiologischen Eigenschaften sind die Archaeen den Eukaryoten ähnlicher als den Bakterien. Dennoch besitzen sie typisch bakterielle Eigenschaften, z. B. die Zellgröße, das Fehlen einesZellkerns,die Art derZellteilung,sie besitzen ein in sich geschlossenesDNA-Molekül, ebenfalls verhältnismäßig einfach aufgebaute Fortbewegungsorgane (Flagellen) und – wie die Bakterien –Ribosomenmit demSedimentationskoeffizienten70S (allerdings sind die archaeellen Ribosomen komplexer in ihrer Struktur). Die Gene beider Domänen sind in sogenanntenOperonsorganisiert. Archaeen können auchPlasmidetragen, wie beispielsweise ein Archaeon (mit der vorläufigen BezeichnungSulfolobusNOB8H2) der FamilieSulfolobaceaeim PhylumCrenarchaeota.[3]
Die zentralen molekularen Prozesse, zum BeispielTranslationundTranskription,sind dagegen denjenigen der Eukaryoten recht ähnlich: Archaeen benutzen ähnliche, aus mehreren Proteinuntereinheiten zusammengesetzteRNA-Polymerasen(Rifampicin- undStreptolydigin-resistent), bei der Translation kommen sehr ähnliche Initiations- und Elongationsfaktoren vor, der Beginn der Transkription wird durch eine sogenannteTATA-Boxmarkiert.
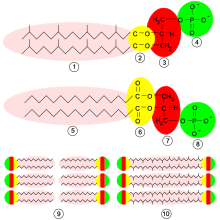
Die Archaeen besitzen jedoch auch viele einzigartige Eigenschaften, besonders der Aufbau derZellwandzeigt deutliche Unterschiede zu den anderen Domänen: Die archaeellen Zellwände enthaltenPseudopeptidoglycan(Pseudomurein) und sind generell sehr vielfältig in ihrem Aufbau: Manchen Archaeen fehlt eine Zellwand völlig (Thermoplasma), andere besitzen hochkomplexe, aus vielen Schichten bestehende Zellwände (Methanospirillum). Aufgrund des anderen Aufbaus sind Archaeen generell gegenZellwandantibiotikaresistent. Auch die Zusammensetzung der archaeellenPlasmamembranunterscheidet sich: In Bakterien und Eukaryoten sindFettsäurenüber eineEsterbindung an dieGlycerolmoleküle gebunden, bei Archaeen findet man Glyceroldiether oder sogar Bis-Glycerol-Tetraether (einschichtige Membran, Monolayer) und verzweigteIsopreneinheitenstatt einfacher Fettsäuren. Hyperthermophile Archaeen besitzen häufig derart stabilisierte Zellmembranen (Glycerol-Tetraether),[4]die nicht nur thermostabiler sind, sondern auch Anpassungen an saure Umgebungen darstellen können.[5]
Einige Archaeenarten können sich in Relation zu ihrer Größe sehr schnell fortbewegen. Mit 400 bis 500 „Körperlängen pro Sekunde “(englischbodies per second,abgekürzt „bps “) sindMethanocaldococcus jannaschiiundMethanocaldococcus villosusdie schnellsten bislang vermessenen Lebewesen.[6]Zum Vergleich: Ein Sportwagen mit 400 bps käme auf eine Geschwindigkeit von über 6000 km/h (nahezuHyperschallgeschwindigkeit). Das BakteriumEscherichia colibewegt sich dagegen mit rund 20 bps fort, ähnlich schnell wie einGepard.
Viele kultivierte Arten der Archaeen sind an extreme Milieubedingungen angepasst. So gibt esArten,die bevorzugt bei Temperaturen von über 80 °C wachsen (hyper-thermophil), andere leben in hoch konzentrierten Salzlösungen (halophil) oder in starksauremMilieu (pH-Wert zuweilen sogar unterhalb 0;acidophil) bzw. stark basischem Milieu (pH-Wert oberhalb von 10;alkaliphil).Thermoplasmatalesder GattungPicrophilus(P. oshimaeundP. torridus) haben ein Wachstumsoptimum bei einem pH-Wert von 0,7 und können sogar bei einem pH-Wert von −0,06 noch überleben.
Archaeen sind in der Forschung von Interesse, da in ihnen vielleicht Merkmale des frühen Lebens auf der Erde erhalten geblieben sind. Aber auch ihr außergewöhnlicherStoffwechselist von Interesse, zum Beispiel die Fähigkeit, bei 110 °C zu wachsen.
Stoffwechsel
[Bearbeiten|Quelltext bearbeiten]Die meisten der bisher bekannten Archaeenarten sindautotroph,d. h. sie benötigen zum Wachstum keine organischen Stoffe, sie gewinnen den Kohlenstoff zum Aufbau ihrer Körperbestandteile ausschließlich durchAssimilationvonKohlenstoffdioxid.Aber auchHeterotrophie,die Gewinnung des Kohlenstoffs aus organischen Verbindungen, ist weit verbreitet.
Die Mehrzahl der bisher kultivierten Archaeen zeichnet sich durch einenanaerobenStoffwechsel aus; für viele anaerobe Archaeen istSauerstoff(O2) toxisch.
Eine Besonderheit archaeellen Stoffwechsels ist dieMethanogenese,die ausschließlich von Methan produzierenden Archaeen, den sogenanntenMethanogenen,vollbracht werden kann. Sie besitzen eine Reihe einzigartigerCofaktoren,beispielsweise CoenzymF420oderMethanofuran.
Die meisten hyperthermophilen Archaeen sindAnaerobier;der energiegewinnende Stoffwechsel ist entwederchemoorganotrophoderchemolithotroph(die Energie wird aus chemischen Umsetzungen organischer bzw. anorganischer Verbindungen gewonnen). Schwefelverbindungen spielen hierbei oft eine große Rolle: Während des Stoffwechsels wird derSchwefelreduziert und dabei Energie freigesetzt.
Bekannt ist aber der Schwefelstoffwechsel der extrem thermo- und acidophilen ArtAcidianus ambivalens(früher:Desulfurolobus ambivalens), aus der OrdnungSulfolobales,welche aerob Schwefel oxidieren kann.[7]
HalophileArchaeen sind meist aerob-chemoorganotroph, sie gewinnen ihre Energie aus chemischen Umsetzungen von organischen Verbindungen. Unter anoxischen Bedingungen oder bei Nährstoffmangel sind viele extrem Halophile sogar zur Nutzung von Lichtenergie fähig: Sie besitzen das ProteinBacteriorhodopsin,das Licht absorbiert und den Protonentransfer durch die Cytoplasmamembran katalysiert; der dadurch erzeugteelektrochemische Gradienttreibt dieATPaseund damit dieATP-Synthese an.
Morphologie
[Bearbeiten|Quelltext bearbeiten]
Wie die Bakterien sind auch die Archaeen in ihrer Form äußerst divers. Die Größen bzw. Längen der archaeellen Zellen variieren von etwa 0,4 (Nanoarchaeum equitans) bis zu 100 µm (Methanospirillum hungatei), durchschnittlich sind die Zellen etwa 1 µm groß. Die Zellen zeigen verschiedene Formen, z. B.:Kokken(z. B.Methanococcus jannaschii),Stäbchen(Thermoproteus neutrophilus),Spirillen-förmig (Methanospirillum hungatei), gelappte Kokken (Archaeoglobus fulgidus), Scheiben (Thermodiscus maritimus), lange Filamente (Thermofilum pendens) oder sogar quadratisch (Haloquadratum walsbyi).
Sie besitzen oft Geißeln (Flagellen) zur Fortbewegung, oder auch fadenartige Anhängsel (Pili) zur Anheftung an Oberflächen.
Genetik
[Bearbeiten|Quelltext bearbeiten]Archaeen weisen in der Regel ein einzigeszirkuläres Chromosomauf,[8]wobei bei zahlreichenEuryarchaeotanachgewiesen wurde, dass sie mehrere Kopien dieses Chromosoms besitzen[9].Das größte bekannte Archaeen-Genom,das im Jahr 2002 ermittelt wurde, umfasste 5.751.492Basenpaarein Methanosarcina acetivorans.[10]Das Genom von Nanoarchaeum equitans mit 490.885 Basenpaaren ist nur ein Zehntel so groß und ist das kleinste bekannte Archaeen-Genom; es enthält schätzungsweise nur 537 proteinkodierendeGene.[11]Kleinere unabhängige DNA-Stücke, sogenanntePlasmide,sind ebenfalls in Archaeen zu finden. Plasmide können in einem Prozess, der derbakteriellen Konjugationähneln könnte, durch physischen Kontakt zwischen Zellen übertragen werden.[12][13]
Archaeen unterscheiden sich genetisch von Bakterien und Eukaryonten. Bis zu 15 % der Proteine, für die ein archaeisches Genom kodiert, sind einzigartig für die Domäne, allerdings haben die meisten dieser Gene keine bekannte Funktion.[14]Die übrigen Proteine mit identifizierter Funktion, gehören überwiegend zu den Euryarchaeota und sind an der Methanogenese beteiligt. Die Proteine, die von Archaeen, Bakterien und Eukaryonten gemeinsam aufgebaut werden, stellen einen gemeinsamen Grundbaustein der Zellfunktionen dar, der sich hauptsächlich auf dieTranskription,dieTranslationund denNukleotidstoffwechselbezieht.[15]Andere charakteristische Merkmale der Archaeen sind die Organisation von Genen mit verwandter Funktion – wie Enzyme, die Schritte desselbenStoffwechselwegsin neuartigeOperonskatalysieren, sowie großex Unterschiede intRNA-Genen und derenAminoacyl-tRNA-Synthetasen.[16]
Die Transkription in Archaeen ähnelt mehr der eukaryotischen als der bakteriellen Transkription, wobei die archaeischeRNA-Polymeraseihrem Äquivalent in Eukaryoten sehr nahe kommt,[8]während die archaeische Translation Anzeichen sowohl bakterieller als auch eukaryotischer Äquivalente aufweist[17].Obwohl Archaeen nur einen Typ von RNA-Polymerase haben, scheinen ihre Struktur und Funktion bei der Transkription der eukaryotischenRNA-Polymerase IIsehr ähnlich zu sein, wobei ähnliche Proteinanordnungen (dieallgemeinen Transkriptionsfaktoren) die Bindung der RNA-Polymerase an denPromotoreines Gens steuern.[18]Andere archaeische Transkriptionsfaktoren sind allerdings näher an denen von Bakterien.[19]Dieposttranskriptionelle Modifikationist einfacher als beiEukaryonten,da den meisten archaeischen GenenIntronsfehlen, obwohl es viele Introns in ihrenTransfer-RNA- undribosomalen RNA-Genen gibt,[20]und Introns in einigen wenigen proteinkodierenden Genen vorkommen können.[21][22]
Gentransfer
[Bearbeiten|Quelltext bearbeiten]Haloferax volcanii,ein extrem halophiles Archaeon, bildet zytoplasmatische Brücken zwischen den Zellen, die offenbar für die Übertragung von DNA von einer Zelle zur anderen in beide Richtungen genutzt werden.[23]
Wenn die hyperthermophilen ArchaeenSulfolobus solfataricus[24]undSulfolobus acidocaldarius[25]einer DNA-schädigendenUV-Bestrahlungoder den WirkstoffenBleomycinoderMitomycin Causgesetzt werden, wird eine artspezifische zelluläre Aggregation ausgelöst. Die Aggregation inS. solfataricuskonnte nicht durch andere physikalische Stressfaktoren wiepH-Wertoder Temperaturveränderung ausgelöst werden,[26]was darauf hindeutet, dass die Aggregation speziell durchDNA-Schädenausgelöst wird. Ajon et al.[27]zeigten, dass UV-induzierte zelluläre Aggregation den Austausch chromosomaler Marker in S. acidocaldarius mit hoher Frequenz vermittelt. Die Rekombinationsraten übertrafen die von nicht induzierten Kulturen um bis zu drei Größenordnungen. Frols et al.[26][28]und Ajon et al.[27]stellten die Hypothese auf, dass die zelluläre Aggregation den artspezifischen DNA-Transfer zwischenSulfolobus-Zellen fördert, um die Reparatur beschädigter DNA durchhomologe Rekombinationzu verbessern. Bei dieser Reaktion könnte es sich um eine primitive Form der sexuellen Interaktion handeln, ähnlich wie bei besser untersuchten bakteriellen Transformationssystemen, die ebenfalls mit einem artspezifischen DNA-Transfer zwischen Zellen verbunden sind, der zu einer homologen Rekombinationsreparatur von DNA-Schäden führt[29].
Fortpflanzung
[Bearbeiten|Quelltext bearbeiten]Archaeen pflanzen sich ungeschlechtlich durch binäre oder multipleFissiparie,Fragmentierung oderKnospungfort.MitoseundMeiosekommen nicht vor, sodass, wenn eine Archaeenart in mehr als einer Form existiert, alle dasselbe genetische Material haben.[30]DieZellteilungwird durch einenZellzyklusgesteuert; nachdem dasChromosomder Zelle repliziert wurde und sich die beidenTochterchromosomengetrennt haben, teilt sich die Zelle.[31]In der GattungSulfolobusweist der Zyklus Merkmale auf, die sowohl bakteriellen als auch eukaryotischen Systemen ähneln. Die Chromosomen werden von mehreren Ausgangspunkten (Replikationsursprüngen) aus mit Hilfe vonDNA-Polymerasenrepliziert, die den entsprechenden eukaryotischen Enzymen ähneln.[32]
In Euryarchaeota ähneln das ZellteilungsproteinFtsZ,das einen sich zusammenziehenden Ring um die Zelle bildet, und die Bestandteile desSeptums,das quer durch das Zentrum der Zelle gebaut wird, ihren bakteriellen Äquivalenten.[31]InCren-[33][34]undThaumarchaea[35]erfüllt der Zellteilungsapparat Cdv eine ähnliche Rolle. Dieser Mechanismus ist mit dem eukaryotischen ESCRT-III-Zellteilungsapparat verwandt. Obwohl dieser am besten für seine Rolle bei der Zellsortierung bekannt ist, ist er auch an der Trennung von teilenden Zellen beteiligt, was auf eine ursprüngliche Funktion in der Zellteilung hindeutet.[36]
Sowohl Bakterien als auch Eukaryoten, nicht aber Archaeen, bildenSporen.[37]EinigeHaloarchaea-Arten durchlaufen einephänotypische Umstellungund wachsen als mehrere verschiedene Zelltypen, einschließlich dickwandiger Strukturen, die gegenosmotischen Schockresistent sind und den Archaeen das Überleben in Wasser mit niedrigen Salzkonzentrationen ermöglichen; diese Strukturen sind jedoch nicht als reproduktive Strukturen zu bezeichnen, sondern könnten ihnen vielmehr dabei helfen, neue Lebensräume zu erreichen.[38]
Habitate
[Bearbeiten|Quelltext bearbeiten]
Die meisten der bisher bekannten Archaeen sindExtremophile,d. h. den extremen Bedingungen ihrerBiotopeangepasst. Viele Vertreter besitzen die Fähigkeit, bei sehr hohen Temperaturen (Hyperthermophile über 80 °C), sehr niedrigen oder sehr hohen pH-Werten (Acidophilebzw.Alkaliphile), hohen Salzkonzentrationen (Halophile) oder hohen Drücken (Barophilie) zu leben.
Hyperthermophile Archaeen findet man häufig in vulkanischen Gebieten, marinen (Schwarzer Raucher) und terrestrischen (Geysire,Solfatarenfelder), so z. B. vulkanisch geprägtenHabitatendesYellowstone-Nationalparks.Halophile gedeihen gut in Umgebungen mit hohem Salzgehalt, so z. B. imToten Meeroder auch in natürlich vorkommenden marinenSolen.
Auch methanogene Archaeen sind in gewisser Weise „extrem “: Sie wachsen ausschließlich unteranoxischenBedingungen und benötigen häufig molekularenWasserstofffür ihrenStoffwechsel.Diese Archaeenarten sind relativ weit verbreitet und kommen in Süßwasser, Meer und Boden vor, aber auch alsSymbiontenim Darmtrakt von Tieren und Menschen. Archaeen konnten sogar in den Falten des menschlichen Bauchnabels nachgewiesen werden, wobei dies selten ist.[39]
Wegen dieser „Extremophilie “hat man die ökologische Bedeutung der Archaeen zunächst als relativ gering eingeschätzt. Erst in den letzten Jahren wurde durch Einsatz feinerer molekularbiologischer Nachweismethoden deutlich, dass Archaeen zu großen Anteilen in verhältnismäßig kaltem Meerwasser, aber auch in Böden und Süßwasser-Biotopen vorkommen. In bestimmten ozeanischen Bereichen machen z. B.Crenarchaeotabis zu 90 % der vorhandenen Lebewesen aus. Insgesamt schätzt man, dass in den Ozeanen etwa 1,3 × 1028Archaeen und 3,1 × 1028Bakterien vorkommen.
Die Mehrzahl der isolierten und alsReinkulturim Labor verfügbaren Archaeenarten ist allerdings nach wie vor „extremophil “; in einigen Fällen ist eine Kultivierung auch unter weniger extremen Bedingungen gelungen. Aus den bisherigen Untersuchungen geht hervor, dass die Archaeen eine bedeutende Rolle für denStickstoff-,Kohlenstoff-undSchwefelkreislaufim Ökosystem der Erde spielen.
Systematik
[Bearbeiten|Quelltext bearbeiten]Die separate Stellung der Archaeen als eine eigenständige Domäne ist begründet durch eine Reihe genetischer, physiologischer, struktureller und biochemischer Merkmale, insbesondere deutliche Unterschiede in der Sequenz der in denRibosomenenthaltenenRNA(der kleinen ribosomalen Untereinheit,16S rRNA).
Ende der 1970er Jahre wurde von den US-amerikanischen MikrobiologenCarl Woeseund George Fox die Eigenständigkeit der Archaeen und ihre Zugehörigkeit zu einer eigenen systematischen Einheit neben den Bakterien (Eubakterien) und Eukaryoten erkannt und beschrieben. In der Sequenz der ribosomalen RNA entdeckten die Forscher auffällige Unterschiede zu Bakterien. Auch die Struktur der Zellen und deren Eigenheiten im Stoffwechsel ließen auf eine separate Gruppe von Prokaryoten schließen.[40]Diese Ergebnisse wurden in den folgenden Jahren bestätigt, und weitreichende Fortschritte in der molekularen Biologie machten eine generelle Änderung derTaxonomienotwendig:Eubakterienwurden inBacteriaumbenannt undArchaebakterieninArchaea.Beide wurden 1990 im Rahmen eines Drei-Domänen-Systems als zwei eigenständigeDomänenneben der Domäne der Eukarya beschrieben.[41]Dabei stehen dieArchaeadenEukaryaphylogenetischvermutlich näher als dieBacteria.Zwar lassen sich in Archaeen keineZellorganellenfinden, doch können sie zur Stabilisierung ihrer Form besondere, einemCytoskelettvergleichbare Filamente ausbilden.[42][43]
Für die Beschreibung von Genus und Art gibt es eine festgelegte Prozedur.[44]Durch Publikation oder Validierung im International Journal of Systematic and Evolutionary Microbiology (IJSEM)[45]sind Gattung und Art festgelegt. Höhere Taxa können hier auch beschrieben werden. Der aktuelle Stand kann in der List of Prokaryotic names with Standing in Nomenclature (LPSN),[46]gepflegt durch Jean Euzéby, eingesehen werden. Dies entspricht demInternationalen Code der Nomenklatur der Prokaryoten(ICNP).[47]Taxa, die diesem Standard nicht entsprechen, werden in Anführungszeichen dargestellt.
Darüber hinaus wurde die globale Einteilung innerhalb der Archaeen und Bakterien mittels phylogenetischer Analyse des 16S-rRNS-Gens reformiert.[48]Eine aktuelle Zusammenstellung der Taxa aus dieser und zahlreichen weiterführenden Publikationen erscheint inBergey’s Manual,[49]und inTaxonomic Outline of the Bacteria and Archaea,[50]wobei mittlerweile zusätzlich zum 16S-rRNS-Gen teilweise weitere phylogenetischeMarkergenehinzugezogen werden. Einige dieser Taxa haben ihre Berechtigung, sind aber bis heute nicht valide publiziert oder werden generell nicht vom ICNB erfasst. Solche Taxa werden in Anführungszeichen dargestellt.
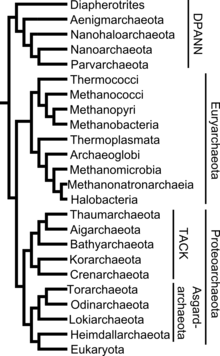

Die hier wiedergegebene Systematik enthält die Taxa von Phylum bis Familie. Bei manchen Taxa gibt es widersprüchliche Einträge. Diese wurden anhand von Originalliteratur und einer phylogenetischen Analyse auf Stichhaltigkeit geprüft.[51][52][53]
Vor einigen Jahren wurde die Beschreibung der zusätzlichenPhyla„Korarchaeota“und „Nanoarchaeota“veröffentlicht. Ein Vertreter des vorgeschlagenen Phylums „Nanoarchaeota “konnte erfolgreich co-kultiviert[54]und sein Genom sequenziert werden,[55]das sogenannteNanoarchaeum equitans.Vom vorgeschlagenen Phylum „Korarchaeota “, zunächst anhand seiner 16S rRNA-Gen-Basensequenzen in Probenheißer Quellennachgewiesen,[56]gibt es Anreicherungskulturen. Daraus konnte nun die komplette Basensequenz des Genoms veröffentlicht werden,[57]mit dem informellen Namen „CandidatusKorarchaeum cryptofilum“versehen. Ohne isolierte Stämme haben die Vertreter dieser Phyla nach den derzeitigen Regeln des ICSB keinen validierten Platz in der Taxonomie,[58]stellen jedoch zwei von vier bekannten Phyla der Archaeen dar.
- Superphylum „Euryarchaeota“Woeseet al.1990
- KlasseArchaeoglobi
- KlasseHalobacteria
- KlasseMethanobacteria
- Klasse „Methanococci“Boone 2002
- Klasse „Methanomicrobia“
- Klasse „Methanopyri“Garrity & Holt 2002
- KlasseThermococci
- KlasseThermoplasmata
- Klasse „Eurythermea“Cavalier-Smith2002[59]
- Klasse „Neobacteria“Cavalier-Smith 2002[59]
- Klasse „Hadesarchaea“
- Superphylum „DPANN“
- Superphylum „Proteoarchaeota“Petitjeanet al.2014
Archaeen und Menschen
[Bearbeiten|Quelltext bearbeiten]Archaeen wurden beim Menschen im Darm (Colon), in derMundhöhle(Zahnflora), imBauchnabel[63]und in derVaginanachgewiesen.[64]Archaeen machen etwa 10 % deranaerobenGemeinschaft im menschlichen Darm aus.[65]Im Darm treten vor allem Archaeen auf, die derGattungMethanobrevibacterzugehören, im SpeziellenMethanobrevibacter smithii.Diese zählen zu denmethanogenen Archaea.Nicht bei allen Menschen kommtM. smithiiim Darm vor, und bei Säuglingen unter zwei Jahren wurden bisher noch nie Archaeen identifiziert. In einer Studie wurden Archaeen auch auf derHautnachgewiesen, die zum Phylum Thaumarchaeota gehören.[66]Möglicherweise korreliert die Anzahl jener Archaeen mit der Häufigkeit des Schwitzens.
Methanogene der ArtenMethanobrevibacter smithiiundMethanosphaera stadtmanaeleben vergesellschaftet mitsyntrophenBakterien im menschlichen Verdauungstrakt, sodass sie einen Einfluss auf die Verdauung ausüben.[67]Diese nutzen die beiden Produkte bakterieller Gärungen, Wasserstoff und Formiat, für die Methanogenese. Eine hohe Konzentration an Wasserstoff hemmt dieATP-Erzeugung anderer Bakterien.M. smithiibaut unter Methanbildung auchMethanolab, das für den Menschen toxisch ist. Daher haben die Methanogenen einen positiven Einfluss auf die menschlicheDarmflora.Ob diese auch beeinflussen, wie vielEnergieder Mensch aus der Nahrung aufnehmen kann, ist noch Gegenstand der Forschung.
Obwohl Archaeen in engem Kontakt zum Menschen stehen, gibt es keinen Hinweis aufhumanpathogeneArten.[65][68]Es wurde aber eine Korrelation zwischen Erkrankung und Anzahl von methanogenen Archaeen nachgewiesen: Je mehr Archaeen beispielsweise im (entzündeten)Zahnfleischvorhanden waren, desto stärker war eine entsprechendeParodontitisausgeprägt. Hierbei treten insbesondere Archaeen der ArtMethanobrevibacter oralisauf. Auch bei Patienten mitDarmkrebsbzw.Divertikulosewar die Menge methanogener Archaeen in jenen Bereichen erhöht. Dennoch tragen diese Archaeen nur indirekt zur Erkrankung bei, indem sie das Wachstum echt pathogener Bakterien fördern – die Archaeen selbst sind es nicht. Wenn man Archaeen als „Kopathogene “oder „Pathobionten“[69](Symbionten, die unter bestimmten Bedingungen pathologisch werden) betrachtet, dann könnte die Erkrankung mit Medikationen therapiert werden, die diese Archaeen zum Ziel haben. So inhibieren beispielsweiseStatinedas Wachstum der bei einer Parodontitis vergesellschaftetenMethanobrevibacter oralis.[66]
Warum die bekannten Archaeen nicht humanpathogen sind, ist noch nicht eindeutig geklärt. Auch wenn unter den Archaeen keine menschlichen Parasiten bekannt sind, so gibt es in derDPANN-Gruppe zumindest einige kleine Vertreter, die alsEpibionten(Parasiten?) auf größeren Archaeen leben (etwaNanoarchaeum equitans). Das Fehlen vieler archaeenspezifischer Kofaktoren und Vitamine im Menschen ist nicht notwendigerweise die Ursache für das Nichtvorkommen humanpathogener Archaeen.[70][71]Selbst dass die durch pathogene Prozesse erzeugtenMikrohabitatebesetzt werden, ist kein Alleinstellungsmerkmal der Archaeen – prinzipiell könnten auch Organismen mit ähnlichem (anaeroben, hydrogenotrophen) Stoffwechsel diese Habitate nutzen.[69]
Biotechnologisches Potential
[Bearbeiten|Quelltext bearbeiten]Archaeelle Stoffwechselleistungen, Zellbestandteile oderEnzymewerden industriell angewendet. Vor allem die Extremophilen besitzen viele Eigenschaften, die sich biotechnologisch nutzen lassen. Einige Beispiele, die sich bereits in der Entwicklungsphase oder Anwendung befinden:
- Biotechnologie
- Biogas-Gewinnung (Methangewinnung inBiogasanlagen)
- Mikrobielle Erzlaugung(„microbial ore leaching “oder „bioleaching “): Bei diesem Prozess werden niederwertige,sulfidischeErzeausgelaugt (die Sulfidanteile werden mikrobiell zuSulfatoxidiert und dadurch dieSchwermetallein einen löslichen Zustand überführt); dies wird zum Beispiel zur Gewinnung vonKupfer,ZinkundNickelangewendet.
- Recycling: Kunststoff-Zersetzung zu wiederverwertbaren Kunststoff-Rohstoffen (i.e.Monomeren) dank in Archaeen vorhandenen Enzymen[72]
- Medizin: Verwendung von Zellwandbestandteilen (sogenannteS-Layer) als Träger fürImpfstoffe
- Nanotechnologie
- Verwendung derS-Layerfür dieUltrafiltration
- Bacteriorhodopsin/Purpurmembran phototropher halophiler Archaeen alsBiosensoren
- Biologie
- Gewinnung hitzeresistenterEnzyme,z. B. α-Amylasen,proteolytischeEnzyme,DNA-Polymerasen
- Gewinnung neuerRestriktionsenzyme
- Boden- undGewässersanierung
Literatur
[Bearbeiten|Quelltext bearbeiten]Archaeen in Standardwerken
[Bearbeiten|Quelltext bearbeiten]- Georg Fuchs (Hrsg.):Allgemeine Mikrobiologie.(begr. von Hans G. Schlegel). 8. Auflage. Georg Thieme Verlag, Stuttgart/New York 2007,ISBN 978-3-13-444608-1.
- Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.)The Prokaryotes, A Handbook of the Biology of Bacteria.7 Bände, 3. Auflage. Springer-Verlag, New York u. a., 2006,ISBN 0-387-30740-0.
- Joseph W. Lengeler, Gerhart Drews, Hans G. Schlegel (Hrsg.)Biology of the Prokaryotes.Georg Thieme Verlag, Stuttgart 1999,ISBN 3-13-108411-1.
- H. König:Archaea.In:Encyclopedia of Life Sciences.John Wiley & Sons, 2003, (doi:10.1038/npg.els.0000443)
- Michael T. Madigan, John M. Martinko, Thomas Lazar (Übersetzer) und Freya Thomm-Reitz (Übersetzer):Brock Mikrobiologie.11., aktualisierte Auflage. Pearson Studium, 2009,ISBN 978-3-8273-7358-8;
Beschreibungen in der wissenschaftlichen Literatur
[Bearbeiten|Quelltext bearbeiten]- Carl R. Woese,Otto Kandler,M. L. Wheelis:Towards a natural system of organisms: Proposal of the domains Archaea, Bacteria and Eucarya.In:Proc. Natl. Acad. Sci. U.S.A.Band 87(12), 1990, S. 4576–4579.PMID 2112744;PDF(freier Volltextzugriff, engl.)
- B. M. Karner, E. F. DeLong, D. M. Karl:Archaeal dominance in the mesopelagic zone of the Pacific ocean.In:Nature.Band 409(6819), 2001, S. 507–510.PMID 11206545;doi:10.1038/35054051
- R. Cavicchioli:Cold-adapted archaea.In:Nat Rev Microbiol.4(5), 2006, S. 331–343.PMID 16715049;doi:10.1038/nrmicro1390
- H. Huber, M. J. Hohn, R. Rachel, T. Fuchs, V. C. Wimmer,K. O. Stetter.A new phylum of Archaea represented by a nanosized hyperthermophilic symbiont.In:Nature.Band 417(6884), 2002, S. 63–67.PMID 11986665;doi:10.1038/417063a
- E. Conway de Macario, Alberto J. L. Macario:Methanogenic archaea in health and disease: a novel paradigm of microbial pathogenesis.In:Int J Med Microbiol.299 (2), 2009, S. 99–108.PMID 18757236;doi:10.1016/j.ijmm.2008.06.011
- R. Cavicchioli:Archaea - timeline of the third domain.In:Nat Rev Microbiol.9(1), 2011, S. 51–61.PMID 21132019;doi:10.1038/nrmicro2482
- R. E. Valas, P. E. Bourne:The origin of a derived superkingdom: how a gram-positive bacterium crossed the desert to become an archaeon.In:Biology direct.Band 6, 2011, S. 16,ISSN1745-6150.doi:10.1186/1745-6150-6-16.PMID 21356104.PMC 3056875(freier Volltext).
- Hans-Peter Horz:Archaeal Lineages within the Human Microbiome: Absent, Rare or Elusive?In:Life (Basel).5(2), 2015, S. 1333–1345.doi:10.3390/life5021333
Weblinks
[Bearbeiten|Quelltext bearbeiten]- Archaeen wandeln in sauren Böden Ammonium um,Auf Pflanzenforschung.de vom 20. Dezember 2011: Archaeen oxidieren in sauren Böden Ammoniak zu Nitrat
- Nadja Podbregar:Unser Ur-Urahn war ein Archaeon.Aufwissenschaft.devom 6. Mai 2015
- Josephine Franke:Mikrobiom des Darms ist diverser als gedacht – Archaeen machen 1,2 Prozent der mikrobiellen Darmbesiedelung aus.Aufscinexx.de vom 18. Januar 2022
- Chris Rinke:Behind the Paper: Standardising archaeal taxonomy,NatureMicrobiology Community, 21. Juni 2021
- SIB:Archaeal cell– Archaeenzelle, Interaktive Graphik von SwissBioPics
- Christa Schleper,German Jurgens, Melanie Jonuscheit:Genomic studies of uncultivated archaea.In:Nat Rev Microbiol.3. Jahrgang,Nr.6,Juni 2005,S.479–488,doi:10.1038/nrmicro1159,PMID 15931166(englisch).
- Cindy J. Castelle,Jillian F. Banfield:Major New Microbial Groups Expand Diversity and Alter our Understanding of the Tree of Life.In:Cell,Band 172, Nr. 6, S. 1181–1197;doi:10.1016/j.cell.2018.02.016,PMID 29522741(englisch).
- Chris Greening, Princess R. Cabotaje, Luis E. Valentin Alvarado, Pok Man Leung, Henrik Land, Thiago Rodrigues-Oliveira, Rafael I. Ponce-Toledo, Moritz Senger, Max A. Klamke, Michael Milton, Rachael Lappan, Susan Mullen, Jacob West-Roberts, Jie Mao, Jiangning Song, Marie Schoelmerich, Courtney W. Stairs, Christa Schleper, Rhys Grinter, Anja Spang,Jillian F. Banfield,Gustav Berggren:Minimal and hybrid hydrogenases are active from archaea.In:Cell,Band 187, Nr. 13, S. 3357-3372.e19, 20. Juni 2024;doi:10.1016/j.cell.2024.05.032,Epub 11. Juni 2024 (englisch). Dazu:
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Merriam-Webster Online Dictionary
- ↑A. L. Hartman et al.:The Complete Genome Sequence of Haloferax volcanii DS2, a Model Archaeon.In:PLOS ONE.Band5,Nr.3,2010,S.e9605,PMC 2841640(freier Volltext) – (englisch).
- ↑Christa Schleperet al.:A multicopy plasmid of the extremely thermophilic archaeon „Sulfolobus “effects its transfer to recipients by mating.In:J. Bacteriol.Band 177, 1995, S. 4417–4426.PMID 7635827.
- ↑A. Pearsonet al.:Factors Controlling the Distribution of Archaeal Tetraethers in Terrestrial Hot Springs.In:Appl. Environ. Microbiol.Band 74, 2008, S. 3523–3532, als(PDF)
- ↑E. Boydet al.:The role of tetraether lipid composition in the adaptation of thermophilic archaea to acidity.In:Front Microbiol.Band4,Nr.62,April 2013,doi:10.3389/fmicb.2013.00062,PMC 3615187(freier Volltext) – (englisch).
- ↑Bastian Herzog, Reinhard Wirth:Swimming Behavior of Selected Species of Archaea.In:Applied and Environmental Microbiology.Band 78, Nr. 6, 2012, S. 1670–1674,doi:10.1128/AEM.06723-11
idw-online.devom 28. Februar 2012:Archaeen sind die schnellsten Lebewesen der Welt – Mikroorganismen glänzen mit Weltrekord. - ↑T. Urichet al.:The sulphur oxygenase reductase from Acidianus ambivalens is a multimeric protein containing a low-potential mononuclear non-haem iron centre.In:Biochem J.Band 381, Teil 1, 2004, S. 137–146.doi:10.1042/BJ20040003
- ↑abThorsten Allers, Moshe Mevarech:Archaeal genetics — the third way.In:Nature Reviews Genetics.Band6,Nr.1,Januar 2005,ISSN1471-0064,S.58–73,doi:10.1038/nrg1504(nature[abgerufen am 4. Juni 2024]).
- ↑Catherina Hildenbrand, Tilmann Stock, Christian Lange, Michael Rother, Jörg Soppa:Genome Copy Numbers and Gene Conversion in Methanogenic Archaea.In:Journal of Bacteriology.Band193,Nr.3,Februar 2011,ISSN0021-9193,S.734–743,doi:10.1128/JB.01016-10,PMID 21097629,PMC 3021236(freier Volltext).
- ↑James E. Galagan, Chad Nusbaum, Alice Roy, Matthew G. Endrizzi, Pendexter Macdonald, Will FitzHugh, Sarah Calvo, Reinhard Engels, Serge Smirnov, Deven Atnoor, Adam Brown, Nicole Allen, Jerome Naylor, Nicole Stange-Thomann, Kurt DeArellano, Robin Johnson, Lauren Linton, Paul McEwan, Kevin McKernan, Jessica Talamas, Andrea Tirrell, Wenjuan Ye, Andrew Zimmer, Robert D. Barber, Isaac Cann, David E. Graham, David A. Grahame, Adam M. Guss, Reiner Hedderich, Cheryl Ingram-Smith, H. Craig Kuettner, Joseph A. Krzycki, John A. Leigh, Weixi Li, Jinfeng Liu, Biswarup Mukhopadhyay, John N. Reeve, Kerry Smith, Timothy A. Springer, Lowell A. Umayam, Owen White, Robert H. White, Everly Conway de Macario, James G. Ferry, Ken F. Jarrell, Hua Jing, Alberto J. L. Macario, Ian Paulsen, Matthew Pritchett, Kevin R. Sowers, Ronald V. Swanson, Steven H. Zinder, Eric Lander, William W. Metcalf, Bruce Birren:The Genome of M. acetivorans Reveals Extensive Metabolic and Physiological Diversity.In:Genome Research.Band12,Nr.4,1. April 2002,ISSN1088-9051,S.532–542,doi:10.1101/gr.223902,PMID 11932238(cshlp.org[abgerufen am 4. Juni 2024]).
- ↑Elizabeth Waters, Michael J. Hohn, Ivan Ahel, David E. Graham, Mark D. Adams, Mary Barnstead, Karen Y. Beeson, Lisa Bibbs, Randall Bolanos, Martin Keller, Keith Kretz, Xiaoying Lin, Eric Mathur, Jingwei Ni, Mircea Podar, Toby Richardson, Granger G. Sutton, Melvin Simon, Dieter Soll, Karl O. Stetter, Jay M. Short, Michiel Noordewier:The genome of Nanoarchaeum equitans: insights into early archaeal evolution and derived parasitism.In:Proceedings of the National Academy of Sciences of the United States of America.Band100,Nr.22,28. Oktober 2003,ISSN0027-8424,S.12984–12988,doi:10.1073/pnas.1735403100,PMID 14566062.
- ↑C Schleper, I Holz, D Janekovic, J Murphy, W Zillig:A multicopy plasmid of the extremely thermophilic archaeon Sulfolobus effects its transfer to recipients by mating.In:Journal of Bacteriology.Band177,Nr.15,August 1995,ISSN0021-9193,S.4417–4426,doi:10.1128/jb.177.15.4417-4426.1995,PMID 7635827,PMC 177192(freier Volltext).
- ↑Sota M, Top EM:Plasmids: Current Research and Future Trends.Caister Academic Press, 2008,abgerufen am 4. Juni 2024(englisch).
- ↑David E. Graham, Ross Overbeek, Gary J. Olsen, Carl R. Woese:An archaeal genomic signature.In:Proceedings of the National Academy of Sciences.Band97,Nr.7,28. März 2000,ISSN0027-8424,S.3304–3308,doi:10.1073/pnas.97.7.3304.
- ↑Terry Gaasterland:Archaeal genomics.In:Current Opinion in Microbiology.Band2,Nr.5,Oktober 1999,ISSN1369-5274,S.542–547,doi:10.1016/s1369-5274(99)00014-4(sciencedirect[abgerufen am 4. Juni 2024]).
- ↑Terry Gaasterland:Archaeal genomics.In:Current Opinion in Microbiology.Band2,Nr.5,Oktober 1999,ISSN1369-5274,S.542–547,doi:10.1016/s1369-5274(99)00014-4(sciencedirect[abgerufen am 4. Juni 2024]).
- ↑Patrick P Dennis:Ancient Ciphers: Translation in Archaea.In:Cell.Band89,Nr.7,Juni 1997,S.1007–1010,doi:10.1016/S0092-8674(00)80288-3(elsevier[abgerufen am 4. Juni 2024]).
- ↑Finn Werner:Structure and function of archaeal RNA polymerases.In:Molecular Microbiology.Band65,Nr.6,September 2007,ISSN0950-382X,S.1395–1404,doi:10.1111/j.1365-2958.2007.05876.x.
- ↑L Aravind:DNA-binding proteins and evolution of transcription regulation in the archaea.In:Nucleic Acids Research.Band27,Nr.23,1. Dezember 1999,S.4658–4670,doi:10.1093/nar/27.23.4658,PMID 10556324,PMC 148756(freier Volltext).
- ↑J Lykke-Andersen:Archaeal introns: splicing, intercellular mobility and evolution.In:Trends in Biochemical Sciences.Band22,Nr.9,September 1997,ISSN0968-0004,S.326–331,doi:10.1016/s0968-0004(97)01113-4(cell[abgerufen am 4. Juni 2024]).
- ↑Yoh-ichi Watanabe, Shin-ichi Yokobori, Toshiro Inaba, Akihiko Yamagishi, Tairo Oshima, Yutaka Kawarabayasi, Hisasi Kikuchi, Kiyoshi Kita:Introns in protein‐coding genes in Archaea.In:FEBS Letters.Band510,Nr.1-2,2. Januar 2002,ISSN0014-5793,S.27–30,doi:10.1016/S0014-5793(01)03219-7.
- ↑Shigeo Yoshinari, Takashi Itoh, Steven J. Hallam, Edward F. DeLong, Shin-ichi Yokobori, Akihiko Yamagishi, Tairo Oshima, Kiyoshi Kita, Yoh-ichi Watanabe:Archaeal pre-mRNA splicing: A connection to hetero-oligomeric splicing endonuclease.In:Biochemical and Biophysical Research Communications.Band346,Nr.3,August 2006,ISSN0006-291X,S.1024–1032,doi:10.1016/j.bbrc.2006.06.011(sciencedirect[abgerufen am 4. Juni 2024]).
- ↑Ilan Rosenshine, Ronen Tchelet, Moshe Mevarech:The Mechanism of DNA Transfer in the Mating System of an Archaebacterium.In:Science.Band245,Nr.4924,22. September 1989,ISSN0036-8075,S.1387–1389,doi:10.1126/science.2818746.
- ↑Sabrina Fröls, Malgorzata Ajon, Michaela Wagner, Daniela Teichmann, Behnam Zolghadr, Mihaela Folea, Egbert J. Boekema, Arnold J. M. Driessen, Christa Schleper, Sonja‐Verena Albers:UV‐inducible cellular aggregation of the hyperthermophilic archaeon Sulfolobus solfataricus is mediated by pili formation.In:Molecular Microbiology.Band70,Nr.4,November 2008,ISSN0950-382X,S.938–952,doi:10.1111/j.1365-2958.2008.06459.x.
- ↑Małgorzata Ajon, Sabrina Fröls, Marleen van Wolferen, Kilian Stoecker, Daniela Teichmann, Arnold J. M. Driessen, Dennis W. Grogan, Sonja-Verena Albers, Christa Schleper:UV-inducible DNA exchange in hyperthermophilic archaea mediated by type IV pili: UV-inducible DNA exchange in hyperthermophilic archaea.In:Molecular Microbiology.Band82,Nr.4,November 2011,S.807–817,doi:10.1111/j.1365-2958.2011.07861.x.
- ↑abSabrina Fröls, Malgorzata Ajon, Michaela Wagner, Daniela Teichmann, Behnam Zolghadr, Mihaela Folea, Egbert J. Boekema, Arnold J. M. Driessen, Christa Schleper, Sonja‐Verena Albers:UV‐inducible cellular aggregation of the hyperthermophilic archaeon Sulfolobus solfataricus is mediated by pili formation.In:Molecular Microbiology.Band70,Nr.4,November 2008,ISSN0950-382X,S.938–952,doi:10.1111/j.1365-2958.2008.06459.x.
- ↑abMałgorzata Ajon, Sabrina Fröls, Marleen van Wolferen, Kilian Stoecker, Daniela Teichmann, Arnold J. M. Driessen, Dennis W. Grogan, Sonja-Verena Albers, Christa Schleper:UV-inducible DNA exchange in hyperthermophilic archaea mediated by type IV pili: UV-inducible DNA exchange in hyperthermophilic archaea.In:Molecular Microbiology.Band82,Nr.4,November 2011,S.807–817,doi:10.1111/j.1365-2958.2011.07861.x.
- ↑Sabrina Fröls, Malcolm F. White, Christa Schleper:Reactions to UV damage in the model archaeonSulfolobus solfataricus.In:Biochemical Society Transactions.Band37,Nr.1,20. Januar 2009,ISSN0300-5127,S.36–41,doi:10.1042/bst0370036(portlandpress[abgerufen am 4. Juni 2024]).
- ↑Harris Bernstein, Carol Bernstein:Sexual Communication in Archaea, the Precursor to Eukaryotic Meiosis.In:Biocommunication of Archaea.Springer International Publishing, Cham 2017,ISBN 978-3-319-65536-9,S.103–117,doi:10.1007/978-3-319-65536-9_7.
- ↑Krieg N:Bergey's Manual of Systematic Bacteriology.(PDF) In:ResearchGate.Springer, 2005,S. 21–26,abgerufen am 4. Juni 2024(englisch).
- ↑abRolf Bernander:Archaea and the cell cycle.In:Molecular Microbiology.Band29,Nr.4,August 1998,ISSN0950-382X,S.955–961,doi:10.1046/j.1365-2958.1998.00956.x.
- ↑L KELMAN, Z KELMAN:Multiple origins of replication in archaea.In:Trends in Microbiology.Band12,Nr.9,September 2004,ISSN0966-842X,S.399–401,doi:10.1016/j.tim.2004.07.001(cell[abgerufen am 4. Juni 2024]).
- ↑Ann-Christin Lindås, Erik A. Karlsson, Maria T. Lindgren, Thijs J. G. Ettema, Rolf Bernander:A unique cell division machinery in the Archaea.In:Proceedings of the National Academy of Sciences.Band105,Nr.48,2. Dezember 2008,ISSN0027-8424,S.18942–18946,doi:10.1073/pnas.0809467105.
- ↑Rachel Y. Samson, Takayuki Obita, Stefan M. Freund, Roger L. Williams, Stephen D. Bell:A Role for the ESCRT System in Cell Division in Archaea.In:Science.Band322,Nr.5908,12. Dezember 2008,ISSN0036-8075,S.1710–1713,doi:10.1126/science.1165322.
- ↑Erik A. Pelve, Ann‐Christin Lindås, Willm Martens‐Habbena, José R. de la Torre, David A. Stahl, Rolf Bernander:Cdv‐based cell division and cell cycle organization in the thaumarchaeon Nitrosopumilus maritimus.In:Molecular Microbiology.Band82,Nr.3,November 2011,ISSN0950-382X,S.555–566,doi:10.1111/j.1365-2958.2011.07834.x.
- ↑Yaron Caspi, Cees Dekker:Dividing the Archaeal Way: The Ancient Cdv Cell-Division Machinery.In:Frontiers in Microbiology.Band9,2. März 2018,ISSN1664-302X,doi:10.3389/fmicb.2018.00174,PMID 29551994,PMC 5840170(freier Volltext).
- ↑Rob U. Onyenwoke, Julia A. Brill, Kamyar Farahi, Juergen Wiegel:Sporulation genes in members of the low G+C Gram-type-positive phylogenetic branch (Firmicutes).In:Archives of Microbiology.Band182,Nr.2,1. Oktober 2004,ISSN1432-072X,S.182–192,doi:10.1007/s00203-004-0696-y.
- ↑N. A. Kostrikina, I. S. Zvyagintseva, V. I. Duda:Cytological peculiarities of some extremely halophilic soil archaeobacteria.In:Archives of Microbiology.Band156,Nr.5,1. Oktober 1991,ISSN1432-072X,S.344–349,doi:10.1007/BF00248708.
- ↑Hulcr J, Latimer AM, Henley JB, Rountree NR, Fierer N,et al.(2012) A Jungle in There: Bacteria in Belly Buttons are Highly Diverse, but Predictable. PLoS ONE 7(11): e47712.doi:10.1371/journal.pone.0047712
- ↑C. R. Woese, G. E. Fox:Phylogenetic structure of the prokaryotic domain: the primary kingdoms.In:Proc. Natl. Acad. Sci. U.S.A.Band 74, Heft 11, 1977, S. 5088–5090.PMID 270744
- ↑C. R. Woeseet al.:Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya.In:Proc. Natl. Acad. Sci. U.S.A.Band 87, Heft 12, 1990, S. 4576–4579.PMID 2112744
- ↑J. D. Trentet al.:Chaperonin filaments: the archaeal cytoskeleton?In:PNAS.Band 94, Nr. 10, 1997, S. 5383–5388.PMID 9144246;PDF(freier Volltextzugriff, engl.)
- ↑F. Haraet al.:An actin homolog of the archaeon Thermoplasma acidophilum that retains the ancient characteristics of eukaryotic actin.In:J. Bacteriol.Band 189, Nr. 5, 2007, S. 2039–2045.PMID 17189356;PDF(freier Volltextzugriff, engl.)
- ↑B. J. Tindallet al.:Valid publication of names of prokaryotes according to the rules of nomenclature: past history and current practice.In:Int J Syst Evol Microbiol.Band 56, Heft 11, 2006, S. 2715–2720.PMID 17082418.doi:10.1099/ijs.0.64780-0.
- ↑International Journal of Systematic and Evolutionary Microbiology.(IJSEM)
- ↑J. P. Euzéby:List of bacterial names with standing in nomenclature: a folder available on the Internet.In:Int. J. Syst. Bacteriol.Band 47, 1997, S. 590–592.PMID 9103655-List of Prokaryotic names with Standing in Nomenclature(vom 30. Dezember 2010 imInternet Archive) (LPSN)
- ↑S. P. Lapageet al.:International Code of Nomenclature of Bacteria, 1990 Revision.(Bacteriological Code). ASM Press, Washington, D.C. 1992,ISBN 1-55581-039-X.
- ↑C. R. Woeseet al.:A phylogenetic definition of the major eubacterial taxa.In:Syst. Appl. Microbiol.Band 6, 1985, S. 143–151.PMID 11542017.
- ↑Bergey’s Manual Trust, Department of Microbiology, 527 Biological, Sciences Building, University of Georgia, Athens, GA 30602-2605, USA -Bergey’s Manual
- ↑George M. Garrityet al.:Taxonomic Outline of the Bacteria and Archaea.Release 7.7, 6. März 2007, Michigan State University Board of Trustees, taxonomicoutline.org
- ↑W. Ludwiget al.:ARB: a software environment for sequence data.In:Nucleic Acids Res.Band 32, 2004, S. 1363–1371.
- ↑E. Pruesseet al.:SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB.In:Nuc. Acids Res.Band 35, Nr. 21, 2007, S. 7188–7196.
- ↑P. Yarzaet al.:The All-Species Living Tree Project: a 16S rRNA-based phylogenetic tree of all sequenced type strains.In:Syst. Appl. Microbiol.2008,doi:10.1016/j.syapm.2008.07.001.
- ↑H. Huberet al.:A new phylum of Archaea represented by a nanosized hyperthermophilic symbiont.In:Nature.417, 2002, S. 63–67.PMID 11986665.
- ↑E. Waterset al.:The genome ofNanoarchaeum equitans:insights into early archaeal evolution and derived parasitism.In:Proc Natl Acad Sci U.S.A.100, 2003, S. 12984–12988.PMID 14566062.
- ↑S. M. Barnset al.:Perspectives on archaeal diversity, thermophily and monophyly from environmental rRNA sequences.In:Proc Natl Acad Sci U.S.A.93, 1996, S. 9188–9193.PMID 8799176.
- ↑J. G. Elkinset al.:A korarchaeal genome reveals insights into the evolution of the Archaea.In:Proc Natl Acad Sci U.S.A.105, 2008, S. 8102–8107.PMID 18535141.
- ↑P. De Vos,H. G. Trüper:Judicial Commission of the International Committee on Systematic Bacteriology. IXth International (IUMS) Congress of Bacteriology and Applied Microbiology. Minutes of the meetings, 14, 15 and 18 August 1999, Sydney, Australia.In:Int. J. Syst. Evol. Microbiol.Band 50, 2000, S. 2239–2244.
- ↑abTaxa above the rank of class.In:List of Prokaryotic names with Standing in Nomenclature.Abgerufen am 8. August 2017(englisch).
- ↑GTDB:Thermoproteota(phylum).
- ↑T. Cavalier-Smith:The neomuran revolution and phagotrophic origin of eukaryotes and cilia in the light of intracellular coevolution and a revised tree of life.In:Cold Spring Harb. Perspect. Biol.6. Jahrgang,Nr.9,2014,S.a016006,doi:10.1101/cshperspect.a016006,PMID 25183828,PMC 4142966(freier Volltext) – (englisch).
- ↑Paul-Adrian Bulzu, Adrian-Stefan Andrei, Michaela M. Salcher, Maliheh Mehrshad, Keiichi Inoue, Hideki Kandori, Oded Beja, Rohit Ghai, Horia L. Banciu:Casting light on Asgardarchaeota metabolism in a sunlit microoxic niche,in: Nat Microbiol, Band 4, S. 1129–1137,doi:10.1038/s41564-019-0404-y
- ↑Souri Somphanith:Plunging into the Unknown: Belly Button Bacteria and You.In:PLOS Blogs.
- ↑E. Conway de Macario, Alberto J. L Macario:Methanogenic archaea in health and disease: a novel paradigm of microbial pathogenesis.In:Int J Med Microbiol.299 (2), 2009, S. 99–108.PMID 18757236
- ↑ab Jennifer Wirth, Mark Young:The intriguing world of archaeal viruses.In:PLOS Pathog.16. Jahrgang,Nr.8,13. August 2020,S.e1008574,doi:10.1371/journal.ppat.1008574,PMID 32790746,PMC 7425843(freier Volltext) – (englisch).
- ↑abMor N. Lurie-Weinberger und Uri Gophna:Archaea in and on the Human Body: Health Implications and Future Directions.In:PLOS Pathogens.Band11,Nr.6,11. Juni 2015,S.e1004833,doi:10.1371/journal.ppat.1004833,PMID 26066650.
- ↑Joan L. Slonczewski, John W. Foster:Mikrobiologie: Eine Wissenschaft mit Zukunft.2. Auflage. Spektrum Akademischer Verlag, Berlin/Heidelberg 2012,ISBN 978-3-8274-2909-4,S. 854.
- ↑R. Cavicchioliet al.:Pathogenic archaea: do they exist?In:Bioessays.Band 25, Nr. 11, 2003, S. 1119–1128.PMID 14579252;doi:10.1002/bies.10354
- ↑abRustam I. Aminov:Role of archaea in human disease.In:Frontiers in Cellular and Infection Microbiology.Band3,1. Januar 2013,doi:10.3389/fcimb.2013.00042,PMID 23964350.
- ↑W. Martin:Pathogenic archaebacteria: do they not exist because archaebacteria use different vitamins?In:Bioessays,Band 26, Nr. 5, 2004, S. 592–593;PMID 15112239,doi:10.1002/bies.20044.
- ↑R. Cavicchioli, P. Curmi:Response to William Martin's letter.In:Bioessays,Band 26, Nr. 5, 2004, S. 593;doi:10.1002/bies.20043.
- ↑Tageszeitung28. Februar 2024, Ilse Bullerdiek:„Mikrobiologische Forschung: Ur-Enzyme fressen Plastik “