Arzneimittel
EinArzneimittel(abgeleitet von „Arznei “,mittelhochdeutsch'arzenīe,aucherzenīe:„Heilkunde,Heilkunst, Heilmittel, Arzneimittel,Pharmazie“;[1]verwandt mit „Arzt“) oder gleichbedeutendMedikament(lateinisch, abgeleitet wiemedicinavon derselben Wurzelmed-,medicamentumundmedicamensowieremedium:„Heilmittel “, kurz Medis), genannt auchPharmakonundTherapeutikum,ist ein Stoff (Arzneistoff) oder eine Zubereitung aus Stoffen, der bzw. die „zur Heilung oder zur Verhütung menschlicherKrankheiten“bestimmt ist oder sich zur BeeinflussungphysiologischerFunktionen eignet oder eine medizinischeDiagnoseermöglicht.[2]
Diese Definition beruht auf der ausführlicheren Formulierung im grundlegenden gesetzlichen Regelwerk der Europäischen Union (EU), der Richtlinie2001/83/EG[3](Gemeinschaftskodex für Humanarzneimittel). Die Definition aus den EU-Richtlinien ist mittlerweile in etliche nationale Arzneimittelgesetze eingeflossen, darunter auch in dasdeutsche Arzneimittelgesetz.Der gelegentlich synonym gebrauchte BegriffHeilmittelwurde bereits im 19. Jahrhundert auch als Überbegriff angesehen und wurde in der deutschen Gesetzgebung um 1981 bewusst (zur Aussonderung aus der Erstattungspflicht der Krankenkassen) vom „Arzneimittel “unterschieden.[4]Arzneimittel für Tiere (Tierarzneimittel) wurden in der EU mit Wirkung zum 28. Januar 2022 in ein eigenes Recht ausgegliedert.[5]
Die BezeichnungArznei[6]aus der gehobenen Allgemeinsprache und frühere Bezeichnung von „zur Abgabe an den Verbraucher hergerichtete Arzneimittel “um 1980 gebräuchlich[7]gewesen, wird in der Fachsprache nicht mehr verwendet. Die WortformArzenei[8]ist veraltet. Die Behandlung mit Arzneimitteln wird alsMedikation,[9]Arzneimitteltherapie,Arzneitherapie,Pharmakotherapieodermedikamentöse Therapie/Behandlungbezeichnet.
Arzneimittelbegriff
[Bearbeiten|Quelltext bearbeiten]Die WHO definierte Arzneimittel als Substanz, die dazu verwendet wird oder dafür vorgesehen ist, zum Nutzen der Menschen physiologische Funktionen oder pathologische Zustände zu beeinflussen bzw. zu untersuchen.[10] Bei der in der Einleitung genannten Definition des Arzneimittelbegriffes gemäß europäischer Regelungen ist als wesentlich die zweifache Bedeutung hervorzuheben, nämlich hinsichtlich der
- Zweckbestimmung des Mittels, losgelöst von einer tatsächlichen Wirksamkeit (Arzneimittel nach der Bezeichnung,Präsentationsarzneimittel)
- Existenz einer pharmakologischen, immunologischen oder metabolischen Wirkung im behandelten menschlichen oder tierischen Organismus (Arzneimittel nach der Wirkung,Funktionsarzneimittel).[11]
Das bedeutet, es sind sowohl Produkte, die zum Zweck der Heilung oder Krankheitsverhütung angewendet werden bzw. angewendet werden sollen, losgelöst von einer tatsächlichen Wirkung, als Arzneimittel einzustufen wie auch Produkte, die keinen Heilanspruch erheben, jedoch aufgrund ihrer speziellen Zusammensetzung eine Wirkung entfalten. Diese Einstufung ist wichtig, da Arzneimittel unter ein anderes Recht fallen alsLebensmittel,KosmetikaoderMedizinprodukte(Problematik derProduktabgrenzung).
Heilmittelhingegen umfassen andere medizinisch unterstützende Maßnahmen wieBadekuren,Massagen,ErgotherapieoderKrankengymnastik.
Deutschland
[Bearbeiten|Quelltext bearbeiten]In der Bundesrepublik Deutschland erfolgte die erste Festlegung des Begriffs Arzneimittel durch eine nicht umfassende Legaldefinition im Jahr 1961 und orientiert sich nur an der Fähigkeit eines solchen Mittels, Einfluss auf Beschaffenheit, Funktion oder auch den Zustand eines menschlichen oder tierischen Körpers zu nehmen.[12]
Das deutsche Arzneimittelgesetz hat die europäischen Arzneimitteldefinitionen für Human- und Tierarzneimittel übernommen und unter nur leichter Abwandlung des Wortlauts in§ 2Absatz 1 vereint.
Auch die sogenannte „Zweifelsfall-Regelung “aus Artikel 2 Absatz 2 der Richtlinien 2001/83/EG und 2001/82/EG wurde in das AMG übernommen. Sie besagt, dass die Regelungen des Arzneimittelgesetzes auch dann anzuwenden sind, wenn ein Produkt sowohl unter die Arzneimitteldefinition als auch unter die Definition anderer Produktgruppen (beispielsweise Lebensmittel,Nahrungsergänzungsmittel,Medizinprodukte,Biozideoder Kosmetika) fällt.
Das Arzneimittelgesetz definiert darüber hinaus in§ 4als spezielle Erscheinungsform eines Arzneimittels dieFertigarzneimittel:Dies sind
[…] Arzneimittel, die im Voraus hergestellt und in einer zur Abgabe an den Verbraucher bestimmten Packung in den Verkehr gebracht werden oder andere zur Abgabe an Verbraucher bestimmte Arzneimittel, bei deren Zubereitung in sonstiger Weise ein industrielles Verfahren zur Anwendung kommt oder die, ausgenommen in Apotheken, gewerblich hergestellt werden. Fertigarzneimittel sind nicht Zwischenprodukte, die für eine weitere Verarbeitung durch einen Hersteller bestimmt sind.
Im Gegensatz zu Fertigarzneimitteln werden sogenannteRezeptur- und DefekturarzneimittelinApothekenhergestellt.
Weiterhin differenziert das AMG die Arzneimittel je nach Beschaffenheit oder Anwendungsbereich inBlutzubereitungen,Sera,Impfstoffe,Allergene,Fütterungsarzneimittel,Arzneimittel für neuartige Therapien(auch ATMPs genannt;Advanced Therapy Medicinal Products), sowie inradioaktive,xenogene,homöopathische,anthroposophischeundpflanzlicheArzneimittel.
Österreich
[Bearbeiten|Quelltext bearbeiten]In Österreich ist die europäische Arzneimitteldefinition noch nicht vollständig umgesetzt. Arzneimittel sind in§ 1Abs. 1 Arzneimittelgesetz definiert:
„Arzneimittel “sind Stoffe oder Zubereitungen aus Stoffen, die
- 1. zur Anwendung im oder am menschlichen oder tierischen Körper und als Mittel mit Eigenschaften zur Heilung oder zur Linderung oder zur Verhütung menschlicher oder tierischerKrankheitenoder krankhafter Beschwerden bestimmt sind, oder
- 2. im oder am menschlichen oder tierischen Körper angewendet oder einem Menschen oder einem Tier verabreicht werden können, um entweder
- a) die physiologischen Funktionen durch eine pharmakologische, immunologische oder metabolische Wirkung wiederherzustellen, zu korrigieren oder zu beeinflussen, oder
- b) als Grundlage für eine medizinische Diagnose zu dienen.
Die Definition ist nahezu wortidentisch zu der im deutschen Arzneimittelgesetz vor Inkrafttreten der 15. AMG-Novelle im Juli 2009.
Außerdem gelten als Arzneimittel solche Gegenstände, die ein Arzneimittel enthalten oder auf die ein Arzneimittel aufgebracht ist, und die zur Anwendung am oder im menschlichen oder tierischen Körper bestimmt sind sowie Stoffe und Zubereitungen aus Stoffen, die die Merkmale des Absatz 1 nicht aufweisen, sofern sie dazu bestimmt sind, für die Herstellung von Arzneimitteln verwendet zu werden.
Schweiz
[Bearbeiten|Quelltext bearbeiten]In der Schweiz definiert Artikel 4 desHeilmittelgesetzes(HMG) Arzneimittel im Sinne des Gesetzes so:
Produkte chemischen oder biologischen Ursprungs, die zur medizinischen Einwirkung auf den menschlichen oder tierischen Organismus bestimmt sind oder angepriesen werden, insbesondere zur Erkennung, Verhütung oder Behandlung von Krankheiten, Verletzungen und Behinderungen; zu den Arzneimitteln gehören auch Blut undBlutprodukte.
Das Heilmittelgesetz kennt unter anderem den Begriff „Arzneimittel der Komplementärmedizin “. Unter diesen Begriff fallen nach der Komplementär- und Phytoarzneimittelverordnung namentlich „asiatische, homöopathische (einschließlich homöopathisch-spagyrische/spagyrische) sowie anthroposophische Arzneimittel “; unter asiatischen Arzneimitteln werdenchinesische,tibetischeoderayurvedischeArzneimittel verstanden.[13]
Arzneimittelbezeichnung und Klassifizierung
[Bearbeiten|Quelltext bearbeiten]Angesichts der großen Vielfalt an Arzneimitteln und einer unüberschaubaren Zahl volkstümlicher Bezeichnungen[14]ist es wichtig, dass diese eindeutige Bezeichnungen tragen, um potentiell gefährliche Verwechslungen zu vermeiden. Für Fertigarzneimittel wurden deshalb feste Regeln für die Bezeichnung eingeführt. Als Name des Arzneimittels wird oft ein vom Hersteller vorgeschlagener, von den Behörden genehmigter Phantasiename verwendet,[15]der zugleich oft alsHandelsnamegeschützt ist. Alternativ wird der von derWeltgesundheitsorganisationvergebene, auf denArzneistoffbezogeneInternationale Freiname,teils in Verbindung mit dem Herstellernamen oder anderen Zusätzen, als Arzneimittelname verwendet. Dies ist bei Generika häufig der Fall. Der Freiname muss bei Arzneimitteln mit bis zu drei Wirkstoffen in jedem Fall angegeben werden.[16]Der Freiname ist nicht nur eine frei verwendbare eindeutige Bezeichnung für den Arzneistoff, aus bestimmten Kennsilben im Namen kann auch die Wirkstoffklasse abgeleitet werden.[17]
Zur systematischen Ordnung der Arzneimittelvielfalt wurden Klassifikationssysteme entwickelt, die Arzneimittel nach Stoffgruppen oder Diagnosegruppen einteilen. Ein viel gebräuchliches System ist das von der Weltgesundheitsorganisation koordinierteAnatomisch-Therapeutisch-Chemische Klassifikationssystem.Dieses nutzt die Organe für den Hauptwirkort, Therapiegruppen sowie die chemische Struktur, um Substanzen, alsoArzneistoffeund teilweise auch Kombinationen, zu kategorisieren. Für den deutschen Arzneimittelmarkt gibt es eine angepasste amtliche deutsche Version.[18]
Arzneimittelinformation
[Bearbeiten|Quelltext bearbeiten]Zuverlässige Information zur Qualität, Wirksamkeit und Unbedenklichkeit ist unerlässlich für die sichere Anwendung von Arzneimitteln. Bei Fertigarzneimitteln ist die amtlicheZusammenfassung der Merkmale des Arzneimittelsein zentrales Dokument, von dem sich ein großer Teil der Arzneimittelinformation ableitet.[19]Dort werden beispielsweise Zusammensetzung, Anwendungsgebiete, Dosierung, Gegenanzeigen, Nebenwirkungen und Wechselwirkungen angegeben. AlsFachinformationwird die Information von den Herstellern vor allem für Fachkreise bereitgestellt; auch diePackungsbeilagefür den Verbraucher leitet sich inhaltlich von diesem Dokument ab. Vorschriften zur Bezeichnung von Arzneimitteln sowie zu Pflichtinformationen, die der Hersteller für Anwender und Verbraucher bereitstellen muss, sind imArzneimittelrechtgeregelt.
Arzneimittelverzeichnis
[Bearbeiten|Quelltext bearbeiten]Arzneimittelverzeichnisseerleichtern das Finden von Informationen über Arzneimittel. Weite Verbreitung haben kommerzielle Verzeichnisse wie dieRote Listeoder die Gelbe Liste, die die Zusammensetzung von Fertigarzneimitteln, deren Anwendungsgebiet, die Dosierung, den Hersteller, den Preis und andere Details angeben. Zur Information der Öffentlichkeit wurden amtliche, frei zugängliche Arzneimittelinformationssysteme aufgebaut, darunterEudraPharmfür die EU undPharmNet.Bundfür Deutschland. In Österreich sind derAustria-Codex[20]bzw. dasArzneispezialitätenregister[21]maßgebend. Für die Schweiz gibt es dasArzneimittel-Kompendium der Schweiz.Weitere international bedeutende Listen sind dieBritish National Formularyund dieListe der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation.
Arzneibuch
[Bearbeiten|Quelltext bearbeiten]DasArzneibuchdeckt einen anderen Bereich der Information ab als die Arzneimittelverzeichnisse. Es verzeichnet die gebräuchlichenArzneistoffe,HilfsstoffeundArzneiformen.Dort werden alle für die Arzneimittelprüfung wichtigen Spezifikationen (qualitative und quantitative Grenzwerte) und Prüfmethoden in detaillierten Monographien beschrieben. Fertigarzneimittel sind im Arzneibuch aus systematischen Erwägungen heraus grundsätzlich nicht erfasst. Laienmedizinische Anwendungen und in derHausapothekeverwendete Arzneimittel (Hausarzneien[22]) finden sich in sogenannten[23]Hausarzneibüchern.
Entwicklung
[Bearbeiten|Quelltext bearbeiten]Arzneimittel sind meist keine Reinstoffe, sondern Zubereitungen vonArzneistoffenmitHilfsstoffenund werden heute zum weit überwiegenden Teil vonPharmaunternehmenals so genannteFertigarzneimittelentwickelt und hergestellt.
Die Entwicklung neuer Arzneimittel umfasst die Identifizierung und nichtklinische Entwicklung neuer Wirkstoffe (Arzneistoffe), die galenische Entwicklung vonArzneiformensowie dieklinische Prüfung.Wegen der umfangreichen und langwierigen vorgeschriebenen Wirksamkeits- und Verträglichkeitsprüfungen ist die Entwicklung einesinnovativenArzneimittels sehr teuer. Neue Wirkstoffe werden deshalb von den Entwicklernpatentiert,sie können somit nur vom Patentinhaber kommerziell verwendet werden. Erst nach Ablauf des Patentschutzes können andere Firmen billigereGenerika-Präparatemit dem gleichen Wirkstoff auf den Markt bringen. Jährlich kommen nur wenige innovative neue Arzneimittel auf den Markt. Die Entwicklung eines Arzneimittels ohne neuen Wirkstoff, beispielsweise eine neue Arzneiform eines bekannten Arzneistoffs oder ein Generikum, ist weit weniger aufwendig.
Nichtklinische Entwicklung
[Bearbeiten|Quelltext bearbeiten]In der nichtklinischen Entwicklung werden neue Wirkstoffe identifiziert, verbessert und in geeigneten experimentell-pharmakologischen Testsystemen auf ihre Eignung als Arzneistoff untersucht.[24]Die Entwicklung schließt eine umfangreicheToxizitätsbestimmungeinschließlich vorgeschriebenerTierversucheein.
Die neuen Stoffe könnensynthetische StoffeoderNaturstoffeaus Pflanzen, Tieren oder Mikroorganismen sein. Oft werden großeMolekülbibliothekendurchsucht, aus denen am Ende nur einige wenige neue Stoffe zur weiteren Entwicklung geeignet sind. Seit dem Ende des 20. Jahrhunderts werden auch vermehrtgentechnischhergestellte Stoffe eingesetzt.
DiePharmazeutische TechnologieoderGalenikentwickelt die Arzneiform eines fertigen Arzneimittels aus einem (oder mehreren) Arzneistoffen und einem (oder mehreren)Hilfsstoffen.Durch die Galenik kann die Freisetzungsgeschwindigkeit, der Ort der Freisetzung und der Ort der Wirkung beeinflusst werden.
Klinische Prüfung
[Bearbeiten|Quelltext bearbeiten]Für die Zulassung eines Humanarzneimittels ist dessen Prüfung inklinischen Studienam Menschen vorgeschrieben. Diese umfassen:[24]
- Phase I: Überprüfung der Aufnahme des Arzneistoffs und erste qualitative Überprüfungen der (Neben-)Wirkungen an einem kleinen Kreis in der Regel gesunder Probanden (ca. 10–50 Probanden).
- Phase II: Qualitative und quantitative Überprüfungen der Wirkungen und Nebenwirkungen eines Arzneistoffs und Dosisfindung für Phase III der klinischen Prüfung (ca. 100–500 Patienten).
- Phase III: Quantitativer Nachweis derWirksamkeiteines Arzneimittels gegenüber einemPlacebooder einer anderen Kontrolle unter definierten Bedingungen (meist über 1.000 Patienten).
- (Phase IV): Nach erteilter Zulassung werden Arzneimittel weiter inLangzeitstudienuntersucht.
Die meisten experimentellen Arzneimittel scheitern im Verlauf der klinischen Prüfung. Nur ca. 8 % der in Phase I untersuchten Mittel erreichen am Ende die Zulassung.[24]
Herstellung
[Bearbeiten|Quelltext bearbeiten]Die Arzneimittelherstellung umfasst die Produktion des Arzneimittels in seiner gewünschten Arzneiform, aber auch die Beschaffung der Ausgangsmaterialien und die Verpackung sowie die Qualitätssicherung. Die Herstellung findet heute zum größten Teil industriell inPharmaunternehmenstatt, dieEigenherstellung von Arzneimittelnin Apotheken (und wie im Mittelalter etwa auch durchWundärzteund Laienärzte[25]) spielt nur noch eine geringe Rolle.
Arzneiformen
[Bearbeiten|Quelltext bearbeiten]
Arzneistoffe werden meist nicht als reiner Stoff verwendet, sondern in einer besonderenArzneiformzubereitet. Die Zubereitung soll in der Anwendung eine sichere Dosierbarkeit erlauben und die Wirkung des Arzneistoffs optimieren. Dazu werden die Arzneistoffe mit Hilfsstoffen in verschiedenen Herstellungsverfahren verarbeitet. Die am häufigsten hergestellten Formen sindTablettenundKapseln;zusammen stellen diese ca. 80 % der verwendeten Arzneimittel.[26]Neben festen Arzneiformen sind noch flüssige Formen zurInjektionoderInfusion,sowie zur oralen Anwendung (z. B. Sirup),Salbenzur äußerlichen Anwendung sowieAerosoleund Lösungen zurInhalationgebräuchlich; weitere Sonderformen kommen nur recht selten zum Einsatz.
Produktion
[Bearbeiten|Quelltext bearbeiten]
Die Herstellungsverfahren derpharmazeutischen Technologiesind je nach Arzneiform sehr verschieden. Bei der häufigsten Form, der Tablette, werden beispielsweise die Ausgangsstoffe eingewogen und gemischt, meist zur besseren Verarbeitbarkeit granuliert und dann erst trocken zu Tabletten gepresst.[26]Diese werden anschließend oft noch mit einem Überzug versehen, der ihnen besondere Eigenschaften wie beispielsweise Gleitvermögen, Säurefestigkeit, Form und Farbe verleiht.
Die Produktion muss unter kontrollierten, keimarmen Bedingungen erfolgen. Arzneimittel zur Injektion müssensterilhergestellt werden. Besonders aufwändig ist die Herstellungbiologischer Arzneimittel,bei denen geringe Abweichungen im Verfahren zu großen Unterschieden in der Wirkstärke führen können. Die gesamte Herstellung wird von einer laufenden Qualitätssicherung überwacht. Dabei ist die Beschaffenheit des Arzneimittels, insbesondere Identität, Gehalt und Reinheit, zu kontrollieren. Alle Herstellungsschritte müssen ausführlich dokumentiert werden.[27]
Verpackung und Kennzeichnung
[Bearbeiten|Quelltext bearbeiten]
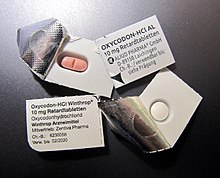
Die Verpackung samt ihrer Kennzeichnung ist ein fester Bestandteil einesFertigarzneimittels.Sie muss im Rahmen der Zulassung genehmigt werden. Feste Arzneiformen werden oft inSichtverpackungen(Blistern), die inFaltschachtelnverpackt werden, abgegeben.
Fertigarzneimittel müssen in derEuropäischen Unionunter anderem mit dem Namen des Arzneimittels, der Stärke und der Darreichungsform, dem internationalen Freinamen, dem Namen des Pharmaunternehmens, derPackungsgröße,demVerfalldatumund derChargennummergekennzeichnet sein.[16]Ebenso sind Hinweise für die Aufbewahrung vorgeschrieben (etwa außerhalb der Reichweite von Kindern, ggf. bestimmte Lagerungstemperaturen). Darüber hinaus können von Land zu Land weitere Kennzeichen gesetzlich vorgeschrieben oder handelsüblich erforderlich sein.
In Deutschland wird beispielsweise die für die Logistik und die Abrechnung wichtigePharmazentralnummermitCode 39verwendet. Dazu haben die betroffenen Spitzenverbände der Apotheken und Krankenkassen sich gemäß § 300 SGB V (Fünftes Buch) vertraglich geeinigt, bei der Arzneimittelabrechnung die PZN als Identifikationsschlüssel zu verwenden. Zu diesem Zweck übertragen die Apotheken die PZN der zu Lasten der GKV abgegebenen Arzneimittel maschinenlesbar auf die Verordnungsblätter. Der Pharmahandel nutzt PZN für Bestellung, Fakturierung, Logistik und für das Lagerwesen. Hierbei dienen PZN als Artikel-/ Bestellnummern in (elektronischen) Bestellaufträgen zwischen Industrie, Pharmazeutischen Großhandlungen und Apotheken, auf Lieferscheinen und Rechnungen. Sie unterstützen die Tourenplanung und -verfolgung, die Identifikation der gelieferten Waren beim Wareneingang und im Warenlager. In diesem Zusammenhang spielt das ThemaStrichcodierungeine zentrale Rolle.
Rechtsvorschriften
[Bearbeiten|Quelltext bearbeiten]Die Arzneimittelherstellung ist durch nationale, europäische und internationale Regelwerke geregelt. Damit soll die Versorgung der Bevölkerung mit qualitativ hochwertigen Arzneimitteln sichergestellt werden. Arzneimittelhersteller benötigen eine behördliche Herstellungserlaubnis, für deren Erteilung geeignete und ausreichende Räume, technische Einrichtungen und Kontrollmöglichkeiten vorhanden sein müssen.[28]In der Europäischen Union muss für den Hersteller einesachkundige Personbescheinigen, dass jede Charge eines Arzneimittels entsprechend den Spezifikationen und Vorschriften hergestellt und geprüft worden ist. Die Einhaltung derGuten Herstellungspraxis,die eine ordnungsgemäße, hygienische, gut dokumentierte und kontrollierte Herstellung vorschreibt, wird durch behördliche Inspektionen überprüft.[27]
Verkehr
[Bearbeiten|Quelltext bearbeiten]Das so genannteInverkehrbringenbeinhaltet nach dem deutschen AMG (§ 4,Abs. 17) „das Vorrätighalten zum Verkauf oder zu sonstiger Abgabe, das Feilhalten, das Feilbieten und die Abgabe an andere. “In vielen Ländern ist der Verkehr mit Arzneimitteln durch dasArzneimittelrechtstreng reguliert. Arzneimittel dürfen nur nach behördlicher Zulassung in den Verkehr gebracht werden. Die Abgabe von Arzneimitteln an Endverbraucher ist für verschiedene Kategorien von Arzneimitteln unterschiedlich streng reglementiert. DieArzneimittelwerbungunterliegt in vielen Ländern einer gesonderten Rechtsprechung.
Zulassung
[Bearbeiten|Quelltext bearbeiten]Fertigarzneimittel bedürfen in vielen Ländern einer behördlichen Genehmigung, bevor sie in den Verkehr gebracht werden dürfen. Zweck dieser Regelung ist es, die Bevölkerung vor schädlichen oder unwirksamen Arzneimitteln zu schützen. Das Pharmaunternehmen muss in einem Zulassungsantrag die Wirksamkeit, Unbedenklichkeit und Qualität des Arzneimittels belegen. Entscheidend für die Zulassung durch die zuständigeArzneimittelbehördeist, dass die Beurteilung der Unterlagen für das Arzneimittel ein günstigesNutzen-Risiko-Verhältnisergibt. Die mit dem Antrag bei der Behörde vorzulegendeDokumentationist detailliert geregelt.[29]
In der Europäischen Union wurden einheitliche Verfahren eingeführt, die eine Zulassung in mehreren Mitgliedstaaten ermöglichen. Für bestimmte Arzneimittel, darunter gentechnisch hergestellte Arzneimittel und Arzneimittel mit neuen Wirkstoffen gegen HIV, Krebs, Diabetes und einige weitere Krankheiten ist die Antragstellung bei derEuropäischen Arzneimittelagenturfür eine EU-weite Zulassung zwingend vorgeschrieben.[29]Für andere Arzneimittel kann der Zulassungsantrag bei der jeweils zuständigen nationalen Behörde gestellt werden, in Deutschland bei demBundesinstitut für Arzneimittel und Medizinprodukteoder demPaul-Ehrlich-Institut,in Österreich bei der in derÖsterreichischen Agentur für Gesundheit und Ernährungssicherheit(AGES) angesiedelten Medizinmarktaufsicht.
Die Schweiz führt Zulassungen unabhängig von der EU durch, zuständig ist hier dieSwissmedic.In denUSAerfolgt die Zulassung durch dieFDA.
In den letzten Jahren wurden in der EU und in den USA spezielle Vorschriften und Verfahren für die Zulassung vonOrphan-Arzneimittelnund Kinderarzneimitteln eingeführt, um in diesen vernachlässigten Gebieten die Entwicklung zu fördern.
Die Verordnung eines zugelassenen Arzneimittels in einerIndikationoder Patientengruppe außerhalb der erteilten Zulassung wird alsOff-Label-Usebezeichnet.[30]Die in Einzelfällen vorzeitig geduldete Anwendung eines noch nicht zugelassenen Arzneimittels aus humanitären Erwägungen nennt man auchCompassionate Use.
Abgabe
[Bearbeiten|Quelltext bearbeiten]Die Abgabe von Arzneimittel an den Endverbraucher ist streng geregelt.[30]PharmaunternehmenundPharmagroßhandelbeliefern in der Regel nurApothekenundKrankenhausapotheken;die weitaus meisten Arzneimittel dürfen nur von Apotheken an den Endverbraucher abgegeben werden. Damit soll eine fachkundige Beratung der Verbraucher sichergestellt werden.
In Deutschland können Arzneimittel nach Abgabeerlaubnis in vier Gruppen eingeteilt werden:
- freiverkäufliche, d. h. nicht apothekenpflichtige (Verkauf auch außerhalb von Apotheken)[31]
- apothekenpflichtige(Abgabe nur in Apotheken)
- verschreibungspflichtige(Abgabe nur in Apotheken gegen Vorlage einer ärztlichen, zahnärztlichen oder tierärztlichenVerschreibung)
- Betäubungsmittel(Abgabe in Apotheken nur gegen Vorlage einesBetäubungsmittelrezeptes)
Die ersten beiden Gruppen von Arzneimitteln werden zusammen auch alsOTC-Arzneimittel(von engl. „over the counter “= über die Ladentheke) bezeichnet. Im Jahr 2007 waren von allen in Deutschland zugelassenen Arzneimitteln 60 % verschreibungspflichtig, 34 % apothekenpflichtig und 5 % frei verkäuflich. Betäubungsmittel machten ein Prozent aus.[32]
In der Schweiz existieren entsprechend fünfAbgabekategorien:
- Kategorie A: In der Regel einmalige Abgabe auf ärztliche Verschreibung; Dauerrezepte sind seit 2018 jedoch möglich. Kategorie A+ sind Betäubungsmittel auf besonderem Rezept.
- Kategorie B: In der Regel auf ärztliche Verschreibung, Dauerrezepte je nach Kanton 1 oder 2 Jahre lang gültig. Bei bestimmten, häufigen Erkrankungen ist kein Rezept notwendig.
- Kategorie C: Abgabe in Apotheken. Diese Kategorie wurde im Jahr 2019 aufgelöst. 15 % der Mittel wurden in die Kategorie B eingeteilt, 85 % in die Kategorie D.
- Kategorie D: Abgabe in Apotheken und Drogerien
- Kategorie E: Abgabe ohne Fachberatung, auch in Supermärkten
Im Jahr 2005 fielen 59 % aller in der Schweiz zugelassenen Arzneimittel in die Kategorien A und B, 10 % in die Kategorie C und 31 % in die Kategorien D und E.[33]
Die Voraussetzungen, die erfüllt sein müssen, um Arzneimittel abgeben zu dürfen, sind von Land zu Land verschieden. In Deutschland dürfen nurApothekerApotheken besitzen und apothekenpflichtige Humanarzneimittel abgeben. In manchen anderen europäischen Ländern, darunter auch Österreich und einige Kantone der Schweiz, haben auch bestimmte Ärzte ein solchesDispensierrecht.Tierärzte dürfen auch in DeutschlandTierarzneimittelaus einerTierärztlichen Hausapothekeabgeben.[30]
Anwendung
[Bearbeiten|Quelltext bearbeiten]Arzneimittel werden unter vielfältigen Umständen angewendet, von der eigenverantwortlichenSelbstmedikationbis hin zur Gabe durch Fachärzte unter intensiver stationärer Überwachung. In jedem Fall ist die Wahl eines für das Anwendungsgebiet geeigneten Mittels entscheidend. Dabei können Arzneimittel in verschiedenen Arzneiformen über verschiedene Anwendungsarten gegeben werden.
Anwendungsgebiet
[Bearbeiten|Quelltext bearbeiten]Unter medizinischen Gesichtspunkten ist entscheidend, ein für das Anwendungsgebiet, die so genannteIndikation,geeignetes Arzneimittel anzuwenden. Dabei sind Gegenanzeigen oderKontraindikationenundArzneimittelwechselwirkungenzu beachten. Eine Verordnung eines Arzneimittels außerhalb der in der Zulassung genannten Anwendungsgebiete (Off-Label-Use) erfordert eine besondere Aufklärung des Patienten durch den Arzt.[30]
Die im Jahr 2007 in Deutschland am häufigsten verordneten Arzneimittelgruppen warenACE-HemmerundSartanezur Behandlung desBluthochdrucks,Antibiotikagegen bakterielle Infektionen,EntzündungshemmerundAntirheumatika,Schmerzmittel,Betablockerbei Herz-Kreislauferkrankungen undAntidiabetikabeiDiabetes mellitus.[34]
Verordnung
[Bearbeiten|Quelltext bearbeiten]Die Anwendung der weitaus meisten Arzneimittel erfolgt auf ärztliche Verordnung. Ärzte sind angehalten, beim Ausstellen einesRezeptesneben der medizinischen Notwendigkeit auch die Möglichkeit einer nichtmedikamentösen Behandlung, die Wirtschaftlichkeit sowie weitere rechtliche Vorgaben zu berücksichtigen.[35]Unterlassen Ärzte beim Einsatz von Medikamenten, die sich lebensgefährlich auswirken können, die gebotene lückenlose ärztliche Kontrolle, kann dies zu berufsrechtlichen Sanktionen führen.[36]Der Arzneimittelverordnung sollte eine für den Patienten individuelle Nutzen-Risiko-Abwägung vorausgehen.
Anwendungsart
[Bearbeiten|Quelltext bearbeiten]Für Arzneimittel gibt es eine Reihe verschiedener Anwendungsarten oderApplikationsformen.Man kann beispielsweise innerliche und äußerliche,örtlicheundkörperweiteApplikationen unterscheiden. Am häufigsten ist dieperoraleGabe durch den Mund, da diese vom Patienten einfach selbstständig durchzuführen ist und entsprechende Arzneiformen günstig herzustellen sind. Arzneimittelgaben durchInjektionsind aufwändiger und müssen in der Regel durch medizinisches Fachpersonal durchgeführt werden. Bei bestimmten chronischen Erkrankungen wie Diabetes mellitus können Patienten geschult werden, sich selbst Injektionen zum Beispiel vonInsulinpräparatenzu verabreichen.
Qualitätssicherung
[Bearbeiten|Quelltext bearbeiten]Um Schädigungen durch unsachgemäße Anwendung von Arzneimitteln zu vermeiden, sindQualitätssicherungsmaßnahmenerforderlich. Ärzte können bei der Verordnung neben der jeweiligen Fachinformation herstellerunabhängigeTherapieleitlinienheranziehen, die für viele Erkrankungen den Stand der Wissenschaft darlegen.[37]EDV-Lösungen können bei Unstimmigkeiten zwischen Diagnosen und Verordnungen oder bei zu erwartenden Wechselwirkungen entsprechende Hinweise geben. Apotheker sind bei der Abgabe von Arzneimitteln verpflichtet, die ärztliche Verordnung auf Irrtümer zu überprüfen und die Qualität des abzugebenden Arzneimittels zu kontrollieren. Pflegekräfte sollen beim Richten und Verabreichen von Arzneimitteln Prinzipien wie die so genannte 5-R-Regel anwenden: richtiger Patient, richtiges Arzneimittel, richtige Dosierung und/oder Konzentration, richtige Applikationsart, richtiger Zeitpunkt.[38]
Viele Patienten müssen im Laufe eines Tages mehrere Arzneimittel einnehmen. Um die Einnahme zu erleichtern, werden oftMedikamentendispensereingesetzt. Eine andere Möglichkeit ist die individuelle Verblisterung von Arzneimitteln durch eine Apotheke. Hierbei werden die verschiedenen verschriebenen Fertigarzneimittel für den Patienten in eine Sichtverpackung umverpackt. Nach dem deutschen Arzneimittelgesetz ist für eine solche Verblisterung keine Zulassung erforderlich.(§ 21,Abs. 2, 1b. (b))
Die korrekte Medikation und Einhaltung der5R-Regel(„richtige Person, richtiges Medikament, richtige Dosierung, richtige Applikationsform und richtiger Zeitpunkt “) wird in Krankhausapotheken oft durch das sogenannteUnit-Dose-Systemunterstützt. Hierbei werden Arzneimittel in patientenunabhängige Unit Doses umverpackt. Beim darauffolgenden Umverpackungsprozess, der vollautomatisiert ist, wird jede Einzeldosis mit einem Label versehen. Auf dem Label sind die Angaben von der Originalverpackung, wie beispielsweise das Ablaufdatum versehen. Durch die Einzelverpackungen werden Kontaminierungen durch andere Medikamente vermieden und die Informationen aus der Originalverpackung gehen nicht verloren.[39]
Die verordneten Arzneimittel sowie die entsprechenden Einnahmevorschriften werden in einemMedikationsplandokumentiert.
Wirkungen
[Bearbeiten|Quelltext bearbeiten]Arzneimittel und die in ihnen enthaltenen Arzneistoffe interagieren auf vielfältige Weise mit dem menschlichen oder tierischen Körper.[40]Diese Wechselwirkungen untersucht diePharmakologie.Sie studiert den zeitlichen Verlauf der Arzneistoffmenge im Körper nach Gabe ebenso wie die Wirkstärke und die Wirkmechanismen am Wirkort und letztlich die Auswirkungen auf den Körper insgesamt. Die erwünschten Wirkungen von Arzneimitteln („Wirksamkeit “) werden oft von Nebenwirkungen begleitet, die meist unerwünscht sind. Die Abwägung des Nutzens gegenüber dem Risiko ist stets individuell abzuwägen.
Pharmakokinetik
[Bearbeiten|Quelltext bearbeiten]Die Pharmakokinetik betrachtet den zeitlichen Verlauf derKonzentrationeines Arzneistoffs im Körper nach Gabe des Arzneimittels.[40]Um ihre Wirkung im Körper ausüben zu können, müssen Arzneimittel beziehungsweise die in ihnen enthaltenen Arzneistoffe Gelegenheit erhalten, den Wirkort zu erreichen. Beispielsweise müssen Tabletten nach dem Schlucken zuerst im Magen oder im Darm zerfallen, dann muss der freigesetzte Arzneistoffresorbiertund ins Blut aufgenommen werden. Die Verteilung im Körper erfolgt durch denBlutkreislauf,der den Arzneistoff auch zum Wirkort transportiert. Gleichzeitig wirken weitere Körperfunktionen auf den Arzneistoff ein. Durch den Stoffwechsel kann er verändert oder abgebaut werden. DieseBiotransformationkann den Arzneistoff unwirksam machen, aber auch schädliche Abbauprodukte erzeugen. Schließlich werden Arzneistoffe oder ihre Abbauprodukte auch wieder ausgeschieden, meist über dieNiereoder dieGalle.
Pharmakodynamik
[Bearbeiten|Quelltext bearbeiten]Die Pharmakodynamik untersucht die Wirkung des Arzneistoffs am Wirkort.[40]Definitionsgemäß üben Arzneimittel eine pharmakologische,immunologischeodermetabolischeWirkung auf die Körperfunktionen aus.[41]Dies erfolgt in der Regel durch hochselektive Wechselwirkungen mit bestimmten Körperbestandteilen. Der Wirkmechanismus der meisten Arzneistoffe beruht darauf, an bestimmte Zielstrukturen im Körper zu binden (im menschlichen Körper gibt es einige hundert verschiedene Zielstrukturen). Dies sind oftMembranrezeptorenoderEnzyme,deren Funktion durch den Arzneistoff aktiviert oder gehemmt wird. Dadurch werden die Körperfunktion und der Krankheitsverlauf beeinflusst.
Die Stärke der pharmakologischen Wirkung hängt in der Regel von derDosisdes Arzneimittels ab. Dies lässt sich in einerDosis-Wirkungs-Beziehungdarstellen. Nicht alle Wirkungen eines Arzneimittels sind erwünscht. Aus den Dosis-Wirkungs-Beziehungen für die erwünschten und die unerwünschten Wirkungen lässt sich die sogenanntetherapeutische Breiteeines Arzneimittels ableiten. Diese ist ein Maß für die Sicherheit: Je größer die therapeutische Breite, desto sicherer ist das Arzneimittel in der Anwendung.
Wirksamkeit
[Bearbeiten|Quelltext bearbeiten]Die Wirksamkeit eines Arzneimittels ist die Summe seiner erwünschten Wirkungen für das jeweilige Anwendungsgebiet.[42]Arzneimittel werden insbesondere angewendet, um Krankheiten zu erkennen, zu verhüten, zu lindern oder zu heilen. Dieses Ziel geht weit über eine rein pharmakologische Wirkung hinaus. Arzneimittel sollen je nach Bestimmung eine therapeutische Wirksamkeit, eine diagnostische Eignung oder eine präventive Wirkung haben, die inklinischen Studienbelegt wurde. Dies ist eine Voraussetzung für die Arzneimittelzulassung.
Nicht alle Arzneimittel vermögen Krankheiten zu heilen oder die Krankheitsursachen zu behandeln. Oft beschränkt sich die Wirksamkeit auf eineBesserung von Symptomen.
Nebenwirkungen
[Bearbeiten|Quelltext bearbeiten]Die Wirksamkeit wird fast immer vonNebenwirkungenbegleitet. Eine Nebenwirkung (in der Fachsprache auch „unerwünschte Arzneimittelwirkung “genannt) ist eine bei normalem Gebrauch auftretende Wirkung, die schädlich und unbeabsichtigt ist.[43]Bekannte Nebenwirkungen sind in der Packungsbeilage zusammen mit ihrer Häufigkeit dokumentiert.
Die Abwägung von Nutzen und Risiken ist ein zentrales Problem in der Entwicklung, Zulassung und Anwendung von Arzneimitteln. In schweren Fällen können Nebenwirkungen zu dauerhaften körperlichen Schäden führen. Treten solche Schäden nach bestimmungsgemäßem Gebrauch des Arzneimittels auf, dann kann das Pharmaunternehmen dafür haften.
Wechselwirkungen
[Bearbeiten|Quelltext bearbeiten]Die Wirkung von Arzneimitteln wird dadurch verkompliziert, dass sich verschiedene Arzneimittel gegenseitig beeinflussen können.[40]Diese Arzneimittelwechselwirkungen (Interaktionen) können bis zum vollständigen Wirkungsverlust eines Mittels oder auch zu schweren Nebenwirkungen führen. Folgende Arten der Wechselwirkung werden unterschieden:
- pharmakodynamische Interaktion – Wechselwirkung der Arzneistoffe am selben Wirkort (oder dieselbe Körperfunktion betreffend)
- pharmakokinetische Interaktion – Wechselwirkung bei der Aufnahme, der Verteilung, der Verarbeitung durch den Stoffwechsel oder der Ausscheidung
- pharmazeutische Interaktion – Wechselwirkung, die auf Unverträglichkeit der Stoffe beruht
- Auch manche Lebensmittel können die Wirkung bestimmter Arzneimittel beeinflussen.
Insbesondere bei einerMultimedikationsind Arzneimittelwechselwirkungen ein großes Problem, da die Wahrscheinlichkeit von Wechselwirkungen mit der Zahl der Arzneimittel rasch zunimmt. In diesem Zusammenhang ist auch neben der allgemeinen Schaffung größerer Übersichtlichkeit ein detaillierter Medikamentenplan, der laut neuemE-Health-Gesetzesentwurf ab Oktober 2016 von ärztlicher Seite aus pflichtausgehändigt werden soll, als sinnvoll zu erachten. So lassen sich potentielle Wechselwirkungen leichter recherchieren und von erfahrenen Ärzten eventuell auf einen Blick erkennen, was ansonsten aufgrund situations- und aufregungsbedingt im Arztgespräch vergessener Medikamente durchaus untergehen kann zum Nachteil der Therapiesicherheit und des -erfolgs.
Missbrauch
[Bearbeiten|Quelltext bearbeiten]Wegen ihrer Wirkungen werden manche Arzneimittel auch immer wieder missbraucht. Besonders problematisch ist der oft mit einer Abhängigkeit verbundeneMedikamentenmissbrauchbeispielsweise vonBenzodiazepinenundOpiaten.In Deutschland wird die Zahl der medikamentenabhängigen Menschen auf 1,4 bis 1,9 Millionen geschätzt.[44]
Ein anderer Bereich, in dem Arzneimittel missbräuchlich eingesetzt werden, ist dasDoping.Hier kommt es durch Einsatz von illegal beschafften bedenklichen Mitteln und durch Fehlgebrauch immer wieder zu schweren Arzneimittelschäden.
Überwachung
[Bearbeiten|Quelltext bearbeiten]Fertigarzneimittel werden nach der Zulassung laufend auf das Auftreten unerwünschter Wirkungen hin überwacht, um unerwartete, bisher unbekannte und seltene Nebenwirkungen zu erfassen.[45]Der Grund hierfür ist, dass bei der Zulassung nur wenige tausend Patienten behandelt wurden, wodurch seltene Nebenwirkungen nicht erfasst werden können. Auch Langzeitschäden sind zum Zeitpunkt der Zulassung meist nicht absehbar.
Deshalb müssen Ärzte und Apotheker Verdachtsfälle solcher Nebenwirkungen melden. Die pharmazeutischen Unternehmer sind gesetzlich verpflichtet, unerwünschte Wirkungen – selbst wenn es nur Verdachtsfälle sind – je nach Schwere entweder kurzfristig oder zu vorgeschriebenen Berichtszeitpunkten der Zulassungsbehörde anzuzeigen. Sie müssen regelmäßig Datenbanken und die Literatur analysieren und auswerten und die Ergebnisse an die zuständigen Behörden berichten, die wiederum die Meldungen bewerten. In Deutschland ergreifen dann dasBfArModer dasPEIbei Bedarf nach einemStufenplanverfahrenentsprechende Maßnahmen, um gesundheitliche Risiken abzuwenden. Das können Auflagen zur Arzneimittelinformation oder Einschränkungen der Zulassung sein; in seltenen Fällen werden Arzneimittel sogar ganz vom Markt genommen.
Ökonomie und Gesundheitssysteme
[Bearbeiten|Quelltext bearbeiten]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Arzneimittel zählen zu den wichtigsten Werkzeugen der Medizin. Sie sind einerseits ein bedeutendes Wirtschaftsgut, das in manchen Industrieländern erheblich zur Handelsbilanz beiträgt, andererseits ein großer Kostenfaktoren für die Gesundheitssysteme. Deshalb ist in vielen Ländern ein dichtes Geflecht an jeweils spezifischen Regulierungen zur Preisbildung und zur Kostenübernahme entstanden. Diese sind auch in der EU nicht harmonisiert.
Die Arzneimittelausgaben allerOECD-Länder lagen 2007 bei über 650 Mrd. US $.[47]Damit entfielen im Schnitt 15 % aller Gesundheitsausgaben auf diesen Bereich, der nach der Krankenhausbehandlung und der ambulanten Versorgung der drittgrößte Kostenfaktor ist.
Weltweit und auch in Deutschland besteht ein Trend zu höheren Preisen für neue Arzneimittel: kostete 2011 eine Packung im Durchschnitt (ungewichtetes Mittel) 180 €, lagen die Packungspreise im August 2021 dagegen bei 1225 €. Neue Arzneimittel, die seit August 2018 angeboten werden, kosten im Durchschnitt 51.189 € pro Packung (2011: 902 €). Den aktuellen Spitzenplatz nimmtLibmeldyzur Behandlung einer seltenen Erbkrankheit bei Kindern mit dem Listenpreis von knapp 2.900.000 € ein.[48][49]
2007 gaben die USA mit weitem Abstand am meisten pro Kopf für Arzneimittel aus, gefolgt von Kanada und Griechenland. Deutschland und die Schweiz liegen im Mittelfeld, etwas über dem OECD-Durchschnitt.[47]
Deutschland
[Bearbeiten|Quelltext bearbeiten]Im Jahr 2004 wurden Arzneimittel im Wert von 36,1 Mrd. € abgegeben.[32]Zwei Drittel der Kosten trugen die gesetzlichen Krankenversicherungen (GKV), weitere 22 % private Haushalte. Von den Ausgaben der Haushalte waren wiederum ein DrittelSelbstbeteiligungen,der Rest ging in dieSelbstmedikation.Die Arzneimittelkosten zu Lasten der GKV waren 2004 mit 308 € je Versichertem im internationalen Vergleich moderat.[32]Dazu trägt ein Generikaanteil von über 50 % der Verordnungen bei.
2012 gaben die gesetzlichen Krankenkassen in Deutschland 29,4 Milliarden Euro für Arzneimittel aus[50],2018 betrug dies 38,7 Milliarden Euro.[51]
| Rang | Handelsname | Wirkstoff | Mio. Euro |
|---|---|---|---|
| 1 | Humira | Adalimumab | 844 |
| 2 | Xarelto | Rivaroxaban | 691 |
| 3 | Eliquis | Apixaban | 633 |
| 4 | Revlimid | Lenalidomid | 569 |
| 5 | Zytiga | Abirateronacetat | 340 |
Bei verschreibungspflichtigen Arzneimitteln werden dieAbgabepreisedurch dieArzneimittelpreisverordnunggeregelt. Das hohe Preisniveau von Arzneimitteln wird kritisiert.[32]
Versicherte in der deutschen GKV haben nach demSGB Vim Wesentlichen Anspruch auf Versorgung mit verschreibungspflichtigen Arzneimitteln. Dieser Anspruch wird durch dieArzneimittel-RichtliniedesG-BAkonkretisiert. Um das Wachstum der Arzneimittelausgaben zu bremsen, wurden für viele ArzneimittelgruppenFestbeträgeeingeführt, die den maximalen Preis festlegen, der von der GKV übernommen wird. 2010 wurde dasGesetz zur Neuordnung des Arzneimittelmarktes(AMNOG) verabschiedet: überArzneimittel-Rabattverträgekönnen Krankenversicherungen mit Herstellern Vergünstigungen aushandeln. Auch wurde eineKosten-Nutzen-Bewertung von Arzneimittelndurch dasIQWiGeingeführt, auf deren Grundlage der G-BA die Versorgung mit einzelnen Arzneimitteln beschränken kann. 2011 und 2012 wurden insgesamt 120 Millionen Euro eingespart.[50]
| Rang | Handelsname | Wirkstoff | Mio. Packungen |
|---|---|---|---|
| 1 | Novaminsulfon | Metamizol | 24,2 |
| 2 | Ibuflam | Ibuprofen | 19,1 |
| 3 | RamiLich | Ramipril | 12,2 |
| 4 | L-Thyroxin Henning | Levothyroxin | 9,7 |
| 5 | Amlodipin dexcel | Amlodipin | 7,8 |
LautBundesinstitut für Arzneimittel und Medizinprodukte(BfArM) haben sich seit den 2010er Jahren Lieferengpässe in der Arzneimittelversorgung stark ausgeweitet. Wurden der BfArM als Aufsichtsbehörde 2013 lediglich 40 Arzneien mit Lieferproblemen neu gemeldet, waren es 2018 schon 264 Medikamente. Thomas Preis, Chef des Apothekerverbands Nordrhein, gab an, dass 2019 Apotheken im Durchschnitt deutlich mehr als 100 Medikamente feststellen, die nicht lieferbar sind. Als Ursache gilt, dass immer weniger Hersteller/Fabrikstandorte einen Wirkstoff produzieren und die Produktion immer häufiger aus betriebswirtschaftlichen Gründen ins Ausland verlagert worden ist.[53]Für 2018 habe es an einer einzigen Universitätsklinik in Deutschland 133 Lieferengpässe gegeben, veranschaulichte Frank Dörje, Präsident des Bundesverbandes Deutscher Krankenhausapotheker, die Größenordnung der Problemlage. Betroffen seien insbesondere schwerkranke Patienten. Immerhin habe das Arzneimittel-Versorgungsstärkungsgesetz (VSG) 2017 die Hersteller verpflichtet, eigene Lieferengpässe unverzüglich an die Krankenhäuser zu melden.[54]Das BfArM hat zuletzt im März 2019 eine „Liste der als versorgungsrelevant bzw. mit einem akut erhöhten Versorgungsrisiko eingestuften Wirkstoffe “veröffentlicht.[55]
Schweiz
[Bearbeiten|Quelltext bearbeiten]Im Jahr 2012 wurden Arzneimittel im Wert von 5,649 Mrd. Franken abgegeben, ohne die im stationären Spitalbereich abgegebenen Medikamente, deren Kosten auf 700 Mio. Franken geschätzt werden.[56]Die Arzneimittel machen 22 % der ambulanten Kosten derobligatorischen Krankenpflegeversicherungaus. Die Ausgaben pro Kopf lagen 2012 bei 700 Franken.[56]Die Grundversicherung zahlt nur Arzneimittel in der Spezialitätenliste, einerPositivliste für Arzneimittel,die gleichzeitig Höchstpreise enthält, bis zu denen Kosten übernommen werden. Im Jahr 2016 sind die Ausgaben für Arzneimittel zu Lasten der Grundversicherung im Vergleich zum Vorjahr um rund 6 Prozent gestiegen. Sie beliefen sich damit auf über 7 Mrd. Franken, was rund einem Viertel der Grundversicherungskosten entspricht.[57]In der Schweiz werden 54 % des Umsatzes mit patentgeschütztenOriginalpräparatengemacht, etwa 20 % mit Originalen ohne Patentschutz und etwa 20 % mit Generika. Selbstbehalteregelungen, die Generika gegenüber Originalpräparaten begünstigen, wurden 2006 eingeführt und sollen deren Verwendung fördern.[56]
Arzneimittelpreise werden in der Schweiz durch die Krankenpflege-Leistungsverordnung geregelt. Preisvergleiche zwischen europäischen Ländern zeigen, dass Arzneimittel in der Schweiz besonders teuer sind.[56]
Österreich
[Bearbeiten|Quelltext bearbeiten]Österreich gilt bei Arzneimitteln als „Billigpreisland “.[58] Im Jahr 2007 wurden Arzneimittel im Wert von 2,822 Mrd. € auf Kosten der GKV abgegeben.[58]Damit haben Arzneimittel (mit Mehrwertsteuer) 21,4 % der Ausgaben der Krankenversicherungsträger ausgemacht. Die Arzneimittelausgaben pro Einwohner lagen 2008 bei 326 € ohne Mehrwertsteuer.[58]Arzneimittel müssen imErstattungskodexverzeichnet sein, wenn sie von der Sozialversicherung bezahlt werden sollen; die Aufnahme in den Kodex ist oft mit Preisvereinbarungen verbunden. Patienten werden in den meisten Fällen über eineRezeptgebühran den Arzneimittelkosten beteiligt.
Arzneimittelrückstände
[Bearbeiten|Quelltext bearbeiten]Arzneimittel enthalten aufgrund ihrer Bestimmung in der Regel biologisch hochaktive Stoffe, die oft auch relativ stabil sind und im Körper oder in der Umwelt nur langsam abgebaut werden. Da eine unbeabsichtigte Aufnahme von Arzneimitteln zu Gesundheitsschäden führen kann, müssen auch deren Rückstände beachtet werden.
Rückstände in Lebensmitteln
[Bearbeiten|Quelltext bearbeiten]Tierarzneimittel,die beiLebensmittelliefernden Tieren eingesetzt werden, können eine Gefährdung für den Menschen darstellen. Deshalb ist die Verwendung von Arzneimitteln in der Tierproduktion gesetzlich geregelt. Schon bei der Zulassung von Tierarzneimitteln werden gesundheitliche Risiken durch Rückstände bewertet und die Lebensmittelsicherheit beurteilt.[59]So legt in der EU dieVerordnung (EG) Nr. 470/2009 über Rückstandshöchstmengen pharmakologisch wirksamer Stoffe in Lebensmitteln tierischen UrsprungsHöchstmengen von Rückständen fest, die für den Menschen als unbedenklich gelten. Nach der Anwendung von Tierarzneimitteln müssen oft vorgeschriebene Wartezeiten eingehalten werden, bevor das behandelte Tier in die Lebensmittelherstellung gelangen darf. Lebensmittel werden von Behörden laufend stichprobenartig auf Arzneimittelrückstände geprüft.
Rückstände in der Umwelt
[Bearbeiten|Quelltext bearbeiten]Arzneimittel, ihre Inhaltsstoffe und deren Abbauprodukte gelangen auf vielfältige Weise in die Umwelt, wo sie unter Umständen Menschen, Tiere und Ökosysteme gefährden können.
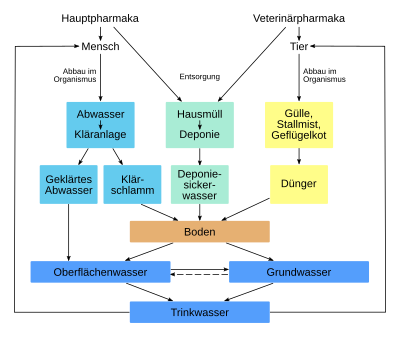
Eintragsquellen sind neben den Ausscheidungen (Urin, Kot) von Mensch und Tier auch das unsachgemäße Entsorgen ungebrauchter Arzneimittel über die Kanalisation, beispielsweise über die Toilette, das Waschbecken oder das Ausspülen von Behältern mit Resten von Medikamenten. Entgegen der weit verbreiteten Annahme ist die Entsorgung von geringen Mengen an Altarzneimitteln über den Hausmüll aus Sicht der Abfallwirtschaft unbedenklich für die Umwelt. Denn seit 2005 werden Siedlungsabfälle in Deutschland verbrannt oder enthaltene Schadstoffe durch eine Vorbehandlung inaktiviert. Erst danach erfolgt die Deponierung. Allein der Sicherheitsaspekt – Hausmülltonnen sind häufig frei zugänglich – lässt diesen Entsorgungsweg bedenklich erscheinen. Das Umweltbundesamt rät deshalb, abgelaufene oder ungenutzte Medikamente in Apotheken oder Schadstoffsammelstellen abzugeben. Weiterhin können Schadstoffmobile genutzt werden. Enthält der Beipackzettel Entsorgungshinweise, ist diesen Folge zu leisten.[60]
Durch verbesserteAnalysetechnikenwerden seit etwa Mitte der 1990er Jahre vermehrt Arzneimittelrückstände inOberflächen-,Grund-[61]undTrinkwässernnachgewiesen.[62]Allerdings sind die Konzentrationen so niedrig, dass eine akute pharmakologische Wirkung nicht zu erwarten ist.[63]Andererseits sind die Stoffmengen in Gewässern durchaus mit denen vonPflanzenschutzmittelnvergleichbar. Eine möglicheÖkotoxizitätwird daher vermehrt beachtet. Mit dem Antrag auf Zulassung eines Arzneimittels muss der Antragsteller deshalb seit einigen Jahren auch eine Umweltrisikobewertung vorlegen. Auf der Ebene derEuropäischen Unionwird der Schutz der Gewässer vor Arzneimittelrückständen in derWasserrahmenrichtlinieseit 2013 zusammen mit weiterenSpurenstoffenbetrachtet.
2019 konnte in Österreich in sämtlichen 40 untersuchtenFließgewässernzwischen 35 und 69 Arzneimittelwirkstoffe und-metabolitennachgewiesen werden.[64] Besonders kritisch werden Rückstände vonAntibiotikain der Umwelt angesehen, da befürchtet wird, dass sich beiBakterienAntibiotikum-Resistenzenausbilden, die die Wirksamkeit von Antibiotika gegen Krankheitserreger einschränken.[65]
Um die Arzneimittelbelastung des Abwassers zu verringern, gibt es verschiedene Ansätze. Kläranlagen sollen verbessert undKlärschlämmenicht mehr auf Böden aufgebracht werden.[66]Ein anderer Ansatz ist, nachhaltige Wirkstoffe zu entwickeln, die in der Umwelt biologisch abbaubar sind. Weitere Möglichkeiten liegen in der Infektionsprävention, einer reflektierten Verschreibungspraxis oder auch in der Integration des Themas Arzneimittel in der Umwelt in medizinische Ausbildungsberufe.[67]
Nach Angaben des Umweltbundesamts werden jährlich in Deutschland 30.000 Tonnen Humanarzneimittel verbraucht, mit 2.300Wirkstoffen.Davon sind 1.100 Wirkstoffe ökologisch unbedenklich, soVitamine,Elektrolyteund Peptide, und es bleiben 1.200 Wirkstoffe und ein Jahresverbrauch von 8.100 Tonnen, die als „umweltrelevant “eingestuft werden. Die im Oberflächenwasser vorhandenen Rückstände stammen zu 88 % aus Ausscheidungen, 10 % aus unsachgemäßer Entsorgung von Arzneimitteln und 2 % aus dem Herstellungsprozess. Bis zu 47 % der Patienten würden ihre Restarzneimittel mindestens gelegentlich unsachgemäß entsorgen. Eines der am häufigsten verwendeten Arzneimittel, derEntzündungshemmerDiclofenac,hat einen Jahresverbrauch von 14 MillionenTagesdosenund 90 Tonnen Jahresumsatz in Deutschland, wovon 60–70 % durch natürliche Ausscheidung ins Abwasser gelangen und dort bisher nicht geklärt oder abgebaut werden können. Auch dieSartanealsBlutdrucksenkerfinden sich in hohem Maße im Abwasser wieder, bis zu 70 Tonnen jährlich, und gelten als „humantoxikologisches Risiko “. Andere Mittel mit hohem Absatz und höherer Konzentration im Abwasser sind Ibuprofen (ebenfalls ein Entzündungshemmer),Carbamazepin(gegen Krampfleideneingesetzt),Ethinylestradiol(einHormonpräparat) undSulfamethoxazol(einAntibiotikum).[68]
Tierarzneimittel
[Bearbeiten|Quelltext bearbeiten]Für Tierarzneimittel bestehen einige rechtliche Besonderheiten, die sich großenteils darauf gründen, dass viele Tiere der Gewinnung vonLebensmittelndienen. Aus Gründen desVerbraucherschutzesmüssen Arzneimittel bei lebensmittelliefernden Tieren besonders umsichtig angewendet werden, bestimmte Arzneistoffe sind gar nicht erst erlaubt. Die den EU-Ländern bestehenden Rechtsvorschriften dienen der Durchführung der seit dem 28. Januar 2022 unmittelbar geltendenenVerordnung (EU) 2019/6 über Tierarzneimittel,die dieRichtlinie 2001/82/EG (Gemeinschaftskodex für Tierarzneimittel)ablöste.[69]Zentrale Aspekte der Tierarzneimittel, die EU-weit durch „klare, ausführliche und direkt anwendbare Bestimmungen “der neuen Verordnung geregelt werden, betreffen insbesondere die tierärztliche Verschreibung, Verordnungsmanagement und Monitoringsysteme fürAntibiotika,den Versandhandel sowie dieUmwidmung.
Geschichte
[Bearbeiten|Quelltext bearbeiten]Arzneimittel werden seit Jahrtausenden genutzt.[70]PflanzlicheArzneidrogenund manche andere Stoffe waren schon im Altertum und in der Antike gebräuchlich. Für eine Reihe vonHeilpflanzenfinden sich Hinweise auf ihre Anwendung schon aus vor- und frühgeschichtlicher Zeit. Aus demNeolithikum,der jüngeren Steinzeit, sind eine Reihe von Funden bekannt, die auf die Anwendung von Heilpflanzen schließen lassen. Neben pflanzlichen Arzneistoffen gibt es auch tierische und mineralische.
Antike
[Bearbeiten|Quelltext bearbeiten]Schon zur Zeit der Hochkulturen Mesopotamiens und Ägyptens wurde die Arzneiform Pille, genanntCataputonimCorpus Hippocraticum,[71]erwähnt. Der römische EnzyklopädikerAulus Cornelius Celsusübernahm das griechische Wort alsCatapotium(Plural:Catapotia) und gab als Größe der Pille die einer Erbse oder Bohne an. Die heutige Bezeichnung „Pille “geht über die Formenpillaundpillulaauf daslateinischepilulazurück, eine Verkleinerungsform vonpila(„Ball “), die sich bei dem römischen SchriftstellerPlinius dem Älterenbereits im pharmazeutischen Zusammenhang mit der Bedeutung „Kügelchen “findet. Die Pillen wurden damals durch Kneten der Arzneimasse in der Hand hergestellt.[72]
Die Pharmakotherapie bezeichnete Celsus mit der Diätetik (Regelung der Lebensweise) und der Chirurgie als eines der drei Teile der (antiken) Medizin.[73]
Die zweite beliebte Arzneiform waren Lecksäfte, die bereits in babylonischer Zeit erwähnt wurden. Ein solcher Lecksaft wurde in Griechenlandeclegma(Pluraleclegmata) genannt. Sie wurden hergestellt, indem man die Arzneistoffe zerrieb und mit Honig anrührte. Verabreicht wurden sie den Patienten in einer Muschel.Pliniusbeschrieb, dass man daseclegmaauf der Zunge zergehen lassen muss. Der griechische ArztPedanios Dioskuridesverschrieb Lecksäfte als Lungentherapeutika. Eclegmata können nachGalenin die Gruppen Diamoron (Maulbeersaft), Diacodyon, Diacaryon (Saft aus Nüssen) und Succus de scillae (Meerzwiebelsaft) eingeteilt werden. Diamoron und Diacaryon wurden vonGalenundPaulos von Aiginaals Wund- und Schlundsalben verwendet.[72]Im Mittelalter und später wurde ein solcher Lecksaft als sehr flüssigeLatwergeLinctusund alsDicksaftvon SalsenkonsistenzLohoch(dicker als ein Sirup und dünner als eine Latwerge) bezeichnet.[74]Verwandt mit den Lecksäften (vgl. auch die ArzneiformJulep[75][76]) waren die Elektuarien (lateinischElectuaria,vom griechischen Wort für „auflecken “), die hauptsächlich als „Antidot“,etwa bei Vergiftungen wie z. B. durch Schlangenbisse eingesetzt wurden. In der babylonischen Medizin wurden sie auch bei Lungen- und Brusterkrankungen angewendet.Nikandros von Kolophon(2. Jahrhundert v. Chr.) berichtet in seinen WerkenTheriacaundAlexipharmacaüber die Zusammensetzung und Wirkung der Gegengifte. Beispiele für Elektuarien sind das Heilmittel bei Schlangenbissen „(Antidotum) Mithridat(i)um “vonMithridates Eupator von Pontos,sowie die weiterentwickelte Form „Theriaca Andromachi “von Andromachus, dem LeibarztNeros.Außerdem wurden Elektuarien auch als Laxantien eingesetzt, was aus den Werken vonAlexander von Tralleis,Marcellus EmpiricusundTheodorus Priscianushervorgeht.[77]
In der ägyptischen Medizin im „Papyrus Ebers“sind auch Pulverrezepturen zur innerlichen und äußerlichen Anwendung sowie für Zahnpulver überliefert. Auch imCorpus Hippocraticumsind Pulver beschrieben.Pedanios Dioskuridesbeschreibt zahlreiche Rezepturen zur äußerlichen Anwendung bei Hautkrankheiten, sowie Augen- und Nasenpulver. Innerlich finden Pulver nachDioskuridesAnwendung bei Magen- und Unterleibserkrankungen.
Salben wurden bereits im Papyrus Ebers erwähnt und sowohl in der Medizin als auch in der Kosmetik angewandt.Pliniusüberliefert, dass vor allem die Perser eifrige Salbenbenutzer waren. Laut Corpus Hippocraticum waren sie zusammengesetzt aus Honig, Wasser, Milch, Wein, Ölen oder Fetten, wurden mit Drogen vermengt und anschließend auf die Haut aufgetragen. In der römischen Überlieferung tauchen Salben ausschließlich als Kosmetika auf, die von nicht hoch angesehenen Salbenherstellern (unguentuarii) angerührt wurden.
Bei Abszessen, Furunkeln und äußerlichen Krankheiten fand in der Antike auch das Pflaster (Emplastrum) Anwendung. Bekannt war dasDiachylonpflaster,das der griechische Leibarzt vonKaiser TiberiusMenekrates aus Zeofleta (4 n. Chr.). erfand und auch vonGalenbeschrieben wird.Paulos von Aiginateilte die Pflaster ein in Wundpflaster, vernarbende, zerteilende, erweichende, reifende Pflaster, Zugpflaster und lindernde Pflaster. Die Pflasterherstellung galt damals als sehr kompliziert. Eine einfachere Variante waren breiartige Umschläge sogenannteKataplasmen,bei denen die Arzneistoffe mit Arzneistoffträgern vermischt wurden.[78]
Eine heute nicht mehr bekannte Arzneiform der ägyptischen Medizin ist die Räucherung, durchgeführt an einzelnen Organen wie Nase, Scheide und After. Dabei wurden Harze, Weihrauch, Myrrhe, Benzoe und andere Stoffe verbrannt und der Rauch in das Organ geleitet. Das Räuchermittel „Kuefi “bestehend aus Myrrhe, Wacholderbeeren, Weihrauch, Zypernmastixzweigen, Bockshornklee,KalmusundStyraxgalt als besonders beliebt. Auch imCorpus Hippocraticumwird die Räucherung, sowie spezielle Räucherkerzen beschrieben.CelsusundDioskuridesberichten ebenfalls davon.Paulos von Aiginaüberlieferte, dass die Räucherung das Gehirn öffnet und dort Verstopfungen beseitigt.[79]
Für die Arzneien der westlichen Medizin sind folgende Autoren besonders wichtig:
- Theophrastos von Eresos(371–287 v. Chr.) beschrieb 550 Pflanzen, darunter zahlreiche Arznei- undGiftpflanzen.
- Plinius der Ältere(23/24–79 n. Chr.) schrieb eine höchst umfangreiche enzyklopädischeNaturkunde,dieNaturalis historia.Die Heilmittel nehmen einen breiten Raum ein, es werden beinahe 1000 aus demPflanzenreichbeschrieben.
- Die in fünf Büchern abgefasste ArzneimittellehreDe materia medicades römischen MilitärarztesDioskurides(1. Jahrhundert) ist die umfangreichste des Altertums. Sie behandelt Arzneimittel aus allen drei Naturreichen, es werden 102 mineralische, 101 tierische und 813 pflanzliche Arzneimittel beschrieben. Das Werk erschien um 78 n. Chr. und wirkte über Jahrhunderte. Besonders imMittelalterdiente es als Vorbild und Fundgrube für andere einschlägige Kompendien.
Arzneimittel in der griechisch-römischen Medizin standen im Kontext einer Therapie zur Unterstützung des natürlichen Heilungsprozesses.[80]Dabei fanden einerseits „einfache “Arzneistoffe (Simplicia) Anwendung, die teils auf Volksmedizin, teils auf Empirie beruhten. Andererseits wurden aus der Mischung der Simplicia immer neueCompositakreiert, die gerade in römischer Zeit immer beliebter wurden, wie auch die Verwendung von exotischen Zutaten. Exotische Inhaltsstoffe waren aufgrund der weiten Herkunft hochpreisig und wurden wegen des hohen Wertes vielfach als besonders wirksam erachtet.[81]In diesem historischen Kontext entstanden auchScribonius Largus’Compositiones.
Mittelalter
[Bearbeiten|Quelltext bearbeiten]
Die mittelalterlichen Quellen zum Arzneischatz sind zahlreich. Dazu gehört unter anderem dasLehrgedichtLiber de Cultura HortorumoderHortulusdesWalahfrid Strabo(9. Jahrhundert), der Abt desKlosters Reichenauwar. Das Wissen über die Heilkräfte der Pflanzen wird in Gedichtform (Hexameter) vermittelt. Ebenfalls ein Lehrgedicht über Heilpflanzen und durch denHortulusbeeinflusst ist derMacer floridus.Der Verfasser,Odo von Meung,lebte im11. Jahrhundert.Eine vom13. Jahrhundertan überlieferte thüringisch-schlesische Prosaübersetzung und -bearbeitung, der „Ältere deutsche Macer “, war weit verbreitet und diente neben anderen Quellen als Textgrundlage für den „Gart der Gesundheit“von 1485, eines der einflussreichsten gedrucktenKräuterbücher.Zudem wird das europäische Mittelalter etwa vom Jahr 1000 an mit verloren geglaubten oder in Vergessenheit geratenen Schriften derAntikedurchÜbersetzungenaus dem Arabischen ins Lateinische bekannt. Die Zentren der Übersetzertätigkeit liegen in Süditalien (Salerno) und Spanien (Toledo). Dazu kommen eigenständige Erkenntnisse arabischer Gelehrter.Abu Bakr Mohammad Ibn Zakariya al-Razi(865 bis etwa 930),Avicenna(980–1037) und andere arabische Autoren zählen zu den hochgeachteten Autoritäten der europäischen Heilkunde. In ihren Schriften werden bislang unbekannteArzneidrogenbeschrieben, zum BeispielAmbra,Benzoeharz,Cubeben,Galgant,Kampfer,Moschus,Muskat,Mumie(sieheMumia),Sandelholz,Sennesblätterund andere.
Auch unabhängig vom antiken oder arabischen Einfluss werden hier und da neue, eigenständige Beobachtungen gemacht, die das Wissen über den Arzneischatz bereichern. Herausragend sind diePhysicaderHildegard von Bingenund eine Schrift desAlbertus Magnusmit dem TitelDe vegetabilibus.
Frühe Neuzeit
[Bearbeiten|Quelltext bearbeiten]Seit der frühenNeuzeitwurde der europäische Arzneischatz[82]erheblich erweitert. Nach der Entdeckung des Seeweges nach Ostindien durchVasco da Gamaund die Landung inAmerikadurchKolumbuseröffnete sich eine neue Dimension im Handel mit Heilpflanzen und Drogen. So kamen beispielsweiseBrechwurzel,Chinarinde,Curare,GuajakundPerubalsamnach Europa.
Einflussreich war auch dieAlchemiederAraber,da hier eine medizinische Zielrichtung in den Vordergrund trat: die Suche nach derPanazee,der Universalmedizin. Der wichtigste Wegbereiter für den Einsatz (al)chemischerPräparatein der Medizin wurde Philippus Theophrastus Bombastus von Hohenheim, genanntParacelsus(1493–1541). Er vertrat als Erster die innerliche Anwendung vonChemikalien,gerade von giftigenAntimon- undQuecksilberpräparaten.Zwar fanden seine Lehren zu seinen Lebzeiten nur einen beschränkten Anhängerkreis, doch seine Nachfolger, dieParacelsisten,vermittelten seine Ideen einem immer größer werdenden Kreis von Medizinern und anderen Gelehrten. Paracelsus entwickelte Heilmittel auf Basis von Alkohol, die – später verbessert durch Valerius Cordus – alsHoffmannsche Tropfen(Ether und Alkohol) seit 1560 sehr beliebt waren.
Johann Rudolph Glauber(1604–1670) stellteNatriumsulfatdar und erprobte es als Heilmittel, nach ihm wird Natriumsulfat auch „Glaubersalz “genannt. Er fand antiseptische Eigenschaften von Phenol und isolierte Alkaloide mit Schwefelsäure und Salpetersäure. Damit war er ein früher Vertreter derpharmazeutischen Chemie.
18. bis 20. Jahrhundert
[Bearbeiten|Quelltext bearbeiten]

Zu den Fortschritten der Pharmakotherapie im 18. Jahrhundert gehört die 1785 erfolgte Bekanntgabe der Wirkung derDigitalisglykosideaus der PflanzeDigitalisauf das kranke Herz durchWilliam Withering.Um 1804 isolierteFriedrich Wilhelm Adam SertürnerdasMorphinausOpium,1811 entdeckteBernard CourtoisdasJodin Meeresalgenasche.[84]Zu Beginn des 19. Jahrhunderts wurde der Arzneischatz zunächst wieder reduziert: Übrig blieben Arzneimittel, deren Wirksamkeit nach dem damaligen Stand der Wissenschaft als gesichert galt. Dabei war deren Herstellung ausschließlich Apothekern vorbehalten.
Der Erkenntniszuwachs in derChemieführte dazu, dass eine Fülle von wirksamen Inhaltsstoffen ausArzneipflanzenisoliert wurden, etwa die AlkaloideChinin(entdeckt um 1819), Morphin,Strychnin.Nicht nurAlkaloide,auch viele weitere Pflanzeninhaltsstoffe wurden isoliert und davon eine große Zahl arzneilich verwendet. Dies wurde durch die Einführung von neuen Apparaturen und Geräten in der Apotheke ermöglicht: 1823 erfand der Apotheker Petit aus Corbeil die Pulverisiertrommel und 1833 der Pariser ApothekerPierre Francois Guillaume Boullay(1777–1869) diePerkolationsmethode,die die Extraktionspresse verdrängte.
Gegen Ende des 19. Jahrhunderts begann der Siegeszug derorganisch-synthetischenArzneimittel, die von derTeerfarben-Industrie entwickelt wurden, wobei das Herstellungsverfahren demPatentschutzunterlag. Dies förderte ganz erheblich dieindustrielleProduktion von Arzneispezialitäten, den in abgabefertiger Verpackung hergestellten Arzneimitteln, wie sie heute das Bild beherrschen und die Einzelherstellung in der Apotheke weitgehend ersetzen. DieAcetylsalicylsäure,bekannt unter dem Namen Aspirin, viele andereSchmerzmittelund weitere auf dasNervensystemwirkende Arzneistoffe gehören hierher (Narkosemittel,Antiepileptika,Parkinsonmittel,Psychopharmakaund andere). Weitere Beispiele sind Arzneimittel, die dasvegetative Nervensystembeeinflussen, etwa die Sympatholytika (zu denen dieBetablockerzählen), die zur Behandlung vonHerz-Kreislauf-Erkrankungeingesetzt werden. Die Zahl der synthetisierten Wirkstoffe wurde rasch unüberschaubar.
Bei denHormonenundVitaminengab es in der Folgebiochemischer,physiologisch- und klinisch-chemischer Untersuchungen des 19. und 20. Jahrhunderts zahlreiche Fortschritte. Dabei wurden unter anderem die Grundlagen für den therapeutischen Einsatz von Vitaminen,Insulin,denSexualhormonen(Estrogene,Gestagene,die „Pille“,Androgene), den Hormonen derNebennierenrinde(Glukokortikoidewie Cortison),Schilddrüsenhormonen,denGewebshormonenund ihrenAntagonisten(beispielsweise Antihistaminika alsAntiallergika) gelegt.
Besondere Bedeutung erlangten Arzneimittel zur Vorbeugung und Therapie derInfektionskrankheiten,basierend auf dem Konzept derZauberkugelvonPaul Ehrlichaus dem Jahr 1900. Dazu gehören vor allemAntibiotika,Impfstoffesowie Mittel zurDesinfektionund Sterilisation. Mit ihrer Hilfe, aber auch durch bessere Ernährung und Wohnung sowie infolge verbesserterHygiene,sind einst lebensbedrohliche Erkrankungen („Geißeln der Menschheit “), die aufMikroorganismenzurückgehen, stark zurückgegangen. Zu nennen sind hier die Forschungen von Paul Ehrlich (1854–1915) (Arsphenamin) undGerhard Domagk(1895–1964) (Sulfonamide). Dazu kam die Entdeckung, dassNaturstoffewie das vonSchimmelpilzengebildetePenicillinalsAntibiotikaerfolgreich gegen diese Krankheiten eingesetzt werden können.
Siehe auch
[Bearbeiten|Quelltext bearbeiten]Literatur
[Bearbeiten|Quelltext bearbeiten]Pharmakologie und Toxikologie
- W.E. Haefeli, M. Seibert-Grafe und C.H. Gleiter:Arzneimittel–Kombinationstherapie,Kommissionsverlag Michael Itschert, Sankt Augustin 2002,ISBN 3-89796-102-4.
- Felix Haffneru. a.:Normdosen gebräuchlicher Arzneistoffe und Drogen.28. Auflage. Loseblattausgabe. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2023,ISBN 978-3-8047-4394-6
- Ernst Mutschler,G. Geisslinger,Heyo K. Kroemer,S. Menzel, P. Ruth:Arzneimittelwirkungen: Pharmakologie – Klinische Pharmakologie – Toxikologie.10. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2012.
Geschichte
- Erwin Heinz Ackerknecht:Wendepunkte in der Geschichte der Pharmakotherapie.In:Schweizerische Apotheker-Zeitung.Band 95, 1957, S. 751–757.
- Nicholas Eschenbruch, Viola Balz, Ulrike Klöppel, Marion Hulverscheidt:Arzneimittel des 20. Jahrhunderts. Historische Skizzen von Lebertran bis Contergan.Transcript, Bielefeld 2009,ISBN 978-3-8376-1125-0.
- Theodor Husemann:Arzneimittel.In: Ewald Geissler,Josef Moeller(Hrsg.):Real-Encyclopädie der gesammten Pharmacie. Handwörterbuch für Apotheker, Ärzte und Medicinalbeamte,Band 1. Wien/Leipzig 1886, S. 635 f.
- Wolf-Dieter Müller-Jahncke,Christoph Friedrich,Ulrich Meyer:Arzneimittelgeschichte.2., überarb. und erw. Auflage. Stuttgart 2005,ISBN 3-8047-2113-3.
- Wolf-Dieter Müller-Jahncke,Christoph Friedrich:Geschichte der Arzneimitteltherapie.Deutscher Apothekerverlag, Stuttgart 1996,ISBN 3-7692-2038-2.
- Rudolf Schmitz:Historische und kritische Betrachtungen zum Begriff „Arzneimittel “.In:Deutsche Apotheker-Zeitung.Band 116, 1976, S. 1591–1595.
- Rudolf Schmitz:Der Arzneimittelbegriff der Renaissance.In: Rudolf Schmitz,Gundolf Keil:Humanismus und Medizin.Acta humaniora, Weinheim 1984 (=Deutsche Forschungsgemeinschaft: Mitteilungen der Kommission für Humanismusforschung.Band 11),ISBN 3-527-17011-1,S. 1–21, hier: S. 1–6.
- Rudolf Schmitz:Geschichte der Pharmazie.Band I:Von den Anfängen bis zum Ausgang des Mittelalters.Govi-Verlag, Eschborn 1998,ISBN 3-7741-0706-8.
- Rudolf Schmitz,Wolf-Dieter Müller-Jahncke,Christoph Friedrich:Geschichte der Pharmazie.Band II:Von der Frühen Neuzeit bis zur Gegenwart.Govi-Verlag, Eschborn 2005,ISBN 3-7741-1027-1.
- Wolfgang Schneider:Lexikon zur Arzneimittelgeschichte: Sachwörterbuch zur Geschichte der pharmazeutischen Botanik, Chemie, Mineralogie, Pharmakologie, Zoologie.7 Bände (Band 5 in drei Teilen), Govi Verlag, Frankfurt am Main 1968 bis 1975 (Band 1:Tierische Drogen,Band 2:Pharmakologische Arzneimittelgruppen,Band 3:Pharmazeutische Chemikalien und Mineralien,Band 4:Geheimmittel und Spezialitäten,Band 5:Pflanzliche Drogen,Band 6:Ergänzungen zu Band 3,Band 7:Register).
Kritische Literatur über Arzneimittel
- Marcia Angell:Der Pharma-Bluff. Wie innovativ die Pharmaindustrie wirklich ist.Kompart, Bonn / Bad Homburg 2005,ISBN 3-9806621-9-5.
- Markus Grill:Kranke Geschäfte – Wie die Pharmaindustrie uns manipuliert.Rowohlt, Reinbek 2007,ISBN 978-3-498-02509-0.
- Sonia Shah:Am Menschen getestet!Redline Wirtschaft, München 2008,ISBN 978-3-636-01561-7.
- Ben Goldacre:Die Pharma-Lüge: Wie Arzneimittelkonzerne Ärzte irreführen und Patienten schädigen.(Titel der amerikanischen Originalausgabe 2012:Bad Pharma) Kiepenheuer & Witsch, 2013,ISBN 978-3-462-04577-2.
Arzneimittelmetabolismus
- Karl-Heinz Beyer:Biotransformation der Arzneimittel.Springer Verlag, Berlin / Heidelberg / New York / London / Paris / Tokyo / Hong Kong 1990,ISBN 3-540-50696-9.
- G. Gordon Gibson, Paul Skett:Introduction to Drug Metabolism.Chapman & Hall, London / Glasgow / New York / Tokyo/ Melbourne/ Madras 1986,ISBN 0-412-26390-4.
- S Preissner:database Cytochrome-Drug interactions (Drug metabolism).Nucleic Acids Research,2010,abgerufen am 20. August 2011(englisch).
Weblinks
[Bearbeiten|Quelltext bearbeiten]- Literatur von und über Arzneimittelim Katalog derDeutschen Nationalbibliothek
- Alte Arzneimittel – ein Fall für die Tonne.Webseite des Umweltbundesamts zur Entsorgung von Arzneimitteln
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Frühneuhochdeutsches Wörterbuch.Band 2 (1994), Sp. 206–210.
- ↑Vollständige Definition:
„a) Alle Stoffe oder Stoffzusammensetzungen, die als Mittel mit Eigenschaften zur Heilung oder zur Verhütung menschlicher Krankheiten bestimmt sind, oder b) alle Stoffe oder Stoffzusammensetzungen, die im oder am menschlichen Körper verwendet oder einem Menschen verabreicht werden können, um entweder die menschlichen physiologischen Funktionen durch einepharmakologische,immunologischeodermetabolischeWirkung wiederherzustellen, zu korrigieren oder zu beeinflussen oder eine medizinische Diagnose zu erstellen. “(Begriffsbestimmung im Gemeinschaftskodex für Humanarzneimittel,Richtlinie 2001/83/EG in der konsolidierten Fassung vom 16. November 2012vgl. Artikel 1) - ↑Richtlinie 2001/83/EG in der konsolidierten Fassung vom 16. November 2012.
- ↑Rudolf Schmitz:Der Arzneimittelbegriff der Renaissance.In: Rudolf Schmitz,Gundolf Keil:Humanismus und Medizin.Acta humaniora, Weinheim 1984 (=Deutsche Forschungsgemeinschaft: Mitteilungen der Kommission für Humanismusforschung.Band 11),ISBN 3-527-17011-1,S. 1–21, hier: S. 3.
- ↑Begriffsbestimmung Tierarzneimittel (Verordnung (EU) 2019/6über Tierarzneimittel, Artikel 4):
Für die Zwecke dieser Verordnung bezeichnet der Ausdruck ‚Tierarzneimittel‘ alle Stoffe oder Stoffzusammenstellungen, die mindestens eine der nachstehenden Voraussetzungen erfüllen:
a) Sie sind zur Heilung oder zur Verhütung von Tierkrankheiten bestimmt;
b) sie sind dazu bestimmt, im oder am tierischen Körper angewendet oder einem Tier verabreicht zu werden, um entweder die physiologischen Funktionen durch eine pharmakologische, immunologische oder metabolische Wirkung wiederherzustellen, zu korrigieren oder zu beeinflussen;
c) sie sind dazu bestimmt, bei Tieren zum Zweck einer medizinischen Diagnose verwendet zu werden;
d) sie sind zur Euthanasie von Tieren bestimmt; - ↑Arznei.Duden online
- ↑Rudolf Schmitz:Der Arzneimittelbegriff der Renaissance.1984, S. 3, Anm. 6 (im Gegensatz zu Arzneimitteln als „lose, zur Abgabe an den Verbraucher nicht hergerichtete vorrätig gehaltene Stoffe und Zubereitungen “).
- ↑Arzeneiauf zeno.org
- ↑Medikation.Duden online
- ↑Gerhard Kienle:Arzneimittelsicherheit und Gesellschaft.Stuttgart/ New York 1974, S. 336.
- ↑Präsentationsarzneimittel(vom 3. Mai 2018 imInternet Archive) Website desBundesinstituts für Arzneimittel und Medizinprodukte(BfArM), Glossar, abgerufen am 3. Mai 2018
- ↑Rudolf Schmitz:Der Arzneimittelbegriff der Renaissance.In: Rudolf Schmitz, Gundolf Keil:Humanismus und Medizin.Acta humaniora, Weinheim 1984 (=Deutsche Forschungsgemeinschaft: Mitteilungen der Kommission für Humanismusforschung.Band 11),ISBN 3-527-17011-1,S. 1–21, hier: S. 1 f.
- ↑Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Komplementär- und Phytoarzneimitteln (Komplementär- und Phytoarzneimittelverordnung)HTML.
- ↑Johannes Arends:Volkstümliche Namen der Drogen, Heilkräuter, Arzneimittel und Chemikalien.Berlin 1958; 17. Auflage. Berlin/Heidelberg 2001.
- ↑Richtlinie 2001/83/EG Artikel 1 (20).
- ↑abRichtlinie 2001/83/EG Artikel 54.
- ↑Franz Bracher, Frank Dombeck:Was internationale Freinamen aussagen.In:Pharmazeutische Zeitung.45 (2002)(online)
- ↑Wissenschaftliches Institut der AOK:Anatomisch-therapeutisch-chemische Klassifikation (ATC)(vom 23. Februar 2009 imInternet Archive).
- ↑Richtlinie 2001/83/EG Artikel 11.
- ↑Österreichischer Apotheker-Verlag.Archiviert vom(nicht mehr online verfügbar) am3. Juli 2017;abgerufen am 25. August 2018.
- ↑Arzneispezialitätenregister.Bundesamt für Sicherheit im Gesundheitswesen,abgerufen am 25. August 2018.
- ↑Vgl.Joachim Telle(Hrsg.):Pharmazie und der gemeine Mann. Hausarznei und Apotheke in deutschen Schriften der frühen Neuzeit (Ausstellung der Herzog-August-Bibliothek Wolfenbüttel in der Halle des Zeughauses vom 23. August 1982 bis März 1983).Wolfenbüttel 1982 (=Ausstellungskataloge der Herzog-August-Bibliothek.Band 36).
- ↑Vgl. Birgit Zimmermann:Das Hausarzneibuch. Ein Beitrag zur Untersuchung laienmedizinischer Fachliteratur des 16. Jahrhunderts unter besonderer Berücksichtigung ihres humanmedizinisch-pharmazeutischen Inhalts.Naturwissenschaftliche Dissertation Marburg 1975.
- ↑abcAchim Aigner, Frank Czubayko, Gerhard Klebe, Milton Stubbs:Das Nadelöhr – von der Forschung zur Entwicklung.In: Dagmar Fischer, Jörg Breitenbach (Hrsg.):Die Pharmaindustrie.3. Auflage. Spektrum Akademischer Verlag, Heidelberg 2010,ISBN 978-3-8274-2129-6.
- ↑Wolfgang Wegner:‚Freiberger Arzneimittellehre‘.In:Werner E. Gerabeku. a. (Hrsg.):Enzyklopädie Medizingeschichte.De Gruyter, Berlin / New York 2005,ISBN 3-11-015714-4,S. 437.
- ↑abRobert Becker:Dem Arzneistoff eine Chance – die Arzneiform.In: Dagmar Fischer, Jörg Breitenbach (Hrsg.):Die Pharmaindustrie.3. Auflage. Spektrum Akademischer Verlag, Heidelberg 2010,ISBN 978-3-8274-2129-6.
- ↑abTobias Jung:Menschen, Prozesse, Material – die Produktion.In: Dagmar Fischer, Jörg Breitenbach (Hrsg.):Die Pharmaindustrie.3. Auflage. Spektrum Akademischer Verlag, Heidelberg 2010,ISBN 978-3-8274-2129-6.
- ↑Richtlinie 2001/83/EG in der konsolidierten Fassung vom 26. Januar 2007,abgerufen am 4. Dezember 2011, Artikel 40.
- ↑abManfred Schlemminger:The proof of the pudding – die Zulassung.In: Dagmar Fischer, Jörg Breitenbach (Hrsg.):Die Pharmaindustrie.3. Auflage. Spektrum Akademischer Verlag, Heidelberg 2010,ISBN 978-3-8274-2129-6.
- ↑abcdErwin Deutsch,Andreas Spickhoff:Medizinrecht.Kapitel XXVIII:Arzneimittelverkehr.6. Auflage. Springer, Berlin 2008,ISBN 978-3-540-72467-4.
- ↑Informationen über freiverkäufliche Arzneimittel nach § 50 des Arzneimittelgesetzes.Abgerufen am 17. Juli 2018.
- ↑abcdMichael Simon:Das Gesundheitssystem in Deutschland. Eine Einführung in Struktur und Funktionsweise.Kapitel 7:Die Arzneimittelversorgung.2. Auflage. Huber, Bern 2008,ISBN 978-3-456-84135-9.
- ↑Fridolin Marty:MedikamenteIn: Gerhard Kocher, Willy Oggier (Hrsg.):Gesundheitswesen Schweiz 2007–2009.Huber, Bern 2007,ISBN 978-3-456-84422-0.
- ↑Ulrich Schwabe, Dieter Paffrath (Hrsg.):Arzneiverordnungsreport2008Kapitel 1:Arzneiverordnungen 2007 im Überblick.Springer, Heidelberg 2008,ISBN 978-3-540-69218-8.
- ↑Arzneimittelkommission der deutschen Ärzteschaft:Arzneiverordnungen.Kapitel A:Vorschriften und Ratschläge für die Verordnung.20. Auflage. Deutscher Ärzteverlag, Köln 2003,ISBN 3-7691-1140-0.
- ↑VG Berlin, Urteil vom 2. November 2011,Az. 90 A 3.08, Volltext.
- ↑Rainer Lasek,Bruno Müller-Oerlinghausen:Therapieempfehlungen der Arzneimittelkommission der deutschen Ärzteschaft.In:Z Arztl Fortbild Qualitatssich.Band 91, 1997, S. 375–383;PMID 9340209.
- ↑Antje Jelinek, Rainer Danz (Hrsg.):Arzneimittel. Lehrbuch für Pflegeberufe.Kapitel 3:Umgang mit Arzneimitteln.Fischer & Urban, München 2005,ISBN 3-437-26290-4.
- ↑Die 5r Regel und das Unit-Dose-Konzept.30. August 2021,abgerufen am 7. September 2022.
- ↑abcdErnst Mutschler, Gerd Geisslinger, Heyo Kroemer, Peter Ruth, Monika Schäfer-Korting:Arzneimittelwirkungen.9. Auflage. Wiss. Verlagsges., Stuttgart 2008,ISBN 978-3-8047-1952-1.
- ↑Richtlinie 2001/83/EG in der konsolidierten Fassung vom 26. Januar 2007,abgerufen am 4. Dezember 2011, Artikel 1 (2).
- ↑Karl Feiden, Hermann Pabel:Wörterbuch der PharmazieBand 3:Arzneimittel- und Apothekenrecht.Wiss. Verlagsges., Stuttgart 1985,ISBN 3-8047-0670-3.
- ↑Richtlinie 2001/83/EG in der konsolidierten Fassung vom 26. Januar 2007,abgerufen am 4. Dezember 2011, Artikel 1 (11).
- ↑Drogenbeauftragte der Bundesregierung:Drogen- und Suchtbericht 2009.(PDF)
- ↑Arzneimittelkommission der deutschen Ärzteschaft:Pharmakovigilanz.In:Arzneiverordnung in der Praxis.Band 32, Sonderheft April 2005.akdae.de(PDF)
- ↑World Health Organisation:The World Medicines Situation.(1.052KB PDF) 8. September 2004,abgerufen am 31. Dezember 2012(englisch).
- ↑abOECD:Health at a Glance 2009Kapitel 7.4.:Pharmaceutical Expenditure.OECD, Paris 2009,ISBN 978-92-64-07555-9.
- ↑H. Schröder, P. Thürmann, C. Telschow, M. Schröder:Arzneimittel-Kompass 2021. Hochpreisige Arzneimittel – Herausforderung und Perspektiven.In:Arzneimittel-Kompass.Springer, Berlin 2021,ISBN 978-3-662-63928-3,S.307.
- ↑Arzneimittel-Kompass 2021 diskutiert neue Regeln für die Preisregulierung und Patientensicherheit.In:wido.de.27. Oktober 2021,abgerufen am 6. November 2023.
- ↑abPeter Thielen:Finanziell noch kein großer Erfolg.In:Handelsblatt.Nr.102,31. Mai 2013,S.14.
- ↑Daten zum Gesundheitswesen: Arzneimittel.21. Oktober 2019,abgerufen am 23. November 2019.
- ↑abARZNEIMITTEL IM WANDEL – VON KLEINEN MOLEKÜLEN ZU KOMPLEXEN BIOLOGIKA.arznei-telegramm,15. November 2019,abgerufen am 23. November 2019.
- ↑Mehr Lieferengpässe: Medikamente oft nicht verfügbar,ARD-Tagesschau vom 28. Juli 2019, abgerufen am 28. Juli 2019
- ↑Lieferengpässe bei Arzneimitteln nehmen zu,Ärzteblatt vom 12. Juni 2019, abgerufen am 28. Juli 2019
- ↑Lieferengpässe: Liste der versorgungsrelevanten Wirkstoffe (ohne Impfstoffe)(vom 28. Juli 2019 imInternet Archive),BfArMStand: 28. März 2019, abgerufen am 28. Juli 2019
- ↑abcdAndreas Schiesser:MedikamenteIn: Willy Oggier (Hrsg.):Gesundheitswesen Schweiz 2015–2017.5. Aufl. Hogrefe, Bern 2015,ISBN 978-3-456-85441-0(E-Book (PDF)ISBN 978-3-456-95441-7) S. 243–266.
- ↑Helsana:Helsana-Arzneimittelreport 2017 schafft Transparenz im MedikamentenbereichIn: helsana.ch, 20. November 2017.
- ↑abcÖsterreichische Apothekerkammer:Die Österreichische Apotheke in Zahlen 2009(PDF).
- ↑Bundesamt für Verbraucherschutz und LebensmittelsicherheitzuRückständen von Tierarzneimitteln in Lebensmittelnabgerufen am 4. Dezember 2011.
- ↑Altmedikamente verantwortungsbewusst entsorgen.In:Abfallmanager Medizin.Abgerufen am 7. August 2018.
- ↑Bundesamt für Umwelt:Arzneimittel im GrundwasserIn: bafu.admin.ch,abgerufen am 16. September 2018.
- ↑Pharmaceuticals in the environment—Global occurrences and perspectives.doi:10.1002/etc.3339
- ↑Bayerisches Landesamt für Umwelt:Arzneistoffe in der Umwelt.(vom 25. September 2015 imInternet Archive) (PDF) 2008 (PDF).
- ↑Manfred Clara, Christina Hartmann, Karin Deutsch:Arzneimittelwirkstoffe und Hormone in Fließgewässern.GZÜV Sondermessprogramm 2017/2018. (bmnt.gv.at[PDF; abgerufen am 2. November 2019]).Arzneimittelwirkstoffe und Hormone in Fließgewässern(vom 2. November 2019 imInternet Archive)
- ↑Radka Alexy,Klaus Kümmerer:Antibiotika in der Umwelt.In:KA – Abwasser, Abfall.Band 52(5), 2005, S. 563–571.
- ↑Klärschlammverordnung (AbfKlärV): Verordnung über die Verwertung von Klärschlamm, Klärschlammgemisch und Klärschlammkompost.In:Abfallmanager Medizin.Abgerufen am 7. August 2018.
- ↑Medikamente und Chemikalien im Wasser: Interview mit Prof. Kümmerer, Leuphana Universität Lüneburg.In:Abfallmanager Medizin.Archiviert vom(nicht mehr online verfügbar) am7. August 2018;abgerufen am 7. August 2018.
- ↑Vera Zylka-Menhorn:Arzneimittelrückstände im Wasser: Vermeidung und EliminationDeutsches Ärzteblatt2018, Jahrgang 115, Heft 22 vom 1. Juni 2018, Seiten A1054-A1056
- ↑M. Jung:Neue EU-Verordnung für Tierarzneimittel,Pharmazeutische Zeitung, 7. Januar 2019.
- ↑Wolfgang Schneider:Lexikon zur Arzneimittelgeschichte: Sachwörterbuch zur Geschichte der pharmazeutischen Botanik, Chemie, Mineralogie, Pharmakologie, Zoologie.7 Bände (Band 5 in drei Teilen), Govi Verlag, Frankfurt am Main 1968 bis 1975 (Band 1: Tierische Drogen, Band 2: Pharmakologische Arzneimittelgruppen, Band 3: Pharmazeutische Chemikalien und Mineralien, Band 4: Geheimmittel und Spezialitäten, Band 5: Pflanzliche Drogen, Band 6: Ergänzungen zu Band 3, Band 7: Register).
- ↑Vgl.Johann Heinrich Dierbach:Die Arzneimittel des Hippokrates, oder Versuch einer systematischen Aufzählung der in allen hippokratischen Schriften vorkommenden Medikamenten.Neue Akademische Buchhandlung von Karl Groos, Heidelberg 1824.
- ↑abWolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer:Arzneimittelgeschichte.2., überarb. und erw. Auflage. Wiss. Verl.-Ges, Stuttgart 2005,ISBN 978-3-8047-2113-5,S.19.Daneben siehe denEintrag „Pille “imDigitalen Wörterbuch der deutschen Sprache.Erwähnung derpilulabei Plinius dem Älteren,Naturalis historia16,11, § 30.
- ↑Jutta Kollesch,Diethard Nickel:Antike Heilkunst. Ausgewählte Texte aus den medizinischen Schriften der Griechen und Römer.Philipp Reclam jun., Leipzig 1979 (=Reclams Universal-Bibliothek.Band 771); 6. Auflage ebenda 1989,ISBN 3-379-00411-1,S. 41.
- ↑Otto Zekert (Hrsg.):Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570.Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 141 (Ecglemata) und 146 (Lohoch).
- ↑Otto Zekert (Hrsg.):Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570.Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 145 (Julep, Julapium, Lecksaft: „wohlschmeckende, angenehm riechende und schön gefärbte Mixtur, meist aus einem Syrup und einem aromatischen Wasser hergestellt “).
- ↑Vgl. auch ebenda, S. 145 (Lambitivum:Lecksaft, vonlambitare„lecken “).
- ↑Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer:Arzneimittelgeschichte.2., überarbeitete und erweiterte Auflage. Wissenschaftliche Verlags-Gesellschaft, Stuttgart 2005,ISBN 978-3-8047-2113-5,S.20.
- ↑Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer:Arzneimittelgeschichte.2., überarb. und erw. Auflage. Wiss. Verl.-Ges, Stuttgart 2005,ISBN 978-3-8047-2113-5,S.21.
- ↑Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer:Arzneimittelgeschichte.2., überarb. und erw. Auflage. Wiss. Verl.-Ges, Stuttgart 2005,ISBN 978-3-8047-2113-5,S.22.
- ↑Christian Schulze:Therapie.In: Karl-Heinz Leven (Hrsg.):Antike Medizin, ein Lexikon.Beck, München 2005,ISBN 3-406-52891-0,Sp.855–859,hier: Sp. 856 f..
- ↑Peter Dilg:Arzneischatz.In: Karl-Heinz Leven (Hrsg.):Antike Medizin, ein Lexikon.Beck, München 2005,ISBN 3-406-52891-0,Sp.98–99.
- ↑Vgl. auchRudolf Schmitz:Der Arzneimittelbegriff der Renaissance.In: Rudolf Schmitz, Gundolf Keil:Humanismus und Medizin.Acta humaniora, Weinheim 1984 (=Deutsche Forschungsgemeinschaft: Mitteilungen der Kommission für Humanismusforschung.Band 11),ISBN 3-527-17011-1,S. 1–21.
- ↑Albert Gossauer:Struktur und Reaktivität der Biomoleküle.Verlag Helvetica Chimica Acta, Zürich 2006,ISBN 3-906390-29-2,S. 495.
- ↑Paul Diepgen,Heinz Goerke:Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin.7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 33.