Azobenzol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
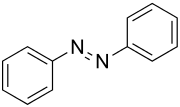
| |||||||||||||||||||
| Strukturformel von (E)-Azobenzol | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Azobenzol | ||||||||||||||||||
| Andere Namen |
Diphenyldiazen(IUPAC) | ||||||||||||||||||
| Summenformel | C12H10N2 | ||||||||||||||||||
| Kurzbeschreibung |
orangerote Blättchen[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 182,22 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
293 °C [(E)-Azobenzol, unzersetzt][1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werdenSI-Einheitenverwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten beiStandardbedingungen(0 °C, 1000 hPa). | |||||||||||||||||||
Azobenzolist die einfachstearomatischeAzoverbindung.Sie besteht aus zweiPhenylgruppen,die durch eineAzobrücke(–N=N–) miteinander verbunden sind. Sie ist die Stammsubstanz zahlreicherAzofarbstoffe.
Geschichte
[Bearbeiten|Quelltext bearbeiten]Bereits sechs Jahre nach dem allgemein anerkannten Beginn der „organischen Synthese “(F. Wöhler,HarnstoffausAmmoniumcyanat) und 22 Jahre vorW. H. Perkin(Mauvein) berichtetE. Mitscherlich[4][5]über eine rote Verbindung, die er durchDestillationvonNitrobenzolmitKalilaugeerhielt. Er nannte sie Azobenzol.
Lange Zeit wusste man nichts über dieKonstitutiondieser Verbindung. Mitscherlich selbst schlug alsSummenformelC12H5N vor.[6]Aufgrund vonDampfdichtemessungenkamen andere Autoren zur Summenformel C24H10N2.[7][8]Erst im Jahre 1860 wurde die richtige Summenformel postuliert.[9]F. A. Kekulémachte 1866 schließlich den ersten korrekten Strukturvorschlag.[10]
Ungeklärt blieb die Frage derKonfigurationder N=N-Doppelbindung. Für analoge Verbindungen (Diazohydroxide) schlugA. Hantzsch1921 eineIsomerievor, damals „syn-/anti-Isomerie “genannt.[11]DieIUPACempfiehlt heute die Verwendung der (E/Z)-Nomenklatur.
Isomere
[Bearbeiten|Quelltext bearbeiten]1937 fandS. Hartleydurch Belichten von Azobenzol eine zweite, gelbeModifikation.[12]Das gelbe Isomer konnte erchromatographischabtrennen. Die genaue Konfiguration der beiden Isomere wurde 1939 durch eineRöntgenstrukturanalysebewiesen.[13]Azobenzol existiert demnach in Form von zwei Isomeren (siehecis-trans-Isomerie), die sich in Farbe, Löslichkeit, im chromatographischen Verhalten usw. unterscheiden.[14]
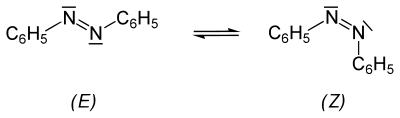
Bei der Bestrahlung einer Lösung von (E)-Azobenzol mitUV-Lichtgeht dieses in einerGleichgewichtsreaktionteilweise in die (Z)-Form über, in Abhängigkeit vomLösungsmittelentstehen dabei 15–40 % (Z)-Azobenzol. Reines (Z)-Azobenzol wandelt sich langsam thermisch im Feststoff[15]bzw. in der Schmelze[15][16]in das stabilere (E)-Isomer um. DieReaktionsenthalpieder Isomerisierung in der Schmelze beträgt −48,2 kJ·mol−1bzw. −264,5 J·g−1.[16]
Das stabilere, normalerweise vorliegende (E)-Azobenzol hat keinDipolmoment(µ = 0D), im Gegensatz zum metastabilen (Z)-Azobenzol (µ = 3 D).[17]
Darstellung und Gewinnung
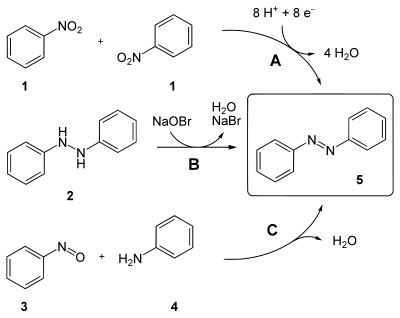
[Bearbeiten|Quelltext bearbeiten]Azobenzol (5) lässt sich auf folgende Arten herstellen (vergleiche auch unteres Bild):
- durchReduktionvonNitrobenzol(1) mitNatriumamalgamoderLithiumaluminiumhydrid(WegA)
- durchOxidationvonHydrazobenzol(2) mitNatriumhypobromitlösung(WegB)
- durchKondensationvonNitrosobenzol(3) mitAnilin(4) inessigsaurerLösung (Baeyer-Mills-Reaktion,besonders zur Herstellung vonasymmetrischenDerivaten) (WegC)
Verwendung
[Bearbeiten|Quelltext bearbeiten](E)-Azobenzol findet als Testsubstanz für dasKofler-Heiztischmikroskopbzw. als Kalibriersubstanz für dieKofler-HeizbankVerwendung.[18]Aufgrund der chromophoren Gruppen werden Azobenzole mit funktionellen Gruppen an den Benzol-Ringen auch in Form vonAzofarbstoffenin der Färbemittelproduktion oder als Lebensmittelfarbe verwendet.[19]Des Weiteren können durch die Verwendung von pH-sensitiven funktionellen Gruppen an den Benzol-Ringen die Azobenzole alsIndikator (Chemie)verwendet werden (z. B.Methylrot,Methylorange,Alizaringelb R,oderKongorot).[20]
Literatur
[Bearbeiten|Quelltext bearbeiten]- H. Zollinger:Chemie der Azofarbstoffe.(Chemische Reihe,Bd. 13). Birkhäuser-Verlag, Basel, 1958.
- E. Merino:Synthesis of azobenzenes: the coloured pieces of molecular materials.Chem.Soc. Rev., 2011,40,S. 3835–3853,doi:10.1039/c0cs00183j
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑abcdeHans Beyer,Wolfgang Walter:Lehrbuch der Organischen Chemie,20. Auflage, Hirzel, Stuttgart 1984. S. 529.
- ↑abcdEintrag zuAzobenzolin derGESTIS-StoffdatenbankdesIFA,abgerufen am 1. Februar 2016.(JavaScript erforderlich)
- ↑Eintrag zuAzobenzeneimClassification and Labelling InventoryderEuropäischen Chemikalienagentur(ECHA), abgerufen am 1. Februar 2016. Hersteller bzw.Inverkehrbringerkönnen die harmonisierte Einstufung und Kennzeichnungerweitern.
- ↑E. Mitscherlich:Annalen der Physik und ChemieXXXII (1834), S. 224.
- ↑E. Mitscherlich:Annalen der Chemie und PharmacieXII, S. 311.
- ↑Otto Linné Erdmann:Journal für praktische Chemie.Band82.Verlag von Johann Ambrosius Barth, 1861,S.444(Online lesenin der Google-Buchsuche).
- ↑P. Hofmann:Annalen der Chemie und PharmacieCXV. S. 362.
- ↑Peter Griefs:Zur Kenntnifs des s. g. Azobenzols und verwandter Verbindungen.In: Justus Liebig, Freiherr von (Hrsg.):Annalen der Chemie und Pharmacie.Bände 131–132. C.F. Winter'sche, 1864 (Online lesenin der Google-Buchsuche).
- ↑P. Hofmann:Annalen der Chemie und Pharmacie(1860), S. 324.
- ↑Carl Glaser:Ueber eine neue Bildungsweise des Azobenzols.In:Zeitschrift für Chemie.1866 (Online lesenin der Google-Buchsuche).
- ↑A. Hantzsch, G. Reddelien:Die Diazoverbindungen.Springer, Berlin, 1921.
- ↑G. S. Hartley:Nature140 (1937). S. 281.
- ↑Robertson, J.M.:Crystal structure and configuration of the isomeric azobenzenesinJ. Chem. Soc.1939, S. 232–236,doi:10.1039/JR9390000232.
- ↑Cook, A.H.:The preparation of some cis-azo-compoundsinJ. Chem. Soc.1938, S. 876–881,doi:10.1039/JR9380000876.
- ↑abWolf, E.; Cammenga, H.K.:Thermodynamic and Kinetic Investigation of the Thermal Isomerization of Cis-azobenzeneinZ. Phys. Chem.107 (1977) S. 21–38,doi:10.1524/zpch.1977.107.1.021.
- ↑abEckardt, N.; Flammersheim, H.J.; Cammenga, H.K.:The cis-trans isomerization of azobenzene in the molten stateinJ. Therm. Anal. Calorim.52 (1998), S. 177–185,doi:10.1023/A:1010178610642.
- ↑R. J. W. Le Fevre, G. S. Hartley:The dipole moments of cis- and trans-azobenzenes and of some related compoundsinJ. Chem. Soc.1939, S. 531–535,doi:10.1039/JR9390000531.
- ↑M. Kuhnert-Brandstätter: Thermomicroscopy in the Analysis of Pharmaceuticals, Pergamon Press, Oxford (1971).
- ↑Karl Hunger:Industrial Dyes: Chemistry, Properties, Applications.Wiley-VCH, Weinheim 2003,ISBN 978-3-527-30426-4.
- ↑Ram Wasudeo Sabnis:Handbook of Acid-Base Indicators.Hrsg.: CRC Press. 2007,ISBN 0-8493-8218-1,S.18.


