Caesium
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name,Symbol,Ordnungszahl | Caesium, Cs, 55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Alkalimetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe,Periode,Block | 1,6,s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | goldgelb glänzend | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-155-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.323 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an derErdhülle | 6,5 ppm (42. Rang)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 132,90545196(6)[3]u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius(berechnet) | 265 (298)pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 244 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 343[4]pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 6s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.Ionisierungsenergie | 3.893905695(24)eV[5]≈375.7kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 23.15745(6) eV[5]≈2234.35 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 33.195(4) eV[5]≈3202.8 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 43.0(1,7) eV[5]≈4150 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 56.0(1,9) eV[5]≈5400 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch-raumzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 1,90 g/cm3(20°C)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 0,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch(χm= 5,2 · 10−6)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 301,59K(28,44 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 963,2 K[9](690 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 70,94 · 10−6m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 66,1 kJ/mol[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 2,09 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 2,14eV[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 4,76 · 106S·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 36W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,923V(Cs++ e−→ Cs) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 0,79 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope sieheListe der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werdenSI-Einheitenverwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten beiStandardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Caesium(nachIUPAC) [],standardsprachlichCäsium(bis 2024 auchZäsium;im amerikanischen EnglischCesium), ist einchemisches Elementmit demElementsymbolCs und derOrdnungszahl55. ImPeriodensystemsteht es in der 1.Hauptgruppe,bzw. der 1.IUPAC-Gruppeund gehört zu denAlkalimetallen.Caesium ist das schwerste stabile Alkalimetall.
Caesium wurde 1861 vonRobert Wilhelm BunsenundGustav Robert KirchhoffimDürkheimerMineralwasser derMaxquelleentdeckt. Aufgrund der zwei blauenSpektrallinien,mit denen das Element nachgewiesen wurde, benannten sie es nach dem lateinischencaesiusfür himmelblau. Das Reinelement konnte erstmals 1881 vonCarl Theodor Setterbergdargestellt werden.
Caesium ist ein extrem reaktives, sehr weiches, goldfarbenes Metall. Da es sofort und sehr heftig mit Luft reagiert, wird es in abgeschmolzenenGlasampullenunterInertgasaufbewahrt.
Eine biologische Bedeutung des nicht toxischen Elements ist nicht bekannt. Aufgrund der Ähnlichkeit zu Kalium wird es allerdings im Magen-Darm-Trakt resorbiert und analog zu Kalium vorwiegend im Muskelgewebe gespeichert. Deshalb fand dasradioaktiveIsotopCaesium-137(137Cs), ein Produkt derKernspaltung,in der Öffentlichkeit besondere Beachtung, als es infolge derKatastrophe von Tschernobylam 26. April 1986 in größeren Mengen in die Umwelt gelangte. Durch die großflächige Verteilung – und damit vergleichsweise geringe Konzentration – im Falle Tschernobyl ist von akuter Radiotoxizität nicht auszugehen, jedoch können chronische Effekte, insbesondere durchBioakkumulation,nicht ausgeschlossen werden. Unfälle mit größeren Mengen Caesium-137 aus unsachgemäß entsorgten Abfällen derNuklearmedizinwie derGoiânia-Unfallhaben mehrfach zu Todesfällen durch dieStrahlenkrankheitgeführt, da hierbei sehr hohe akute Dosen auftraten.[12][13]
Geschichte
[Bearbeiten|Quelltext bearbeiten]
Caesium wurde erstmals 1861 vonGustav Robert KirchhoffundRobert Wilhelm Bunsenbeschrieben. Sie untersuchten Mineralwasser ausDürkheimund entdeckten nach der Abtrennung vonCalcium,Strontium,MagnesiumundLithiumzwei bisher unbekannteLinienim blauenSpektralbereich.Sie schlossen aus ihren Beobachtungen, dass es im untersuchten Mineralwasser ein weiteres, bisher unbekanntes Element geben müsse, das sie wegen der blauen SpektrallinienCaesium,nach dem lateinischencaesiusfür „himmelblau “, nannten.[14]
Bunsen versuchte ebenfalls Caesium von den anderen Alkalimetallen zu trennen, um weitere Eigenschaften des Elements zu erforschen. Dazu versetzte er die Lösung mit einerPlatinchlorid-Lösung, umKaliumund die neuentdeckten schwereren AlkalimetalleRubidiumund Caesium als unlöslichesHexachloridoplatinatauszufällen. Das Kalium konnte durch mehrmaliges Aufkochen in wenig Wasser entfernt werden. Zur Gewinnung der reinen Chloride wurde das Platin mitWasserstoffzum Element reduziert, so dass die nun wasserlöslichenCaesium-undRubidiumchlorideausgelaugt werden konnten. Die Trennung von Caesium und Rubidium erfolgte unter Ausnutzung der unterschiedlichen Löslichkeit der Carbonate in absolutemEthanol,worin Caesiumcarbonat im Gegensatz zur entsprechenden Rubidiumverbindung löslich ist. Caesiumchlorid diente Bunsen und Kirchhoff auch für eine erste Bestimmung dermolaren Massedes neuen Elements, wofür sie den Wert von 123,35 g/mol fanden.[14]Dieser Wert ist nach heutigen Erkenntnissen gut 10 Gramm zu niedrig.
Die beiden Forscher konnten kein elementares Caesium gewinnen, denn bei derElektrolysevon geschmolzenem Caesiumchlorid entstand anstelle des Metalls eine blaue Verbindung, die sie alsSubchloridbezeichneten, bei der es sich aber wahrscheinlich um eine kolloide Mischung von Caesium und Caesiumchlorid handelte.[15]Bei der Elektrolyse einer wässrigen Lösung mit einerQuecksilberanodebildete sich das leicht zersetzbare Caesiumamalgam.[14]
Die Darstellung des elementaren Caesiums gelang schließlich 1881Carl Theodor Setterberg,der die Probleme mit dem Chlorid vermied, indem er für dieSchmelzflusselektrolyseCaesiumcyanidverwendete. Dabei störte zunächst die zum Schmelzen des Caesiumcyanids nötige relativ hohe Temperatur, die er jedoch durch dasEutektikummitBariumcyanidherabsetzen konnte.[16]
Vorkommen
[Bearbeiten|Quelltext bearbeiten]
Mit einem Gehalt von 3ppmin der kontinentalenErdkruste[17]ist Caesium auf der Erde ein seltenes Element. Es ist nach dem instabilenFranciumdas seltenste Alkalimetall. Aufgrund seiner hohen Reaktivität kommt es nicht elementar, sondern immer nur in Form von Verbindungen vor. Meist ist Caesium ein seltenes Begleitelement in Kalium- oder anderen Alkalimetallsalzen wieLepidolith,es sind jedoch auch einige Caesiummineralebekannt. Das häufigste Caesiummineral istPollucit,(Cs,Na)2Al2Si4O12· H2O, das in größeren Vorkommen vor allem amBernic Lakein der Nähe vonLac du Bonnetin derkanadischenProvinzManitobain derTanco-Minevorkommt. Weitere größere Vorkommen liegen inBikita,Simbabweund inNamibia.Die Vorkommen in der Tanco Mine bei Lac du Bonnet sind die einzigen, in denen Caesium abgebaut wird.[18]Seltenere Caesiumminerale sind beispielsweiseCesstibtantit(Cs,Na)SbTa4O12undPautovitCsFe2S3.
Aufgrund der Wasserlöslichkeit der meisten Caesiumverbindungen ist das Element imMeerwassergelöst; ein Liter enthält dabei durchschnittlich 0,3 bis 4 Mikrogramm Caesium. In vergleichbaren Mengen finden sich dort auch häufigere, aber schlechter lösliche Elemente wieNickel,ChromoderKupfer.[17]
Gewinnung und Darstellung
[Bearbeiten|Quelltext bearbeiten]
Caesium wird nur in geringem Umfang hergestellt. Im Jahr 1978 betrug die weltweit produzierte Menge an Caesium und Caesiumverbindungen etwa 20 Tonnen.[19]Ausgangsmaterial für die Gewinnung des elementaren Caesiums und aller Caesiumverbindungen istPollucit,der mit Säuren oder Basen aufgeschlossen werden kann. Als Säuren könnenSalz-,Schwefel-oderBromwasserstoffsäuregenutzt werden. Dabei entsteht jeweils eine caesium- und aluminiumhaltige Lösung, aus der durchFällung,IonenaustauschoderExtraktiondie reinen Caesiumsalze gewonnen werden. Eine weitere Möglichkeit ist es, Pollucit mitCalcium-oderNatriumcarbonatund den entsprechenden Chloriden zu erhitzen und anschließend mit Wasserauszulaugen.Dabei entsteht eine unreine Caesiumchloridlösung.
Caesiummetall kann chemisch durchReduktionvon Caesiumhalogeniden mitCalciumoderBariumgewonnen werden. Dabeidestilliertdas im Vakuum flüchtige Caesiummetall ab.[19]
- Reduktion von Caesiumchlorid mit Calcium
Weitere Möglichkeiten der Caesiummetallherstellung sind die Reduktion vonCaesiumhydroxidmitMagnesiumund die Reduktion vonCaesiumdichromatmitZirconium.[20]
- Reaktion von Caesiumdichromat und Zirconium zu Caesium,Zirconium(IV)-oxidundChrom(III)-oxid
Hochreines Caesium lässt sich über die Zersetzung vonCaesiumazid,das ausCaesiumcarbonatgewonnen werden kann, und anschließende Destillation darstellen. Die Reaktion erfolgt bei 380 °C an einem Eisen- oder Kupferkatalysator.[21]
Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]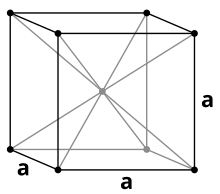

Caesium ist einLeichtmetallmit einer Dichte von 1,873 g/cm3,das, anders als die leichteren Alkalimetalle, goldfarben ist. Der Grund liegt in der geringerenBandlückeund damit an der geringerenAnregungsfrequenz,die in den blau-violetten Teil des sichtbaren Lichtspektrums reicht. Der blaue Anteil wird absorbiert, dadurch ist Caesium komplementär dazu gelb beziehungsweise goldfarben.[22]In vielen Eigenschaften steht es zwischen denen desRubidiumsund – soweit bekannt – denen des instabilenFranciums.Es besitzt mit 28,7 °C mit Ausnahme von Francium den niedrigsten Schmelzpunkt aller Alkalimetalle und hat zugleich nach Quecksilber und vergleichbar mitGalliumeinen der niedrigsten Schmelzpunkte für Metalle überhaupt. Caesium ist sehr weich (Mohs-Härte: 0,2) und sehr dehnbar.
Wie die anderen Alkalimetalle kristallisiert Caesium beiStandardbedingungenimkubischen Kristallsystemmit einerkubisch-raumzentriertenElementarzellein derRaumgruppeIm3m(Raumgruppen-Nr. 229)mit demGitterparametera= 614pmsowie zweiFormeleinheitenpro Elementarzelle. Unter einem Druck von 41 kbar erfolgt einePhasenumwandlungin eine kubisch-flächenzentrierteKristallstrukturmit dem Gitterparametera= 598 pm.[23]
Mit Ausnahme vonLithiumlässt sich Caesium mit anderen Alkalimetallen beliebig mischen. Bei einem Verhältnis von 41 % Caesium, 12 % Natrium und 47 % Kalium entsteht eineeutektischeLegierung mit dem bisher niedrigsten bekanntenSchmelzpunktfür Metallische Materialien von −78 °C.[24]
Das Caesiumatom und auch das Ion Cs+besitzen einen großenRadius,sie sind – wiederum mit Ausnahme von Francium – die größten einzelnen Atome beziehungsweise Ionen. Dies hängt mit der besonders niedrigeneffektiven Kernladungzusammen, wodurch vor allem das äußerste s-Elektron nur in geringem Maße an den Kern gebunden ist. Dies bewirkt neben dem großen Atomradius auch die geringeIonisierungsenergiedes Caesiumatoms und damit die hohe Reaktivität des Elements.[25]
Gasförmiges Caesium hat einen ungewöhnlichenBrechungsindexkleiner als eins. Das bedeutet, dass diePhasengeschwindigkeitderelektromagnetischen Welle– in diesem FallLicht– größer als imVakuumist, was aber nicht im Widerspruch zur Relativitätstheorie steht.[26]
Chemische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Caesium ist das Element mit der niedrigstenIonisierungsenergie.Für die Abspaltung des äußerstenElektronsweist es die niedrigsteElektronegativitätauf. Caesium gibt dieses bei Kontakt mit anderen Elementen sehr leicht ab und bildet einwertige Caesiumsalze. Da durch die Abspaltung dieses einen Elektrons dieEdelgaskonfigurationerreicht ist, bildet es keine zwei- oder höherwertigen Ionen.
Reaktionen mit Caesium verlaufen in der Regel sehr heftig, so entzündet es sich beim Kontakt mitSauerstoffsofort und bildet wie Kalium und Rubidium das entsprechendeHyperoxid.
Auch mit Wasser reagiert es sehr heftig unter Bildung vonCaesiumhydroxid,diese Reaktion findet sogar mit Eis bei Temperaturen von −116 °C statt.[27]
Beim Erhitzen mitGoldbildet sichCaesiumaurid(CsAu), eine Verbindung, die – trotz Bildung aus zwei Metallen – keine Legierung ist, sondern ein Halbleiter; in flüssigem CsAu liegen Cs+- und Au−-Ionen vor.[28]
Isotope
[Bearbeiten|Quelltext bearbeiten]
Insgesamt sind 41 Isotope und 29 weitereKernisomeredes Caesiums bekannt. In der Natur kommt nur das Isotop133Cs vor. Caesium ist daher einReinelement.Von den künstlichen Isotopen haben134Cs mit 2,0644 Jahren,[29]135Cs mit 2,33 Millionen Jahren und137Cs mit 30,05 Jahren[30]mittlere bis sehr lange Halbwertszeiten, während die der anderen Isotope zwischen 1 µs bei111Cs und 13,16 Tagen bei136Cs liegen.[31]
Ein wichtiges künstliches Isotop ist137Cs, einBetastrahlermit einerHalbwertszeitvon 30,08 Jahren.[31]137Cs zerfällt mit einer Wahrscheinlichkeit von 94,6 % zuerst in das metastabile Zwischenprodukt137mBa, das mit einer Halbwertszeit von 2,552 Minuten durchGammazerfallin das stabile Barium-Isotop137Ba übergeht (vgl.Cäsium-Barium-Generator). Bei den restlichen 5,4 % gibt es einen direkten Übergang zum stabilen Barium-Isotop137Ba. Zusammen mit weiteren Caesiumisotopen entsteht es entweder direkt bei derKernspaltunginKernreaktorenoder durch den Zerfall anderer kurzlebiger Spaltprodukte wie137I oder137Xe.
- Bildung von137Cs bei der Kernspaltung von235U[32]
137Cs ist neben dem Cobaltisotop60Co eine wichtige Gammastrahlenquelle und wird in derStrahlentherapiezur Behandlung vonKrebserkrankungen,zur Messung der Fließgeschwindigkeit in Röhren und zur Dickenprüfung etwa von Papier, Filmen oder Metall verwendet.[33]Daneben dient es in der Qualitätskontrolle in derNuklearmedizinals langlebiges Nuklid inPrüfstrahlern.[34]
Größere Mengen des Isotops137Cs gelangten durch oberirdischeKernwaffenversucheund durch dieReaktorunglücke von TschernobylundFukushimain die Umwelt. Die bei allen oberirdischen Kernwaffentests freigesetzte Aktivität an137Cs betrug 9,48·1017Bq.[35]Gemäß derspezifischen Aktivitätvon137Cs von 3,215 TBq/g[36]entspricht das etwas weniger als 300 Kilogramm. Die Gesamtmenge an137Cs, das durch die Tschernobyl-Katastrophe freigesetzt wurde, hatte eine Aktivität von etwa 8,5·1016Bq.[35]Dies entspricht etwa 26 Kilogramm. Hinzu kam eine Aktivität von etwa 4,7·1016Bq durch134Cs (entspricht etwa 15 Gramm) und 3,6·1016Bq durch136Cs (etwa 200 Milligramm).[35]Die Belastung durch die letzteren beiden Isotope ist noch im Verlaufe des Jahres 1986 (136Cs mit einer Halbwertszeit von 13,16 Tagen) bzw. binnen der folgenden Jahre (134Cs mit einer Halbwertszeit von 2,065 Jahren) auf nicht mehr nennenswerte Mengen abgeklungen. Nach 10 Halbwertszeiten liegt nochder ursprünglichen Menge vor, was sich mit jeder weiteren Halbwertszeit wiederum halbiert. Nach Masse –nichtnach Aktivität – dürfte eine vergleichbare Menge135Cs wie137Cs freigesetzt worden sein, da größenordnungsmäßig ähnlich häufig derIsobarmit Massezahl 137 wie jener mit Massezahl 135 bei der Spaltung von235U entsteht.[37]Dieser Isobar betazerfällt dann über kürzerlebige Zwischenprodukte zu den entsprechenden Caesium-Isotopen.[38]
Durch denFalloutwurden viele Gebiete in Europa, auch in Deutschland, vor allem imBayerischen Waldund südlich derDonau,mit radioaktivem Caesium in messbarem Ausmaß belastet.[39]Besonders reichert sich137Cs inPilzenan, dieLigninzersetzen können und dadurch einen leichteren Zugang zu Kalium und damit auch zu dem chemisch sehr ähnlichen Caesium haben als Pflanzen. Insbesondere derMaronen-Röhrling(Boletus badius) und derFlockenstielige Hexen-Röhrling(Boletus erythropus) reichern Caesium an, während beispielsweise der verwandteGemeine Steinpilz(Boletus edulis) nur eine geringe Caesium-Anreicherung zeigt. Die Ursache für die hohe Caesium-Anreicherung der beiden erstgenannten Pilze ist durch deren HutfarbstoffeBadion AundNorbadion Abegründet, die Caesium komplexieren können.[40][41] Im Steinpilz sind diese beiden Derivate derPulvinsäurenicht vorhanden.[42] Betroffen sind auch Wildtiere, die Pilze fressen.[43]Die genaue Caesiumbelastung ist abhängig von der Menge an niedergegangenem Fallout und der Bodenbeschaffenheit, da Böden Caesium unterschiedlich stark binden und damit für Pflanzen verfügbar machen können.[44]Auch saisonale Unterschiede sind – insbesondere bei Wildbret – messbar. Im Winter suchen die Tiere in tieferen Bodenschichten nach Nahrung, welche gegebenenfalls mehr Caesium enthalten als der Oberboden. Da diebiologische Halbwertszeitvon Caesium relativ gering ist, sind diese saisonalen Schwankungen auch bei Untersuchung des Fleisches messbar.[45]Dieser saisonale Effekt ist bei Rehwild stärker als bei Wildschweinen.[46]Auch in Menschen kann137Cs durch Messungen mitGanzkörperzählernnachgewiesen werden, wobei die Aktivität im Körper von den Verzehrgewohnheiten, insbesondere dem Verzehr kontaminierter Wildpilze und von Wildschweinfleisch, abhängt.[39]Typische Körperaktivitäten von137Cs liegen im Berich wenigerBecquerelbis einiger zehn Becquerel und bei Personen, die diese Lebensmittel regelmäßig verzehren, auch bei einigen hundert Becquerel.[39]Zum Vergleich: die Aktivität desprimordialen40K – einem langlebigen radioaktivemKalium-Isotop– in einem durchschnittlichen Erwachsenen mit 70 kg Körpergewicht liegt bei etwa 4000–5000 Becquerel.[47]
Der in der EU geltende Grenzwert von 330 Bq/kg für Milch und Säuglingsnahrung und 600 Bq/kg für alle übrigen Lebensmittel[48]ist vergleichsweise niedrig und führt immer wieder dazu, dass Wildbret, welches die Grenzwerte überschreitet, vernichtet werden muss.[49][50]Werte von 5000 Bq/kg und mehr in Wildschwein kommen durchaus immer wieder vor.[51]In Japan wurde der Grenzwert nach dem Unfall von Fukushimagesenktund zwar auf den Wert von 100 Bq/kg.[52]Die allermeisten getesteten Lebensmittel aus derPräfektur Fukushimahalten diesen im internationalen Vergleich außerordentlich strengen Grenzwert ein,[53]dennoch besteht nach wie vor ein Stigma gegen Produkte aus der Region,[54]welche vor 2011 in Japan einen exzellenten Ruf genossen hatten.[55][56]
Ein Vorfall, bei dem Menschen aufgrund der Strahlenexposition durch137Cs starben, war derGoiânia-Unfallim Jahr 1987 in Brasilien, bei dem aus einer verlassenen Strahlenklinik zwei Müllsammler einen Metallbehälter entwendeten. Das darin enthaltene137Cs wurde aufgrund der auffälligen fluoreszierenden Farbe an Freunde und Bekannte verteilt.[57]Die insgesamt involvierte Menge von 93 Gramm Caesiumchlorid enthielt 19 Gramm oder 50,9 Terabecquerel137Cs, von denen über 80 % in die Umwelt gelangten bzw. von den Opfern des Unfalls inkorporiert wurden.[57]BeimNuklearunfall von Kramatorskwurde eine137Cs-Quelle mit rund 5,2·1010Bq137Cs (entspricht etwa 16 Milligramm) versehentlich in die Betonwand eines Wohnhauses eingebaut.[58]
Andere Radioisotope des Caesium sind im öffentlichen Bewusstsein weniger präsent, obwohl auch sie in nennenswerter Menge in die Umwelt abgegeben wurden. Hier ist zum einen Caesium-134 zu nennen, welches durchNeutroneneinfangaus stabilem Caesium-133 entsteht, aufgrund seiner relativ kurzen Halbwertszeit um die zwei Jahre allerdings mittelfristig weniger Relevanz hat. Während 20 Jahre nach der Freisetzung noch mehr als die Hälfte des ursprünglichen Caesium-137 vorhanden ist, ist die Menge an Caesium-134 auf weniger als ein Tausendstel gesunken. Caesium-135 ist zwar relativ langlebig (Halbwertszeit über eine Million Jahre) jedoch aufgrund seiner geringen Radioaktivität weniger relevant. Das Verhältnis von Caesium-135 zu anderen Caesium-Isotopen kann auch genutzt werden, um herauszufinden, ob der Ursprung einer radioaktiven Kontamination eine Atombombe oder ein Kernkraftwerk ist. Caesium-135 entsteht bei der Kernspaltung nicht direkt, sondern alsTochternuklidvon Xenon-135. Da Xenon-135 ein starkesNeutronengiftist, wird in einem Kernkraftwerk mit (genähert) konstantemNeutronenflussein erheblicher Teil des Xenon-135 durch Neutroneneinfang zu Xenon-136 umgewandelt, bevor es zu Caesium-135 zerfallen kann.[59]In Atombomben ist das Xenon-135 noch gar nicht aus seinem „Vorgänger “Iod-135 entstanden, wenn durch die Explosion der Bombe der Neutronenfluss abreißt.[60][61]
Verwendung
[Bearbeiten|Quelltext bearbeiten]Auf Grund der komplizierten Herstellung und hohen Reaktivität wird elementares Caesium nur in geringem Maße eingesetzt. Es hat seine Einsatzgebiete vorwiegend in der Forschung.
Raumfahrt
[Bearbeiten|Quelltext bearbeiten]Da Caesium eine kleineAustrittsarbeithat, kann es alsGlühkathodeetwa zur Gewinnung freier Elektronen verwendet werden. Auchmagnetohydrodynamische Generatorenwerden mit Caesium als möglichemPlasmamaterialuntersucht.[19]In der Raumfahrt wird Caesium nebenQuecksilberundXenonauf Grund seiner hohen molaren Masse, die einen größeren Rückstoß als leichtere Elemente bewirkt, als Antriebsmittel inIonenantriebeneingesetzt.[62]Vorteilhaft im Vergleich zu Quecksilber ist die Ungiftigkeit von Caesium und die relative Unbedenklichkeit einer etwaigen Freisetzung (z. B. bei gescheiterten Startversuchen). Im Vergleich zu Xenon ist der niedrigere Preis als Vorteil zu nennen. Obwohl Caesium nur in geringen Mengen elementar gewonnen wird, ist es doch leichter verfügbar als das nur in Spuren in der Atmosphäre vorhandene Edelgas Xenon, welches mittelsLuftverflüssigunggewonnen wird.
Zeitmessung
[Bearbeiten|Quelltext bearbeiten]DieSekundealsMaßeinheitder Zeit ist seit 1967 über die Frequenz eines bestimmten atomaren Übergangs im Caesium-Isotop133Cs definiert.[63][64]Dazu passend ist Caesium das die Frequenz bestimmende Element in denAtomuhren,die die Basis für diekoordinierte Weltzeitbilden.[65]Die Wahl fiel auf Caesium, weil dies einReinelementist und in den 1960er Jahren der Übergang zwischen den beiden Grundzuständen mit ca. 9 GHz mit den damaligen elektronischen Mitteln bereits detektierbar war. Die Breite dieses Übergangs und damit die Unsicherheit der Messung ist nicht durch Eigenschaften des Atoms bestimmt. Durch die niedrige Verdampfungstemperatur kann mit wenig Aufwand einAtomstrahlmit geringer Geschwindigkeitsunsicherheit erzeugt werden.
Eine Wolke von Caesiumatomen kann inmagneto-optischen Fallenin der Schwebe gehalten und mit Hilfe vonLasernbis auf wenige Mikrokelvin an denabsoluten Nullpunktabgekühlt werden. Mit dieser Technik war es möglich, die Frequenzstabilität und damit die Genauigkeit der Caesium-Atomuhr deutlich zu verbessern.[66]
Als Getter
[Bearbeiten|Quelltext bearbeiten]Daneben wird Caesium inVakuumröhrenverwendet, da es mit geringen Restspuren an Gasen reagiert und so für ein besseres Vakuum (Getter) sorgt. Dabei wird das Caesiumin situdurch die Reaktion von Caesiumdichromat mitZirconiumerzeugt.[19]
Legierungsmetall
[Bearbeiten|Quelltext bearbeiten]Caesium ist –legiertmitAntimonund anderen Alkalimetallen – ein Material fürPhotokathoden,die etwa inPhotomultiplierneingesetzt werden.[67]
Radioaktive Anwendungen
[Bearbeiten|Quelltext bearbeiten]Radioaktive Isotope des Caesium (insbesondere135Cs und137Cs) sind leicht alsSpaltproduktzugänglich und finden vielfältige Anwendungen, unter anderem als Quelle für Gammastrahlung in Industrie und Medizin sowie für dieLebensmittelbestrahlung.137Cs bietet für die meisten Anwendungen den besten Kompromiss zwischen hoher spezifischer Aktivität und Langlebigkeit, jedoch liegt in Caesium aus Kernspaltung immer ein Gemisch verschiedener Isotope vor. Neben Kernspaltung kann134Cs auch durchNeutroneneinfangin natürlichem133Cs gewonnen werden.[68]Die ungünstigen chemischen Eigenschaften haben jedoch dazu geführt, dass137Cs in einigen Anwendungen durch60Co verdrängt wurde, welches weniger leicht in die Umwelt entweichen kann, wenn radioaktive Quellen unsachgemäß entsorgt oder bedient werden.[69][70]Ein Einsatz inAtombatterienwäre zwar denkbar, ist jedoch aufgrund der entstehenden Gammastrahlung und der chemischen Eigenschaften des Caesiums selten und erscheint wenig lohnenswert.
Nachweis
[Bearbeiten|Quelltext bearbeiten]Zum Nachweis von Caesium können dieSpektrallinienbei 455 und 459 nm[24]im Blau genutzt werden. Quantitativ lässt sich dies in derFlammenphotometriezur Bestimmung von Caesiumspuren nutzen.
In derPolarographiezeigt Caesium eine reversible kathodische Stufe bei −2,09 V (gegen eineKalomelelektrode). Dabei müssen alsGrundelektrolytquartäre Ammoniumverbindungen(beispielsweiseTetramethylammoniumhydroxid) verwendet werden, da andere Alkali- oder Erdalkalimetallionen sehr ähnliche Halbstufenpotentiale besitzen.[71]
Gravimetrischlässt sich Caesium wie Kalium über verschiedene schwerlösliche Salze nachweisen. Beispiele hierfür sind dasPerchloratCsClO4und dasHexachloridoplatinatCs2[PtCl6].[72]
Biologische Bedeutung
[Bearbeiten|Quelltext bearbeiten]Mit der Nahrung aufgenommenes Caesium wird auf Grund der Ähnlichkeit zu Kalium imMagen-Darm-Traktresorbiert und analog zu Kalium vorwiegend imMuskelgewebegespeichert. Die biologischeHalbwertszeit,mit der Caesium vom menschlichen Körper wieder ausgeschieden wird, ist abhängig von Alter und Geschlecht und beträgt im Durchschnitt 110 Tage.[44]
Caesium ist chemisch nur in sehr geringem Maßgiftig.TypischeLD50-Wertefür Caesiumsalze liegen bei 1000 mg/kg (Ratte, oral).[19]Von Bedeutung ist jedoch die Wirkung derionisierenden Strahlungaufgenommener radioaktiver Caesiumisotope, die je nachDosisdieStrahlenkrankheitverursachen können. Wegen der guten Wasserlöslichkeit der meisten Caesiumsalze werden diese im Magen-Darm-Trakt vollständig resorbiert und vorwiegend im Muskelgewebe verteilt.[44]Durch dieAufnahmevon radioaktivem137Cs nach derKatastrophe von Tschernobylim Jahr 1986 ergab sich in den ersten drei Monaten eine durchschnittlicheeffektive Dosisvon 0,6μSvfür einen Erwachsenen der Bundesrepublik Deutschland.[44]
Sicherheitshinweise
[Bearbeiten|Quelltext bearbeiten]AnLuftentzündet sich Caesium spontan, weshalb es in Ampullen unter reinemArgonoder im Vakuum aufbewahrt werden muss. Wegen seiner hohen Reaktionsfähigkeit reagiert es mit Wasser explosiv. Die Explosivität kann durch die Entzündung des dabei entstehendenWasserstoffsverstärkt werden. Brennendes Caesium muss mitMetallbrandlöscherngelöscht werden. Bei kleinen Mengen (wenige Gramm), kann trockener Sand verwendet werden. Die Entsorgung erfolgt wie bei anderen Alkalimetallen durch vorsichtiges Zutropfen von Alkoholen wie2-Pentanol,tert-ButanoloderOctanolund anschließendeNeutralisation.[11]
Verbindungen
[Bearbeiten|Quelltext bearbeiten]Als typisches Alkalimetall kommt Caesium ausschließlich in ionischen Verbindungen in der Oxidationsstufe +1 vor. Die meisten Caesiumverbindungen sind gut wasserlöslich.
Halogenide
[Bearbeiten|Quelltext bearbeiten]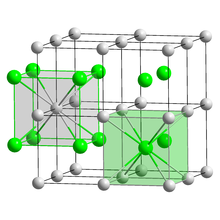
Caesium bildet mit allen Halogenen gut wasserlöslicheHalogenideder Form CsX (X = Halogenid).Caesiumchloridbesitzt eine charakteristischeKristallstruktur,die einen wichtigenStrukturtypbildet (Caesiumchloridstruktur). So kristallisieren mit Ausnahme vonCaesiumfluoridauch die anderen Caesiumhalogenide. Caesiumchlorid ist Ausgangsstoff für die Gewinnung elementarem Caesiums. Da sich bei ausreichend langdauerndem Zentrifugieren automatisch einDichtegradientausbildet, wird es zur Trennung und Reinigung vonDNAin derUltrazentrifugeverwendet.[19]HochreinesCaesiumiodidundCaesiumbromidwerden alstransparentesSzintillationsmaterialinSzintillationszählerneingesetzt.[73][74]
Sauerstoffverbindungen
[Bearbeiten|Quelltext bearbeiten]Caesium bildet eine ungewöhnlich große Zahl anSauerstoffverbindungen.Dies hängt vor allem mit der niedrigen Reaktivität des Caesiumions zusammen, so dass die Bildung von Sauerstoff-Sauerstoff-Bindungen möglich ist. Bekannt sind mehrereSuboxidewie Cs11O3und Cs3O, bei denen ein Überschuss an Caesium vorliegt und die dementsprechendelektrische Leitfähigkeitzeigen. Daneben sind mit steigenden Sauerstoffgehalten dasOxidCs2O, dasPeroxidCs2O2,dasHyperoxidCsO2und dasOzonidCsO3bekannt. Alle diese Verbindungen sind im Gegensatz zu den meisten übrigen Caesiumverbindungen farbig, die Suboxide violett oder blaugrün, die übrigen gelb, orange oder rot.
Caesiumhydroxidist ein starkhygroskopischer,weißer Feststoff, der sich gut in Wasser löst. In wässriger Lösung ist Caesiumhydroxid einestarke Base.
Weitere Caesiumverbindungen
[Bearbeiten|Quelltext bearbeiten]Caesiumcarbonatist ein weißer Feststoff und löst sich in vielen organischen Lösungsmitteln. Es wird in verschiedenen organischen Synthesen als Base beispielsweise fürVeresterungenoder für die Abspaltung speziellerSchutzgruppeneingesetzt.[75]
Caesiumnitratfindet in großem Umfang Verwendung in militärischerPyrotechnik,[76]und zwar inNIR-Leuchtmunition[77]undInfrarottarnnebeln,[78]Während die Verwendung in NIR-Leuchtsätzen auf den intensiven Emissionslinien des Elements bei 852, 1359 und 1469 nm beruht, basiert der Einsatz in Tarnnebeln auf der leichten Ionisierbarkeit des Elements. Die beim Abbrand der pyrotechnischen Wirkmassen in der Flamme gebildeten Cs-Ionen wirken alsKondensationskeimeund verstärken daher die für die Strahlungsabsorption wichtige Aerosolausbeute.
Caesiumchromatkann zusammen mitZirconiumals einfache Quelle für die Gewinnung elementaren Caesiums zur Beseitigung von Wasser- und Sauerstoffspuren in Vakuumröhren eingesetzt werden.[79]
Einen Überblick über Caesiumverbindungen gibt dieKategorie:Caesiumverbindung.
Literatur
[Bearbeiten|Quelltext bearbeiten]- Manfred Bick, Horst Prinz:Cesium and Cesium Compounds.In:Ullmann’s Encyclopedia of Industrial Chemistry,Wiley-VCH, Weinheim 2005 (doi:10.1002/14356007.a06_153).
- A. F. Holleman,E. Wiberg,N. Wiberg:Lehrbuch der Anorganischen Chemie.102. Auflage. Walter de Gruyter, Berlin 2007,ISBN 978-3-11-017770-1.
- Eintrag zuCaesium.In:Römpp Online.Georg Thieme Verlag, abgerufen am 19. Juni 2014.
Weblinks
[Bearbeiten|Quelltext bearbeiten]Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Harry H. Binder:Lexikon der chemischen Elemente.S. Hirzel Verlag, Stuttgart 1999,ISBN 3-7776-0736-3.
- ↑Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, auswebelements (Caesium)entnommen.
- ↑CIAAW, Standard Atomic Weights Revised 2013.
- ↑Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar:Consistent van der Waals Radii for the Whole Main Group.In:J. Phys. Chem. A.113, 2009, S. 5806–5812,doi:10.1021/jp8111556.
- ↑abcdeEintrag zucesiumin Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019):NIST Atomic Spectra Database (ver. 5.7.1).Hrsg.:NIST,Gaithersburg, MD.doi:10.18434/T4W30F(physics.nist.gov/asd).Abgerufen am 11. Juni 2020.
- ↑abcdeEintrag zucaesiumbeiWebElements,webelements,abgerufen am 11. Juni 2020.
- ↑N. N. Greenwood, A. Earnshaw:Chemie der Elemente.1. Auflage. VCH, Weinheim 1988,ISBN 3-527-26169-9,S. 97.
- ↑Robert C. Weast (Hrsg.):CRC Handbook of Chemistry and Physics.CRC (Chemical Rubber Publishing Company), Boca Raton 1990,ISBN 0-8493-0470-9,S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑abYiming Zhang, Julian R. G. Evans, Shoufeng Yang:Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks.In:Journal of Chemical & Engineering Data.56, 2011, S. 328–337,doi:10.1021/je1011086.
- ↑Ludwig Bergmann, Clemens Schaefer, Rainer Kassing:Lehrbuch der Experimentalphysik.Band 6:Festkörper.2. Auflage. Walter de Gruyter, 2005,ISBN 3-11-017485-5,S. 361.
- ↑abcEintrag zuCäsiumin derGESTIS-StoffdatenbankdesIFA,abgerufen am 20. Oktober 2020.(JavaScript erforderlich)
- ↑Cesium-137: A Deadly Hazard.Abgerufen am 20. April 2022.
- ↑CDC Radiation Emergencies | Radioisotope Brief: Cesium-137 (Cs-137).22. April 2019,abgerufen am 20. April 2022(amerikanisches Englisch).
- ↑abcG. Kirchhoff, R. Bunsen:Chemische Analyse durch Spectralbeobachtungen.In:Annalen der Physik und Chemie.189, 7, 1861, S. 337–381,doi:10.1002/andp.18611890702.
- ↑Richard Zsigmondy:Colloids and the Ultramicroscope.Read books, 2007,ISBN 978-1-4067-5938-9,S. 69 (Colloids and the Ultramicroscopein der Google-Buchsuche).
- ↑Carl Setterberg:Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst.In:Justus Liebigs Annalen der Chemie.221, 1, 1881, S. 100–116,doi:10.1002/jlac.18822110105.
- ↑abDavid R. Lide (Hrsg.):CRC Handbook of Chemistry and Physics.90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL,Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea,S. 14-18.
- ↑U.S. Geological Survey:Caesium.(PDF-Datei; 82 kB) In:Mineral Commodity Summaries.Januar 2009.
- ↑abcdefManfred Bick, Horst Prinz:Cesium and Cesium Compounds.In:Ullmann's Encyclopedia of Industrial Chemistry.Wiley-VCH,Weinheim 2005 (doi:10.1002/14356007.a06_153).
- ↑A. F. Holleman,E. Wiberg,N. Wiberg:Lehrbuch der Anorganischen Chemie.102. Auflage. Walter de Gruyter, Berlin 2007,ISBN 978-3-11-017770-1,S. 1273.
- ↑Fritz Blatter, Ernst Schuhmacher:Production of high purity caesium.In:Journal of the Less Common Metals.115, 2, 1986, S. 307–313,doi:10.1016/0022-5088(86)90153-0.
- ↑C. C. Addison:The chemistry of the liquid alkali metals.Wiley, 1984,ISBN 978-0-471-90508-0,S.7.
- ↑K. Schubert:Ein Modell für die Kristallstrukturen der chemischen Elemente.In:Acta Crystallographica.B30, 1974, S. 193–204,doi:10.1107/S0567740874002469.
- ↑abA. F. Holleman,E. Wiberg,N. Wiberg:Lehrbuch der Anorganischen Chemie.102. Auflage. Walter de Gruyter, Berlin 2007,ISBN 978-3-11-017770-1,S. 1274.
- ↑Michael Binnewies, Michael Jäckel, Helge Willner:Allgemeine und Anorganische Chemie.Spektrum Akademischer Verlag, Berlin 2003,ISBN 3-8274-0208-5,S. 49–53.
- ↑L. J. Wang, A. Kuzmich, A. Dogariu:Gain-assisted superluminal light propagation.In:Nature.406, 2000, S. 277–279,doi:10.1038/35018520.
- ↑Caesiumbei webelements, eingesehen am 5. September 2009.
- ↑Eintrag zuGold.In:Römpp Online.Georg Thieme Verlag, abgerufen am 21. April 2015.
- ↑LNE – LNHB/CEA – Table de Radionucleides
- ↑LNE – LNHB/CEA – Table de Radionucleides
- ↑abG. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi:The NUBASE2016 evaluation of nuclear properties.In:Chinese Physics C.41, 2017, S. 030001,doi:10.1088/1674-1137/41/3/030001(Volltext).
- ↑Martin Volkmer:Basiswissen Kernenergie.Informationskreis Kernenergie, Bonn 1996,ISBN 3-925986-09-X,S. 30.
- ↑Radioisotope Brief: Cesium-137 (Cs-137).Centers for Disease Control and Prevention,Atlanta, 4. April 2018,abgerufen am 25. September 2009(englisch).
- ↑L. Geworski, Chr. Reiners:Qualitätsprüfung nuklearmedizinischer Messsysteme: Konstanzprüfung.In: L. Geworski, G. Lottes, Chr. Reiners,O. Schober:Empfehlungen zur Qualitätskontrolle in der Nuklearmedizin.Schattauer Verlag, Stuttgart/New York 2003,ISBN 3-7945-2242-7,S. 258 und S. 263.
- ↑abcUNSCEAR 2008 Report. Sources and effects of ionizing radiation.Band 2.Annex D - Health effects due to radiation from the Chernobyl accident.New York 2011, S. 49,(PDF)
- ↑Cäsium 137 – Radiocäsium Kontamination & Lebensmittel Grenzwert von 600 Bq/kg.In:umweltanalysen.6. Januar 2022,abgerufen am 25. Januar 2023.
- ↑Ben C. Russell, Ian W. Croudace, Phil E. Warwick:Determination of135Cs and137Cs in environmental samples: A review.In:Analytica Chimica Acta.Band890,2015,S.7–20,doi:10.1016/j.aca.2015.06.037.
- ↑Long-lived Fission Product - The 7 Long-lived Fission Products.Abgerufen am 23. Februar 2023.
- ↑abcOliver Meisenberg, Udo C. Gerstmann:Exposure of German hunters and their family members to the radioactive nuclide137Cs due to their eating habits.In:Science of the Total Environment798, S. 149264, 2021.doi:10.1016/j.scitotenv.2021.149264.
- ↑D. C. Aumann, G. Clooth, B. Steffan, W. Steglich:Komplexierung von Caesium-137 durch die Hutfarbstoffe des Maronenröhrlings (Xerocomus badius).In:Angewandte Chemie.Band 101, Nummer 4, 1989, S. 495–496,doi:10.1002/ange.19891010429.
- ↑P. Kuad, R. Schurhammer, C. Maechling, C. Antheaume, C. Mioskowski, G. Wipff, B. Spiess:Complexation of Cs+,K+and Na+by norbadione A triggered by the release of a strong hydrogen bond: nature and stability of the complexes.In:Phys. Chem. Chem. Phys.11, 2009, S. 10299–10310,doi:10.1039/B912518C.
- ↑B. Steffan, W. Steglich:Die Hutfarbstoffe des Maronenröhrlings (Xerocomus badius).In:Angewandte Chemie.Band 96, Nummer 6, Juni 1984, S. 435–437,doi:10.1002/ange.19840960619.
- ↑Landesanstalt für Umwelt, Messungen und Naturschutz Baden-Württemberg:Radioaktivitätsbelastung in Wild.(vom 19. Juni 2008 imInternet Archive) 2007.
- ↑abcdEintrag zuCaesium 137, Caesium 134.In:Römpp Online.Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- ↑Preußisch Blau für die Sau.17. März 2015,abgerufen am 23. Februar 2023(deutsch).
- ↑Strahlenbelastung von Rehen durch Cäsium 137.In:umweltanalysen.Abgerufen am 23. Februar 2023.
- ↑Evgenia I. Tolstykh, Marina O. Degteva, Nikolay G. Bougrov, Bruce A. Napier:Body Potassium Content and Radiation Dose from 40K for the Urals Population (Russia).In:PLoS ONE.Band11,Nr.4,2016,S.e0154266,doi:10.1371/journal.pone.0154266,PMID 27111330,PMC 4844139(freier Volltext).
- ↑Umweltradioaktivität in Lebensmitteln.In:Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit.Abgerufen am 23. Februar 2023.
- ↑Mirjam Uhrich:35 Jahre nach Tschernobyl: Ungenießbares Wildfleisch in Bayern.In:welt.de.25. April 2021,abgerufen am 23. Februar 2023.
- ↑Wildschweinfleisch muss entsorgt werden, weil es radioaktiv ist.In:20min.9. September 2020,abgerufen am 23. Februar 2023.
- ↑Radionuclides in wild game meat.2010,abgerufen im Jahr 2023.
- ↑New Standard limits for RadionuclidesRadionuclides in Foodsin Food.2011,abgerufen im Jahr 2023.
- ↑Fukushima Foods: Safe and Delicious.The Government of Japan,abgerufen am 23. Februar 2023(englisch).
- ↑Should food from Fukushima Prefecture be served at the 2020 Tokyo Olympics?Abgerufen am 23. Februar 2023(englisch).
- ↑Scientists say Fukushima's food is safe. So why aren't the Japanese eating it?Abgerufen am 23. Februar 2023(englisch).
- ↑Justin McCurry:'We always get an A': Fukushima strives to prove food safety before Tokyo Games.In:theguardian.10. März 2020,abgerufen am 23. Februar 2023(englisch).
- ↑abIAEO:The Radiological Accident in Goiânia.Wien 1988,ISBN 92-0-129088-8(englisch,iaea.org[PDF;6,6MB;abgerufen am 13. Dezember 2007]).
- ↑Актуальные проблемы дозиметрии.1999,abgerufen im Jahr 2023.
- ↑FISSION PRODUCT POISONING.Abgerufen im Jahr 2023.
- ↑Guosheng Yang, Hirofumi Tazoe, Masatoshi Yamada:135Cs activity and135Cs/137Cs atom ratio in environmental samples before and after the Fukushima Daiichi Nuclear Power Plant accident.In:Scientific Reports.Band6,Nr.1,7. April 2016,S.24119,doi:10.1038/srep24119.
- ↑Liuchao Zhu, Xiaolin Hou, Jixin Qiao:Determination of135Cs concentration and135Cs/137Cs ratio in waste samples from nuclear decommissioning by chemical separation and ICP-MS/MS.In:Talanta.Band221,1. Januar 2021,S.121637,doi:10.1016/j.talanta.2020.121637,PMID 33076157.
- ↑Europäische Weltraumorganisation:Ionentriebwerke: Der Ritt auf geladenen Teilchen.Stand September 2003, abgerufen am 26. September 2009.
- ↑ Resolution 9 of the 11th CGPM. Definition of the unit of time (second).Bureau International des Poids et Mesures,1960,abgerufen am 12. April 2021(englisch).
- ↑ Resolution 1 of the 26th CGPM. On the revision of the International System of Units (SI).Bureau International des Poids et Mesures,2018,abgerufen am 12. April 2021(englisch).
- ↑Andreas Bauch:Lieferanten der Zeit.In:Physik in unserer Zeit.25, 4, 1994, S. 188–198,doi:10.1002/piuz.19940250412.
- ↑Andreas Bauch:Zeitmessung mit Fontänen: Atomuhren.In:Physik in unserer Zeit.32, 6, 2001, S. 268–273,doi:10.1002/1521-3943(200111)32:6<268::AID-PIUZ268>3.0.CO;2-N.
- ↑Norbert Schaetti:Beeinflussung der Charakteristik einer Cs-Sb-Photokathode durch Zusatz fremder Elemente.In:Zeitschrift für Angewandte Mathematik und Physik(ZAMP).4, 5, 1953, S. 450–459,doi:10.1007/BF02067902.
- ↑Caesium-134.In:chemeurope.Abgerufen am 24. Februar 2023.
- ↑EPA Facts About Cesium-137.US EPA, 2002,abgerufen am 24. Februar 2023.
- ↑CDC Radiation Emergencies | Radioisotope Brief: Cesium-137 (Cs-137).22. April 2019,abgerufen am 24. Februar 2023(amerikanisches Englisch).
- ↑J. Heyrovský, J. Kůta:Grundlagen der Polarographie.Akademie-Verlag, Berlin 1965, S. 509.
- ↑Caesium.In:Lexikon der Chemie.Spektrum Verlag, Heidelberg 2000.
- ↑C. Zink u. a.:Schering Lexikon Radiologie.(vom 14. Oktober 2007 imInternet Archive) 3. Auflage. Abw Wissenschaftsverlag,ISBN 3-936072-20-5,S. 103.
- ↑Wissenschaft-Online-Lexika:Eintrag zu Caesiumverbindungen im Lexikon der Chemie.abgerufen am 14. November 2009.
- ↑Timo Flessner, Sven Doye:Cesium carbonate: A powerful inorganic base in organic synthesis.In:Journal für praktische Chemie.341, 2, 1999, S. 186–190,doi:10.1002/(SICI)1521-3897(199902)341:2<186::AID-PRAC186>3.0.CO;2-6.
- ↑E.-C. Koch:Special Materials in Pyrotechnics, Part II: Application of Caesium and Rubidium Compounds in Pyrotechnics.In:Journal of Pyrotechnics15, 2002, S. 9–24 (Abstract(vom 13. Juli 2011 imInternet Archive)).
- ↑C. W. Lohkamp: USP 3 733 223, The United States as represented by the Secretary of the Navy, USA, (1973).
- ↑M. Weber DE 32 38 444, Pyrotechnische Fabrik F. Feistel GmbH & Co. KG, Göllheim, (1982).
- ↑Eintrag zuCaesium-Verbindungen.In:Römpp Online.Georg Thieme Verlag, abgerufen am 19. Juni 2014.







