Natriumnitrat
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Natriumnitrat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
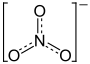
| Summenformel | NaNO3 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser,hygroskopischerFeststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 84,99 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
2,26 g·cm−3(20 °C)[4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
Zersetzung ab 380 °C[4] | |||||||||||||||||||||
| Löslichkeit |
leicht in Wasser (874 g·l−1bei 20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werdenSI-Einheitenverwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten beiStandardbedingungen(0 °C, 1000 hPa). | ||||||||||||||||||||||
Natriumnitrat(auchNatronsalpeteroderChilesalpeter), NaNO3,ist dasNatriumsalzderSalpetersäure.Diechemische Verbindungliegt im reinen Zustand in Form einerhygroskopischenweißen Substanz oder farblosenKristallenvor.
Natriumnitrat findet vielfältige Anwendung alsStickstoffdüngerund in derLebensmittelkonservierungsowie in geringerem Maße für dieHerstellungvonGlasoderEmaille.Ferner wird es auch für pyrotechnische Erzeugnisse oderFesttreibstofffürRaketenantriebeverwendet – allerdings nur eingeschränkt, denn obwohl Natriumnitrat in seinerMolekülstrukturdem auch heute noch häufig verwendetenKaliumnitratähnelt, schränkt die hygroskopische Eigenschaft den Einsatz für diePyrotechnikdeutlich ein, primär der verminderten Lagerbarkeit und Stabilität wegen.
Geschichte
[Bearbeiten|Quelltext bearbeiten]Im Jahr 1736 stellteDuhamelNatriumnitrat erstmalssynthetischdar. Die ersten Ladungen von Chilesalpeter erreichtenEnglandin den 1820er Jahren. Im Laufe der Zeit stieg der Verbrauch und 1859 importierte England bereits 47.000 Tonnen. Schon1870wurden vonIquique– heute eine Hafenstadt im Norden Chiles, damals zu Peru gehörend – bereits 147.000 Tonnen Chilesalpeter nachLiverpoolundHamburgverschifft.[6]Für die gefährliche Reise um dasKap Hoornwurden große Frachtsegler wie diePassateingesetzt.
Die zunehmende Profitabilität der Salpeterexporte führte zwischen 1879 und 1884 schließlich zumSalpeterkrieg,auch Pazifischer Krieg genannt, zwischenChileeinerseits undPeruundBolivienandererseits um die GebieteRegión de Arica y Parinacota,Región de TarapacáundRegión de Atacama,im heutigen Norden Chiles, wo die ergiebigsten Vorkommen von Chilesalpeter zu finden waren. Mit der Erfindung desHaber-Bosch-Verfahrensund der damit verbundenen Erzeugung von synthetischem Natriumnitrat verlor die Gewinnung von Chilesalpeter aus den chilenischen Vorkommen ständig an Bedeutung.
Vorkommen
[Bearbeiten|Quelltext bearbeiten]
Natriumnitrat ist das wichtigste natürlich vorkommendeNitrat.AlsMineralkommt es alsNitronatritvor. Hauptfundort istChile,daher auch derTrivialnameChilesalpeter.[7]Die Lagerstätten in derAtacama-Wüstesind die Reste von abgelagertem Vogelkot (Guano), dessen organische Anteile verwittert sind. Weitere natürliche Vorkommen gibt es inÄgypten,Kleinasien,KolumbienundKalifornien.
Gewinnung
[Bearbeiten|Quelltext bearbeiten]
Natürliche Vorkommen werden durchAuslaugungmit heißenSolengewonnen und durchFiltrationvon Fremdstoffen gereinigt. Das in der Kälte auskristallisierte Natriumnitrat hat eine Reinheit von etwa 98 %. Das in denMutterlaugenenthalteneIodatgeht in dieIodgewinnung.
Natriumnitrat kann auch durch Umsatz vonNatriumcarbonatmitSalpetersäuregewonnen werden:
Hier bietet sich die Absorption von Restgasen der Ammoniakoxidation in konzentrierter Natriumcarbonat-Lösungan:
ZurOxidationdesNitritswird dieses mit Salpetersäure angesäuert, an derLuftzu Nitrat oxidiert und mit Natriumcarbonat neutralisiert. In Vakuumverdampfern wird es bis zumFeststoffeingeengt.
Natriumnitrat kann auch durch Umsetzung vonNatriumhydroxidmit Salpetersäure gewonnen werden:
Eigenschaften
[Bearbeiten|Quelltext bearbeiten]
Physikalische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]- wichtige thermodynamische Eigenschaften
Chemische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]In heißerSchwefelsäurewird es unter Bildung von Salpetersäure zuNatriumhydrogensulfatumgesetzt:
BeiTemperaturenoberhalb von 380 °C zersetzt es sich zuNatriumnitrit:
Bei Temperaturen oberhalb von 800 °C zuNatriumoxid:
Verwendung
[Bearbeiten|Quelltext bearbeiten]
Landwirtschaft, Industrie und Haushalt
[Bearbeiten|Quelltext bearbeiten]Natriumnitrat wird alsDüngemittel,in derBaustoffindustrieals Zementzusatz, als Hilfsstoff in chemischenAbflussreinigernund alsLatentwärmespeicherverwendet. AlsKonversionssalpeterdient es als Grundstoff zur Herstellung vonKaliumnitrat.
Natriumnitrat ist außerdem enthalten in basischenAbflussreinigernum die Bildung von Wasserstoff zu verhindern (Knallgas) und stattdessen Ammoniak zu erzeugen (bessere Handhabe und warnender Geruch).
Konservierungsmittel
[Bearbeiten|Quelltext bearbeiten]Natriumnitrat wird alsKonservierungsmittelzumPökelnvonWurstwaren,Hartkäse,Schnittkäse,eingelegteHeringeundSprotteneingesetzt. Pökelsalz besteht ausKochsalz,dem geringe Mengen Natriumnitrat E 251,NatriumnitritE 250,KaliumnitritE 249 und/oderKaliumnitratE 252 zugesetzt sind. DieNitrateselbst wirken nicht antibakteriell. Sie werden jedoch im Pökelprozess enzymatisch inNitriteumgewandelt, die gegenBakterien,vor allem gegen denBotulismus-ErregerClostridium botulinum,wirken. Bei diesem Prozess wird der chemisch wenig beständige MuskelfarbstoffMyoglobinin eine stabilere Variante umgewandelt (Umrötung). Als Folge davon behält das Fleisch seine rote Farbe. Ungepökelte Fleisch- und Wurstwaren nehmen bald nach der Schlachtung eine graue Farbe an, durch das Pökeln sieht auch alte Fleischware frisch aus. Zudem wird beim Pökeln ein typisches Aroma ausgebildet.
Nachweis
[Bearbeiten|Quelltext bearbeiten]- Nachweisreaktionen
- Natrium: als hell leuchtend gelb in der blauen Bunsenbrennerflamme
- Nitrat: Spatelspitze Substanz mit verdünnter Schwefelsäure lösen und mit einer kalt gesättigtenEisen(II)-sulfatlösungversetzen. Mit etwas konzentrierter Schwefelsäure unterschichten. An der Grenzschicht entsteht ein brauner Ring, der als Nachweis für Nitrat gilt (Ringprobe).
Literatur
[Bearbeiten|Quelltext bearbeiten]- Norbert Tempel:Chile-Salpeter – „Weißes Gold “für die Äcker und Schlachtfelder der Welt.In:Industriekultur. Magazin für Denkmalpflege, Landschaft, Sozial-, Umwelt- und Technikgeschichte,Jg. 28 (2022), Heft 3, S. 18–22.
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Eintrag zuE 251: Sodium nitratein der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 23. August 2020.
- ↑Eintrag zuSODIUM NITRATEin derCosIng-Datenbankder EU-Kommission, abgerufen am 26. Februar 2020.
- ↑Eintrag zuNatriumnitrat.In:Römpp Online.Georg Thieme Verlag, abgerufen am 27. November 2021.
- ↑abcdefEintrag zuNatriumnitratin derGESTIS-StoffdatenbankdesIFA,abgerufen am 3. Januar 2023.(JavaScript erforderlich)
- ↑DatenblattNatriumnitratbeiMerck,abgerufen am 19. Januar 2011.
- ↑Adolf Beer:Allgemeine Geschichte des Welthandels,Verlag Wilhelm Braumüller, Wien, 1884, S. 201.
- ↑[Rainer Kündig, Christoph Bühler, Heinz Surbeck:http:// sgtk.ch/rkuendig/dokumente/HS09_Salz.pdfAngewandte Mineralogie und nichtmetallische Rohstoffe – Nutzung und Umweltaspekte I] (PDF; 1,3 MB)







