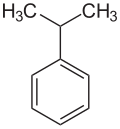
Cumol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cumol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C9H12 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit scharfem, aromatischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 120,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,86 g·cm−3(20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
152 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,49146 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werdenSI-Einheitenverwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten beiStandardbedingungen(0 °C, 1000 hPa). Brechungsindex:Na-D-Linie,20 °C | ||||||||||||||||
Cumolist eineorganisch-chemische Verbindungaus derStoffgruppederaromatischen Kohlenwasserstoffe.Aufgrund der eleganten Überführung inPhenolundAcetonnach demHock-Verfahrenund dessen großtechnischer Verbreitung in den fünfziger Jahren wurde es zu einem bedeutendenZwischenproduktderchemischen Industrie.
Geschichte
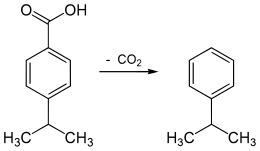
[Bearbeiten|Quelltext bearbeiten]Cumol wurde 1840 bei derDecarboxylierungvonCuminsäureentdeckt. Der erste Namensvorschlag der Entdecker warCumen,sie verwendeten den ersten Wortbestandteil derCuminsäure.Justus v. Liebigschlug dann den NamenCumolvor, der fortan Eingang in die deutsche Literatur fand.[6]
Gewinnung und Darstellung
[Bearbeiten|Quelltext bearbeiten]Die technisch ausschließlich genutzte Methode zur Herstellung von Cumol beruht auf derFriedel-Crafts-AlkylierungvonBenzolmitPropen.Die Umsetzung erfolgt entweder in derFlüssig-oderGasphase.AlsKatalysatorenwerden vorwiegendLewis-oderBrønsted-Säurensowie neuerdings auchsaureZeolitheeingesetzt.
Flüssigphase
[Bearbeiten|Quelltext bearbeiten]Im Flüssigphasenprozess setzt man Benzol mit Propen bei 35–40 °C und niedrigem Propendruck von etwa 7 bar in Gegenwart vonAluminiumchlorid(AlCl3) zu Cumol um.[7]

Außerdem ist ein Verfahren mitFluorwasserstoffbei 50–70 °C und ebenfalls geringem Propendruck bekannt. Bei der säurekatalysierten Alkylierung wird selten und vereinzelt nochSchwefelsäureeingesetzt.[7]
Gasphase
[Bearbeiten|Quelltext bearbeiten]Die Alkylierung von Benzol mit Propen in der Gasphase wird bei Temperaturen von 200–250 °C und Drücken von 20–40 bar anPhosphorsäure-Katalysatoren,welche aufSiliciumdioxidgeträgert sind undBortrifluoridalsPromotorenthalten, durchgeführt. Die gesamte Reaktion läuft dabei imFestbettreaktorab.[7]
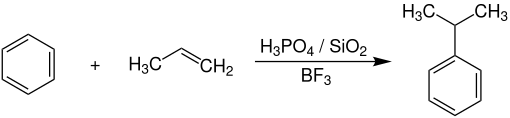
DieSelektivitätenerreichen hierbei 96–97 % bezogen auf Benzol und 91–92 % bezogen auf Propen. AlsNebenprodukteentstehen nur geringe Mengen anDi-undTriisopropylbenzolsowiePropylbenzol.Nach einerdestillativen Aufarbeitungerhält man Cumol in einer Reinheit von mehr als 99,5 %.[7]
Die weltweiten Herstellkapazitäten für Cumol betrugen im Jahr 2004 mehr als 10,5 Millionen Jahrestonnen.[7]Im Jahr 2019 steigerte sich die globale Kapazität auf 19 Millionen Tonnen.[8]Seit den 1990ern werden zunehmendZeoliteals Katalysatoren verwendet.[9]
Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Cumol hat einen charakteristischen, aromatischen Geruch, dieGeruchsschwelleliegt bei 0,04–6,4 mg·m−3.In vielen gängigen organischenLösungsmitteln,z. B.EtherundEthanol,ist Cumol löslich, in Wasser hingegen sehr schwer löslich.
Physikalische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Cumol ist eine farblose Flüssigkeit, die unterNormaldruckbei 152 °C siedet.[1]DieDampfdruckfunktionergibt sich nachAntoineentsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,05419, B = 1455,811 und C = −65.948 im Temperaturbereich von 343,2 K bis 426,5 K.[10] Wichtige thermodynamische Größen werden in der folgenden Tabelle gegeben:
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−41,2 kJ·mol−1[11] 3,92 kJ·mol−1[11] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −5215,44 kJ·mol−1[11] | als Flüssigkeit |
| Wärmekapazität | cp | 215,4 J·mol−1·K−1(25 °C)[12] 1,79 J·g−1·K−1(25 °C) |
als Flüssigkeit |
| Kritische Temperatur | Tc | 631 K[13] | |
| Kritischer Druck | pc | 32,1 bar[13] | |
| Kritische Dichte | ρc | 2,32 mol·l−1[14] | |
| Verdampfungsenthalpie | ΔVH | 41,2 kJ·mol−1[15] | bei 364 K |
| Schmelzenthalpie | ΔfusH | 7,326 kJ·mol−1[12] | am Schmelzpunkt |
Sicherheitstechnische Kenngrößen
[Bearbeiten|Quelltext bearbeiten]Cumol bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einenFlammpunktvon 31 °C.[1]DerExplosionsbereichliegt zwischen 0,8 Vol.‑% (40 g/m3) alsuntere Explosionsgrenze(UEG) und 6 Vol.‑% (300 g/m3) alsobere Explosionsgrenze(OEG).[1][16]Der untereExplosionspunktliegt bei 29 °C.[1]DieGrenzspaltweitewurde mit 1,05 mm bestimmt.[1][16]Es resultiert damit eine Zuordnung in dieExplosionsgruppeIIA.[16]DieZündtemperaturbeträgt 420 °C.[1][16]Der Stoff fällt somit in dieTemperaturklasseT2.
Verwendung
[Bearbeiten|Quelltext bearbeiten]Cumol dient als Zwischenprodukt zur Herstellung vonPhenolundAcetonnach demCumolhydroperoxid-Verfahren(Hock-Verfahren).[17]

In seltenen Fällen wird es auch als Lösungsmittel eingesetzt. Cumol wird auch alsKlopfschutzmittelim Flugtreibstoff verwendet. Gegenüber dem auch verwendbaren Benzol besitzt es einen wesentlich niedrigerenStockpunktvon ca. −96 °C.
Sicherheitshinweise
[Bearbeiten|Quelltext bearbeiten]Cumol ist entzündlich und reizt die Atmungsorgane. Es kann zudem die Haut (Brennen/Jucken) und die Augen reizen, die Leber schädigen und zu Schwindel und Benommenheit führen. DieInternationale Agentur für Krebsforschungstufte Cumol im Jahr 2013 als möglicherweise krebserzeugend ein.[18]
Cumol wurde auf der Grundlage neuer Karzinogenitätsdaten aus den USA neu bewertet. Cumol zeigte eine krebserregende Aktivität bei Ratten und Mäusen aufgrund erhöhter Inzidenzen von Nasen- und Nierentumoren bei Ratten und Lungen- und Lebertumoren bei Mäusen. Die PDE für Cumol wurde von 55 mg/Tag (Klasse 3) auf 0,7 mg/Tag (Klasse 2) gesenkt.[19]
Weblinks
[Bearbeiten|Quelltext bearbeiten]- Eintrag zuCumol.In: P. J. Linstrom, W. G. Mallard (Hrsg.):NIST Chemistry WebBook, NIST Standard Reference Database Number 69.National Institute of Standards and Technology,Gaithersburg MD
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑abcdefghijklmnopqrsEintrag zuCumolin derGESTIS-StoffdatenbankdesIFA,abgerufen am 3. Januar 2023.(JavaScript erforderlich)
- ↑Eintrag zuCumol.In:Römpp Online.Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- ↑CRC Handbook of Tables for Organic Compound Identification,Third Edition, 1984,ISBN 0-8493-0303-6.
- ↑Eintrag zuCumeneimClassification and Labelling InventoryderEuropäischen Chemikalienagentur(ECHA), abgerufen am 26. Juli 2023. Hersteller bzw.Inverkehrbringerkönnen die harmonisierte Einstufung und Kennzeichnungerweitern.
- ↑Schweizerische Unfallversicherungsanstalt(Suva):Grenzwerte – Aktuelle MAK- und BAT-Werte(Suche nach98-82-8bzw.iso-Propylbenzol), abgerufen am 15. September 2019.
- ↑Christian Wiegand:Entstehung und Deutung wichtiger organischer Trivialnamen. I. Kohlenwasserstoffe der Benzolreihe.In:Angewandte Chemie.60 (4), 1948, S. 109–111;doi:10.1002/ange.19480600407.
- ↑abcdeHans-Jürgen Arpe:Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte.6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007,ISBN 978-3-527-31540-6,S.380ff.
- ↑Andy Nicholson:The Downstream Functional Aromatics Market.In: Jacques Mortier (Hrsg.):Industrial Arene Chemistry: Markets, Technologies, Sustainable Processes and Cases Studies of Aromatic Commodities.WILEY-VCH Verlag GmbH, Weinheim 10. März 2023,doi:10.1002/9783527827992.ch2.
- ↑Manfred Weber, Werner Pompetzki, Ralf Bonmann, Markus Weber:Acetone.In:Ullmann's Encyclopedia of Industrial Chemistry.Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2014,ISBN 978-3-527-30673-2,S.1–19,doi:10.1002/14356007.a01_079.pub4(wiley[abgerufen am 4. Juli 2024]).
- ↑C. B. Williamham, W. J. Taylor, J. M. Pignocco, F. D. Rossini:Vapor Pressures and Boiling Points of Some Paraffin, Alkylcyclopentane, Alkylcyclohexane, and Alkylbenzene Hydrocarbons.In:J. Res. Natl. Bur. Stand.(U.S.), 35, 1945, S. 219–244,doi:10.6028/jres.035.009.
- ↑abcE. J. Prosen, R. Gilmont, F. D. Rossini:Heats of combustion of benzene, toluene, ethyl-benzene, o-xylene, m-xylene, p-xylene, n-propylbenzene, and styrene.In:J. Res. Natl. Bur. Stand.(U.S.), 34, 1945, S. 65–70.(PDF)
- ↑abK. Kishimoto, H. Suga, S. Syuzo:Calorimetric study of the glassy state. VIII. Heat capacity and relaxational phenomena of isopropylbenzene.In:Bull. Chem. Soc. Japan.46, 1973, S. 3020–3031,doi:10.1246/bcsj.46.3020.
- ↑abC. Tsonopoulos, D. Ambrose:Vapor-Liquid Critical Properties of Elements and Compounds. 3. Aromatic Hydrocarbons.In:J. Chem. Eng. Data.40, 1995, S. 547–558,doi:10.1021/je00019a002.
- ↑J. L. Hales, R. Townsend:Liquid Densities from 293 to 490 K of Nine Aromatic Hydrocarbons.In:J. Chem. Thermodyn.4, 1972, S. 763–772,doi:10.1016/0021-9614(72)90050-X.
- ↑Emilio Cepeda, Cristina Gonzalez, Jose M. Resa:Isobaric vapor-liquid equilibrium for the cumene-phenol system.In:J. Chem. Eng. Data.34, 1989, S. 270–273,doi:10.1021/je00057a004.
- ↑abcdE. Brandes, W. Möller:Sicherheitstechnische Kenngrößen.Band 1:Brennbare Flüssigkeiten und Gase.Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑Siegfried Hauptmann:Organische Chemie.2. Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1985,ISBN 3-342-00280-8,S. 334.
- ↑IARC:Monograph 101 – Cumol,2013.
- ↑[1]



