Enzyme-linked Immunosorbent Assay
Enzyme-linked Immunosorbent Assay(ELISA) bezeichnet ein antikörperbasiertesNachweisverfahren(Assay). Wie derRadioimmunassay(RIA) gehört auch der ELISA zur Gruppe derImmunassay-Verfahren, basiert aber nicht auf einer Radioaktivitätsmessung, sondern auf einerenzymatischenFarbreaktion und gehört somit zu denenzymatischen Immunadsorptionsverfahren(EIA). Das nachzuweisende Antigen wird anfangs über einen Erstantikörper an eineMikrotiterplatteadsorptiv gebunden und angereichert, ein Enzym-gekoppelter Zweitantikörper (synonym:Detektionsantikörper) führt dann zur Reaktion einesFarbstoffsubstrates.

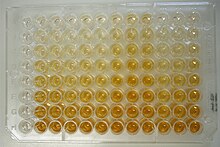
Mit Hilfe des ELISA könnenProteine(z. B.Antikörper) undViren,aber auch niedermolekulare Verbindungen wieHormone,ToxineundPestizidein einer Probe (Blutserum,Milch,Urinetc.) nachgewiesen werden. Hierbei macht man sich die Eigenschaft spezifischer Antikörper zunutze, die an den nachzuweisenden Stoff (Antigen) binden. Ein Antikörper wird zuvor mit einem Enzym markiert. Die durch dasReporterenzymkatalysierte Reaktion dient als Nachweis für das Vorhandensein des Antigens. Das sog. Substrat wird vom Enzym umgesetzt, das Reaktionsprodukt kann üblicherweise durch Farbumschlag, eventuell auch durchChemolumineszenznachgewiesen werden. Die Signalstärke ist eine mit einem Photometer sehr genau bestimmbare Funktion der Antigenkonzentration, so dass ELISA als Mehrfachmessungen ausgeführt auch für quantitative Nachweise verwendet werden kann. AlsReporterenzymewerden meistens dieMeerrettichperoxidase(HRP, von engl.horseradish peroxidase), dieAlkalische Phosphatase(AP) oder seltener auch dieGlucose-Oxidase(GOD) verwendet. Im Falle der alkalischen Phosphatase wird als Farbstoffsubstrat (synonym: Chromogen) z. B.p-Nitrophenylphosphat(pNPP) zugegeben, während bei der Peroxidase meistenso-Phenylendiamin(oPD) verwendet wird. Die alkalische Phosphatase spaltet den Phosphatrest vom farblosen Nitrophenylphosphat ab und es entstehtp-Nitrophenol,welches schwach gelb ist. Die Konzentrationsänderung des durch die enzymatische Reaktion entstandenen Farbstoffs kann nach demLambert-Beerschen Gesetzmit einemPhotometerverfolgt werden. Die Intensität der Farbe steigt dabei mit der Konzentration des entstandenen Nitrophenols und damit auch derKonzentrationdes zu bestimmenden Antigens in der Probe im Vergleich mit einerVerdünnungsreihemit bekannten Konzentrationen (Standardreihe).
Geschichte
[Bearbeiten|Quelltext bearbeiten]Der Vorläufer des ELISAs war seit 1960 der Radioimmunoassay.[1]Für einen enzymatischen Nachweis war die direkte Kopplung von Proteinen notwendig, damit dasReportersignalauch nur gekoppelt mit dem spezifisch bindenden Antikörper auftritt. Die chemische Kopplung von Proteinen wurde gleichzeitig von Stratis Avrameas und G. B. Pierce entwickelt.[2]DieAdsorptionvon Proteinen an Oberflächen war bereits 1966 durch Jerker Porath untersucht worden.[3]Der ELISA wurde im Jahr 1971 gleichzeitig von zwei Arbeitsgruppen entwickelt, darunterPeter PerlmannundEva Engvallin Schweden.[4][5]
Signalverstärkung
[Bearbeiten|Quelltext bearbeiten]Anstatt eines Enzym-gekoppelten Detektionsantikörpers kann zur Signalverstärkung auch die Kombination eines ungekoppelten Detektions-Antikörpers und eines zusätzlichen (dritten) sekundären Antikörpers (sekundär,weil es ein Antikörper gegen Antikörper ist, engl.secondary antibody), an den ein Enzym gebunden wurde, verwendet werden (s. Abb.). Dies erfordert noch einen weiteren Inkubations- und Waschschritt. Als Puffer wird meistensTBS-T-Pufferverwendet. Obwohl aufwändiger, hat die Verwendung eines sekundären Antikörperkonjugats den Vorteil, dass die kostenaufwändige Herstellung vieler verschiedener Enzym-gekoppelter Primärantikörper, die nur für jeweils ein Antigen spezifisch sind, umgangen werden kann. Die verwendeten sekundären Enzym-gekoppelte Antikörper, die alspolyklonale Antikörpergleichzeitig an verschiedeneEpitopein der konstanten Region (Fc-Region) von allen Erstantikörpern einer Spezies binden können, sind breiter einsetzbar und führen zu einer Signalverstärkung. Zudem können Sekundärantikörper-Enzym-Konjugate aufgrund der Spezifität für Fc-Regionen eines Antikörpersubtyps von einer Spezies für eine Vielzahl unterschiedlicher Immunassays verwendet werden, sodass es sich bei dem Sekundärantikörper um ein kostengünstigeres industrielles Massenfertigungsprodukt handelt. Eine weitere, häufige Signalverstärkung kann durch die Bindung vonStreptavidin- oderAvidin-Konjugaten anbiotinylierteDetektionsantikörper im letzten Inkubationsschritt erfolgen. Auch die Detektion mit (Strept-)Avidin-Enzym-Konjugaten führen aufgrund mehrerer Biotinylierungen der Primärantikörper und der daraus folgenden Bindung mehrerer Reportermoleküle zu einer Signalverstärkung.
Moderne Reportersysteme erlauben durch die Verwendung vonFluoreszenzoder derPolymerase-Kettenreaktionteilweise höhere Sensitivitäten (z. B.Immuno-PCR) oder auch parallele Bestimmungen in einem Ansatz (Multiplex), sind aber im strengeren Sinne keine ELISAs.[6]
Antikörper-ELISA
[Bearbeiten|Quelltext bearbeiten]Bei diesem enzymgekoppelten Immunadsorptionstest (EIA) wird das Antigen direkt und ohne einencoating antibodyauf die Polystyroloberfläche einer Mikrotiterplatteadsorbiert,wodurch nachfolgend Antikörperkonzentrationen im Vergleich zu einer Standardreihe gemessen werden können.
Sandwich-ELISA
[Bearbeiten|Quelltext bearbeiten]
Eine der ELISA-Techniken (Sandwich-ELISAoder auchAntigen-ELISA) verwendet zweiAntikörper(Ak), die beide spezifisch an das nachzuweisendeAntigenbinden. Hierbei ist es wichtig, dass beide Antikörper an unterschiedlichen Stellen (Epitope) an das Antigen binden, da sie sich sonst gegenseitig behindern würden. Der erste Antikörper (engl.coat antibodyodercapture antibody) wird an eine feste Phase (meist Mikrotiterplatten mit 96wellsgenannten Vertiefungen) gebunden[7].Die Probe mit dem nachzuweisenden Antigen wird dann in diewellsgegeben und eine Zeit langinkubiert.Während dieser Zeit bindet der an die Platte gebundene Antikörper das in der Probe vorhandene Antigen. Nach Ablauf der Inkubationsphase wird die Platte gewaschen: Die ungebundenen Bestandteile der Probe werden dadurch entfernt, und zurück bleibt nur das amcoat-Antikörper gebundene Antigen. Ein zweiter primärer, unmarkierter Detektionsantikörper wird hinzugefügt, um das Sandwich zu vervollständigen. Durch erneutes Waschen der Platte wird der überschüssige Detektionsantikörper ausgewaschen. Das Ergebnis kann quantifiziert werden, indem ein markierter sekundärer Antikörper hinzugefügt wird, der an den zweiten primären Antikörper bindet und die enzymatische Farbreaktion katalysiert.[8]Für quantitative Nachweise wird üblicherweise eine Serie mit bekannten Antigenkonzentrationen (Standardreihe) durchgeführt, um eine Kalibrierungskurve für das gemessene Signal (optische Extinktion,emittierte Intensität) zu erhalten.
Kompetitiver Immunassay
[Bearbeiten|Quelltext bearbeiten]Häufig wird jedoch auch derkompetitive Immunassay(Enzymgekoppelter Immunadsorptionstest, EIA) angewendet. Hierbei wird zur Detektion kein zweiter, markierter Antikörper verwendet, sondern ein markiertes Kompetitor-Antigen (eine synthetische Verbindung, die dem Analyten strukturell ähnlich ist und auch am Antikörper bindet) eingesetzt. So kommt es zur Kompetition (Konkurrenz) zwischen Analyt und Kompetitor um einen Bindungsplatz am Antikörper. Das Signal verhält sich hier umgekehrt zur Analyt-Konzentration: wenig Analyt = fast alle Antikörperbindestellen werden von markiertem Kompetitor besetzt = starke Farbreaktion; viel Analyt = schwache Farbreaktion. Die verwendeten Nachweissysteme (Enzyme/Substrate) sind meist die gleichen wie beim ELISA.
Auswertung des ELISAs mit Hilfe des Logit-Log-Plots
[Bearbeiten|Quelltext bearbeiten]
EinesigmoideKurvenform tritt dann auf, wenn man auf der x-Achse denLogarithmusder Konzentration und auf der y-Achse die Extinktion (= OD = optische Dichte = Absorption) aufträgt. Diese Darstellungsform ist das halb-logarithmische Diagramm.
Um einelineare Regressionberechnen zu können, muss man diese Sigmoide vorher linearisieren. Zu diesem Zweck behält man die Dimension der x-Achse bei und rechnet die y-Achse inLogit-Werte um. Dabei sollte eine gerade Linie entstehen. Diese Darstellungsform wird Log-Logit-Plot, Logit-Log-Plot oder auch Logit-Plot genannt.
Um Logit-Werte aus den Extinktionswerten berechnen zu können, muss man zuerst die Extinktionswerte (w) normalisieren (n), so dass sie einen Bereich von 0 bis 1 abdecken. Dazu benötigt man die untere (u) und die obere (o)Asymptoteder sigmoiden Kurve.
Umkehrfunktion:
Diese normalisierten Extinktionswerte (n) gehen dann in die Logit-Gleichung ein (L):
Umkehrfunktion:
Die Wertepaare des Logit-Log-Plots aus dem x-Wert (= natürlicher Logarithmus der Konzentration) und dem y-Wert (Logit der normalisierten Extinktionswerte (L)) gehen dann in die Berechnung der linearen Regression ein. Diese liefert dann die Höhe (a) und die Steigung (b) derGeradengleichung:
Umkehrfunktion:
Für dieInterpolationvon unbekannten Messwerten auf die so erstellte Kalibrierkurve, fälschlich auch oft alsEichkurvebezeichnet, benötigt man dann die Umkehrfunktionen. Die höchstePräzisionwird in der Nähe des in der Mitte der Sigmoiden liegendenWendepunkteserreicht, weil an dieser Stelle ihreSteigungam größten ist. Die geringste Genauigkeit entsteht in der Nähe ihrer Asymptoten.
Falls man aus mehreren unterschiedlichen Messwerten mit Hilfe derAsymptotenderKalibrierungkurveeine Messkurve errechnen kann, dann ist es am genauesten, wenn man die Wendepunktskonzentration der Kalibrierkurve mit der Wendepunktverdünnung der Messkurve vergleicht. Die Asymptoten der Messkurven werden ignoriert, weil man alle Messergebnisse auf den Wendepunkt der Kalibrierkurve beziehen muss, der bei den y-Werten n = 0,5 im halblogarithmischen Diagramm, identisch mit L = 0 im Logit-Log-Plot, zu finden ist. Bei der halblogarithmischen Darstellung der Messkurve dient der natürliche Logarithmus des Kehrwertes der Verdünnung als x-Achse, weil bei den Messwerten die Konzentration vor der Berechnung noch unbekannt ist.
Grundsätzlich ist es auch möglich, anstelle der natürlichen Logarithmenlndie dekadischen Logarithmen oder jene mit der Basis von 2 zu verwenden. Anstelle des Kehrwertes der Verdünnung kann auch nur die Verdünnung (Dilution) selbst eingesetzt werden. Es ist zudem zulässig, den Wert von n als von 0 bis 100Prozentgehend zu berechnen, sofern man die Gleichungen korrekt modifiziert. Nicht richtig wäre es aber, den Logit direkt aus den nicht normalisierten Extinktionswerten w zu berechnen.
Literatur
[Bearbeiten|Quelltext bearbeiten]- R. A. Goldsby, T. J. Kindt, B. A. Osborne, J. Kuby:Enzyme-Linked Immunosorbent Assay.In:Immunology.5. Auflage. W. H. Freeman, New York 2003,ISBN 0-7167-4947-5,S. 148–150.
Siehe auch
[Bearbeiten|Quelltext bearbeiten]Weblinks
[Bearbeiten|Quelltext bearbeiten]Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑R. Yalow,S. Berson:Immunoassay of endogenous plasma insulin in man.In:J. Clin. Invest.39. Jahrgang,Nr.7,1960,S.1157–1175,doi:10.1172/JCI104130,PMID 13846364,PMC 441860(freier Volltext).
- ↑R. Lequin:Enzyme immunoassay (EIA)/enzyme-linked immunosorbent assay (ELISA).In:Clin. Chem.51. Jahrgang,Nr.12,2005,S.2415–2418,doi:10.1373/clinchem.2005.051532,PMID 16179424.
- ↑L. Wide,Jerker Porath:Radioimmunoassay of proteins with the use of Sephadex-coupled antibodies.In:Biochim Biophys Acta(1966) 30: S. 257–260.
- ↑E. Engvall, P. Perlman:Enzyme-linked immunosorbent assay (ELISA). Quantitative assay of immunoglobulin G.In:Immunochemistry.8. Jahrgang,Nr.9,1971,S.871–874,doi:10.1016/0019-2791(71)90454-X,PMID 5135623.
- ↑B. K. Van Weemen, A. H. Schuurs:Immunoassay using antigen-enzyme conjugates.In:FEBS Letters.15. Jahrgang,Nr.3,1971,S.232–236,doi:10.1016/0014-5793(71)80319-8,PMID 11945853.
- ↑S. Leng, J. McElhaney, J. Walston, D. Xie, N. Fedarko, G. Kuchel:Elisa and Multiplex Technologies for Cytokine Measurement in Inflammation and Aging Research.In:J Gerontol a Biol Sci Med Sci.63. Jahrgang,Nr.8,Oktober 2008,S.879–884,PMID 18772478,PMC 2562869(freier Volltext).
- ↑ELISA-Kit - Info - Anwendungs Infothek - Ressourcen.Abgerufen am 27. Juli 2023.
- ↑Enzyme-linked Immunosorbent Assay (ELISA) (Ressourcen).Abgerufen am 12. Mai 2018.





