Hippocampus
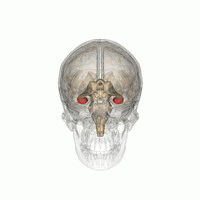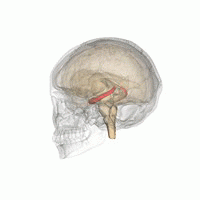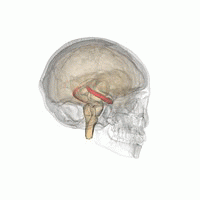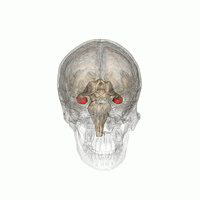
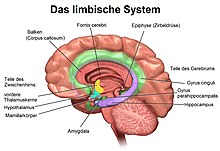
DerHippocampus(PluralHippocampi) ist ein Teil desGehirns,genauer: des erstmals bei Reptilien auftretendenArchicortex.[1]Er befindet sich am inneren Rand desTemporallappensund ist eine zentrale Schaltstation deslimbischen Systems.Es gibt einen Hippocampus proHemisphäre.
Wortherkunft
[Bearbeiten|Quelltext bearbeiten]
Ab 1706 wurde ein Hirnteil nach demSeepferdchen(lateinischHippocampus) benannt. Das Seepferdchen wurde seinerseits seit den 1570er Jahren inlatinisierterForm nach dem MeeresungeheuerHippokampaus dergriechischen Mythologiebezeichnet, dessen vordere Hälfte ein Pferd, der hintere Teil ein Fisch ist. Der Name dieses Fabelwesens (altgriechischἱππόκαμποςhippokampos) ist zusammengesetzt aushippos‚Pferd‘undkampos‚Seeungeheuer‘.[2][3]
Der Hippocampus ähnelt insgesamt einem Seepferdchen ohne Kopf (siehe Abbildung).[4]
Anatomie
[Bearbeiten|Quelltext bearbeiten]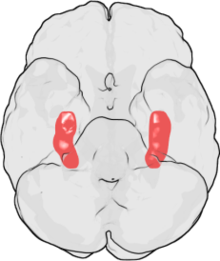
Ansicht von unten (die Stirn liegt im Bild oben)
Der Hippocampus befindet sich im medial gelegenen Teil desTelencephalons(Endhirn) und bildet den sogenannten Archicortex.
Zum Hippocampus gehören mehrere Strukturen, weshalb man auch von einer Hippocampusformation oder Formatio hippocampi spricht:
- Gyrus dentatus
- Cornu Ammonis(Ammonshorn,Hippocampus proprius)
- Subiculum
Zytoarchitektonik
[Bearbeiten|Quelltext bearbeiten]Der Gyrus dentatus stellt die Eingangsstation des Hippocampus dar. Seine Nervenzellkörper liegen imKörnerzellband(Stratum granulare). Die Hauptzellen sind erregende,glutamatergeKörnerzellen,die ihreDendritenin dieMolekularschicht(Stratum moleculare) nach außen entsenden. Außerdem gibt es eine Reihe unterschiedlicher hemmender,GABAergerInterneuronen,die durch ihre Morphologie, damit auch durch ihre Ein- und Ausgänge und ferner durch kennzeichnende Proteine unterschieden werden. Die Molekularschicht lässt sich unterteilen in die innere und äußere Molekularschicht. In beiden Teilen befinden sich kaum Nervenzellkörper, sondern nur Nervenfasern. Die Eingänge der beiden Schichten unterscheiden sich jedoch und können mit verschiedenen Färbungen visualisiert werden (siehe unten). Innerhalb des Bogens der Körnerzellschicht befindet sich derHilus,auch Lamina multiformis genannt. Er enthält einigeInterneurone,vor allem aber dieAxoneder Körnerzellen, die sogenannten Moosfasern (Beachte: Diese Axone haben bis auf den Namen nichts gemeinsam mit den Moosfasern imKleinhirn).
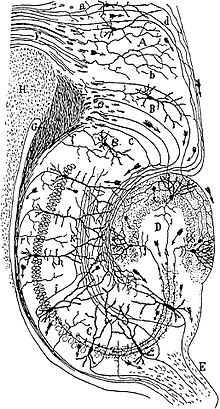
vonSantiago Ramon y Cajal(1911)
Der eigentliche Hippocampus (Hippocampus proprius) ist, als archicorticale Struktur, ebenfalls dreischichtig. Ähnlich wie beim Gyrus dentatus liegen die Nervenzellkörper in einer Schicht, der Pyramidenzellschicht (Stratum pyramidale). Die Hauptzellen sind auch hierglutamatergePyramidenzellen, die Dendriten radial sowohl nach innen als auch nach außen schicken, und es gibt eine ähnliche Vielfalt anInterneuronen.Als Eingangsschichten gliedern sich nach außen an die Pyramidenzellschicht das breiteStratum radiatumund das schmalere Stratumlacunosum-molecularean, nach innen dasStratum oriens,welches die Zellkörper der hemmenden Korbzellen enthält. In seiner tangentialen Richtung wird der Hippocampus proprius unterteilt in die CA1- bis CA4-Regionen (vonCornuAmmonis), wobei nur die CA1- und die CA3-Region tatsächlich anatomisch und funktional von Bedeutung sind.
Das Subiculum ist das Übergangsfeld vom dreischichtigen, archicorticalen Hippocampus zum sechsschichtigenNeocortex.Es liegt zwischen der CA1-Region und demCortex entorhinalis.
Verbindungen
[Bearbeiten|Quelltext bearbeiten]
CA Cornu Ammonis
DG Gyrus dentatus

In der Hippocampusformation sind erregende Neuronen in einer Kette hintereinandergeschaltet. Die Haupteingangsstation für kortikaleAfferenzenist die äußere Molekularschicht des Gyrus dentatus. Hier treffen, als sogenannterTractus perforans,die Axone vom Cortex entorhinalis ein. Sie verschalten auf die ebenfalls erregenden Körnerzellen; daneben aber auch auf einige der verschiedenen Klassen von hemmenden Interneuronen (Vorwärtshemmung). Innerhalb des Gyrus dentatus bewirken andere Interneuronen, die Korb- und Kerzenleuchterzellen, eine Rückwärtshemmung, d. h., sie empfangen Eingänge von Körnerzellen und schalten auf derenSomatabzw. Axonhügel zurück. In der inneren Molekularschicht erhalten die Körnerzellen rückgekoppelte Afferenzen anderer Körnerzellen sowie aus der CA4-Region des Hippocampus proprius (assoziative Fasern), sowie commissurale Afferenzen aus dem Gyrus dentatus der anderen Hemisphäre.
Die Körnerzellen projizieren über die Moosfasern in das innereStratum radiatumder CA3-Region des Hippocampus proprius auf die dortigenPyramidenzellen,die ihrerseits erregend sind. Auch hier gibt es durch Interneuronen wieder Vorwärts- und Rückwärtshemmungen. Weitere Afferenzen tauschen sich zwischen den CA3-Regionen beider Hemisphären aus; sie enden im äußerenStratum radiatum.Die Pyramidenzellen entsenden Axone in denFornix,der die Hippocampusformation verlässt und verschiedene Kerne des Hirnstamms erreicht (u. a.Corpora mamillaria,Substantia nigra,Locus caeruleus).
Abzweigungen derselben Axone, die Schaffer-Kollateralen, verknüpfen die Kette weiter bis in die CA1-Region, wo sie wiederum an Pyramidenzellen enden. Außerdem erreichen Axone des Cortex entorhinalis das Stratum lacunosum-moleculare der CA1-Region. Die Axone der CA1-Pyramidenzellen bilden einen weiteren Teil des Fornix, außerdem projizieren sie in das Subiculum. Diese Projektion ist der Haupteingang des Subiculums. Daneben erhält es Afferenzen aus demCortex perirhinalisund Cortex entorhinalis. Seinerseits projiziert es in die Großhirnrinde beider Seiten zurück, außerdem in denNucleus accumbens,dieAmygdala,denpräfrontalen Cortexund denHypothalamus.
Über die Projektion des Fornix in die Corpora mamillaria ist der Hippocampus eingebunden in denPapez-Kreis,der vonJames W. Papez1937 beschrieben und als neuronale Grundlage vonEmotionenpostuliert wurde. Der Papez-Kreis schließt sich über denThalamus,denGyrus cinguliund den Cortex entorhinalis zurück zur Hippocampusformation.
Die gesamte Hippocampusformation erhält außerdem Afferenzen neuromodulatorischer Bahnen.CholinergeNeuronen imSeptum pellucidumentsenden ihre Axone hierhin,serotoninergeNeuronen der medialenRapheundNoradrenalin-haltige aus dem Locus caeruleus. Eine sehr schwachedopaminergeProjektion aus demventralen Tegmentumist histochemisch nur schwer nachzuweisen.
Elektrische Aktivität
[Bearbeiten|Quelltext bearbeiten]Während derLokomotionund imREM-Schlafist die Aktivität im Hippocampus gering. In Wachzuständen ohne Lokomotion undNon-REM-Schlafgibt es dagegen oft synchrone Aktivität großer Gruppen von Neuronen, die das extrazelluläre elektrische Potential (Feldpotential) im Hippocampus prägt. Charakteristisch sind sägezahnförmige Verläufe (englischsharp wave) mit Perioden von einigen 100 ms, denen im oder kurz vor dem Maximum der Polarisation kurze Wellenpakete (ripple) überlagert sind. Synonyme Abkürzungen für diese Kombination sind SWR und SPW-R. Die Frequenz der Rippel, 100 bis über 200 Hz, ist vonArtzu Art verschieden. Ein Rippel-Ereignis tritt fast immer in CA1 und CA3 und meist in beiden Hemisphären zeitgleich auf, wobei die Rippel selbst nicht synchron sind.
Funktionelle Aspekte
[Bearbeiten|Quelltext bearbeiten]Im Hippocampus fließen Informationen verschiedener sensorischer Systeme zusammen, die verarbeitet und von dort zumCortexzurückgesandt werden. Damit ist er enorm wichtig für dieGedächtniskonsolidierung,also die Überführung von Gedächtnisinhalten aus demKurzzeit-in dasLangzeitgedächtnis.Menschen, bei denen beide Hippocampi entfernt oder zerstört wurden, können keine neuen Erinnerungen formen und weisen somit eine anterogradeAmnesieauf. Alte Erinnerungen bleiben jedoch meist erhalten. Der Hippocampus wird somit als Struktur gesehen, die Erinnerungen generiert, während die Gedächtnisinhalte an verschiedenen anderen Stellen in derGroßhirnrindegespeichert werden.
Es wurde nachgewiesen, dass sich im erwachsenen Gehirn im Hippocampus neue Verbindungen zwischen bestehenden Nervenzellen bilden (synaptische Plastizität) und dass diese Neubildung mit dem Erwerb neuer Gedächtnisinhalte zusammenhängt. Prädestiniert für die Erforschung von molekularen Lernprozessen ist die Schaffer-Kollaterale, die Verbindung zwischen der CA3- und CA1-Region. Hier befinden sich spezielleGlutamat-Rezeptoren(NMDA), die an derLangzeit-Potenzierungbeteiligt sind.
Bei Tieren hat der Hippocampus große Bedeutung für die räumliche Orientierung. Pyramidenzellen in CA1 repräsentieren jeweils einen Bereich einer Umgebung und werden daher auchOrtszellengenannt. Wenn sich das Tier bewegt, werden nacheinander verschiedene Zellen aktiv, wobei Zellen für benachbarte Orte nicht benachbart sind.[5]Auch sind teilweise für einen Ort je nach Bewegungsrichtung oder Ziel verschiedene Ortszellen zuständig. Ortszellen kodieren auch abstrakte Zustände, wie z. B. in welcher Phase eines komplexen Verhaltensablaufs ein Tier gerade ist oder ob gerade ein bestimmter Affekt vorliegt (Hunger, Neugier, Angst). Es gibt also im Gehirn keine topographisch organisierte Landkarte, die kognitive Repräsentation, auch kognitive Karte genannt, enthält jedoch topologische Informationen über die erlebte Umwelt. Zur kognitiven Leistung, Abstände zwischen definierten Orten zu repräsentieren, tragen die sogenanntenGitterzellenimentorhinalen Cortexbei. Menschen mit geschädigten Hippocampi können sich zwar im Alltagsleben orientieren, sind aber außerstande, Wegbeschreibungen zu geben.
Der Hippocampus ist auch für die Koordinierung der verschiedenen Gedächtnisinhalte verantwortlich. Beispielsweise besteht die „innere Karte “, die man z. B. von einer Stadt besitzt, aus zahlreichen Eindrücken, die auch zu unterschiedlichen Zeitpunkten gewonnen wurden. Im Hippocampus werden diese zusammengefügt, und man kann sich so orientieren.
Darüber hinaus spielt die Hippocampusformation auch eine wichtige Rolle für Emotionen:
- Personen mit (unipolarer) Depression zeigen reduziertes Volumen der Hippocampusformation.[6]
- Die Hippocampusformation ist einzigartig in ihrer Vulnerabilität für starke emotionale Stressoren; Tiermodelle zeigen hippocampale Atrophie als Effekt von chronischem emotionalen Stress (bedingt durch Absterben hippocampaler Neurone sowie Reduktion neuronaler Genese im Gyrus dentatus),[7]und Menschen mit schweren emotionalen Traumata (bspw. Vietnam-Veteranen oder Opfer sexuellen Kindesmissbrauchs) zeigen ebenfalls eine Volumenreduktion der Hippocampusformation.[8][9]
- Menschen mit abgeflachter Affektivität zeigen funktionelle Unterschiede in der Hippocampusformation bei der Verarbeitung emotionaler Stimuli.[10]Insbesondere funktionell-bildgebende Studien, die neuronale Korrelate von Emotion mit Musik untersuchen, berichten Aktivitätsunterschiede der Hippocampusformation im Zusammenhang mit musik-evozierten Emotionen.[11]
Neuropathologische Aspekte
[Bearbeiten|Quelltext bearbeiten]Beim Menschen können verschiedene Erkrankungen zu einer Veränderung des Hippocampus führen. Allen voran können Abbauprozesse beiDemenzerkrankungendiese Hirnstruktur schädigen. Darüber hinaus spielt der Hippocampus eine wichtige Rolle bei der Entstehung vonEpilepsieerkrankungen.DieTemporallappenepilepsieist häufig mit einermesialen temporalen Skleroseverbunden, die mittels bildgebender Verfahren (Magnetresonanztomographie) diagnostiziert werden kann. Dieepilepsiechirurgischeeinseitige Entfernung der Hippokampusformation stellt eine Möglichkeit zur Behandlung von medikamentös unbeherrschbaren Anfällen dar. Rauschtrinkenwährend derAdoleszenzsteht im Verdacht, die Ausbildung des Hippocampus nachhaltig zu beeinträchtigen, was im Erwachsenenalter zuVergesslichkeitund mangelnder räumlicher Orientierung führen kann.[12]
Neurogenese im Hippocampus
[Bearbeiten|Quelltext bearbeiten]Der Gyrus dentatus des Hippocampus ist neben demBulbus olfactorius(bzw. der subventrikulären Zone) eine der beiden Strukturen im gesunden Säugetiergehirn, die zeitlebens neue Nervenzellen bilden. DieseNeurogenesevonglutamatergenKörnerzellen wurde 1965 von Altman und Das an Ratten entdeckt und widerspricht dem zuvor über Jahrzehnte bestandenen Dogma, die Neuronen des Gehirns wären von der Geburt an vollständig. Trotzdem erregte die hippocampale Neurogenese erst seit den 1990er Jahren wissenschaftliche Aufmerksamkeit, als mithilfe derBrdU-Markierung sich teilender Zellen gezeigt werden konnte, dass Einflüsse wieStress,Aktivierung desNMDA-Rezeptors,Laufen und reiche Umwelt die Teilungsrate der Zellen und/oder ihre Überlebensrate verändern können. Zahlreiche weitere Studien haben seitdem gezeigt, dass viele Neurotransmitter,Wachstumsfaktoren,Arzneistoffe,Drogenund Umweltfaktoren (darunter auch Lerntraining) die Neurogenese beeinflussen können. Da sich nur ein kleiner Teil der neu gebildeten Zellen zu Neuronen ausdifferenziert, ist es nötig, zwischen den Begriffen Zellproliferation (Mitosevon neuronalen Stammzellen) und Neurogenese zu unterscheiden. Über Nagetiere hinaus wurde die Neurogenese im Hippocampus in dieser Zeit auch bei anderen Säugetieren gefunden, darunter 1998 auch beim Menschen.
Die Funktion der hippocampalen Neurogenese ist noch unklar. Erst seit 2002 ist es möglich, die Zellproliferation durch starke, fokussierteRöntgenstrahlenzu unterbinden und damit aussagekräftige Experimente durchzuführen. Die Ergebnisse dieser Studien sind jedoch bislang uneinheitlich; so geschädigte Tiere zeigen Defizite (aber keinen vollständigen Ausfall) in einigen, aber nicht allen räumlichen Lernparadigmata. Andererseits wurde bei Jugendlichen, die aufgrund einesHirntumorsmit Röntgenstrahlung behandelt wurden, eine fortschreitende und unheilbareanterograde Amnesiebeobachtet. Simulationsstudien mitkünstlichen neuronalen Netzendeuten auf unterschiedliche mögliche Funktionen der Neurogenese hin: Stabilisierung des Hippocampus gegen äußere Einflüsse, Vermeidung katastrophaler Interferenz, leichteres Vergessen früher gelernter Muster. Zu beachten ist dabei, dass eine neu entstandene Zelle sich erst im Laufe von etwa vier Wochen zum Neuron differenziert, also lange nach dem Ereignis, welches die Teilung angeregt hatte. Es wurde gezeigt, dass neue Neuronen in der Zeitspanne von vier bis 28 Tagen nach Teilung die Lernfähigkeit beeinflussen.
Siehe auch
[Bearbeiten|Quelltext bearbeiten]Literatur
[Bearbeiten|Quelltext bearbeiten]- Christine N. Smith, Larry R. Squire:Medial Temporal Lobe Activity during Retrieval of Semantic Memory Is Related to the Age of the Memory.In:J. Neuroscience.Band29,Nr.4,29. Januar 2009,doi:10.1523/JNEUROSCI.4545-08.2009,PMID 19176802,PMC 2670190(freier Volltext) – (englisch,jneurosci.org[abgerufen am 1. November 2016] Review inEndlager der Erinnerung(Wissenschaft.de, 28. Januar 2009)).
- Waters, Spencer & Basile, Benjamin & Murray, Elisabeth (2023):Reevaluating the role of the hippocampus in memory: A meta-analysis of neurotoxic lesion studies in nonhuman primates.Hippocampus. 10.1002/hipo.23499.
Weblinks
[Bearbeiten|Quelltext bearbeiten]- Gyorgy Buzsaki:Hippocampus.In:Scholarpedia.(englisch, inkl. Literaturangaben)
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Antonio Abellán, Ester Desfilis, Loreta Medina:Combinatorial expression of Lef1, Lhx2, Lhx5, Lhx9, Lmo3, Lmo4, and Prox1 helps to identify comparable subdivisions in the developing hippocampal formation of mouse and chicken.In:Frontiers in Neuroanatomy.Band8,2014,doi:10.3389/fnana.2014.00059(englisch, freier Volltext).
- ↑hippocampusdictionary (englisch)
- ↑hippocampusOnline Etymology Dictionary (englisch)
- ↑T. Koch, R. Berg:Lehrbuch der Veterinär-Anatomie.4. Auflage.Band3.Fischer, Jena 1985,S.422.
- ↑Kazu Nakazawa et al.:NMDA receptors, place cells and hippocampal spatial memory.In:Nature Reviews Neuroscience.Band5,2004,doi:10.1038/nrn1385(englisch):“Zitat aus Box 1:The relative locations of these place-receptive fields change in different environments, with no apparent topographical relationship to cell position”
- ↑P. Videbech, B. Ravnkilde:Hippocampal volume and depression.In:Am. J. Psychiatry.Band161,2004,S.1957–1966(englisch).
- ↑J. L. Warner-Schmidt, R. S. Duman:Hippocampal neurogenesis. Opposing effects of stress and antidepressant treatment.In:Hippocampus.Band16,2006,S.239–249(englisch).
- ↑M. B. Stein et al.:Hippocampal volume in women victimized by childhood sexual abuse.In:Psychol. Med.Band27,1997,S.951–959(englisch).
- ↑J. D. Bremner:Does stress damage the brain?In:Biol. Psychiatry.Band45,1999,S.797–805,doi:10.1016/s0006-3223(99)00009-8,PMID 10202566(englisch).
- ↑S. Koelsch et al.:A cardiac signature of emotionality.In:Eur. J. Neurosci.Band26,2007,S.3328–3338(englisch).
- ↑Stefan Koelsch:Towards a neural basis of music-evoked emotions.In:Trends in Cognitive Sciences.Band14,2010,S.131–137,doi:10.1016/j.tics.2010.01.002(englisch,sciencedirect).
- ↑Taffe et al.:Long-lasting reduction in hippocampal neurogenesis by alcohol consumption in adolescent nonhuman primates.In:PNAS.Band107,2010,S.11104–11109(englisch).