Insulin
| Insulin | ||
|---|---|---|

| ||
| Zwei Modelldarstellungen des Insulinmoleküls. Links das einfache Molekül (Monomer) als einKalottenmodell,aus dem die Oberflächenform hervorgeht. Rechts das sechsfache Molekül (Hexamer) als so genanntesBändermodell,bei dem die innere Struktur deutlich wird. Bei letzterem sindα-Helicesdurch Schrauben undβ-Faltblätterdurch Pfeile dargestellt. | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/LängePrimärstruktur | 5,8 kDa[1]/ 51 Aminosäuren | |
| Sekundär-bisQuartärstruktur | Heterodimer (21 + 30 aa) | |
| Präkursor | Proinsulin | |
| Bezeichner | ||
| Gen-Name | INS | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | A10AB01 | |
| DrugBank | DB00030 | |
| Vorkommen | ||
| Homologie-Familie | CLU_140421_1_0 | |
| ÜbergeordnetesTaxon | Wirbeltiere | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 3630 | 16334 |
| Ensembl | ENSG00000129965 | ENSMUSG00000000215 |
| UniProt | P01308 | Q5EEX1 |
| Refseq(mRNA) | NM_000207 | NM_008387 |
| Refseq(Protein) | NP_000198 | NP_032413 |
| Genlocus | Chr 11: 2.14 – 2.14 Mb | Chr 7: 142.49 – 142.49 Mb |
| PubMed-Suche | 3630 | 16334
|
Insulin(andere Namen:Insulinum,Insulinhormon,Inselhormon) ist ein für alleWirbeltierelebenswichtigesProteohormon(Polypeptidhormon), das in den β-ZellenderBauchspeicheldrüsegebildet wird. Diese spezialisierten Zellen befinden sich in denLangerhans-Inseln.Von diesen „Inseln “leitet sich auch der Name „Insulin “ab (vonlateinischinsula„Insel “). Das seit 1921 bekannte Insulin ist an der Regulation des Stoffwechsels, insbesonderedem der Kohlenhydrate,beteiligt. Insulin senkt denBlutzuckerspiegel,indem es Körperzellen dazu anregt,Glucoseaus demBlutaufzunehmen.
Funktion und Wirkung
[Bearbeiten|Quelltext bearbeiten]Die Regulation der Konzentration vonGlucoseim Blut erfolgt durch einenRegelkreisaus zwei Hormonen, die abhängig von der Blutzuckerkonzentration ausgeschüttet werden. Insulin ist das einzigeHormon,das den Blutzuckerspiegel senken kann. Sein Gegenspieler ist dasGlucagon,dessen Hauptaufgabe es ist, den Blutzuckerspiegel zu erhöhen. AuchAdrenalin,KortisolundSchilddrüsenhormonehaben blutzuckersteigernde Wirkungen.
DerBlutzuckerspiegelsteigt vor allem nach der Aufnahme vonkohlenhydratreicherNahrung. Als Reaktion darauf wird von den β-Zellen Insulinins Blut ausgeschüttet.Insulin senkt den Blutzuckerspiegel dadurch, dass es mittels seiner „Schlüsselfunktion “der Glucose aus demBlutplasmaund derGewebsflüssigkeitden Durchtritt durch dieZellmembranin dasZellinnereermöglicht. Vor allem dieLeber-undMuskelzellenkönnen in kurzer Zeit große Mengen Glucose aufnehmen und sie in Form vonGlycogenspeichern oder zurEnergiegewinnungabbauen (sieheGlycolyse).
Auch auf andere Zellen wirkt das Hormon, so hat es Einfluss auf denFett-undAminosäurestoffwechselsowie auf denKaliumhaushalt.
Das Hormon ist wesentlicher Faktor folgender Erkrankungen:



Das im Blut zirkulierende Insulin entfaltet seine Wirkung durch Bindung an Insulinrezeptoren.
Insulinrezeptor
[Bearbeiten|Quelltext bearbeiten]Letztlich löst die Bindung dieses Hormons an seinenRezeptoreine Reihe vonKinase-Kaskaden(Kaskade vonPhosphorylierungsreaktionen) aus, die durchSignalwegebeschrieben werden können.[2]
Diese Signalwege bewirken ein Sinken des Blutglucosespiegels durch
- Förderung der Glucose-Aufnahme (GLUT4-Translokationzur Zelloberfläche)
- Förderung der Glucose-Speicherung (Glycogensynthese) in derLeberund denMuskeln
Dieses Signal wird durch die Aktivierung glucoseverbrauchender Wege unterstützt. Weitere unterstützende Maßnahmen bestehen in der Unterdrückung glucoseliefernder Wege, so zum Beispiel durch Abbau dessecond messengercAMPüber einePhosphodiesterase.
Glucoseaufnahme im Muskelgewebe
[Bearbeiten|Quelltext bearbeiten]Das Hormon erhöht in der Muskulatur und im Fettgewebe diePermeabilität(Durchlässigkeit) der Zellmembran für Glucose. Dabei ist zu beachten, dass nicht die Membran selbst permeabler wird, sondern dass vermehrtCarrier-Proteinefür Glucose aktiviert werden. Dieses Carrier-Protein ist GLUT4, ein hochaffiner, insulinabhängiger Glucose-Transporter,welcher die Glucose durch erleichterteDiffusion(passiver Transport) in die Zelle transportiert. Folgende physikalische Eigenschaften sind für GLUT4 relevant:sättigbar,nicht aktivierbar oder inaktivierbar, also Regulation nur durch insulinabhängigen Einbau oder Ausbau.
Glucoseaufnahme und Stoffwechsel im Gehirn
[Bearbeiten|Quelltext bearbeiten]Nervenzellen(undErythrozyten) nehmen Glucose insulinunabhängig auf. Deshalb nehmen die insulinabhängigen Zellen bei einem erhöhten Insulinspiegel mehr Glucose auf, und für die insulinunabhängigen bleibt weniger übrig.
Im Allgemeinen besteht beiHypoglykämiedie Gefahr, dass das auf Glucose angewiesene Nervensystem geschädigt wird. Insulin wird, verabreicht alsNasensprayin direktem Kontakt mit demZNS,zur Behandlung derAlzheimer-Krankheituntersucht.[3]
Auf- und Abbau von Fettgewebe
[Bearbeiten|Quelltext bearbeiten]Das Hormon hemmt dieLipolyseimFettgewebeund somit den Abbau vonFett.Ein Insulinmangel führt daher zu einer gesteigerten Lipolyse mit Bildung vonKetokörpernund einer daraus resultierendenKetose.
Förderung des Zellwachstums
[Bearbeiten|Quelltext bearbeiten]Eine weitere zentrale Funktion desPeptidhormonsInsulin besteht in der Regulation von Zellwachstum undProliferationdurch die Aktivierung der Transkription von Genen, die für Kontrolle und Ablauf des Zellzyklus von großer Bedeutung sind. Diese Insulinwirkung ist beiDiskursen über Insulinpräparateein Thema.
Tryptophan-Aufnahme im Gehirn
[Bearbeiten|Quelltext bearbeiten]Höhere Insulinspiegel haben einen leicht steigernden Einfluss auf die Aufnahme vonTryptophanins Gehirn.[4]
Insulin und die Regelung des Blutzuckerspiegels
[Bearbeiten|Quelltext bearbeiten]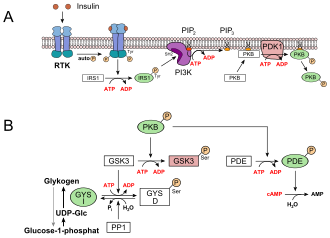
Eine der wichtigsten biologischen Wirkungen des Insulins ist die rasche Beschleunigung der Glucoseaufnahme in Muskel- und Fettzellen und Regulierung der Zwischenspeicherung in der Leber im Rahmen der Regelung desBlutzuckerspiegels:
- In der Leber und der Muskulatur werden die mit der Nahrung aufgenommenenKohlenhydratealsGlycogengespeichert. Dies hat ein Absinken derGlucosekonzentrationim Blut zur Folge. Die Glucoseaufnahme in die Leberzellen erfolgtinsulinunabhängigüber GLUT2. Durch Insulin wird eineRezeptor-Tyrosinkinase(RTK) aktiviert, die eine Signaltransduktion in Gang setzt. Beteiligt sind dabei das Insulinrezeptorsubstrat1 (IRS1), diePhosphoinositid-3-Kinase(PI3K), dersecond messengerPhosphatidylinositol-4,5-bisphosphat (PIP2), die Phosphoinositid-abhängige Kinase-1 (PDK1) und schließlich dieProteinkinase B(PKB) (siehe Bild, A). PKB phosphoryliert dieGlycogensynthase-Kinase 3,GSK3, die dadurch inaktiviert wird. GSK3 ist eine Kinase, die dieGlycogensynthasephosphoryliert und damit inaktiviert (GYSb). GSK3 steht in Konkurrenz zu einerPhosphatase,derProtein-Phosphatase 1(PP1). Dadurch, dass GSK3 nicht mehr wirken kann, liegt daher immer mehr Glycogensynthase in seiner dephosphorylierten Form vor (GYSa,siehe unteres Bild, B). Außerdem aktiviert die PKB eine Phosphodiesterase, PDE, die cAMP zu AMP hydrolysiert. Infolgedessen erlischt zusätzlich der Signalweg für dieProteinkinase A,die für den Abbau von Glycogen sorgt.
- In der Leber, demFettgewebeund der Muskulatur wird unter Insulineinfluss dieTriglyceridsynthesestimuliert. Substrate dafür sind neben den Kohlenhydraten mit derNahrungaufgenommeneLipide.
- In den drei genannten Geweben werdenAminosäurenverstärkt aufgenommen und für die Proteinsynthese verwendet.
DiemetabolischenundmitogenenEffekte von Insulin werden über die Bindung an dessen Rezeptor auf der Zelloberfläche der Zielgewebe Leber, Muskel und Fett initiiert.
- Insulin induziert weiterhin dieGlycogensyntheseund -speicherung in Leber und Muskel, die Triglyceridsynthese in Leber und Fettgewebe sowie die Speicherung von Aminosäuren im Muskel.
- Gleichzeitig hemmt Insulin diehepatischeGluconeogeneseund zählt daher insgesamt zu den wichtigsten Regulatoren desGlucosemetabolismus.
Gegenspieler
[Bearbeiten|Quelltext bearbeiten]Fällt der Blutzuckerspiegel im Körper unter einen Wert von 80 mg/dl ab, wird die Insulinproduktion bereits stark reduziert.
Sinkt der Blutzucker weiter ab, treten verschiedene Gegenspieler des Insulins auf:
Die Spiegel dieser gegenregulierenden Hormone steigen bereits deutlich an, wenn der Blutzucker unter 60 mg/dl absinkt.
Beim Typ 1-Diabetes ist oft auch der Gegenregulationmechanismus gestört, was zu zusätzlichen Problemen mitHypoglykämienführt.
Somatostatinhat einen hemmenden Einfluss auf die Sekretion von Insulin und Glucagon, da er als allgemeinerHemmerim Körper fungiert.
Wirkung auf den Kaliumspiegel
[Bearbeiten|Quelltext bearbeiten]Insulin senkt denKaliumspiegelim Blut, indem es dafür sorgt, dass Kalium in das Zellinnere vonHepatozytenundSkelettmuskelzellenverlagert wird, also vonextrazellulärnachintrazellulär.Dies erfolgt durch Aktivierung derNatrium-Kalium-ATPasedurch Insulin. Insulinpräparate werden daher gemeinsam mit Glucose (zur Vermeidung einerHypoglykämie) zur Behandlung einerHyperkaliämieverwendet.[5]
Vorkommen
[Bearbeiten|Quelltext bearbeiten]Insulinsequenzen von mehr als 100 verschiedenenSpeziessind bekannt. DieProteinsequenzender jeweiligen Insuline sind sich ähnlich – sie zeigenSequenzhomologie– sind aber nicht identisch.[6]Über die Unterschiede im chemischen Aufbau von Humaninsulin gegenüber den Insulinen einiger Säugetiere sowie Informationen zu künstlich hergestelltem Insulin sieheInsulinpräparat.
Insulin undEvolution:Genotypen,die inJäger- und Sammlergesellschafteneinen raschen Abbau von Energiereserven bei Nahrungsmangel verhinderten,prädisponierenbeim heutigen Lebensstil mitBewegungsmangelund Nahrungsüberangebot zuAdipositasund Typ-2-Diabetes.[7]
InwieweitGeneden Glucosestoffwechsel und die damit verbundene Wirkung von Insulin beeinflussen, ist noch nicht zur Gänze geklärt.[8]
DieHomologedes Insulins in Insekten sind dieDrosophila Insulin-like Peptides.
Bildung, Speicherung, Freisetzung und Regulierung
[Bearbeiten|Quelltext bearbeiten]Biosynthese
[Bearbeiten|Quelltext bearbeiten]DieSynthesedes Hormons erfolgt in den β-Zellen der Langerhansschen Inseln derBauchspeicheldrüse.DiegenetischeInformation wird von nur einemGenlocusim kurzenArmdesChromosom 11codiert. Das Gen besteht aus ungefähr 300Nukleotiden.[9]
DiemRNAwird zunächst anRibosomen,die sich auf dem rauenEndoplasmatischen Retikulum(ER) befinden, in das Präproinsulintranslatiert,das aus 110 Aminosäuren besteht.
Die weitereProzessierungerfolgt in zwei Schritten, nach derFaltungdesMolekülsdurch Bildung vonDisulfidbrückenentsteht durch Abspaltung vonSignalpeptidund C-Peptid das Insulinmolekül.
|
  |
Speicherung
[Bearbeiten|Quelltext bearbeiten]
Die Insulinmoleküle werden in denVesikelndesGolgi-Apparats,der an der Zellmembran der β-Zelle liegt, durchZink-IonenzuHexamerengebunden und so stabilisiert gespeichert (Zink-Insulin-Komplex).
Die hohe Bindungsfreudigkeit von Insulinmolekülen an Zink hat mehrere wichtige Auswirkungen. Insulin ist in der Form von Hexameren und nach dem Zerfall inDimerenoch nicht wirksam, sondern nur als Einzelmolekül. Diese Eigenschaft spielt bei denInsulinpräparateneine wichtige Rolle. Bei schnellwirkenden Insulinpräparatenist der zu langsame Zerfall der Molekülverbände unerwünscht und es wird nach Möglichkeiten gesucht den Zerfall zu beschleunigen. Bei langwirkenden Insulinpräparaten wird die Zinkbindung zur Verlängerung der Wirkdauer durch hohe Zinkkonzentrationengezielt verstärkt. Bei der Entwicklung von oralen Insulinpräparaten wird die Zinkbindung zur Kopplung von Insulin an Transportmoleküle genutzt.
Ausschüttung
[Bearbeiten|Quelltext bearbeiten]

Die Ausschüttung von Insulin ins Blut erfolgt durchExozytose.
Die Insulinausschüttung erfolgtoszillierend.Alle drei bis sechs Minuten wird Insulin in dieBlutbahnabgegeben. Nach der Nahrungsaufnahme ist bei Stoffwechselgesunden ein biphasischer Verlauf der Insulinsekretion feststellbar: Der erste „Insulinpeak“hat seine Spitze nach drei bis fünf Minuten und dauert zehn Minuten. Danach schließt sich eine zweite Phase an, die so lange anhält, wie eineHyperglykämiebesteht.[11]Die erste Phase besteht aus den gespeicherten Insulinmolekülen, die zweite Phase vor allem aus neu gebildetem Insulin.[12]
Das C-Peptid wird erst bei Anstieg des Blutzuckerspiegels aus dem Proinsulin durchPeptidasenherausgeschnitten und gemeinsam mit dem aktiven Insulin und Zink ausgeschüttet. Durch den Nachweis von C-Peptid im Serum kann dieendogeneInsulinproduktion gemessen werden. So kann bei Diabetikern eine Aussage darüber getroffen werden, wie viel Insulin noch vom Körper selbst hergestellt wird, da das synthetische Produkt keine C-Sequenz enthält.[13]
Nach einemTraumaist die Insulinsekretion in der Akutphase (etwa 12 bis 24 Stunden) supprimiert.[14]
Regulierung
[Bearbeiten|Quelltext bearbeiten]Die Hauptaufgabe von Insulin besteht darin, im Zusammenwirken mit Glucagon den Blutglucosespiegel ständig zwischen bestimmten Werten zu halten. Gerät der Blutzuckerspiegel unter einen gewissen Wert, droht das hypoglykämische Koma und der Tod, gerät er darüber, drohen Schäden an Gefäßen, Nierenkörperchen und anderen Geweben. Zusammen mitLeptinscheint Insulin aber auch maßgeblichen Anteil an der Energiehomöostasezu haben. Dabei wirkt aber nicht nur Leptin auf Insulin ein, sondern das Insulin wirkt selbst ebenfalls auf das Leptin ein, genauer auf die Aufnahme von Leptin im Gehirn.
Aufgrund der lebenswichtigen Funktion muss die biochemische Implementierung des Regelkreises robust sein. Da Zellen nicht „denken “können, kann es nur so sein, dass Einzelzellen wie ein Zustandsautomat funktionieren bzw. dass wenige Zellen dermaßen zusammenwirken, dass ein Reiz sinnvoll verrechnet wird.
Der Hauptreizzur Ausschüttung von Insulin aus der β-Zelle ist der Blutzuckerspiegel (ab 5 mmolGlucose/l Blut), und dieser wird direkt von der β-Zelle „gemessen “. Biochemisch umgesetzt wird das mit Hilfe von ATP-gesteuerten Kaliumkanälen etc., siehe#Glucosegesteuerter Freisetzungsmechanismus.
Die HormoneGastrin,Sekretin,GIPundGLP-1modifizieren den grundlegenden Glucose-Insulin-Regelkreis, indem sie auf die β-Zelle wirken. SieheInkretin-Effekt.
GIPwird vonK-Zellen,welche sich in der Schleimhaut desDuodenumsbefinden und die Glucose imChymus„messen “, ins Blut sezerniert und erhöht die Insulinausschüttung der β-Zellen. Das GIP wirkt also auf die β-Zellen zu einem Zeitpunkt ein, wo die Glucose aus der Nahrung noch nicht ins Blut gelangt ist.
GLP-1wird vonL-Zellen,welche sich in der Schleimhaut desIleumund desCaecumbefinden und die Glucose im Chymus „messen “, ins Blut sezerniert und erhöht ebenfalls die Insulinausschüttung der β-Zellen. Der Großteil der Nährstoffe wird bereits imJejunumextrahiert und ins Blut bzw. in die Lymphe abgegeben. Im Caecum findet keinerlei Absorption von Nährstoffen, sondern hauptsächlich eine Fermentation statt.
Zusätzlich sind β-Zellen sowohl vomparasympathischenals auchsympathische Nervensysteminnerviert:
Das parasympathische NS wird bei Leptin-Insuffizienz (oder auch bei Leptin-Resistenz) aktiviert und wirkt allgemein trophotropisch, d. h., es bewirkt die Speicherung von Energie. Es erhöht also die Insulinabgabe. Zumindest bei Mäusen wirkt es außerdem gleichzeitig auf Adipozyten ein und erhöht ihre Empfindlichkeit für Insulin, während die Empfindlichkeit der Leber- und Muskelzellen nicht beeinflusst wird. Glucose wird in Leber- und Muskelzellen zu Glycogen verbaut und derart gespeichert, in den Adipozyten erfolgt De-novo-Lipogenese und Speicherung von TGs.
Das sympathische NS wird bei Leptin-Suffizienz aktiviert und wirkt allgemein ergotropisch, d. h., es bewirkt die Erhöhung des Energieverbrauchs. Es senkt die Insulinabgabe. Die Senkung der Insulinabgabe scheint einem erhöhten Energieverbrauch entgegenzuwirken, denn die Muskelzellen können sehr viel mehr Glucose aus dem Blut aufnehmen, wenn sie möglichst viele GLUT-4 Transporter auf der Oberfläche aufweisen. Sie müssen also auf die bereits gespeicherte Energie in Form von Glycogen und Fettsäuren zurückgreifen.
Glucosegesteuerter Freisetzungsmechanismus
[Bearbeiten|Quelltext bearbeiten]
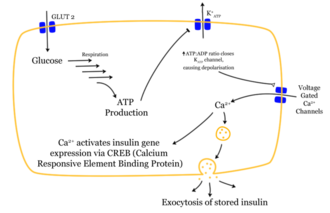
Das Eindringen eines Glucose-Moleküls in die β-Zelle setzt eine Wirkungskette in Gang. Nachdem die Glucose durch denGLUT1-Transporter in die Zelle gelangt ist, wird sie durchGlycolyseverstoffwechselt. Das dabei entstehendeATPhemmt den Ausstrom vonKalium-Ionen (ATP-sensitive Kaliumkanäle). So kommt es durch den stark verminderten Kaliumausstrom zurDepolarisation,weil die Stabilität desMembranpotentialsnicht weiter durch Kaliumausstrom erhalten wird. Das depolarisierte Membranpotential bewirkt eine ÖffnungspannungsabhängigerCalcium-Kanäle. Der Einstrom der Calciumionen ist der entscheidende Reiz für die Verschmelzung der insulinhaltigenVesikelmit der Zellmembran.
Die gespeicherten Insulinmoleküle werden durch Verschmelzen der Membranen (Exozytose) aus den β-Zellen in denExtrazellularraumund weiter in den Blutkreislauf freigesetzt. Dabei werden die Speicher-Hexamere aufgetrennt. Der Insulinspiegel im Blut steigt an.
Halbwertszeit und Abbau
[Bearbeiten|Quelltext bearbeiten]Diebiologische Halbwertszeiteinzelner Insulinmoleküle im Blutkreislauf liegt bei circa fünf Minuten.[11]
Das Insulin wird über manche Insulinrezeptoren in die Zellen aufgenommen, dort abgebaut und somit verbraucht. In der Leber und in derNierewird Insulin durchInsulinaseinaktiviert, die Insulinase oder genauerGlutathion-Insulin-Transhydrogenasespaltet die Disulfidbrücken zwischen der A- und der B-Ketteauf, wodurch das Insulin in zwei Teile zerfällt und wirkungslos wird.[16]Die Abbauprodukte werden durch die Niere ausgeschieden, ebenso 1,5 % des noch intakten Insulins.[17]Die kurze Zeitspanne der Aktivität des Insulins zeigt, dass diephysiologischeSteuerung desZuckerstoffwechselsim gesunden Körper sehr schnell funktioniert; dieseGeschwindigkeitkann bei der Behandlung desDiabetes mellituspraktisch nicht erreicht werden.
Insulin als Arzneistoff
[Bearbeiten|Quelltext bearbeiten]
In derInsulintherapiewerden verschiedeneInsulinpräparateverwendet. Die häufigste und älteste Verabreichungsart ist diesubkutane Injektion.Für diesen Zweck steht eine Reihe von kurz-, mittel- und langwirkenden Humaninsulinen undInsulinanalogazur Verfügung. Werden diese zur Therapie kombiniert, so ist auf die unterschiedlicheHalbwertzeitbesonders zu achten.

- sehr schnell und kurz wirkend: Insulin glulisin, Insulin lispro, Insulin aspart
- kurz wirkend: Normalinsulin (= gelöstes Humaninsulin)
- intermediär wirkend:NPH-Insulin,biphasisches Insulin lispro, biphasisches Insulin aspart
- lang wirkend:Insulin detemir,Insulin glargin,Insulin degludec
Peroralist Insulin unwirksam, da die Eiweißketten imMagen-Darm-Traktvon körpereigenenEnzymenabgebaut werden, bevor sie ihre Wirkung entfalten können. Untersucht wird, inwieweit sich Insuline inNanopartikelverkapseln lassen, um auf diesem Wege „unverdaut “in den Blutkreislauf eingeschleust werden zu können.[18]Jüngere Entwicklungen wie Präparate zurInhalation,die das Insulin über die Atemwege zuführen, haben sich auf dem Markt bisher nicht behaupten können.
In der Vergangenheit wurde Insulin im Rahmen derInsulinschocktherapiezur Behandlung von Menschen mitpsychischen Krankheiteneingesetzt. Diese Methode der Behandlung wurde zum Beispiel im biografischen FilmA Beautiful MindanJohn Nashgezeigt. Dieses Verfahren wird nicht mehr praktiziert.[19]
Missbrauch von Insulin
[Bearbeiten|Quelltext bearbeiten]Insulin steht auf derListe der verbotenen Doping-Substanzen,[20]da es zu mehreren Zwecken missbraucht werden kann. Da Insulin der durchSomatropinverringerten Glucoseaufnahme in die Muskelzellen entgegenwirkt, wird es oft zur Kompensation dessen unerwünschter Nebenwirkung verwendet (sieheAnabolikum). Andere Anwendungen sind die Förderung der Füllung derGlycogenspeicherbeiAusdauersportlernund die Unterstützung des Aufbaus von Muskelmasse.[21]
DiemissbräuchlicheSelbstverabreichung von Insulin, um den Blutzuckerspiegel übermäßig abzusenken, führt zum Krankheitsbild derHypoglycaemia factitia.
Im März 2008 wurde derKrankenpflegerColin Norris in Newcastle zu einerFreiheitsstrafevon 30 Jahren verurteilt, weil er vier seiner Patientinnen durch Injektion zu hoher Insulindosen ermordet hatte.[22]
Der erste dokumentierte Mord mit Insulin stammt aus dem Jahr 1957.[23]
Zeittafel zur Forschungsgeschichte
[Bearbeiten|Quelltext bearbeiten]1869 entdecktePaul Langerhansdie Inselzellen im Gewebe der Bauchspeicheldrüse. 1889 könntenOskar MinkowskiundJosef von Meringbei Hunden einen Diabetes mellitus durch die Entfernung der Bauchspeicheldrüse auslösen. Kurz darauf wurden die Inselzellen als endokrines (hormon-produzierendes) Gewebe vermutet. Der französische Physiologe und Endokrinologe Eugene Gley (1857–1930) senkte 1894 den Blutzucker eines Hundes, dem die Bauchspeicheldrüse entfernt wurde, mit einem Pankreasextrakt. Er differenzierte zwischen exokriner und endokriner Funktion und ordnete letztere den Inselzellen zu. Der deutsche InternistGeorg Ludwig Zülzerführte am 21. Juni 1906 erstmals eine Injektion mit einem von ihm isolierten und von der Firma Schering hergestellten Kälberpankreasextrakt namens Acomatol am Menschen durch.
1909 tauchte erstmals der BegriffInsulin(„von den Inseln “) kommend, auf. Der belgische PathologeJean de Meyer(1878–1934) schlug diesen Namen für die noch unbekannte Substanz vor.[24]1910 benannte der englische PhysiologeEdward Albert Sharpey-Schaferdie den Diabetikern fehlende Substanz aus dem Pankreas ebenfalls „Insulin “. Wer den Namen zuerst geprägt hat, ist aus den vorliegenden Quellen nicht klar ersichtlich.[25]
1916 gelang esNicolae Paulescuerstmals, Insulin aus Pankreasgewebe zu gewinnen. Fünf Jahre später isoliertenFrederick BantingundCharles BestInsulin aus den Bauchspeicheldrüsen tierischer Feten, sie nannten es „Isletin “. 1922 wurde Insulin erfolgreich bei Patienten angewendet. In diesem Jahr begann auch die industrielle Insulin-Herstellung in Kanada. 1923 erhielten Frederick Banting undJohn James Rickard MacleoddenNobelpreis für Physiologie oder Medizinfür die Entdeckung des Insulins.John Jacob Abelkonnte 1926 Insulin in kristallisierter Form herstellen. Zwei Jahre später gelangOskar Wintersteinerder Nachweis, dass Insulin ein Protein ist. 1958 wurdeFrederick SangerderNobelpreis für Chemiefür seine Arbeiten über die Struktur der Proteine, besonders des Insulinsverliehen.
1963 gelangHelmut Zahnund seinem Team die weltweit erste chemische Synthese des Insulins.[26]Im Folgejahr ging derNobelpreis für ChemieanDorothy Hodgkinfür ihre mit der Röntgenstrukturanalyse durchgeführten Bestimmungen des biochemischen Aufbaus wichtiger Stoffe, wie des Insulins und des Vitamins B12.1971 wurde die dreidimensionale Proteinstruktur des Insulins von Blundell et al. aufgeklärt.[27] 1982 gelang es erstmals,Humaninsulindurch gentechnisch veränderte Bakterien in großer Menge herzustellen.
Einer der ersten Insulinhersteller in Deutschland war das 1945 in München gegründete Unternehmen Hormon-Chemie,[28]das als Präparate etwa das DepotinsulinHorm,das Thrombokinase-PräparatTachystyptund den OrganextraktNucleotonanbot.[29]Das erste schnellwirkende Insulinanalogon Insulin lispro (HandelsnameHumalog) kam 1996 auf den Markt, 2000 mit Insulin glargin (HandelsnameLantus) das erste langwirksame Insulinanalogon, 2015 mitAbasaglar(Insulin glargin) das erste Insulin-Biosimilar.
Weblinks
[Bearbeiten|Quelltext bearbeiten]Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Matthias Otto:Analytische Chemie.John Wiley & Sons, 2011,ISBN 978-3-527-32881-9,S. 557.
- ↑Jeremy M. Berg, John L. Tymoczko, Lubert Stryer:Biochemie.6. Auflage. Spektrum-Verlag, 2007,ISBN 978-3-8274-1800-5.
- ↑S. Craft, L. D. Baker, T. J. Montineet al.:Intranasal insulin therapy for alzheimer disease and amnestic mild cognitive impairment: A pilot clinical trial.In:Archives of Neurology.Band69,Nr.1,Januar 2012,S.29–38,doi:10.1001/archneurol.2011.233.
- ↑P. M. Daniel, E. R. Love, S. R. Moorhouse, O. E. Pratt:The effect of insulin upon the influx of tryptophan into the brain of the rabbit.In:J Physiol.Vol 312, März 1981, S. 551–562,doi:10.1113/jphysiol.1981.sp013643
- ↑„Oje, das Kalium ist 7,2 mmol/l “.(PDF)Abgerufen am 6. Oktober 2018(Vorlesung der Medizinischen Universität Wien).
- ↑So haben auch derMensch,derSchimpanse,dieMaus,dasKaninchenund derZebrafischähnliche, aber nicht identische Insuline:Species Sequence Alignment of Insulin.
- ↑J. Vander Molen, L. M. Frisse, S. M. Fullerton, Y. Qian, L. Del Bosque-Plata, R. R. Hudson, A. Di Rienzo:Population genetics of CAPN10 and GPR35: implications for the evolution of type 2 diabetes variants.In:American Journal of Human Genetics.Band 76, Nummer 4, April 2005, S. 548–560,doi:10.1086/428784.PMID 15696418,PMC 1199293(freier Volltext).
- ↑Gene beeinflussen Glucosestoffwechsel.In:aerzteblatt.de.18. Januar 2010, archiviert vom(nicht mehr online verfügbar) am26. November 2015;abgerufen am 25. November 2015.
- ↑David Owerbach, Graeme I. Bell,William J. Rutter,Thomas B. Shows:The insulin gene is located on chromosome 11 in humans.In:Nature.286, 1980, S. 82,doi:10.1038/286082a0.
- ↑abUniProtP01308
- ↑abHelmut Schatz (Hrsg.):Diabetologie kompakt.4. Auflage. 2006,ISBN 3-13-137724-0.
- ↑Heiner Laube:Insulinresistenz.Pathophysiologie,TherapieundPerspektiven.Uni-Med, 2001,ISBN 3-89599-541-X.
- ↑Florian Horn:Biochemie des Menschen: das Lehrbuch für das Medizinstudium.5. Auflage. Thieme, Stuttgart 2012,ISBN 978-3-13-130885-6,S.351.
- ↑Karl.-Heinz Altemeyer, Wulf Seeling, J. E. Schmitz, Bernd Koßmann:Posttraumatischer Stoffwechsel – Grundlagen und klinische Aspekte.In:Der Anaesthesist.Band 33, Heft 1, Januar 1984, S. 4–10, hier: S. 4 und 7–8.
- ↑Mark E Daly:Acute effects on insulin sensitivity and diurnal metabolic profiles of a high-sucrose compared with a high starch diet.In:Am J Clin Nutr.Nr.67,1998,S.1186–1196(englisch,ajcn.org[PDF; abgerufen am 19. Februar 2011]).
- ↑Skriptum Biochemie 2.Fachschaft Medizin der Uni München;archive.org
- ↑Hagers Handbuch der pharmazeutischen Praxis.S. 552.
- ↑Yu-Hsin Lin u. a.:Preparation and Characterization of Nanoparticles Shelled with Chitosan for Oral Insulin Delivery.In:Biomacromolecules.8 (1), 2007, S. 146–152.doi:10.1021/bm0607776
- ↑Hans Bangen:Geschichte der medikamentösen Therapie der Schizophrenie.Berlin 1992, S. 43–56,ISBN 3-927408-82-4
- ↑WADA:The Prohibited List 2007(vom 21. April 2014 imInternet Archive) (PDF; 125 kB)
- ↑Dopingnews:Insulin(vom 7. Juni 2007 imInternet Archive)
- ↑Tom Chivers:Colin Norris, ‘Angel of Death’ nurse, convicted.In:The Telegraph.2. März 2008,abgerufen am 6. September 2016(englisch).
- ↑Vincent Marks, Caroline Richmond:Kenneth Barlow: The first documented case of murder by insulin.In:Journal of the Royal Society of Medicine.Band101,Nr.1,Januar 2008,S.19–21,doi:10.1258/jrsm.2007.071002,PMID 18263909,PMC 2235920(freier Volltext).
- ↑Jacek Zajac, Anil Shrestha, Parini Patel, Leonid Poretsky:Principles of Diabetes Mellitus.Hrsg.: Leonid Poretsky. Springer US, New York 2010,ISBN 978-0-387-09840-1,KapitelThe Main Events in the History of Diabetes Mellitus,S.3–16,doi:10.1007/978-0-387-09841-8_1(friedmanfellows[PDF]).
- ↑Vivienne Baillie Gerritsen:Protein of the 20th century.In:Protein Spotlight.9. April 2001.
- ↑Helmut Zahn, Johannes Meienhofen, Dietrich Brandenburg u. a.:Synthese der Insulinketten und ihre Kombination zu insulinaktiven Präparaten.In:Zeitschrift für Naturforschung B.18, 1963, S. 1120–1121 (online).
- ↑T. L. Blundell, J. F. Cutfield, S. M. Cutfieldet sl.:Atomic positions in rhombohedral 2-zinc insulin crystals.In:Nature.Band231,Nr.5304,Juni 1971,S.506–511,PMID 4932997.
- ↑innomonitor.de.
- ↑Horm.In:Münchener Medizinische Wochenschrift.Band 95, Nr. 1, 2. Januar 1953, S. LXXXII.