Iod
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name,Symbol,Ordnungszahl | Iod, I, 53 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Halogene | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe,Periode,Block | 17,5,p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | gasförmig: dunkel-violett, als Feststoff: grauschwarz, glänzend | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-442-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.585 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an derErdhülle | 0,06 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 126,90447(3)[3]u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius(berechnet) | 140 (115)pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 139 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 198 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d105s25p5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.Ionisierungsenergie | 10.451260(25)eV[4]≈1008.39kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 19.13126(12) eV[4]≈1845.89 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 29.570(25) eV[4]≈2853.1 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 40.357(25) eV[4]≈3893.9 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 51.52(4) eV[4]≈4971 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Ionisierungsenergie | 74.4(4) eV[4]≈7179 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7. Ionisierungsenergie | 87.61(6) eV[4]≈8453 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | orthorhombisch | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 4,94 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch(χm= −4,3 · 10−5)[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 386,85K(113,70 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 457,2 K[7](184 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 25,72 · 10−6m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 41,6 kJ/mol[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 7,76 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | 35Pabei 298 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,449W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | ±1, 3, 5, 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,536V(I2+ 2 e−→ 2 I−) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,66 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope sieheListe der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3bzw. 1 mg·m−3[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werdenSI-Einheitenverwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten beiStandardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Iod(standardsprachlichJod[11]) ist einchemisches Elementmit demElementsymbolI(vor der internationalen Elementsymboleinführung war esJ) und derOrdnungszahl53. ImPeriodensystemsteht es in der 7.Hauptgruppebzw. der 17.IUPAC-Gruppeund gehört somit zu denHalogenen.Der Name leitet sich vom altgriechischen Wort „ioeides “(ιο-ειδής) für „veilchenfarbig, violett “ab. Beim Erhitzen entstehende Dämpfe sind charakteristisch violett.
Ältere Bezeichnungen sind Jodium, Jodina und Jodine.[12]
Iod ist bei Raumtemperatur ein Feststoff, der schlecht wasserlöslich, aber gut löslich in wässrigerKaliumiodid-Lösung (siehe dazu:Lugolsche Lösung) und sehr gut löslich inEthanolund anderen organischenLösungsmittelnist.
In derAlltagsspracheistJoddie gebräuchliche Schreibweise, auch in der älteren chemischen und überwiegend in der aktuellen medizinischen Fachliteratur. Die SchreibweiseIodwird imDudenmit dem Hinweis aufJodaufgeführt und auf die Fachsprachlichkeit hingewiesen.[13]Das ElementsymbolIwird bereits seit 1970 in der IUPAC-Publikation[14]in der chemischen Fachliteratur benutzt, in der älteren deutschsprachigen Literatur findet man durchgängig die ElementbezeichnungJ.[15]
Iod ist ein unentbehrlicher Bestandteil des tierischen und menschlichen Organismus und wird mit der Nahrung aufgenommen. Am höchsten ist die Konzentration beim Menschen in derSchilddrüseund wird dort in den HormonenThyroxinundTriiodthyroninund alsDiiodtyrosingenutzt.Jodmangelim Trinkwasser und der Nahrung ist in der Regel für das Auftreten desKropfsverantwortlich. Als Vorbeugung wird der wöchentlich ein- bis mehrmalige Verzehr von Seefisch sowie die Verwendung von sogenanntemJodsalz(Speisesalz mitNatrium-oderKaliumiodatversetzt) empfohlen. Durch diese individuelleJodprophylaxeund die Iodierung von Futtermitteln wird in Deutschland der Mangel an Iod in den Böden teilweise ausgeglichen. Es konnte vorübergehend erreicht werden, dass in der Gesamtjodversorgung der Bevölkerung die Vorgaben derWHOknapp eingehalten wurden. Stand 2020 weist die Jodversorgung lautBundesinstitut für Risikobewertungeine rückläufige Tendenz auf und ist nicht optimal.[16]
Geschichte
Die pharmakologische Bedeutung iodhaltiger Zubereitungen war schon imAltertumbekannt. So wurden bereits 1500 Jahre vor unserer ZeitrechnungKropfkrankendie iodhaltigenSchilddrüsenvonSchafenoderAschenvon Meeresschwämmen verordnet.
Iod wurde erstmals im Jahr 1811 durch denPariserSalpetersiederund SodafabrikantenBernard Courtoisbei der Herstellung vonSchießpulveraus der Asche vonSeetanggewonnen. Den elementaren Charakter (den zum BeispielHumphry Davyfrüh öffentlich bekanntgab und der dem Jod den Namen gab[17]) erforschten jedoch erst ab 1813 diefranzösischenNaturwissenschaftlerNicolas ClémentundJoseph Louis Gay-Lussac,der ihm ein Jahr später den heutigen Namen verlieh.
Vorkommen
Iod ist abgesehen vonAstatwesentlich seltener als die übrigen Halogene. In der Natur ist es weit verbreitet, jedoch nur in Form seinerVerbindungen,zum Beispiel angereichert (0,02–1 %) imChilesalpeter,hauptsächlich in Form vonNatriumiodat(NaIO3), aber auchNatriumperiodat(NaIO4) undLautarit(Ca(IO3)2). In geringen Spuren ist es inBödenundGesteinennachweisbar. Im Durchschnitt enthält 1000 Gramm wasserfreierFeinbodenaus dem deutschen Raum etwa 2,5MilligrammIod.[18]Der Iodgehalt des Bodens ist wesentlich für die Versorgung der Bevölkerung mit natürlichem Iod. AlsIodwasserstoffkommt es in geringsten Mengen invulkanischenGasen vor.
Lösliche Iodverbindungen wieAlkali-undErdalkaliiodidewerden während derVerwitterungvon Gesteinen durch Regenwasser freigesetzt oder zerfallen bei höheren Temperaturen. So gelangen sie insGrundwasserund schließlich in dieMeere.EinigeMineralwässerenthalten Iod. Die Mineralquelle vonWoodhall SpainLincolnshire (England)bringt Wasser hervor, das durch Iod braun gefärbt ist. ImMeerwasserliegt die Menge an Iod bei 0,05 Milligramm pro Liter. Es kommt dort in Form von Iodid (I−) und Iodat (IO3−) in einer Konzentration von etwa 500 nmol/L vor. Die Verteilung variiert in Oberflächenwasser im Allgemeinen von 0–200 nmol I−/L.[19]
In derErdatmosphäreist Iod in Form von organischen Verbindungen oder anorganisch in Form von Iodoxid (IO), Iodnitrat oder höheren Oxiden zu finden. Für dieStratosphäregibt es wenig Informationen und eine obere Grenze von 0,1 ppt für anorganisches Iod.[20]Über Algenfeldern an Küsten wurden hohe Konzentrationen von mehr als 10 ppt IO nachgewiesen[21]und auch auf dem tropischen Atlantik wurde das Iodoxid-Radikal nachgewiesen.[22]
OrganischeIodverbindungen kann man aus Meeresalgen(19 Gramm Iod pro KilogrammTrockenmasse),TangenundSchwämmen(bis zu 14 Gramm Iod pro Kilogramm Trockenmasse) isolieren. Die globale Menge Iod in Meerwasser wird auf 90 Milliarden Tonnen geschätzt, die derzeit (2022) bekannten globalen Iodreserven betragen 6,2 Millionen Tonnen. Eine Knappheit ist trotz der relativen Seltenheit von Iod deshalb nicht gegeben oder zu erwarten. Das spiegelt sich auch im Preis wider, der 2021 deutlich unter dem Höchststand aus dem Jahr 2013 (bis zu 85 $ pro kg) bei durchschnittlich 36,5 $ pro kg notierte. Die Gewinnung aus Seegras und Algen spielt dabei derzeit eine untergeordnete Rolle, da die Gewinnung als Nebenprodukt aus dem Bergbau bzw. Gas- und Ölförderung kommerziell erfolgreicher ist. Vor 1959 war diese Form der Iodgewinnung jedoch vorherrschend. Die weltweite Iodförderung betrug 2020 über 30.000 Tonnen, ohne Fördermengen aus den USA, die diese als Geschäftsgeheimnis seit 2005 nicht mehr veröffentlichen. Größter globaler Iodproduzent istChilemit seinen Nitratminen, aus denen ca. 2/3 der globalen Iodmengen gewonnen werden. Zweitgrößter Produzent istJapan,wo Iod bei der Öl- und Gasförderung gewonnen wird, und auf Platz 3 der wichtigsten Quellen liegtSoleförderungaus Minen im nordwestlichenOklahoma.[23]
| Land | 2005[24] | 2019[25] | 2020[23] | Reserven[23] |
|---|---|---|---|---|
| (inTonnen) | ||||
| 300 | 190 | 180 | 170.000 | |
| 15.000 | 20.200 | 20.000 | 610.000 | |
| 550 | n. bek. | n. bek. | n. bek. | |
| 75 | 40 | 31 | 100.000 | |
| 7300 | 9100 | 8880 | 4.900.000 | |
| 300 | 2 | 3 | 120.000 | |
| 270 | 600 | 600 | 70.000 | |
| 1570 | n. bek. | n. bek. | 250.000 | |
| Gesamt (gerundet) | 25.400 | 30.100 | 29.900 | 6.200.000 |
Gewinnung und Darstellung
Früher gewann man Iod in Form von Iodiden und Iodaten, indem man die durch die Flut an den Strand angeschwemmtenTangeeinsammelte und verbrannte. Die erhaltene Asche enthielt etwa 0,1–0,5 % Iod. Diese Iodgewinnung hat heute jedoch nur noch lokale Bedeutung und macht ungefähr 2 % der Weltjahresproduktion aus.
Die technische Gewinnung von Iod ist eng mit derSalpetergewinnungverknüpft. Das in denMutterlaugenenthaltene Iodat wird durchReduktionin elementares Iod umgewandelt. Im erstenReaktionsschrittsetzt manSchweflige Säureein, umIodsäure(Iodat ist dasAniondieser Säure) zuIodwasserstoffzu reduzieren:
- Iodsäure und Schweflige Säure reagieren zu Iodwasserstoff undSchwefelsäure
Der Iodwasserstoff wird wiederum in einem zweiten Schritt durch die in derLösungvorhandene Iodsäure zu Iodoxidiert.Man spricht in diesem Fall von einerKomproportionierung,da Iod in zwei verschiedenenOxidationsstufen(−1 im Iodwasserstoff und +5 in der Iodsäure) zu elementarem Iod mit der Oxidationsstufe 0 wird.
- Iodsäure und Iodwasserstoff komproportionieren zuWasserund Iod
Alternativ kann zur Reduktion auchSchwefeldioxid(SO2) den Endlaugen, aus denen der Salpeter bereits auskristallisiertist, zugesetzt werden.
Bei derErdöl- undErdgasförderungfallen bedeutende Mengen anSalzsolean, die einen Iodgehalt von 30 bis über 100ppmaufweisen. Das in Form von Natriumiodid vorliegende Iod wird durch die Oxidation mitChloraus der Sole freigesetzt:
- Natriumiodid und Chlor reagieren zuNatriumchloridund Iod
Eine weitere Reinigung des gewonnenen Iods wird dadurch erreicht, dass es mit Luft ausgeblasen, anschließend mit Schwefeldioxid in schwefelsaurer Lösung wieder reduziert und zum Schluss mit gasförmigem Chlor zum Iod zurück oxidiert wird.
- Iod wird durch Schwefeldioxid zu Iodwasserstoff reduziert
- Iodwasserstoff und Chlor reagieren zuChlorwasserstoffund Iod
Chromatographischkann Iod mittelsAdsorptionvonPolyiodidanAnionenaustauschernangereichert werden. Zur Reinstherstellung setzt man Kaliumiodid und halogenfreiesKupfersulfatein.
Im Labormaßstab lässt sich Iod durch Einwirken von Schwefelsäure undMangan(IV)-oxidoderWasserstoffperoxidaufKaliumiodidherstellen. Die Gewinnung gelingt ebenso aus der iodhaltigen Asche von Meerespflanzen durch Behandlung mit Chlor.
Eigenschaften
Physikalische Eigenschaften
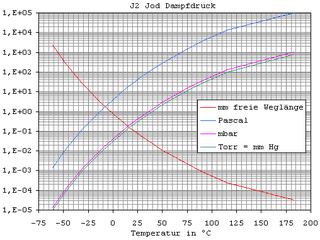
Iod ist unterNormalbedingungenein Feststoff, der grauschwarze, metallisch glänzende Schuppen bildet, deren Dichte 4,94 g·cm−3beträgt. Iod geht beim Schmelzen (Schmelzpunkt113,70 °C) in eine braune,elektrisch leitfähigeFlüssigkeit über. Es siedet bei 184,2 °C unter Bildung eines violetten Dampfes, der aus I2-Molekülen besteht. Iodsublimiertschon bei Zimmertemperatur, so dass ein Schmelzen nur unter rascher und starker Temperaturerhöhung möglich ist.[26]
-
Dampfdruck von Iod
-
Iod als Kristall
-
Iod als Dampf
-
Kristallines Iod
Kristall- und Molekülstruktur
Iod besitzt die Eigenschaften einesHalbleiters.Diese Eigenschaften sind auf das Vorhandensein eines Schichtgitters zurückzuführen, in dem einzelne Ebenen aus I2-Molekülen (Bindungslänge 271,5pm) bestehen. Der Abstand der Ebenen in einem orthorhombischen Schichtkristall beträgt 441,2 pm und entspricht damit dem Van-der-Waals-Abstand zwischen zwei Iod-Atomen (430 pm). Das Ergebnis der Messung des kürzesten Abstands zwischen zwei Iod-Molekülen liegt mit 349,6 pm deutlich darunter.
-
3-D-Modell derElementarzelle
Chemische Eigenschaften
Iod reagiert weitaus weniger heftig mit anderen Elementen wiePhosphor,Aluminium,EisenundQuecksilberalsChlorundBrom.MitWasserstoffreagiert Iod zuIodwasserstoff,welcher beim leichten Erwärmen jedoch schnell wieder in die Elemente zerfällt.
- Iod und Wasserstoff stehen mit Iodwasserstoff im Gleichgewicht. Bei erhöhter Temperatur wird dieses nach links verschoben.
MitAmmoniakfindet aufgrund der damit verbundenen Volumenzunahme eine explosionsartige Reaktion statt.
- DreiMolIod und zwei Mol Ammoniak reagieren zu sechs Mol Iodwasserstoff und einem MolStickstoff.
MitAmmoniaklösungbildet IodTriiodstickstoff(NI3).
Eine interessante Eigenschaft des Iods äußert sich darin, Polyiodidverbindungen einzugehen. Dabei verbinden sich gelöste I2-Moleküle jeweils mit einem Iodid-Anionzum einfach negativ geladenen I3−-Anion. Eine Eigenschaft dieser Polyiodidverbindung ist, dass sie sich in Stärke-Heliceseinlagert. Diese Einlagerungsverbindungen rufen bereits in geringen Konzentrationen eine intensive Blaufärbung hervor (empfindlicher und spezifischerIod-Stärke-Nachweis).
Iod-Kationen
Von Iod sind verschiedeneKationenbekannt. So entsteht das blaue Diiod-Kation I2+,wenn Iod durch inSchwefelsäuregelöstesSchwefeltrioxid(65%igesOleum:H2SO4· 2 SO3)oxidiertwird:
Zur Oxidation kann ebensoAntimon(V)-fluoridbzw.Tantalpentafluoridin flüssigemSchwefeldioxidverwendet werden:
Es gelang jedoch bisher nicht, Verbindungen mit dem unsolvatisierten,das heißt lösungsmittelfreien Monoiod-Kation I+herzustellen. Selbst in Verbindung mit einer extrem schwachenLewis-Basewie demPerchlorat-Anion ClO4−findet man kovalent gebundenes Iod vor. In der Gasphase kann man das I+-Ion bei Abwesenheit eines Gegenions jedoch nachweisen.
Isotope
Von Iod sind bisher 36Isotopeund 10Kernisomerebekannt. Von diesen ist nur ein Isotop stabil, so dass natürlich vorkommendes Iod zu 100 % aus dem einzigen stabilenIsotop127I besteht. Iod ist daher einReinelement(anisotop). Von den instabilen Isotopen besitzt derBetastrahler129I mit 15.700.000 Jahren eine sehr lange Halbwertszeit. Daneben gibt es vier Isotope mit mehr als einem Tag Halbwertszeit:124I (4,2 Tage),125I (59 Tage),126I (13 Tage) und131I (8,0 Tage). Instabile Iodisotope entstehen z. B. bei derKernspaltungund stellen bei ihrer Freisetzung in die Luft eine Gesundheitsgefahr dar, weil sie sich in der Schilddrüse anreichern können. Iod-135 ist bei derXenonvergiftungrelevant, da es Mutternuklid desNeutronengiftesXenon-135 ist. Daher stammt auch der in englischen Publikationen zu findende NameIodine Pit– Jodgrube – für das Phänomen.
Verwendung
Lebensmittel
| Tiergruppe | Iodmenge [mg/kg] |
|---|---|
| Unpaarhufer(Pferde, Esel, Maultiere) |
4 |
| Milchkühe | 5 |
| Legehennen | 5 |
| Schweine | 10 |
| Mastgeflügel | 10 |
| Fische | 20 |
DerMineralstoffIod (meist in der Form als Iodid) gilt in der Ernährung der Menschen und vieler Tiere alsNährstoffund hierbei alsessentiellesSpurenelement.InsbesondereJodsalzwird als iodiertes Lebensmittel (angereichert mit Iodaten) zur Vorbeugung gegen Jodmangel eingesetzt. InVerordnung (EG) Nr. 1925/2006 (Anreicherungsverordnung)wurde der Iodgehalt in Lebensmitteln festgesetzt, um ihn gesundheitsbezogen entsprechendVerordnung (EG) Nr. 1924/2006 (Health Claims)in derEuropäischen Union(deklariert nach Maßgabe der nationalenLebensmittel-Kennzeichnungsverordnungenin Deutschland, Österreich und der Schweiz) bewerben zu dürfen. Dazu wird es oft zugesetzt, meist als Calciumiodid. Auch in Fertig-Tierfutter wird Iod zugesetzt, so in den meisten Katzen- und Hundenahrungen, aber auch Vogelfutter (z. B. für Kanarienvögel) kann iodiert werden. Für die Iodzugabe bei Schlachttieren gelten in der EU auf Empfehlung bzw. auf Befragen derEuropäischen Behörde für Lebensmittelsicherheit(EFSA) Höchstgehalte (siehe nebenstehende Tabelle).
In Deutschland kommen Iodverbindungen in den Böden unverändert in zu geringen Mengen vor. Durch die Jodprophylaxe, die im Wesentlichen aus der Iodierung von Speisesalz („Jodsalz “) und der Iodierung von Futtermitteln in der Landwirtschaft besteht, konnte die Iodversorgung in Deutschland soweit verbessert werden, dass dieIoduriebei Kindern – die als zuverlässigstes Kriterium zur Beurteilung der Iodversorgung gilt – in einer großen Stichprobe zwischen 2003 und 2006 imMedian117 μg/l erreichte. Sie lag damit im unteren Bereich der von derWeltgesundheitsorganisation(WHO) empfohlenen Spanne von 100 bis 200 μg/l.[28]Damit gilt Deutschland nach WHO-Kriterien als ausreichend mit Iod versorgt.[29]Dennoch besteht in Deutschland bei 36 % der Bevölkerung ein milder und bei 21 % ein moderater bis schwererJodmangel.[29]
Medizinische Anwendungen

IodtinkturundIodoformenthalten Iod in elementarer bzw. gebundener Form und dienen alsAntimykotikumundAntiseptikum.Es wird vermutet, dass diedesinfizierendeWirkung auf der Abspaltung vonSauerstoffaus Wasser beruht. Dieser Sauerstoff ist kurz nach seiner Freisetzung(in statu nascendi)besonders reaktionsfähig:
Dieser Mechanismus wird auch für die anderen Halogene diskutiert. Iod wird aus diesem Grund in einzelnen Fällen auch zurDesinfektionvon Wasser in Badeanstalten genutzt. Vorteilhaft ist in diesem Zusammenhang, dass Iod weniger aggressiv ist als Chlor. Allerdings vermag diese Wasserbehandlung nicht Algen abzutöten, so dass zusätzlich einAlgizidzugesetzt werden muss. Der intensive Gebrauch von Iod kann aber zu Hautverfärbungen führen. Auch besteht die Gefahr derAllergisierung.Beides ist durch Einsatz von so genanntenIodophoren,Trägermaterialien, die Iod binden können, vermeidbar.
Iodatewerden in Form vonNatriumiodatoderKaliumiodatin geringen Mengen demSpeisesalzzugesetzt, umJodmangelerkrankungenvorzubeugen. Es wird im Handel umgangssprachlich alsJodsalzangeboten.
DieradioaktivenIod-Isotope131I (8,02 Tage Halbwertszeit) und123I (13,22 Stunden Halbwertszeit) werden als Radiopharmaka in dernuklearmedizinischenDiagnostik und Therapie vorwiegend vonSchilddrüsenerkrankungeneingesetzt (vergleicheRadiojodtherapie), wobei131I heute verstärkt zum Einsatz kommt. Zur Bestimmung desKnochenmineralgehaltswird125I (GammastrahlungvonEγ= 35 keV,59,4 Tage Halbwertszeit) herangezogen.125I ist zudem das am häufigsten imRadioimmunassay(RIA) verwendete Radioisotop.[30]
Iod ist ein häufig eingesetzterKatalysatorbeichemischen Reaktionen.So verwendet man es bei stereospezifischenPolymerisationenvon1,3-Butadien.DieSulfurierungaromatischerVerbindungen sowie dieAlkylierungundKondensationaromatischerAminesind weitere Einsatzfelder.
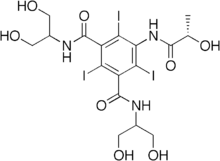
AromatischeIodverbindungen werden alsRöntgenkontrastmittelin derDiagnostikeingesetzt.
Natriumiodid wird alsSzintillatorinSzintillationszählerneingesetzt.
Strahlenschutz
Radioaktive Iod-Isotope sind imFalloutvon Nuklearexplosionen und im Reaktor vonKernkraftwerken(KKW) enthalten. Für den Fall einesAtomunfallesmit der Freisetzung radioaktiver Iodisotope bevorraten Bund und Länder in der Umgebung der deutschen Kernkraftwerke insgesamt 137 MillionenKaliumiodid-Tabletten mit hohem Gehalt des stabilen Iodisotops127I (meist als „Jod-Tabletten “bezeichnet), die im Kontaminierungsfall durch eineIodblockadedie Aufnahme der radioaktiven Iodisotope in der Schilddrüse verhindern sollen. Der Vorrat wurde zuletzt 2004 erneuert.[31]In der Schweiz werden an alle Personen, die im Umkreis von 50 Kilometer um ein Kernkraftwerk wohnen (rund 4,6 Millionen), sowie an die dort ansässigen Betriebe Kaliumiodid-Tabletten abgegeben.[32]
Iod-Radionuklide liegen als Ergebnis der Kernspaltung in hoher Konzentration im Gap, dem Spalt zwischen den Brennstofftabletten und demHüllrohrder KKW-Brennstäbe, vor. Sollte derSicherheitsbehälterdes KKW im Falle einesKernschadensoder gar einerKernschmelzenach Unfalleintritt ein Leck aufweisen, so sorgt es aus Sicht des Strahlenschutzes für großen Schaden, da es als sehrflüchtigesNuklid praktisch als erstes, neben den radioaktiven Isotopen85Kr und135Xe der EdelgaseKryptonundXenon,in größerer Konzentration freigesetzt wird und in den biologischen Kreislauf gelangt.
Biologische Bedeutung

Nach Aufnahme von größeren, im Milligrammbereich liegenden Dosen von Iodverbindungen treten Reizwirkungen an Haut und Schleimhäuten auf. Dies kann zum „Jodismus “führen, einhergehend mit den Symptomen Schnupfen („Jodschnupfen “),Konjunktivitis,BronchitisundExanthemen.Die Wirkung auf die Bronchialschleimhaut hat dazu geführt, dass Iodsalze früher alsExpektoransbenutzt wurden. Andererseits kann hochdosiertes Iodid beiHyperthyreosezur Suppression genutzt werden, da es die Freisetzung und die Synthese von Schilddrüsenhormonen hemmt.
Schilddrüsenhormone
Iod spielt im Organismus hauptsächlich eine Rolle für die Produktion der SchilddrüsenhormoneThyroxin(T4) undTriiodthyronin(T3), die vier bzw. drei Iodatome enthalten. Der Iodvorrat im menschlichen Körper wird auf 10 bis 30 Milligramm beziffert.Jodmangelführt zunächst nur zu einereuthyreotenKropfbildung.Erst ein ausgeprägter Jodmangel hat auch eine Unterfunktion derSchilddrüse(Hypothyreose) zur Folge, die sich durch eine Minderproduktion von T4 und T3 auszeichnet. Da die Schilddrüsenhormone wesentliche Funktionen in der Regulation vonStoffwechselprozessenin beinahe jeder Zelle des Körpers übernehmen, resultieren aus einerSchilddrüsenunterfunktionschwerwiegende Stoffwechsel- und Entwicklungsstörungen.
Zur Rolle der Iodversorgung bei Schilddrüsenkrankheiten sieheJodprophylaxe,Iodunverträglichkeit,HyperthyreoseundHashimoto-Thyreoiditis.
Sicherheitshinweise
Iod ist von der EU alsGefahrstoffklassifiziert, dessen Freisetzung in die Umwelt zu vermeiden ist. Beim Umgang mit dem Element sind entsprechende Schutzmaßnahmen einzuhalten. Reste von Iod sind mitNatriumthiosulfat-Lösung zu behandeln (→ Reduktion zu Iodid). Vor der Entsorgung ins Abwasser muss der pH-Wert des Reaktionsgemisches mitNatriumhydrogencarbonatneutralisiertwerden. Iod darf niemals mit Ammoniak in Verbindung gebracht werden, da sich sonst explosiverIodstickstoffbilden kann.
Analytik
Klassische qualitative Analytik von Iod
Die Iod-Stärke-Reaktion ist die bekannteste Methode, um elementares Iod nachzuweisen. Für den Nachweis gibt man etwas wässrige Stärkelösung in die zu untersuchende Probe. Bei Anwesenheit von Iod bildet sich ein farbiger Komplex aus.
Iodid-Ionen lassen sich durch spezifischeFällungsreaktionennachweisen. Sehr bekannt ist die Reaktion mitSilbernitrat,was zu einer Fällung von gelbemSilberiodidführt:
Quecksilber(I)-nitratfällt, wenn es im Überschuss eingesetzt wird, Iodid-Ionen in Form von gelbgrünemQuecksilber(I)-iodid:
Wird dagegenQuecksilber(II)-nitratverwendet, so erhält man einen roten Niederschlag vonQuecksilber(II)-iodid:
Die Redoxreaktion von elementarem Chlor mit Iodid ist die Grundlage einer weiteren qualitativen Nachweisreaktion.Chlorwasservermag Iodid zu elementarem Iod zuoxidieren,während Chlor zum Chlorid reduziert wird. Das gebildete Iod wird als bräunliche Färbung sichtbar. Es kann mit organischen Lösungsmitteln (z. B.ChloroformoderTetrachlorkohlenstoff) extrahiert und zur photometrischen quantitativen Analyse herangezogen werden.
Instrumentelle quantitative Analytik des Iods
Atomabsorptionsspektrometrie (AAS)
Iod ist mit Hilfe der AAS praktisch nicht routinemäßig nachweisbar, da die Resonanzlinie im Vakuum-UV bei 183,0 nm liegt. Lediglich vereinzelte analytische Arbeitsgruppen berichten von indirekten Verfahren, welche jedoch mit großen Unsicherheiten behaftet sind.[33]
Atomemissionsspektrometrie (AES)
Iodid kann mit Hilfe der ICP-AES (ICP, induktiv-gekoppeltes Plasma) nachgewiesen werden. Eine Methode ist die oxidative Ioddampferzeugung. Die aus Iodat reduktiv erzeugten Iodidionen werden im Plasma atomisiert und zur Emission bei 178,3 nm angeregt. Die mit dieser Methode erreichteNachweisgrenzebeträgt 0,4 μg/l.[34]
Massenspektrometrie (MS)
In der Natur kommt nur das Isotop127I vor. Es ist als einziges stabil. Mit Hilfe der ICP-Quadrupol-MS (ICP, induktiv-gekoppeltes Plasma) kann es in aufgeschlossenen Gesteinsproben mit einer Nachweisgrenze von etwa 0,01 ng/ml bestimmt werden.[35]Für die Analytik des Iods in Serum- und Urinproben steht als spezifische und sensitive Methode die Kopplung derIonenchromatographieund derICP-MSzur Verfügung.[36]
Ionenchromatographie (IC)
Eine gute Methode, um Iodide aus einer Probelösung zu separieren, ist die Anionenaustausch-Chromatographie. Dabei wird Iodid auf einer Ionentauschersäule von anderen Ionen getrennt. Die Detektion erfolgt z. B. mit Hilfe elektrochemischer Detektoren, die entweder die Leitfähigkeit desEluatsmessen oder mittels gepulsterAmperometriedie geflossene Strommenge bestimmen. Mit Hilfe der gepulsten Amperometrie konnte eine Nachweisgrenze von 0,5 μg/l Iodid im Meerwasser erzielt werden.[37]Seit kurzer Zeit wird die Ionenchromatographie auch mit der Massenspektrometrie gekoppelt. Die IC-Tandem-MS-Technik erreicht eine Nachweisgrenze von 0,33 μg/l Urin.[38]
Photometrie
Die bekannteste Methode zur photometrischen Erfassung von Iodid ist die kinetische Methode nach Sandell und Kolthoff. Die katalytische Wirkung von Iodid auf die Reduktion von Cer(IV) durch As(III) ist proportional zur Iodidkonzentration und kann über die Geschwindigkeit der Entfärbung der gelben Cer(III)-Lösung bestimmt werden. Dieses Verfahren wurde von Moxon und Dixon weiterentwickelt und auf die Oxidation von Thiocyanat durch Nitrit angewandt. Die kinetische Messung derAbsorbanzwird bei 450 nm durchgeführt. Es wurde eine Nachweisgrenze für den Gesamtiodgehalt in Nahrungsmitteln von 0,01 μg/g erreicht.[39]
Voltammetrie
Für die elektrochemische Bestimmung von Iodid eignet sich hervorragend die kathodische Stripping-Voltammetrie.Dabei geht der eigentlichen voltammetrischen Bestimmung eine oxidative Anreicherungsperiode auf einer Kohlenstoffpaste-Elektrode bei 700 mV voraus. Das angereicherte Iod wird beim Scannen eines Potentialfensters von 700 mV bis −400 mV wieder reduziert. Der Reduktionsstrom ist proportional zur Iodidkonzentration. Es wurde eine Nachweisgrenze von 0,25 μmol/l erzielt.[40]
Verbindungen
→ Kategorie:Iodverbindung
Iod bildet Verbindungen in verschiedenenOxidationsstufenvon −1 bis +7. Die stabilste und häufigste Oxidationsstufe ist dabei −1, die höheren werden nur in Verbindungen mit den elektronegativeren ElementenSauerstoff,Fluor,ChlorundBromgebildet. Dabei sind die ungeraden Oxidationsstufen +1, +3, +5 und +7 stabiler als die geraden.
Iodwasserstoff und Iodide
Anorganische Verbindungen, in denen das Iod in der Oxidationsstufe −1 und damit alsAnionvorliegt, werdenIodidegenannt. Diese leiten sich von der gasförmigen WasserstoffverbindungIodwasserstoff(HI) ab. Eine wässrige Lösung davon bezeichnet man alsIodwasserstoffsäure.In wässriger Lösung gibt sie sehr leicht dasProton(pKs–10) ab und wirkt daher stärker sauer alsBromwasserstoff(pKs–8,9) oderChlorwasserstoff(pKs–6,2) in Wasser.
Besonders bekannt sind die Iodide derAlkalimetalle,vor allemNatriumiodidundKaliumiodid. Iodide sind in der Regel gut wasserlöslich, Ausnahmen sind viele Schwermetalliodide wie z. B.Silberiodid,Quecksilber(I)-iodid,Quecksilber(II)-iodidundBlei(II)-iodid.
Iodide wirken als starke Reduktionsmittel. Lufteinwirkung bewirkt eine allmähliche Braunverfärbung bei Iodiden, Kupfer(II)-Salzlösungen verursachen das Ausfällen vonCu(I)-Iodidund Freisetzen von Iod.Silberiodidist nur bei Lichtausschluss stabil, bei Belichtung oxidiert Ag(I) das Iodid zu Iod und Silberkristallkeimen (Schwarzfärbung bei Photonegativen).
Iodoxide
Es ist eine größere Anzahl Verbindungen von Iod undSauerstoffbekannt. Diese sind nach den allgemeinen Formeln IOx(x = 1–4) und I2Ox(x = 1–7) aufgebaut. Von den Iodoxiden wurden die Verbindungen IO, IO2,[41]I2O4,I4O9,I2O5und I2O6nachgewiesen, wovonDiiodpentoxid(I2O5) die stabilste Verbindung ist.[42]
Iodsauerstoffsäuren
Neben den Iodoxiden bilden Iod und Sauerstoff auch mehrereSauerstoffsäuren,bei denen ein Iodatom von einem bis vier Sauerstoffatomen umgeben ist, sowie die dazugehörigen Salze:Hypoiodige Säure(HIO) undHypoiodite,Iodige Säure(HIO2) und die entsprechendenIodite,Iodsäure(HIO3) undIodatesowie diePeriodsäure(H5IO6) und die dazugehörigenPeriodate.
Interhalogenverbindungen
Iod geht mit den anderen Halogenen eine Reihe vonInterhalogenverbindungenein. Diese sindIodfluorid(IF),Iodtrifluorid(IF3),Iodpentafluorid(IF5),Iodheptafluorid(IF7),Iodchlorid(ICl),Ioddichlorid((ICl2)2),Iodtrichlorid(ICl3) undIodbromid(IBr). Iod ist in diesen Verbindungen stets das elektropositivere Element.
Organische Iodverbindungen
Eine Vielzahl von organischen Iodverbindungen (auchOrganoiodverbindungen) wird synthetisch hergestellt, z. B.IodalkaneundIodaromaten.Eingesetzt werden sie unter anderem in der Medizin alsKontrastmittel. Auch in der Natur werden Iodverbindungen durch bspw. Makroalgen produziert. Unter Sonneneinstrahlung ist außerdem die Produktion von CH3I und anderen Verbindungen an der Meeresoberfläche möglich.[43]
Siehe auch
Literatur
- A. F. Holleman,E. Wiberg,N. Wiberg:Lehrbuch der Anorganischen Chemie.102. Auflage. Walter de Gruyter, Berlin 2007,ISBN 978-3-11-017770-1,S. 440–442.
- B. J. Füger, R. Dudczak, C. H. Pirich, G. Zettinig:Jodstoffwechsel.In:Journal für Ernährungsmedizin.4 (2), 2002, S. 7–9 (Ausgabe für Österreich),(PDF; 185 kB).
Weblinks
- Jodversorgung in Deutschland wieder rückläufig – Tipps für eine gute Jodversorgung– Fragen und Antworten desBundesinstituts für Risikobewertung (BfR)
Einzelnachweise
- ↑Harry H. Binder:Lexikon der chemischen Elemente.S. Hirzel Verlag, Stuttgart 1999,ISBN 3-7776-0736-3.
- ↑Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, auswebelements (Iod)entnommen.
- ↑CIAAW, Standard Atomic Weights Revised 2013.
- ↑abcdefgEintrag zuiodinein Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019):NIST Atomic Spectra Database (ver. 5.7.1).Hrsg.:NIST,Gaithersburg, MD.doi:10.18434/T4W30F(physics.nist.gov/asd).Abgerufen am 11. Juni 2020.
- ↑abcdefgEintrag zuiodinebeiWebElements,webelements,abgerufen am 11. Juni 2020.
- ↑Robert C. Weast (Hrsg.):CRC Handbook of Chemistry and Physics.CRC (Chemical Rubber Publishing Company), Boca Raton 1990,ISBN 0-8493-0470-9,S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑abYiming Zhang, Julian R. G. Evans, Shoufeng Yang:Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks.In:Journal of Chemical & Engineering Data.56, 2011, S. 328–337,doi:10.1021/je1011086.
- ↑abcdefEintrag zuIodin derGESTIS-StoffdatenbankdesIFA,abgerufen am 24. Mai 2024.(JavaScript erforderlich)
- ↑Eintrag zuIodineimClassification and Labelling InventoryderEuropäischen Chemikalienagentur(ECHA), abgerufen am 1. August 2016. Hersteller bzw.Inverkehrbringerkönnen die harmonisierte Einstufung und Kennzeichnungerweitern.
- ↑Schweizerische Unfallversicherungsanstalt(Suva):Grenzwerte – Aktuelle MAK- und BAT-Werte(Suche nach7553-56-2bzw.Iod), abgerufen am 2. November 2015.
- ↑Theodor C. H. Cole:Wörterbuch der Chemie / Dictionary of Chemistry.Springer-Verlag, 2018,ISBN 978-3-662-56331-1,S. 314.
- ↑Eduard Reich:Lehrbuch der Chemie für Studenten und praktische Ärzte.Band 1, 1858.
- ↑Duden, Die deutsche Rechtschreibung.24. Auflage. 2006.
- ↑iupac.org
- ↑Wolfgang Liebscher:Nomenklatur der Anorganischen Chemie.John Wiley & Sons, 2009,ISBN 978-3-527-62545-1,S. XXV (eingeschränkte Vorschauin der Google-Buchsuche)
- ↑Jodversorgung in Deutschland wieder rückläufig – Tipps für eine gute Jodversorgung - BfR.In:bfr.bund.de.Bundesinstitut für Risikobewertung,20. Februar 2020,abgerufen am 7. Juni 2020.
- ↑L. Pearce-Williams:André-Marie Ampère.In:Charles Coulston Gillispie(Hrsg.):Dictionary of Scientific Biography.Band1:Pierre Abailard – L. S. Berg.Charles Scribner’s Sons, New York 1970,S.139–147(Auch Ampère vermutete ein neues Element ähnlich Chlor).
- ↑Europäischer FOREGS-Atlas, 2005 (Forum of the European Geological Surveys Directors,Text/PDF,Karte;PDF; 446 kB).
- ↑V. Truesdale, A. Bale, E. Woodward:The meridional distribution of dissolved iodine in near-surface waters of the atlantic ocean.In:Progress in Oceanography.45 (3), 2000, S. 387–400,doi:10.1016/S0079-6611(00)00009-4.
- ↑A. Butz u. a.:Constraints on inorganic gaseous iodine in the tropical upper troposphere and stratosphere inferred from balloon-borne solar occultation observations.In:Atmospheric Chemistry and Physics.9 (18), 2009, S. 7229–7242,(PDF).
- ↑K. Seitz u. a.:The spatial distribution of the reactive iodine species IO from simultaneous active and passive DOAS observations.In:Atmospheric Chemistry and Physics.10 (5), 2010, S. 2117–2128,(PDF).
- ↑Katie A. Read u. a.:Extensive halogen-mediated ozone destruction over the tropical Atlantic Ocean.In:Nature.453 (7199), 2008, S. 1232–1235,doi:10.1038/nature07035.
- ↑abcU.S. Geological Survey, Mineral Commodity Summaries 2022: IODINE.
- ↑U.S. Geological Survey, Mineral Commodity Summaries 2007: IODINE.
- ↑U.S. Geological Survey, Mineral Commodity Summaries 2021: IODINE.
- ↑A. F. Holleman,E. Wiberg,N. Wiberg:Lehrbuch der Anorganischen Chemie.102. Auflage. Walter de Gruyter, Berlin 2007,ISBN 978-3-11-017770-1,S. 440–442.
- ↑Deutscher Verband Tiernahrung:Wird Futter Jod zugegeben und wenn ja wieso?Gesehen 12. Mai 2015.
- ↑M. Thamm, U. Ellert, W. Thierfelder, K.-P. Liesenkötter, H. Völzke:Jodversorgung in Deutschland. Ergebnisse des Jodmonitorings im Kinder- und Jugendgesundheitssurvey (KiGGS).In:Bundesgesundheitsbl – Gesundheitsforsch – Gesundheitsschutz.Band50,2007,S.744–749,doi:10.1007/s00103-007-0236-4,PMID 17514459(rki.de[PDF; abgerufen am 27. Oktober 2011]).
- ↑abHans-Christian Pape, Armin Kurtz, Stefan Silbernagl:Physiologie.7. Auflage. Georg Thieme Verlag, Stuttgart 2014,ISBN 978-3-13-796007-2,S.620.
- ↑Rowa Yousef Alhabbab:Radioimmunoassay (RIA).In:Basic Serological Testing(=Techniques in Life Science and Biomedicine for the Non-Expert). Springer International Publishing, Cham 2018,ISBN 978-3-319-77694-1,S.77–81,doi:10.1007/978-3-319-77694-1_11.
- ↑Vorrat an Jodtabletten wird ausgetauscht – BMUB-Pressemitteilung.In:bmub.bund.de.19. Mai 2004,abgerufen am 5. November 2017.
- ↑Die Abgabe von Jodtabletten zur Vorsorge bei einem Kernkraftwerkunfall wird ausgeweitet.In:admin.ch.22. Januar 2014,abgerufen am 5. November 2017.
- ↑B. Welz, M. Sperling:Atomabsorptionsspektrometrie.4. Auflage. Wiley-VCH, Weinheim 1997,ISBN 3-527-60320-4.
- ↑E. Vtorushina, A. Saprykin, G. Knapp:Optimization of the Conditions of Oxidation Vapor Generation for Determining Chlorine, Bromine and Iodine in Aqueous Solutions by Inductively Coupled Plasma Atomic-Emission Spectrometry.In:Journal of Analytical Chemistry.63 (7), 2008, S. 643–648,doi:10.1134/S1061934808070071.
- ↑J. Chai, Y. Muramatsu:Determination of Bromine and Iodine in Twenty-three reference Geochemical Reference Materials by ICP-MS.In:Geostandards and Geoanalytical Research.31 (2), 2007, S. 143–150,doi:10.1111/j.1751-908X.2007.00856.x.
- ↑B. Michalke, H. Witte:Characterization of a rapid and reliable method for iodide biomonitoring in serum and urine based on ion chromatography-ICP-mass spectrometry.In:J Trace Elem Med Biol.29, Jan 2015, S. 63–68,PMID 24933092.
- ↑L. Liang, Y. Cai, Sh. Mou, J. Cheng:Comparisons of disposable and conventional silver working electrode for the determination of iodide using high-performance anion-exchange chromatography with pulsed amperometric detection.In:Journal of Chromatography A.1085, 2005, S. 37–41,doi:10.1016/j.chroma.2004.12.060,PMID 16106845.
- ↑L. Valentin-Blasini, B. Blount, A. Delinsky:Quantification of iodide and sodium-iodide symporter inhibitors in human urine using ion chromatography tandem mass spektrometry.In:Journal of Chromatography A.1155, 2007, S. 40–46,doi:10.1016/j.chroma.2007.04.014,PMID 17466997.
- ↑R. Moxon, E. Dixon:Semi-automatic Method for the Determination of Total Iodine in Food.In:Analyst.105, 1980, S. 344–352,doi:10.1039/AN9800500344,PMID 7406209.
- ↑I. Svancara, J. Konvalina, K. Schachl, K. Kalcher, K. Vytras:Stripping Voltammetric Determination of Iodide with Synergistic Accumulation at a Carbon Paste Electrode.In:Electroanalysis.10 (6), 1998, S. 435–441,doi:10.1002/(SICI)1521-4109(199805)10:6<435::AID-ELAN435>3.0.CO;2-J.
- ↑B. J. Allan, J. M. C. Plane, G. McFiggans:Observations of OIO in the remote marine boundary layer.In:Geophysical Research Letters.28 (10), 2001, S. 1945–1948,doi:10.1029/2000GL012468.
- ↑A. F. Holleman,E. Wiberg,N. Wiberg:Lehrbuch der Anorganischen Chemie.102. Auflage. Walter de Gruyter, Berlin 2007,ISBN 978-3-11-017770-1,S. 488–489.
- ↑Manuela Martino u. a.:A new source of volatile organoiodine compounds in surface seawater.In:Geophysical Research Letters.36 (1), 2009,doi:10.1029/2008GL036334.