Borneole
DieBorneolesind eine in der Natur vorkommende Gruppechemischer Verbindungen.DieisomerenVertreter sind feste, farblose Substanzen, die strukturell einwertige, sekundäreAlkoholeaus derStoffklasseder bicyclischenMonoterpenesind.
Vorkommen
[Bearbeiten|Quelltext bearbeiten]Alssekundäre Pflanzenstoffesind die Borneole Bestandteile vielerätherischer Öle,wieSalbei(Salvia officinalis),Plectranthus barbatus,Rosmarin(Rosmarinus officinalis),Baldrian(Valeriana officinalis),Koriander(Coriandrum sativum),Waldkiefern(Pinus sylvestris),Thai-Ingwer(Alpinia galanga),Behaarter Zweizahn(Bidens pilosa),Ingwer(Zingiber officinale),Oregano(Origanum vulgare),Winter-Bohnenkraut(Satureja montana),Mutterkraut(Tanacetum parthenium) undEukalyptus(Eucalyptus grandis).[1](+)-Borneol/(D)-Borneol (Borneo Camper) findet man hauptsächlich im ätherischen Öl von Drybalanops camphora, einem auf Sumatra und Borneo heimischen Baum, sowieMuskatnuss(Myristica fragrans),[2]Amomum(Amomum compactum,Amomum xanthioides),[3]Boswellia sacra,[3]Zitwerwurzel(Curcuma zedoaria),[3]Ingwer (Zingiber officinale),[3]Rosmarin,LavendelundOlibanumöl. Hingegen findet man (–)-Borneol/(L)-Borneol (Ngai Camper) inPinaceae,[4]Citronellöl,[4]Hanf(Cannabis sativa),Korianderöl(Coriandrum sativum),Mutterkraut(Chrysanthemum parthenium,Tanacetum parthenium),Zitronengras(Cymbopogon nardus),Schwarz-Fichte(Picea mariana), Baldrianöl (Valeriana officinalis), Citronellöl,Thujaöl(Thuja occidentalis) und anderen ätherischen Ölen.[5][6][7]
-
Ingwer
-
Salbei
-
Rosmarin
-
Muskatnuss
-
Lavendel
Isoborneole findet man unter anderem in Baldrian (Valeriana officinalis), Salbei (Salvia officinalis),Thymian(Thymus cilicicus), Oregano/Dost(Origanum vulgare,Origanum minutiflorum),Gemeiner Schafgarbe(Achillea millefolium),Bohnenkräuter(Satureja cilicica,Satureja odora),Bergminzen(Micromeria croatica),Kurkuma(Curcuma longa) und Rosmarin (Rosmarinus officinalis).[8]
-
Bergminze
-
Kurkuma
-
Gemeine Schafgarbe
-
Thymian
Vertreter
[Bearbeiten|Quelltext bearbeiten]Die Molekülstruktur der Borneole enthältchiraleKohlenstoffatome und kommt daher in zweidiastereomerenFormen vor, die üblicherweise Borneol und Isoborneol genannt werden. Da jede dieser beiden Formen ein (enantiomeres) Spiegelbild hat, existieren insgesamt vierStereoisomere,von denen jeweils zweienantiomerzueinander sind und dieRacemate(±)-Borneol und (±)-Isoborneol bilden:
| Name | (+)-Borneol | (−)-Borneol | (+)-Isoborneol | (−)-Isoborneol | |||
| IUPAC-Name | (1R,2S,4R)-1,7,7-Trimethyl- bicyclo[2.2.1]heptan-2-ol |
(1S,2R,4S)-1,7,7-Trimethyl- bicyclo[2.2.1]heptan-2-ol |
(1S,2S,4S)-1,7,7-Trimethyl- bicyclo[2.2.1]heptan-2-ol |
(1R,2R,4R)-1,7,7-Trimethyl- bicyclo[2.2.1]heptan-2-ol | |||
| andere Namen | endo-Borneol (±)-Borneol |
exo-Isoborneol (±)-Isoborneol | |||||
| 2-Borneol 2-Bornylalkohol | |||||||
| Strukturformel | 
|

|

|
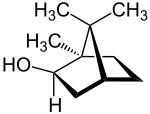
| |||
| CAS-Nummer | 464-43-7 | 464-45-9 | 16725-71-6 | 10334-13-1 | |||
| 507-70-0(Racemat) | 124-76-5(Racemat) | ||||||
| PubChem | 6552009 | 1201518 | 6321405 | ? | |||
| ?(Racemat) | 24900674(Racemat) | ||||||
| FL-Nummer | 02.016 (Racemat) | 02.059 (Racemat) | |||||
| Summenformel | C10H18O | ||||||
| Molare Masse | 154,25 g·mol−1 | ||||||
| Aggregatzustand | fest | ||||||
| Kurzbeschreibung | farbloser, geruchloser Feststoff[9] | kristalliner, weißer Feststoff[10] | kristalliner, weißer Feststoff[11]mit angenehmem[11]Geruch nach Vanille und Holz[12] | ||||
| Schmelzpunkt[13] | 208–209°C | 208–209 °C | 212–214 °C | 212–214 °C | |||
| 212 °CRacemat | 210–215 °C Racemat | ||||||
| Optischer Drehwert[α]D | + 37,7°[14] | − 37,7°[14] | + 34,1°[15] | − 33,6°[15] | |||
| Löslichkeit | unlöslich in Wasser[9] | unlöslich in Wasser[10] | unlöslich in Wasser[11] | ||||
| GHS- Kennzeichnung |
|
|
| ||||
| H-Sätze | 228 | 228 | 315‐319‐335 | ||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | |||||
| P-Sätze | 210‐280[9] | 210‐240‐241‐280‐370+378[10] | 261‐302+352‐305+351+338‐321[11] | ||||
| Toxikologische Daten | 5800 mg·kg−1(LD50,Ratte,oral)[10] |
1750 mg·kg−1(LD50,Maus,oral)[11] | |||||
Herstellung
[Bearbeiten|Quelltext bearbeiten]Borneol kann durchMeerwein-Ponndorf-Verley-ReduktionvonCamphererhalten werden.[16]Bei der Reduktion von Campher mitNatriumborhydridoderLithiumaluminiumhydridhingegen entsteht vorwiegend dasStereoisomerIsoborneol:[17]
- Diastereoselektivität der Reduktion von (1R,4R)-(+)-Campher zu (1R,2R,4R)-Isoborneol (ca. 95 %) und (1R,2S,4R)-Borneol (ca. 5 %).
Chemische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Borneol kann mitChromsäureoderSalpetersäurezu Campher oxidiert werden. Dehydratation mit verdünnten Säuren führt zuCamphen.
MitAcetanhydridkann es zumBornylacetatverestertwerden.
Die bakterielle Biosynthese von2-Methylisoborneolhaben Forscher derTU Braunschweigmit demHelmholtz-Zentrum für Infektionsforschungin Braunschweig und der Uni Saarbrücken erforscht.[18]
Verwendung
[Bearbeiten|Quelltext bearbeiten]
Als Bestandteil von ätherischen Ölen ist Borneol mitverantwortlich für Geruch und Geschmack diverser Gewürze. Dergestalt wird es auch inKosmetikaeingesetzt. In der Inhaltsstoffliste wird es alsBORNEOL(INCI)[19]aufgeführt.
Derivatedes Borneols, wie(2S)-(−)-exo-(Dimethylamino)isoborneol(DAIB) werden in dermodernen asymmetrischen Synthesegenutzt.[20]
Struktur
[Bearbeiten|Quelltext bearbeiten]-
Stäbchenmodellvon (S)-Borneol
-
Stäbchenmodell von (S)-Isoborneol
Literatur
[Bearbeiten|Quelltext bearbeiten]- H. Surburg, J. Panten:Common Fragrance and Flavor Materials: preparation, properties, and uses.Wiley-VCH, Weinheim 2006,ISBN 3-527-31315-X.
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑ BORNEOL(engl.) In:Dr. Duke's Phytochemical and Ethnobotanical Database,Hrsg.U.S. Department of Agriculture,abgerufen am 24. Juli 2021.
- ↑ (+)-BORNEOL(engl.) In:Dr. Duke's Phytochemical and Ethnobotanical Database,Hrsg.U.S. Department of Agriculture,abgerufen am 24. Juli 2021.
- ↑abcd D-BORNEOL(engl.) In:Dr. Duke's Phytochemical and Ethnobotanical Database,Hrsg.U.S. Department of Agriculture,abgerufen am 24. Juli 2021.
- ↑ab Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg:Flavors and Fragrances.In:Ullmann’s Encyclopedia of Industrial Chemistry.Band15,2012,S.73–198,doi:10.1002/14356007.a11_141.
- ↑Albert Gossauer:Struktur und Reaktivität der Biomoleküle,Verlag Helvetica Chimica Acta, Zürich, 2006,ISBN 3-906390-29-2,S. 206.
- ↑ (−)-BORNEOL(engl.) In:Dr. Duke's Phytochemical and Ethnobotanical Database,Hrsg.U.S. Department of Agriculture,abgerufen am 24. Juli 2021.
- ↑ L-BORNEOL(engl.) In:Dr. Duke's Phytochemical and Ethnobotanical Database,Hrsg.U.S. Department of Agriculture,abgerufen am 24. Juli 2021.
- ↑ ISOBORNEOL(engl.) In:Dr. Duke's Phytochemical and Ethnobotanical Database,Hrsg.U.S. Department of Agriculture,abgerufen am 24. Juli 2021.
- ↑abcdDatenblatt(+)-Borneol(PDF) beiCarl Roth,abgerufen am 29. April 2010.
- ↑abcdeDatenblatt(–)-BorneolbeiAlfa Aesar,abgerufen am 29. April 2010(Seite nicht mehr abrufbar).
- ↑abcdefgDatenblatt(±)-IsoborneolbeiAlfa Aesar,abgerufen am 29. April 2010(Seite nicht mehr abrufbar).
- ↑Datenblatt(±)-IsoborneolbeiSigma-Aldrich,abgerufen am 29. April 2011 (PDF).
- ↑Eintrag zuBorneole.In:Römpp Online.Georg Thieme Verlag, abgerufen am 29. April 2011.
- ↑abAlbert Gossauer:Struktur und Reaktivität der Biomoleküle.Verlag Helvetica Chimica Acta, Zürich 2006,ISBN 3-906390-29-2,S. 60.
- ↑abHamada, Hiroki. In:Bull. Chem. Soc. Jpn.,1988, 61, S. 869–878.
- ↑Ashok Pandey:Industrial Biorefineries & White Biotechnology.Elsevier, 2015,ISBN 978-0-444-63464-1,S. 132 (eingeschränkte Vorschauin der Google-Buchsuche).
- ↑Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers:Organic Chemistry.Oxford University Press, 2001,ISBN 0-19-850346-6,S. 862.
- ↑Biosynthesis of the Off-flavor 2-Methylisoborneol by the Myxobacterium Nannocystis exedensin:Angew. Chem.2007,119,8436–8439.
- ↑Eintrag zuBORNEOLin derCosIng-Datenbankder EU-Kommission, abgerufen am 1. Oktober 2021.
- ↑James D. White, Duncan J. Wardrop, and Kurt F. Sundermann:(2S)-(−)-exo-(dimethylamino)isoborneol [(2S)-(−)-DAIB]In:Organic Syntheses.79, 2002, S. 130,doi:10.15227/orgsyn.079.0130(PDF).












