Calciumcarbonat
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
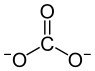
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Calciumcarbonat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | CaCO3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer, kristalliner und geruchloser Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 100,09 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (14 mg·l−1bei 20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 3 mg·m−3(gemessen alsalveolengängiger Staub)[4] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werdenSI-Einheitenverwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten beiStandardbedingungen(0 °C, 1000 hPa). | ||||||||||||||||||||||
Calciumcarbonat(fachsprachlich),Kalziumkarbonatoder in deutscher Trivialbezeichnungkohlensaurer Kalk,ist einechemische Verbindungder ElementeCalcium,KohlenstoffundSauerstoffmit derchemischen FormelCaCO3.Als ein Calcium-SalzderKohlensäuregehört es zur Stoffgruppe derCarbonate.Es ist ein farbloser, kristalliner Feststoff, dessenKristallstrukturaus denIonenCa2+und CO32−im Verhältnis 1:1 besteht.
In der Natur kommt Calciumcarbonat hauptsächlich alsKalkstein,KreideundMarmorvor. Auch in Organismen wie denSchalenweichtierenfindet sich Calciumcarbonat.
Vorkommen
[Bearbeiten|Quelltext bearbeiten]


Calciumcarbonat ist eine der am weitesten verbreiteten Verbindungen auf der Erde, vor allem in Form vonSedimentgesteinen.Es tritt vor allem in der Form desMineralsCalcit(Kalkspat, Doppelspat) auf, das mit einem Anteil von rund fünf Prozent zu den häufigsten Mineralen derErdkrustegehört. Es ist nicht nur in den massiven Kalkgesteinen das vorherrschende Mineral, in Verbindung mitQuarz,BarytundFluoritbildet es auch das Muttergestein sehr vielerErzgänge.Es kann sogar der einzige Bestandteil von Gängen sein, deren Mächtigkeit von einigen Zentimetern bis zu einigenDekameterreicht. Weitere Modifikationen von Calciumcarbonat sind die MineraleAragonitundVaterit.Der Name Aragonit leitet sich vom bedeutendsten Vorkommen des Minerals inAragonienab. Es kommt vermehrt im Umfeld von marinen Gewässern vor. Die Ursache hierfür ist das im Meerwasser enthalteneMagnesium,das die Bildung von Aragonit gegenüber Calcit begünstigt. Aragonit ist neben Calcit das häufigsteBiomineral.Es ist der anorganische Bestandteil inPerlmuttin Muscheln, ist auch häufig in Perlen enthalten und kommt außerdem in Schalen von marinen Einzellern undKorallenvor. Im Vergleich zu Calcit und Aragonit kommt Vaterit in der Natur nur selten vor. Es ist nach dem deutschen Chemiker und MineralogenHeinrich Vaterbenannt. In den Gehäusen mancher Schnecken kommen alle dreiAnhydratmodifikationender Verbindung nebeneinander vor.[7][8]
Daneben existieren mitMonohydrocalcitundIkaitzwei weitere pseudopolymorphe Minerale, dieHydratevon Calciumcarbonat darstellen. Das instabile Monohydrocalcit ist das Monohydrat des Calciumcarbonats. Das erste natürliche Vorkommen von Monohydrocalcit wurde 1959 und 1964 als ein unreines Sediment imIssyk-Kul-Seein Kirgisien beschrieben. In Lebewesen kommt es inBlasensteinenvon Meerschweinchen und in denGehörsteincheneiniger Wirbeltiere vor. Ikait ist das Hexahydrat von Calciumcarbonat und wurde in der Natur erstmals 1963 in Form von bis zu 20 Meter hohen Säulen amIkkafjordaufGrönlandentdeckt. Der Fundort verlieh dem Mineral auch seinen Namen. Das Mineral ist bei Atmosphärendruck über 0 °C instabil und geht darüber in Calcit über. Seine Bildung wird von Magnesium (das in Meerwasser reichlich enthalten ist) und von anderen Additiven begünstigt.[9]
Calciumcarbonat ist der Hauptbestandteil des sedimentär gebildetenKalksteins,des metamorphenMarmorsund weiterer Sedimentgesteine wie zum BeispielOolithoderStromatolith.In der belebten Natur kommt es im Außenskelett vonKrebstieren,Korallen,Muscheln,SchneckensowieEinzellernvor. In diesen liegt es zum Teil auch in einer der mehreren bekannten amorphen Calciumcarbonatphasen (ACC) vor.[10]
Die ersten Kalkgesteine nennenswerten Ausmaßes entstanden durchStromatolithevor über zwei Milliarden Jahren.
Calciumcarbonat ist imBodenweiträumig vorhanden. Die wichtigsten Calcium-Minerale in unseren Boden sind Calcit und Dolomit [CaMg(CO3)2]. Sie werden im Boden freigesetzt, wennKarbonatgesteineoderMergelverwittern.[7]
Entgegen landläufiger Meinung enthalten dieKnochenundZähnederWirbeltierekein Calciumcarbonat, sondern die ebenfalls calciumhaltigen StoffeHydroxylapatit(in Knochen)[11]und zusätzlichFluorapatitin den Zähnen. Allerdings kommt Calciumcarbonat beispielsweise bei Pflanzen vor. Die Blatthaare desRoten Hartriegelssind mit Calciumcarbonat überzogen, das bei Berührung mit empfindlichen Stellen der menschlichen Haut zu Reizerscheinungen führen kann.[12]
Calciumcarbonat wurde auch auf dem PlanetenMarsnachgewiesen.[13]
Modifikationen in der Natur
[Bearbeiten|Quelltext bearbeiten]In der Natur bildet Calciumcarbonat verschiedene Gesteine, die zwar chemisch identisch sind, sich jedoch in mancherlei Hinsicht unterscheiden. Calcit ist eines der wenigen Minerale, das in reiner Form als Gesteinsbildner in allen drei Hauptgruppen vertreten ist. Denn neben den Sedimenten Kreide und Kalkstein sowie dem Metamorphit Marmor gibt es auch magmatische Calciumcarbonat-Gesteine – dieCarbonatite.
Kreide
[Bearbeiten|Quelltext bearbeiten]
Kreideist ein feines, mikrokristallinesSedimentgestein,das durch Ablagerung von durch photosynthetischen Kohlensäureentzug gefälltem Calcit sowie der aragonitischen Schalen von fossilen Kleinlebewesen, wieCoccolithender Coccolithophoriden und Schalen derForaminiferen,entstanden ist. Kreide tritt an zahlreichen Standorten entlang des europäischen Kreidegürtels zutage, von Großbritannien über Frankreich bis hin zur InselRügenin Norddeutschland, und wird stellenweise abgebaut.Seekreideam Grund von Seen oder in verlandeten Seebecken besteht fast vollständig aus gefälltem Calcit. Die in der Schule verwendeteTafelkreidewird inzwischen allerdings meist nicht mehr aus echter Kreide, sondern vor allem aus Gips (Calciumsulfat) hergestellt.
Kalkstein
[Bearbeiten|Quelltext bearbeiten]Kalksteinwird ebenfalls überwiegend von Lebewesen gebildet und ist stärker verfestigt als Kreide. Die Kalkablagerung geschieht entweder direkt oder indirekt aus den Überresten der Lebewesen, wie zum Beispiel vonSchnecken,Muscheln,gesteinsbildendenSteinkorallenundSchwämmen,die Calciumcarbonat zum Aufbau von Außen- oder Innenskeletten abscheiden. Indirekt wird er dadurch gebildet, dass Lebewesen, vor allemphototrophe,CO2assimilieren und so das Milieu alkalisieren, was zur Ausfällung von Calciumcarbonat führt. Die Größe der Carbonatkristalle liegt zwischen derjenigen von Kreide und Marmor. Große Kalkstein-Vorkommen befinden sich zum Beispiel auf derSchwäbischenundFränkischen Alb,imJura,in denKalkalpenund denWestalpen,imHimalayaund in vielen anderen Gebieten.
Marmor
[Bearbeiten|Quelltext bearbeiten]
Marmorist ein grobkristallines,metamorphesGestein, das entsteht, wenn Kreide, Kalkstein oderDolomitunter dem Einfluss hoher Temperaturen und/oder hoher Drücke (über 1000 bar) umkristallisiert werden. Große Marmor-Vorkommen finden sich in Europa beispielsweise in Südtirol (Laas), Österreich (Gummern), Norwegen (Molde) oder im italienischenCarrara,der Heimat des reinweißenStatuario,aus demMichelangeloseine Skulpturen schuf, sowie auch in Nordamerika.
Darstellung
[Bearbeiten|Quelltext bearbeiten]Synthetisches Calciumcarbonat wird alsPCC(englischprecipitated calcium carbonate„gefälltes Calciumcarbonat “) bezeichnet – im Unterschied zuGCC(engl.ground calcium carbonate„gemahlenes Calciumcarbonat “). PCC kann auf verschiedene Arten hergestellt werden. Bekannte Prozesse sind die Fällung mit Kohlendioxid, dasKalk-Soda-Verfahrenund derSolvay-Prozess,bei dem PCC als Nebenprodukt derAmmoniak-Herstellung anfällt.
Die Fällung mit Kohlendioxid ist der am häufigsten eingesetzte Prozess, insbesondere in den On-site-Anlagen der Papierindustrie. Sauberer Kalkstein beziehungsweise Branntkalk wird zunächst zum Calciumhydroxid (Kalkmilch) gelöscht und anschließend als dünne Suspension dem Reaktionsbehälter zugeführt. Dort leitet man so lange Kohlendioxid ein, bis das Calciumhydroxid vollständig zu Calciumcarbonat umgesetzt ist. Die Reaktionsdauer kann durch den Verlauf despH-Wertesbeurteilt und gesteuert werden.
Die Fällung erfolgt bei einem Feststoffgehalt von etwa 20 %. Über die Prozessführung (Temperatur, Druck, Zeit, Konzentration) können unterschiedliche Kristallformen (Kristallmorphologien) und Kornverteilungen erzeugt („gezüchtet “) werden. Bevorzugt wird dierhomboedrischeoderskalenoedrischeKristallform. Weil mit hochreinen Ausgangsprodukten gearbeitet werden kann, sind die PCCs besonders weiß und haben auch Vorteile bezüglich derOpazität.Inzwischen erzeugen große Papierfabriken PCC in einem „Verbund “, indem sie Kohlenstoffdioxid, das bei der Verbrennung inKraftwerkenin Form von Rauchgasen entsteht, durch Bindung an Calciumhydroxid wieder rückgewinnen. Dies stellt jedoch keinen Beitrag zur Reduzierung der Kohlenstoffdioxid-Konzentration in der Atmosphäre (Klimawandel) dar, weil bei der zuvor notwendigen Herstellung von Kalkhydrat natürlicher Kalkstein gebrannt werden muss, wobei wieder CO2freigesetzt wird.
Eine außergewöhnliche Calciumcarbonat-Lagerstätte gibt es im französischenVilleau,wo ein fossiler Calciumcarbonat-Niederschlag seit über 30 Millionen Jahren nie verfestigt wurde, sondern locker geblieben ist und so in seiner Zusammensetzung und Struktur dem künstlich gefällten PCC gleicht.[7]
Beim Kalk-Soda-Verfahren entsteht Calciumcarbonat als Nebenprodukt bei der Herstellung der ÄtzalkalienNatriumhydroxidundKaliumhydroxid.
Vaterit fällt besonders aus übersättigten Lösungen in Form mikroskopisch kleiner Kristalle aus. Monohydrocalcit kann durch Entwässerung unter ständigem Absaugen des Wassers des Hexahydrates oder durch Additive, wie z. B. Magnesium, direkt in einem Temperaturbereich von 0 bis 40 °C synthetisiert werden. Ikait konnte erstmals 1865 vonPelouzedurch Einleiten von Kohlendioxid in eine wässrigeCalciumoxid/Zucker-Lösung hergestellt werden. Es kann auch durch Zugabe einerNatriumcarbonatlösungin eine eisgekühlteCalciumchloridlösunghergestellt werden. Das Zermahlen von Ikait führt zu einer Abgabe des Kristallwassers, wodurch neben Calcit auch eine beträchtliche Menge an Vaterit entsteht.[9]
Amorphes Calciumcarbonat ist nach derStufenregel von Ostwaldbei der Kristallisation von Calciumcarbonat die erste Phase, die ausfällt. Es enthält eingeschlossenes und interstitielles Wasser, jedoch kann der Gehalt an Wasser variieren und wandelt sich im Weiteren in wässrigen Lösungen zu einer der wasserfreien polymorphen Phasen des Calciumcarbonats um. Verschiedene Arten von Additiven können ACC stabilisieren, jedoch kann stabilisiertes ACC auch ohne die Hilfe von Zusätzen erhalten werden, wenn es bei hoher Übersättigung gefällt wird. ACC, das frei von Zusätzen ist und aus äquilibrierten, leicht übersättigten (metastabilen) wässrigen Calciumcarbonatlösungen mithilfe eines plötzlichen Wechsels in ein schlechtes Lösungsmittel für Calciumcarbonat ausgefällt wurde (z. B. durch „Abschrecken “inEthanol).[10]ACC wurde erstmals von Johnston et al. durch Mischen konzentrierter Lösungen von Calciumchlorid und Natriumcarbonat hergestellt. Später wurde eine Methode gefunden, wodurch beim Einleiten von Kohlendioxid in eine gesättigte Calciumhydroxidlösung zunächst amorphes Calciumcarbonat entsteht, das dann weiter zu Calcit kristallisiert.[9]
Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]
Calciumcarbonat kommt in mehreren wasserfreien und auch zwei Hydrat-Modifikationen sowie weiteren amorphen Formen vor. Alle sind in reiner Form farb- und geruchlose Feststoffe. Calciumcarbonat zerfällt ab ungefähr 600 °C in Calciumoxid und Kohlenstoffdioxid, wobei die genaue Zerfallstemperatur vom vorliegenden CO2-Partialdruck abhängt.
Die bei Normalbedingungen thermodynamisch stabilste und damit weitaus häufigste Calciumcarbonat-Modifikation ist das Calcit. Wie alle nichtkubischen, lichtdurchlässigen Minerale hat es die besondere Eigenschaft der Doppelbrechung, also einen einfallenden Lichtstrahl in zwei polarisierte Lichtstrahlen zu zerlegen, die verschieden stark gebrochen werden. Calcit kristallisiert bei Normalbedingungen in einertrigonalenStruktur in derRaumgruppeR3c(Raumgruppen-Nr. 167).Zudem existieren noch eine Hochtemperaturmodifikation (985 °C bei Normaldruck) mit der RaumgruppeR3m(Nr. 160)und mehrere Hochdruckmodifikationen (Calcit II–Calcit V). Bei Raumtemperatur entsteht Calcit II bei 1,70 GPa, der dann bei 2,15 GPa in Calcit III übergeht. Calcit III ist bei Raumtemperatur bis 6,16 GPa stabil und wandelt sich erst bei einer Temperaturerhöhung auf 345 °C in Aragonit um.[9]
Aragonit kristallisiert in einerorthorhombischenKristallstruktur mit der RaumgruppePmcn(Nr. 62, Stellung 5).Die Calciumionen liegen annähernd auf den Positionen einer hexagonal dichtesten Packung, die durch Stauchung entlang der sechszähligen Achse verzerrt wird. Aragonit ist trocken und bei Raumtemperatur über einen unbestimmten Zeitraum stabil. Dagegen wandelt er sich in Lösung langsam in Calcit um, dessen Morphologie bei der Umwandlung von Aragonit abhängig von den Bedingungen ist. Findet die Transformation in Lösung statt, so erhält man rhomboedrische Kristalle, während die nadelförmige Struktur des Aragonits bestehen bleibt, wenn die Umwandlung durch Erhitzen erfolgt. Die Aragonit-Calcit-Transformation ist irreversibel und findet nicht bei einer bestimmten Temperatur statt. Beim Erhitzen auf 400 °C dauert die Umwandlung zu Calcit ungefähr drei Stunden, während sie bei 470 °C nur wenige Minuten dauert. Der gesamte Umwandlungsbereich liegt zwischen 387 und 488 °C. Geologisch mineralisierter Aragonit tendiert nicht dazu, sich zwischen 10 und 90 °C umzuwandeln, während sich synthetisch hergestellter Aragonit in Lösung nahe 90 °C in Calcit umwandelt.[9]Aragonit ist jedoch die stabilste Phase des Calciumcarbonats oberhalb 70 °C und 1013 hPa und bei extremen Drücken.[8]
Vaterit ist die instabilste wasserfreie kristalline Form des Calciumcarbonats. Er ist im trockenen Zustand über einen langen Zeitraum stabil, wandelt sich dagegen bei Kontakt mit Wasser aufgrund von Auflösung und anschließender Rekristallisation in Calcit um. Daher ist es schwierig, Vaterit aus wässrigen Lösungen zu erhalten. Die Phasenumwandlungstemperatur zu Calcit ist abhängig von den jeweiligen Synthesebedingungen und liegt im Bereich von 320 bis 460 °C. Er kristallisiert in einer hexagonalen Kristallstruktur mit der RaumgruppeP63/mmc(Nr. 194).[9]
Monohydrocalcit, das Monohydrat von Calciumcarbonat, kristallisiert in einer der beiden trigonalen Kristallstrukturen mit der RaumgruppeP3121 (Nr. 152)oderP3221 (Nr. 154).Es ist instabil und kristallisiert innerhalb weniger Stunden, beim Befeuchten mit Wasser sofort, in die wasserfreie Phase Calcit um. Eine Temperaturerniedrigung und eine Erhöhung des hydrostatischen Druckes stabilisieren es. Eine Rückbildung zum Hexahydrat Ikait ist nicht zu beobachten.[9]
Das Ikait als Hexahydrat von Calciumcarbonat kristallisiert in dermonoklinenRaumgruppeC2/c(Nr. 15).Die Struktur enthält diskrete CaCO3-Ionenpaare, die jeweils von einer Hülle aus 18 Wassermolekülen umgeben sind. Es ist bei Atmosphärendruck über 0 °C instabil, bei Drücken von 6 bis 7 kbar jedoch auch bei Raumtemperatur stabil. Es existiert zwar teilweise bei höheren Temperaturen, beginnt jedoch bei über 5 °C eine Umwandlung zu Calcit, die auch bei erneuter Temperaturerniedrigung nicht mehr aufgehalten werden kann. Löslichkeitsbestimmungen zeigen, dass Ikait im Vergleich zu Aragonit und Calcit löslicher ist und seine Löslichkeit im Gegensatz zu den wasserfreien Polymorphen mit sinkender Temperatur abnimmt.[9]
Als amorphes Calciumcarbonat (ACC) werden Modifikationen von Calciumcarbonat bezeichnet, die weder diskrete Röntgen- noch Elektronenbeugungsreflexe liefern. Es enthält bis zu einem Molekül Wasser pro Carbonat-Ion. Es ist instabil, wobei niedrige Fällungstemperaturen bei der Herstellung die amorphe Phase stabilisieren, während ein Temperaturanstieg zu einer schnellen Kristallisation führt. Auch eine stark alkalische Mutterlösung oder die Verwendung geeigneter Additive bei der Fällung, wozu vor allem Magnesium, Phosphate und eine Reihe organischer Substanzen gehören, stabilisieren ACC. Das Kristallisationsprodukt hängt von den Bedingungen ab. So bildet sich im Bereich von 14 bis 30 °C innerhalb von 3 bis 6 Stunden Vaterit und Calcit, während von 60 bis 80 °C in 17 bis 22 Stunden Aragonit und Calcit entstehen. Im dazwischen liegenden Temperaturbereich (40–50 °C) bilden sich alle drei kristallinen wasserfreien Phasen. In Gegenwart organischer Substanzen wie Aminen, Aminosäuren und Carbonsäuren wandelt sich ACC dagegen in Vaterit um. Dabei sindEthylendiaminundNatriumaspartatdie besten Additive für die Vateritbildung.[9]
| Modifikation | Calcit | Aragonit | Vaterit | Monohydro- calcit |
Ikait | ACC |
|---|---|---|---|---|---|---|
| Formel | CaCO3 | CaCO3 | CaCO3 | CaCO3·H2O | CaCO3·6H2O | CaCO3 |
| Kristall- system |
trigonal | ortho- rhombisch |
hexagonal | trigonal | monoklin | - |
| Raumgruppe | R3c(Nr. 167) | Pmcn(Nr. 62, Stellung 5) | P63/mmc(Nr. 194) | P31(Nr. 144) | C2/c(Nr. 15) | - (amorph) |
| Gitter- konstanten Å |
a = 4,991 c = 17,062 γ = 120° |
a = 4,959 b = 7,964 c = 5,738 |
a = 4,130 c = 8,490 γ = 120° |
a = 10,5536 c = 7,5446 γ = 120° |
a = 8,792 b = 8,312 c = 11,021 β = 110,53° |
- |
| Dichte g·cm−3 |
2,71 | 2,93 | 2,65 | 2,43 | 1,83 | |
| Stabilität | stabil | stabil oberhalb 70 °C |
metastabil unterhalb 10 °C |
Wasserabgabe ab 60–80 °C |
stabil unter 0 °C |
bei Wasserentzug instabil |
Chemische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Wie alle Carbonate ist auch Calciumcarbonat empfindlich gegenüber Säuren. Auf dieser einfachen Reaktion beruht die gebräuchlichste Erkennungsmethode für Carbonatgesteine. Tropft man etwasSalzsäureauf einen Kalkstein, wirdKohlenstoffdioxidfrei und lässt die Flüssigkeit aufbrausen.[7]
Diese Säureempfindlichkeit machte sich der Sage nach auch der karthagische FeldherrHannibalzunutze, als er 218 vor Christus mit seinen Elefanten die Alpen überquerte. Um den Tieren das Klettern im Fels zu erleichtern, befahl er seinen Soldaten, große MengenEssigauf das kompakte Kalkgestein zu schütten, worauf das Gestein „chemisch “verwitterte und die Soldaten mühelos Stufen für die Elefanten in den Fels brechen konnten.[7]
Calciumcarbonat selbst ist in reinem Wasser kaum löslich. Die Löslichkeit beträgt gerade einmal 14 Milligramm pro Liter, wobei das Carbonat-Ion alsHydrogencarbonat-Ion in Lösung geht.
Bei Anwesenheit von gelöstem Kohlenstoffdioxid steigt die Löslichkeit jedoch um mehr als das Hundertfache. Auf diesem Effekt beruht die Verwitterung von Kalkgestein, wobei sich das leicht löslicheCalciumhydrogencarbonatbildet.[7]
Wegen seiner Löslichkeit ist Calciumhydrogencarbonat ein Bestandteil der meisten natürlichen Gewässer, je nach Gestein in unterschiedlichen Konzentrationen. Die Konzentration von Calciumcarbonat imWasserwird in Deutschland mit „Grad deutscher Härte“(1 °dH = 10 mg CaO/Liter Wasser oder 17,85 mg CaCO3/Liter oder 0,18 mmol/l) angegeben. In Frankreich wird die Maßeinheit „Grad französischer Härte “benutzt, wobei 1 °fH = 0,1 mmol Ca2+/l oder Mg2+Ionen entspricht. In der Schweiz wird entweder die direkte Angabe über mmol/l oder die französische Härte verwendet.
Der Umkehrung dieses Lösevorgangs, der Ausfällung, verdanken die meisten natürlichen Vorkommen von Calciumcarbonat ihre Entstehung. Da die Löslichkeit des Calciumcarbonats proportional zur Menge des gelösten Kohlendioxids und damit dem Gehalt an Kohlensäure ist, wird sie von den gleichen Faktoren bestimmt, die auch die Konzentration des Kohlendioxids (gemessen alsPartialdruck) bestimmt. Der komplizierte Mechanismus, der an manchen Wasserläufen sichtbar ist, so etwa bei den Kalkterrassen inPamukkale(Türkei), wird durch dasKalk-Kohlensäure-Gleichgewichtbeschrieben. Dabei steigt die Löslichkeit von Kohlendioxid mit zunehmendem Druck und sinkender Temperatur. Wenn Wasser zum Beispiel durch die feinen Rinnen (Diaklasen) eines Kalkgesteins oder eines calciumhaltigen vulkanischen Gesteins fließt, steht es unter Druck und kann dadurch sehr viel mehr Calciumcarbonat lösen. Erreicht dieses Wasser dann das Freie, gleichen sich der Wasserdruck und die Temperatur an den Atmosphärendruck und die Umgebungstemperatur an. Das Kohlendioxid entweicht, das Calciumcarbonat fällt aus und bildet die typischen Kalkablagerungen. Auf diese Weise entstehen unter anderemTravertine(Begriff, der trotz Unterschiede oft synonym je nach Region und Sprache auch fürKalksinteroderKalktuffverwendet wird), mehr oder weniger poröse Kalkgesteine. Ähnliche Vorgänge (Druckänderungen) laufen an Stromschnellen und Wasserfällen von Flüssen ab, wobei sich ebenfalls Travertine bilden. Neben dem Kohlendioxidgehalt bestimmt auch die vorhandene Wassermenge das Gleichgewicht zwischen gelöstem und ungelöstem Calciumcarbonat. Sinkt der Wasseranteil, entsteht zunächst eine übersättigte Lösung, aus der dann Calciumcarbonat ausfällt. Dies kann in der Natur durch Verdunsten bzw. Verdampfen oder durch Ausfrieren auftreten. Das bekannteste Beispiel für die Fällung von Calciumcarbonaten durch Verdunstung ist die Bildung vonTropfsteinenin denKarsthöhlenvon Kalkgesteinen, denStalaktitenundStalagmiten.Auf der Verschiebung des Löslichkeits-Gleichgewichtes (Ausfall von Calciumcarbonat durch Temperaturerhöhung) beruht unter anderem auch die Bildung vonKesselsteinin Heizkesseln, an Durchlauferhitzern und ähnlichen Geräten. Auch Lösungsvorgänge als Bildung von Strukturen sind in der Natur anzutreffen, die sich zum Beispiel in Form vonStyolithen(einige Millimeter bis Zentimeter lange Vorsprünge oder Säulchen, die im Inneren von Kalkgesteinsbanken als unregelmäßige, gerippte Ebenen auftreten) zeigen.[7]
Ähnliche Vorgänge sind in der Tiefsee zu beobachten. DieCalcit- und Aragonit-Kompensationstiefebezeichnet die Tiefe im Meer, unterhalb der sich Calcit und Aragonit vollständig auflöst. Ursache ist die Zunahme der Kohlendioxidkonzentration im Wasser mit zunehmender Meerestiefe.
Auch durch andere saure Bestandteile der Luft sowie durchNitrifikationim Boden wird Calciumcarbonat gelöst. In der Luft enthalteneSchwefeloxidebilden in wässriger UmgebungSchwefelsäure(H2SO4). Diese verwandelt Kalk inCalciumsulfat(CaSO4) oderGips(CaSO4· 2 H2O). Calciumsulfat ist mit etwa 2 g/l zwar ebenfalls wenig wasserlöslich, aber besser löslich als Calciumcarbonat, was zu einem langsamen Auswaschen von Kalkoberflächen durch Feuchtigkeit führt.
Verwendung
[Bearbeiten|Quelltext bearbeiten]Natürliches Calciumcarbonat (Kalkstein) wird in großen Mengen als Rohstoff für dieBaustoff-Industrie, alsZuschlagstoffin derStahlindustrie,als mineralischerDünger,alsFutterkalkund als mineralischerFüllstoffin diversen industriellen Anwendungen verwendet (z. B. inPapieren,Farben,Lacken,Putzen,Kunststoffenund Rückseitenbeschichtungen vonTeppichen). Insgesamt werden jährlich über 400 Millionen Tonnen Kalkgestein abgebaut.
Baustoff
[Bearbeiten|Quelltext bearbeiten]Das Haupteinsatzgebiet ist die Herstellung vonZement(Calciumsilicat,Calciumaluminat) undBranntkalk.
Durch Brennen von Kalk entstehtBranntkalk.Aus diesem wird durch Löschen mit WasserKalkhydrat(Calciumhydroxid Ca(OH)2,gelöschter Kalk) hergestellt. Mit demKohlenstoffdioxidder Luft reagiert er wiederum zu Kalk und schließt dentechnischen Kalkkreislauf.Kalkhydrat und Kalk eignen sich alsPutzoder Wandbeschichtungen wie demTadelakt.Die ersten Entdecker dieses Phänomens waren die Römer, die im großen StileKalkbrennanlagenbetrieben.
Füllstoff
[Bearbeiten|Quelltext bearbeiten]Nach dem weltweit verkauften Volumen ist Calciumcarbonat in Form vonGesteinsmehlder wichtigsteFüllstoff.[14]
Sofern die Füllstoffe auch die optische Erscheinung des Endprodukts beeinflussen, ist oft ein hoherWeißgraderwünscht, den nur der Kalkstein weniger Lagerstätten erfüllt. Der größte industrielle Anwender von weißen Calciumcarbonaten ist mit einer Menge von über 10 Millionen Tonnen (weltweit) pro Jahr diePapierindustrie,danach folgen die Kunststoff- und die Baustoff-Industrie (Putze und Farben) mit insgesamt nochmals 15 Millionen Tonnen pro Jahr. Für den Einsatz in der Papierindustrie, vor allem alsStreichfarbe,werden in Europa insbesondere Lagerstätten in Frankreich, Italien, Deutschland, Norwegen und Österreich abgebaut, wobei das Mineral durch Nassmahlung zerkleinert und alsSlurry(teilweise per Tankschiff) in den Handel kommt.
Landwirtschaft
[Bearbeiten|Quelltext bearbeiten]Beim Bodengefüge werden über den Calciummagnesiumcarbonat-Gehalt derpH-Wertund dadurch die strukturellen Eigenschaften, die biotische Aktivität sowie die Speicherfähigkeit und Umsetzung der Nährstoffe im Boden beeinflusst. Das macht den pH-Wert zur wichtigsten Kenngröße für die Bewirtschaftung aller Bodentypen. Dabei spielt eine ausreichende Kalkversorgung mit „freiem “, nicht an Bodenpartikel gebundenem Calciumcarbonat eine bedeutende Rolle. DurchKalkungwird versucht, einerBodenversauerungentgegenzuwirken und die Bodenfruchtbarkeit zu erhalten oder zu verbessern. Calciumcarbonat dient so seit Jahrhunderten zur Verbesserung der Bodenfruchtbarkeit in der Landwirtschaft.[7]Die Bestimmung des Calciumcarbonatgehaltes im Boden erfolgt durch Zusetzung von 10%igerSalzsäureund Bewertung der auftretenden Reaktion, wie einer Schaumbildung.[15]
Lebensmittelzusatzstoff
[Bearbeiten|Quelltext bearbeiten]In Deutschland wurde Calciumcarbonat durch dieFarbstoff-Verordnungab 1959 alsLebensmittelfarbstofffür die Verwendung in Lebensmitteln zugelassen.[16]Zur Übernahme derRichtlinie des Rats zur Angleichung der Rechtsvorschriften der Mitgliedstaaten für färbende Stoffe, die in Lebensmitteln verwendet werden dürfenin nationales Recht wurde die Farbstoff-Verordnung 1966 angepasst und für Calciumcarbonat dieE-NummerE 170aufgenommen.[17]Ab 1978 wurde die Verwendung in Deutschland durch dieZusatzstoff-Zulassungsverordnunggeregelt. Durch dieVerordnung (EG) Nr. 1333/2008,die am 20. Januar 2009 in Kraft trat, ist die Verwendung von Calciumcarbonat alsLebensmittelzusatzstoffim ganzenEWReinheitlich geregelt.[18]E 170 ist in Gruppe I und zusammen mit anderen Farbstoffen, wieRiboflavine,ZuckercouleuroderCarotinin Gruppe II:Lebensmittelfarbstoffe ohne Höchstmengenbeschränkungeinsortiert und kann somit ohne Mengenbegrenzung (quantum satis) verwendet werden.[18]Calciumcarbonat wird in Lebensmitteln neben der Verwendung als Farbstoff auch alsFüllstoff,Säureregulator,TrennmitteloderRieselhilfeeingesetzt.[19]Im Speisesalz ist es als Rieselhilfe enthalten. Calciumcarbonat wird gebrochen und/oder gemahlen und kommt stückig oder als Mehl in den Handel.
Weitere Einsatzbereiche
[Bearbeiten|Quelltext bearbeiten]Calciumcarbonat fand früher auch alsTafelkreideVerwendung, insbesondere in Frankreich als sogenannteChampagnerkreide,die ausKreidegesteinbesteht, einem chemisch sehr reinen Calciumcarbonat. Etwa 55 Prozent der in Deutschland verkauften Kreide bestanden 1990 ausGips(Calciumsulfat).[20]
Für einige Anwendungen sind natürliche Calciumcarbonate nicht optimal, so dass hier synthetische Calciumcarbonate verwendet werden. Mit der BezeichnungHydro-Calcitwird synthetisches Calciumcarbonat in der Wassertechnik zurEntsäuerungvon Wässern mit „aggressiver Kohlensäure“verwendet. Dieses Verfahren gilt als eines der ältesten Entsäurerungsverfahren.[21]
Zusammen mitMagnesiumcarbonatwird Calciumcarbonat in Medikamenten zurMagensäureregulation(Antazida) eingesetzt.
Siehe auch
[Bearbeiten|Quelltext bearbeiten]- Kalkseife
- Kesselstein
- Tropfstein
- Technischer Kalkkreislauf,mit den Kreislaufstoffen Calciumcarbonat (dieser Artikel),CalciumoxidundCalciumhydroxid
- Kalkablagerung
- Liste der E-Nummern
- Liste der Lebensmittelzusatzstoffe
Literatur
[Bearbeiten|Quelltext bearbeiten]- Temple C. Patton:Pigment Handbook.S. 109 bis 128, John Wiley & Sons,ISBN 0-471-67123-1.
- Lothar Göttsching und Casimir Katz (Hrsg.):Papierlexikon.Gernsbach 1999,ISBN 3-88640-080-8.
- Wolfgang Tegethoff:Calciumcarbonat.ISBN 3-7643-6424-6.
Weblinks
[Bearbeiten|Quelltext bearbeiten]Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Eintrag zuE 170: Calcium carbonatein der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 16. Juni 2020.
- ↑Eintrag zuCALCIUM CARBONATEin derCosIng-Datenbankder EU-Kommission, abgerufen am 16. Januar 2020.
- ↑abcdefghEintrag zuCalciumcarbonatin derGESTIS-StoffdatenbankdesIFA,abgerufen am 16. Dezember 2019.(JavaScript erforderlich)
- ↑Schweizerische Unfallversicherungsanstalt(Suva):Grenzwerte – Aktuelle MAK- und BAT-Werte(Suche nach471-34-1bzw.Calciumcarbonat), abgerufen am 2. November 2015.
- ↑DatenblattCalciumcarbonatbeiMerck,abgerufen am 5. August 2008.
- ↑abDavid R. Lide (Hrsg.):CRC Handbook of Chemistry and Physics.90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL,Standard Thermodynamic Properties of Chemical Substances,S. 5-19.
- ↑abcdefghWolfgang F. Tegethoff:Calciumcarbonat Von der Kreidezeit ins 21. Jahrhundert.Springer-Verlag, 2013,ISBN 978-3-0348-8259-0,S.3(eingeschränkte Vorschauin der Google-Buchsuche).
- ↑abcHolger Nebel, Dissertation, Kontrollierte Fällung von CaCO3in einem modular aufgebauten Kristallisationsreaktor, 2008,urn:nbn:de:hbz:465-20081222-080244-7
- ↑abcdefghiMarkus Neumann:Synthese und Charakterisierung von Calciumcarbonat-Phasen und Calciumphosphat-basierter Knochenersatzmaterialien,Dissertation, Uni Duisburg-Essen, abgerufen am 1. Januar 2016
- ↑abJulyan H. E. Cartwright, Antonio G. Checa, Julian D. Gale, Denis Gebauer, C. Ignacio Sainz-Díaz:Die Polyamorphie von Calciumcarbonat und ihre Bedeutung für die Biomineralisation: Wie viele amorphe Calciumcarbonat-Phasen gibt es?.In:Angewandte Chemie.124, 2012, S. 12126,doi:10.1002/ange.201203125.
- ↑Wissenschaft-Online-Lexika:Eintrag zu Knochen im Kompaktlexikon der Biologie.abgerufen am 3. August 2011.
- ↑Ingrid Schönfelder, Peter Schönfelder:Der Kosmos Heilpflanzenführer.Franckh-Kosmos Verlags- & Company KG, 2019,ISBN 978-3-440-16504-1,S.366(books.google.de).
- ↑W. V. Boynton, D. W. Ming, S. P. Kounaves, S. M. Young, R. E. Arvidson, M. H. Hecht, J. Hoffman, P. B. Niles, D. K. Hamara, R. C. Quinn, P. H. Smith, B. Sutter, D. C. Catling, R. V. Morris:Evidence for calcium carbonate at the Mars Phoenix landing site.In:Science.325, 2009, S. 61–64,PMID 19574384.
- ↑Marktstudie Füllstoffe.Ceresana Research 2007.
- ↑David L. Rowell:Bodenkunde Untersuchungsmethoden und ihre Anwendungen.Springer-Verlag, 2013,ISBN 978-3-642-59093-1,S.21(eingeschränkte Vorschauin der Google-Buchsuche).
- ↑BGBl. 1959 I S. 756vom 19. Dezember 1959
- ↑BGBl. 1966 I S. 74vom 20. Januar 1966
- ↑abVerordnung (EG) Nr. 1333/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Lebensmittelzusatzstoffe.
- ↑CLASS NAMES AND THE INTERNATIONAL NUMBERING SYSTEM FOR FOOD ADDITIVES CXG36-1989.(PDF) In:Codex Alimentarius.FAO,2019,abgerufen am 25. Dezember 2020.
- ↑Compakt Handbuch Chemie1993,ISBN 3-8174-3560-6,S. 387.
- ↑Johann Mutschmann, Fritz Stimmelmayr:Taschenbuch der Wasserversorgung.Springer-Verlag, 2007,ISBN 978-3-8348-9079-5,S.263(eingeschränkte Vorschauin der Google-Buchsuche).






![{\displaystyle \mathrm {CaCO_{3}+2\ CH_{3}COOH\longrightarrow Ca[CH_{3}COO]_{2}+CO_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/79521fe3b58cf6f8595877b471cbe706b663c9ca)

